修回日期: 2009-12-18
接受日期: 2009-12-21
在线出版日期: 2010-01-28
目的: 观察低氧环境下不同浓度的丹参酮ⅡA(TanⅡA)联合5-氟尿嘧啶(5-FU)对人胃癌SGC7901细胞增殖、凋亡的影响及与HIF-1α和突变型P53的表达.
方法: 用氯化钴(CoCl2)创建低氧模型, 采用0、0.5、1.0、2.0、5.0、10.0 mg/L的TanⅡA联合10.0 mg/L的5-FU分别作用于低氧SGC7901细胞24、48和72 h, MTT法检测细胞活力; 用上述同样方式作用于低氧SGC7901细胞24、48和72 h后, Hoechst染色法检测细胞凋亡; TanⅡA(0、0.5、2.0、10.0 mg/L)联合10.0 mg/L的5-FU作用于低氧SGC7901细胞48 h后, 免疫细胞化学二步法检测HIF-1α及突变型P53的表达.
结果: 低氧环境下, 不同浓度的TanⅡA联合10.0 mg/L 5-FU呈时间、剂量依赖性地抑制SGC7901细胞的增殖(均P<0.01), 10.0 mg/L TanⅡA联合5-FU作用细胞72 h后, 其抑制率为67.46%. 0.5-10.0 mg/L TanⅡA联合5-FU作用细胞24、48、72 h, TanⅡA呈时间、剂量依赖性地促进SGC7901细胞凋亡(均P<0.01). HIF-1α及突变型P53表达明显高于常氧组(t = 22.786, 13.914, 均P<0.01), 不同浓度的TanⅡA联合10.0 mg/L 5-FU作用细胞48 h后, HIF-1α、突变型P53蛋白表达明显降低(F = 182.234, 130.062, 均P<0.01), 且二者呈高度正相关(n = 5, r = 0.995, P<0.01).
结论: 在低氧环境下, TanⅡA可能通过抑制HIF-1α及突变型P53蛋白表达从而增强5-FU抑制SGC7901细胞增殖及诱导凋亡作用.
引文著录: 邢国辉, 冯玉光, 宗绪山, 吴美英, 朱芸. 丹参酮IIA联合5-FU对低氧下人胃癌SGC7901细胞增殖、凋亡的影响及与HIF-1α和突变型P53表达的关系. 世界华人消化杂志 2010; 18(3): 222-228
Revised: December 18, 2009
Accepted: December 21, 2009
Published online: January 28, 2010
AIM: To investigate the effects of combined tanshinone IIA (Tan IIA) and 5-fluorouracil (5-FU) on cell proliferation, apoptosis, and the expressions of hypoxia-inducible factor-1 alpha (HIF-1α) and mutant P53 (mt P53) in human gastric cancer cell line SGC7901 under hypoxia.
METHODS: Hypoxia was induced in SGC7901 cells by cobalt dichloride treatment. SGC7901 cells under hypoxia were treated with different concentrations of Tan IIA in combination with 10.0 mg/L of 5-FU for 24, 48 and 72 hours. Cell proliferation was detected by methyl thiazolyl tetrazolium (MTT) assay. Cell apoptosis was detected by Hoechst staining. The expression of HIF-1α and mt P53 proteins was detected by immunocytochemistry.
RESULTS: Combined Tan IIA and 5-FU significantly inhibited the proliferation of SGC7901 cells (all P < 0.01) in a dose- and time-dependent manner under hypoxia. The reduced proliferation rate of cells incubated with Tan IIA at a concentration of 10 mg/L and 5-FU for 72 hours was 67.46%. Hoechst staining showed that Tan IIA in combination with 5-FU promoted the apoptosis of SGC7901 cells in a dose- and time-dependent manner under hypoxia (all P < 0.01). Immunocytochemical staining revealed that the expression levels of HIF-1α and mt P53 proteins in SGC7901 cells under hypoxia were evidently higher than those in SGC7901 cells under normal conditions (t = 22.786 and 13.914, respectively; both P < 0.01). However, Tan IIA in combination with 5-FU significantly downregulated the expression of HIF-1α and mt P53 proteins in SGC7901 cells under hypoxia (F = 182.234 and 130.062, respectively; both P < 0.01). A significant positive correlation was noted between the expression of HIF-1α and mt P53 in SGC7901 cells (n = 5, r = 0.995, P < 0.01).
CONCLUSION: Tan IIA can significantly enhance 5-FU-mediated growth inhibition and apoptosis induction in SGC7901 cells under hypoxia perhaps by downregulating HIF-1α and mt P53 protein expression.
- Citation: Xing GH, Feng YG, Zong XS, Wu MY, Zhu Y. Effects of combined Tan IIA and 5-FU on cell proliferation, apoptosis, and the expression of HIF-1α and mutant P53 in human gastric cancer cell line SGC7901 under hypoxia. Shijie Huaren Xiaohua Zazhi 2010; 18(3): 222-228
- URL: https://www.wjgnet.com/1009-3079/full/v18/i3/222.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i3.222
肿瘤微环境低氧是多种实体瘤包括胃癌的基本特征之一, 肿瘤微环境低氧及基因突变导致低氧诱导因子-1α(hypoxia inducible factor-1 alpha, HIF-1α)表达升高, 而HIF-1α与肿瘤血管生成、放化疗抵抗、克隆选择和恶性演进、浸润转移均密切相关[1-4]. 许多研究发现, 低氧下肿瘤出现化疗抵抗, 而低氧诱导HIF-1α表达是肿瘤低氧环境下化疗抵抗的重要机制[5-7]. P53基因是人类恶性肿瘤最常见的突变基因, 突变型P53不仅失去了抑癌功能, 同时还具有癌基因活性, 大量研究还表明P53突变导致肿瘤对化疗药物发生凋亡抵抗[8-11]. 近年来的研究发现, HIF-1α与P53突变的交互作用与低氧下肿瘤的凋亡抵抗、克隆选择及化疗抵抗有密切关系, 表达野生型P53的肿瘤低氧及化疗打击下容易凋亡, 而表达突变型P53的肿瘤细胞对低氧及化疗诱导的凋亡均不敏感, 在缺氧环境下具有明显的生存优势, 从而引起肿瘤细胞的克隆选择及恶性演进[12,13]. 因此, 寻找以HIF-1α或突变型P53为靶点的小分子化合物和化疗药物联合是逆转或阻止低氧化疗抵抗的有效途径, 是目前国际研究的热点[14-17]. 5-氟尿嘧啶(5-FU)是临床上胃肠道肿瘤化疗的首选和基本用药, 诱导凋亡是其抗肿瘤机制之一[18], 研究表明, P53突变导致肿瘤包括胃癌对5-FU发生凋亡抵抗[19], 而肿瘤低氧也可降低5-FU的抗肿瘤活性[20,21]. 丹参酮ⅡA(TanⅡA)是从中药丹参中提取的一种脂溶性成分, 近年来研究发现丹参酮ⅡA对多种肿瘤细胞具有生长抑制、诱导凋亡作用[22-24], 此前我们研究发现[25], 低氧环境下TanⅡA能显著抑制突变型P53人胃癌SGC7901细胞增殖, 诱导其凋亡, 并抑制低氧诱导的HIF-1α及突变型P53的表达. 我们设想低氧环境下TanⅡA是否可通过抑制HIF-1α及突变型P53表达, 增强5-FU抗肿瘤的作用. 为此, 本研究观察了低氧环境下不同浓度的TanⅡA联合5-FU对人胃癌SGC7901细胞增殖、凋亡的影响及与HIF-1α及突变型P53表达变化的关系.
人胃癌细胞株SGC7901购自山东省医学科学院. TanⅡA为中国药品生物制品检定所的标准品, 用二甲亚砜(DMSO)溶解, 终浓度为0.02%, 4 ℃冷藏备用. 5-FU为上海旭东海普药业有限公司生产. Hoechst32258荧光染色试剂盒及氯化钴(CoCl2)购于美国Sigma公司. RPMI 1640培养基、MTT均购自美国Gibco公司. 胎牛血清(杭州四季青), 突变型P53、HIF-1α单克隆抗体及PV-9000免疫组织化学试剂盒均为为北京中山金桥生物技术有限公司产品. 二氧化碳恒温培养箱(HREA Cell Germany); TE300倒置显微镜及BH-2型荧光显微镜(Olympus公司).
1.2.1 细胞培养: 人胃癌细胞株SGC7901接种于含100 mL/L胎牛血清、青霉素、链霉素各l×105 U/L的RPMI 1640培养液中, 置37 ℃, 50 mL/L CO2培养箱内常规传代培养. 化学缺氧剂CoCl2加入培养液的终浓度为150 µmol/L, 用于模拟肿瘤内低氧微环境.
1.2.2 MTT法测定低氧下胃癌细胞增殖抑制率: 取对数生长期的细胞以3×107/L的密度接种于96孔培养板, 每孔体积为200 μL. 待细胞贴壁后分别加入TanⅡA(终浓度0、0.5、1.0、2.0、5.0、10.0 mg/L)和5-FU(终浓度10.0 mg/L), 并设阴性对照组(细胞正常生长组), 每个浓度组设5个复孔, 四周加入不含药物的细胞培养液为空白对照. 在低氧条件下培养24、48、72 h后, 每孔加入5 g/L的MTT溶液20 μL, 继续培养4 h, 轻轻吸尽上清液, 加入DMSO每孔150 μL, 振荡10 min, 在酶标仪上以490 nm波长测每孔的吸光度(A)值, 并取5孔的平均值, 细胞生长抑制率 = (对照孔A值-实验孔A值) /对照孔A值×100%.
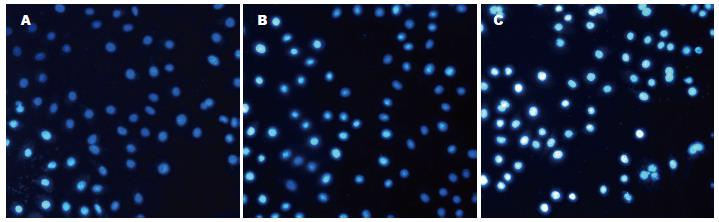
1.2.3 Hoechst染色法检测低氧下胃癌细胞凋亡率: 取对数生长期的SGC7901制成2×108/L的细胞悬液, 每孔0.5 mL, 加入放有盖玻片的24孔板内. 待细胞贴壁后分别加入TanⅡA(终浓度0、0.5、1.0、2.0、5.0、10.0 mg/L)和5-FU(终浓度10.0 mg/L), 并设阴性对照组(细胞正常生长组), 在低氧条件下培养24、48、72 h后, 取出细胞爬片, 甲醇/冰醋酸固定液固定5 min后, 加入荧光染液Hoechst33258重悬细胞, 室温避光l h, PBS冲洗, 用抗荧光液封片. 判定标准: 正常细胞核为蓝色, 凋亡的细胞核为白色. 每片连续观察10个细胞分布均匀的200倍镜视野, 每视野计数50个细胞, 共500个细胞, 计算其阳性率百分数, 并取其均值. 凋亡率 = 凋亡细胞数/(正常细胞数+凋亡细胞数).
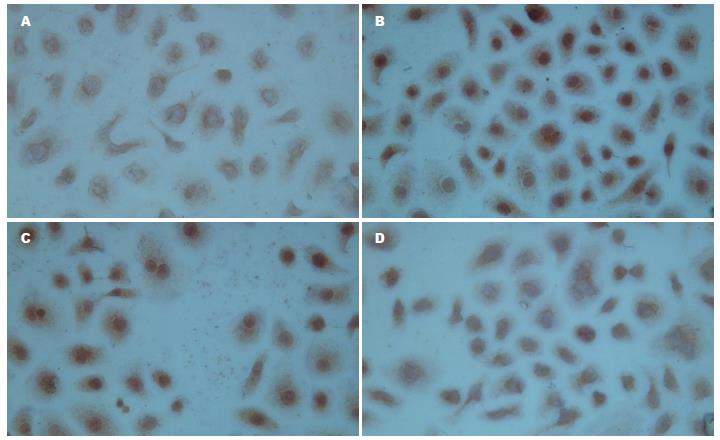
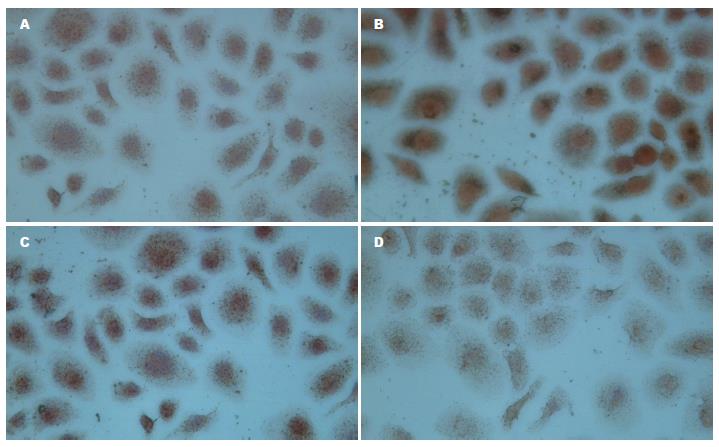
1.2.4 免疫细胞化学二步法观察低氧下胃癌细胞HIF-1α及突变型P53的表达: 取对数生长期的SGC7901制成2×108/L的细胞悬液, 每孔0.5 mL, 加入放有盖玻片的24孔板内, 设常氧对照组、低氧模拟剂氯化钴(CoCl2, 150 μmol/L)对照组和CoCl2加不同浓度TanⅡA组, 待细胞贴壁后分别加入CoCl2、TanⅡA(终浓度0、0.5、2.0、10.0 mg/L)和5-FU(终浓度10.0 mg/L), 48 h后取出细胞爬片, 冷丙酮固定5 min, PBS冲洗, 按PV-9000试剂盒步骤分别检测HIF-1α、突变型P53, DAB显色, 脱水, 透明, 中性树胶封片. 用已知阳性的乳腺癌切片作为阳性对照, 以PBS代替一抗作为阴性对照. 结果判定: HIF-1α、突变型P53阳性结果为细胞核内有棕黄色颗粒出现. 采用HPAIS-1000高清晰度彩色病理图文分析系统, 检测两种蛋白阳性细胞的平均A值, 以间接反映HIF-1α、突变型P53阳性蛋白的表达量, 并取其均值.
统计学处理 实验数据用mean±SD表示, 组间比较用t检验和单因素方差分析, 两变量间用Pearson直线相关分析, 用统计软件SPSS16.0分析, P<0.05为有统计学意义.
低氧环境下0.0-10.0 mg/L TanⅡA联合10.0 mg/L 5-FU作用于SGC7901细胞24、48和72 h后, 细胞增殖抑制率显著高于对照组(F = 148.392, 271.152, 346.513, 均P<0.01); 单独应用5-FU在不同时间后的细胞增殖抑制率无显著差异, 而0.5-10.0 μg/L TanⅡA联合5-FU则呈时间剂量依赖性地抑制SGC7901细胞的增殖, 同一浓度作用48 h其增殖抑制率显著高于24 h, 作用72 h又显著高于48 h(均P<0.01, 表1).
| TanⅡA+5-FU(mg/L) | 24 h | 48 h | 72 h | |||
| A值 | IR(%) | A值 | IR(%) | A值 | IR(%) | |
| 对照组 | 0.749±0.030 | 0.737±0.030 | 0.739±0.018 | |||
| 0.0+10.0 | 0.669±0.020 | 10.57±3.97b | 0.652±0.016 | 11.42±3.60b | 0.624±0.035 | 15.30±4.85b |
| 0.5+10.0 | 0.606±0.014 | 18.90±4.77b | 0.567±0.017 | 22.94±3.63bd | 0.516±0.017 | 29.96±2.25bd |
| 1.0+10.0 | 0.541±0.017 | 27.63±4.60b | 0.516±0.014 | 29.99±2.82bd | 0.475±0.019 | 35.45±2.18bd |
| 2.0+10.0 | 0.510±0.011 | 31.75±4.06b | 0.456±0.019 | 38.07±1.89bd | 0.371±0.022 | 49.59±3.26bd |
| 5.0+10.0 | 0.484±0.012 | 35.28±2.47b | 0.402±0.019 | 45.39±1.46bd | 0.301±0.020 | 59.23±2.50bd |
| 10.0+10.0 | 0.443±0.013 | 40.79±2.96b | 0.367±0.013 | 50.19±2.60bd | 0.239±0.010 | 67.46±1.22bd |
低氧环境下0.0-10.0 mg/L TanⅡA联合10.0 mg/L 5-FU作用于SGC7901细胞24、48和72 h后, 细胞凋亡率显著高于对照组(F = 462.438, 561.124, 889.562, 均P<0.01), 单独应用5-FU在不同时间后的细胞凋亡率无显著差异, 而0.5-10.0 mg/L TanⅡA联合5-FU则呈时间剂量依赖性地促进SGC7901细胞凋亡, 同一浓度作用48 h其细胞凋亡率显著高于24 h, 作用72 h又显著高于48 h(均P<0.01, 表2, 图1).
| TanⅡA+5-FU(mg/L) | 24 h | 48 h | 72 h |
| 对照组 | 2.03±0.67 | 2.07±0.12 | 2.23±0.12 |
| 0.0+10.0 | 4.84±0.51b | 5.28±0.72b | 4.94±0.38b |
| 0.5+10.0 | 6.52±0.48b | 8.77±0.87bd | 12.58±1.31bd |
| 1.0+10.0 | 8.69±0.93b | 14.95±0.94bd | 22.36±1.73bd |
| 2.0+10.0 | 12.18±1.11b | 21.19±1.64bd | 31.31±2.05bd |
| 5.0+10.0 | 21.45±1.39b | 27.18±2.17bd | 45.68±1.59bd |
| 10.0+10.0 | 30.57±1.69b | 43.62±1.85bd | 60.34±2.58bd |
常氧对照组HIF-1α、突变型P53蛋白呈低水平表达, 低氧诱导48 h后HIF-1α、突变型P53蛋白表达明显增高, 两种蛋白表达与常氧组比较有统计学意义(HIF-1α: t = 22.786, P<0.01; 突变型P53: t = 13.914, P<0.01). 低氧环境下不同浓度TanⅡA联合10.0 mg/L 5-FU作用48 h后, HIF-1α、突变型P53蛋白表达随TanⅡA浓度的增加而逐渐降低, 与低氧组比较均有统计学意义(HIF-1α: F = 182.234, P<0.01; 突变型P53: F = 130.062, P<0.01, 表3, 图2, 3).
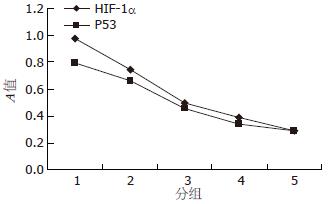
Pearson直线相关分析显示, HIF-1α和突变型P53蛋白表达之间呈高度正相关(n = 5, r = 0.995, P<0.01, 图4).
低氧下发生化疗抵抗是肿瘤化疗失败的重要原因, 多种化疗药物低氧下抗肿瘤作用下降[5-8]. HIF-1α是肿瘤低氧应答的关键因子, HIF-1α与肿瘤血管生成、放化疗抵抗、克隆选择和恶性演进、浸润转移均密切相关[1-4]. P53是人类肿瘤最常见的突变基因之一, P53突变的肿瘤对多种化疗药物出现凋亡抵抗[10,11]. 近年来研究发现, HIF-1α与P53两套信号系统之间的相互作用在肿瘤的细胞周期调控、凋亡诱导与凋亡抵抗、克隆选择、放化疗耐药等方面扮演重要角色[12,13]. 正常情况下, 野生型P53维持在低水平, 被MDM2途径降解, 低氧可通过HIF-1α通路诱导野生型P53蛋白的表达, 从而促进P53依赖的细胞凋亡[27]. 研究发现, 低氧环境下, HIF-1α能通过与野生P53蛋白竞争直接与MDM2结合, 防止P53被MDM2途径降解, 从而引起P53途径的活化[27]. 反过来野生型P53还对HIF-1α进行调节, 这种调节主要有两种方式: 一是通过MDM2介导的泛素-蛋白酶解通路促进HIF-1α蛋白的降解; 二是和HIF-1α竞争与CBP/p300结合, 抑制HIF-1α的转录激活活性, 野生型P53基因缺失会导致HIF-1α水平升高并增强其转录活性[27,28]. 而当P53发生突变时, HIF-1α-P53之间的调馈环路中断, 低氧不能诱导突变型P53肿瘤细胞凋亡, 而且突变型P53还导致HIF-1α水平进一步升高并增强其转录活性[29], 因此, 低氧作为一种环境压力选择使突变型P53细胞生存. 这种突变型P53细胞株在低氧下发生凋亡抵抗, 放化疗抵抗, 最终发生克隆选择, 成为优势细胞群, 发生肿瘤的恶性演进. 临床病理研究也发现, 同时表达HIF-1α和突变型P53的肿瘤对化疗不敏感, 预后不良[30,31]. 寻找以HIF-1α或突变型P53为靶点的小分子化合物和化疗药物联合是逆转或阻止低氧化疗抵抗的有效途径[14-17].
我们系统观察了低氧下不同浓度TanⅡA联合5-FU对SGC7901细胞的增殖、凋亡的影响及与HIF-1α和突变型P53表达变化的关系. MTT试验发现: 低氧下TanⅡA可呈剂量和时间依赖性地显著抑制SGC7901细胞的增殖, 10.0 mg/L TanⅡA联合5-FU作用细胞72 h后, 其抑制率为67.46%. Hoechst染色法观察了低氧环境下5-FU对细胞凋亡的影响, 培养48 h后其凋亡率为5.28%. 进一步观察发现, 随着TanⅡA浓度的升高和作用时间的延长, 细胞凋亡率逐渐增高, 培养72 h后低氧环境下的凋亡率高达60.34%. 此前我们已经发现, 低氧环境下SGC7901细胞HIF-1α和突变型P53表达明显增高, 而TanⅡA可呈剂量依赖性地抑制低氧下HIF-1α和突变型P53的表达. 本研究我们应用免疫细胞化学法进一步观察了低氧环境下不同浓度的TanⅡA联合5-FU对HIF-1α和突变型P53表达的影响, 结果显示: TanⅡA与5-FU联用呈剂量依赖性的抑制HIF-1α和突变型P53表达(P<0.01). 直线相关分析显示, HIF-1α和P53蛋白表达之间呈显著正相关(n = 5, r = 0.995, P<0.01). 说明TanⅡA可通过抑制HIF-1α和突变型P53的表达显著增强5-FU的诱导凋亡作用. 最近, Ravizza等[21]研究亦发现, HIF-1α表达下调可增强人结肠癌细胞株HCT116对5-FU的敏感性. 因此, 我们推测, TanⅡA在低氧环境下可能通过抑制HIF-1α的表达而增强了SGC7901细胞对5-FU的敏感性. 其他一些作者也发现抑制HIF-1α可以增强化疗敏感性或逆转化疗抵抗[32,33].
我们初步研究结果提示, TanⅡA作为一种对HIF-1α和突变型P53等多靶点均有抑制作用的小分子抑制剂, 有可能作为一种重要的辅助化疗药物与化疗药物联用, 用于低氧及P53突变导致的肿瘤放化疗耐药、凋亡抵抗、血管生成、克隆选择及恶性演进的防治.
肿瘤微环境低氧是肿瘤化疗抵抗的重要原因, 从而导致化疗失败. 丹参酮ⅡA对多种肿瘤细胞具有生长抑制、诱导凋亡作用, 且此前研究发现在低氧下其亦能抑制人胃癌细胞增殖、诱导凋亡, 但低氧下其是否能增强化疗药物的敏感性或逆转化疗抵抗报道不多.
郑鹏远, 教授, 郑州大学第二附属医院消化科.
寻找低氧下对肿瘤有抑制作用的小分子化合物和化疗药物联合以逆转或阻止低氧化疗抵抗成为目前肿瘤治疗的研究热点.
近年来研究发现, HIF-1α与P53两套信号系统之间的相互作用在肿瘤的细胞周期调控、凋亡诱导与凋亡抵抗、克隆选择、放化疗耐药等方面扮演重要角色.
本研究从我国的传统医学出发, 选择丹参酮ⅡA联合经典的化疗药物5-FU, 观察其对低氧环境下胃癌细胞的增殖、凋亡的影响, 并阐明其抗肿瘤的分子机制, 有望为肿瘤的治疗提供新的思路.
本研究发现, 在低氧环境下, 丹参酮ⅡA增强了5-FU的抗肿瘤活性, 这种作用可能与其抑制HIF-1α及突变型P53蛋白表达有关. 研究结果表明, 丹参酮ⅡA作为一种对HIF-1α和突变型P53等多靶点均有抑制作用的小分子抑制剂, 有可能作为一种重要的辅助化疗药物与化疗药物联用, 为肿瘤的治疗提供新的途径.
本文对丹参酮ⅡA联合5-氟尿嘧啶对低氧下人胃癌SGC7901细胞增殖、凋亡的影响及与HIF-1α和突变型P53表达变化的关系进行研究,立题新颖, 有一定的理论意义和潜在的临床价值.
编辑: 李军亮 电编:何基才
| 1. | Zhong H, De Marzo AM, Laughner E, Lim M, Hilton DA, Zagzag D, Buechler P, Isaacs WB, Semenza GL, Simons JW. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 1999;59:5830-5835. [PubMed] |
| 2. | Maxwell PH, Dachs GU, Gleadle JM, Nicholls LG, Harris AL, Stratford IJ, Hankinson O, Pugh CW, Ratcliffe PJ. Hypoxia-inducible factor-1 modulates gene expression in solid tumors and influences both angiogenesis and tumor growth. Proc Natl Acad Sci U S A. 1997;94:8104-8109. [PubMed] [DOI] |
| 3. | Zhou J, Schmid T, Schnitzer S, Brüne B. Tumor hypoxia and cancer progression. Cancer Lett. 2006;237:10-21. [PubMed] [DOI] |
| 4. | Kilic M, Kasperczyk H, Fulda S, Debatin KM. Role of hypoxia inducible factor-1 alpha in modulation of apoptosis resistance. Oncogene. 2007;26:2027-2038. [PubMed] [DOI] |
| 5. | Cosse JP, Michiels C. Tumour hypoxia affects the responsiveness of cancer cells to chemotherapy and promotes cancer progression. Anticancer Agents Med Chem. 2008;8:790-797. [PubMed] |
| 6. | Yokoi K, Fidler IJ. Hypoxia increases resistance of human pancreatic cancer cells to apoptosis induced by gemcitabine. Clin Cancer Res. 2004;10:2299-2306. [PubMed] [DOI] |
| 7. | Hussein D, Estlin EJ, Dive C, Makin GW. Chronic hypoxia promotes hypoxia-inducible factor-1alpha-dependent resistance to etoposide and vincristine in neuroblastoma cells. Mol Cancer Ther. 2006;5:2241-2250. [PubMed] [DOI] |
| 8. | Hollstein M, Sidransky D, Vogelstein B, Harris CC. p53 mutations in human cancers. Science. 1991;253:49-53. [PubMed] [DOI] |
| 9. | Cadwell C, Zambetti GP. The effects of wild-type p53 tumor suppressor activity and mutant p53 gain-of-function on cell growth. Gene. 2001;277:15-30. [PubMed] [DOI] |
| 10. | Lowe SW, Ruley HE, Jacks T, Housman DE. p53-dependent apoptosis modulates the cytotoxicity of anticancer agents. Cell. 1993;74:957-967. [PubMed] [DOI] |
| 11. | Jiang XH, Wong BC, Lin MC, Zhu GH, Kung HF, Jiang SH, Yang D, Lam SK. Functional p53 is required for triptolide-induced apoptosis and AP-1 and nuclear factor-kappaB activation in gastric cancer cells. Oncogene. 2001;20:8009-8018. [PubMed] [DOI] |
| 12. | Hammond EM, Giaccia AJ. Hypoxia-inducible factor-1 and p53: friends, acquaintances, or strangers? Clin Cancer Res. 2006;12:5007-5009. [PubMed] [DOI] |
| 13. | Schmid T, Zhou J, Brüne B. HIF-1 and p53: communication of transcription factors under hypoxia. J Cell Mol Med. 2004;8:423-431. [PubMed] [DOI] |
| 14. | Powis G, Kirkpatrick L. Hypoxia inducible factor-1alpha as a cancer drug target. Mol Cancer Ther. 2004;3:647-654. [PubMed] |
| 15. | Melillo G. Inhibiting hypoxia-inducible factor 1 for cancer therapy. Mol Cancer Res. 2006;4:601-605. [PubMed] [DOI] |
| 16. | Brown LM, Cowen RL, Debray C, Eustace A, Erler JT, Sheppard FC, Parker CA, Stratford IJ, Williams KJ. Reversing hypoxic cell chemoresistance in vitro using genetic and small molecule approaches targeting hypoxia inducible factor-1. Mol Pharmacol. 2006;69:411-418. [PubMed] [DOI] |
| 17. | Bullock AN, Fersht AR. Rescuing the function of mutant p53. Nat Rev Cancer. 2001;1:68-76. [PubMed] [DOI] |
| 18. | Yoshida K, Yamaguchi K, Osada S, Kawaguchi Y, Takahashi T, Sakashita F, Tanaka Y. Challenge for a better combination with basic evidence. Int J Clin Oncol. 2008;13:212-219. [PubMed] [DOI] |
| 19. | Matsuhashi N, Saio M, Matsuo A, Sugiyama Y, Saji S. Apoptosis induced by 5-fluorouracil, cisplatin and paclitaxel are associated with p53 gene status in gastric cancer cell lines. Int J Oncol. 2005;26:1563-1567. [PubMed] |
| 20. | Yoshiba S, Ito D, Nagumo T, Shirota T, Hatori M, Shintani S. Hypoxia induces resistance to 5-fluorouracil in oral cancer cells via G(1) phase cell cycle arrest. Oral Oncol. 2009;45:109-115. [PubMed] [DOI] |
| 21. | Ravizza R, Molteni R, Gariboldi MB, Marras E, Perletti G, Monti E. Effect of HIF-1 modulation on the response of two- and three-dimensional cultures of human colon cancer cells to 5-fluorouracil. Eur J Cancer. 2009;45:890-898. [PubMed] [DOI] |
| 22. | Wang X, Morris-Natschke SL, Lee KH. New developments in the chemistry and biology of the bioactive constituents of Tanshen. Med Res Rev. 2007;27:133-148. [PubMed] [DOI] |
| 23. | Yuan SL, Wei YQ, Wang XJ, Xiao F, Li SF, Zhang J. Growth inhibition and apoptosis induction of tanshinone II-A on human hepatocellular carcinoma cells. World J Gastroenterol. 2004;10:2024-2028. [PubMed] |
| 24. | 王 炎, 李 琦, 范 忠泽, 孙 珏, 王 忆勤, 刘 瑞海, 高 虹. 丹参酮ⅡA介导p38MAPK信号转导诱导人肝癌细胞凋亡. 世界华人消化杂志. 2009;17:124-129. [DOI] |
| 25. | 宗 绪山, 冯 玉光, 王 鑫, 邢 国辉, 吴 美英, 朱 芸. 丹参酮ⅡA对低氧培养下人胃癌SGC7901细胞增殖、凋亡及HIF-1α表达的影响. 世界华人消化杂志. 2009;17:642-646. [DOI] |
| 26. | An WG, Kanekal M, Simon MC, Maltepe E, Blagosklonny MV, Neckers LM. Stabilization of wild-type p53 by hypoxia- inducible factor 1alpha. Nature. 1998;392:405-408. [PubMed] [DOI] |
| 27. | Chen D, Li M, Luo J, Gu W. Direct interactions between HIF-1 alpha and Mdm2 modulate p53 function. J Biol Chem. 2003;278:13595-13598. [PubMed] [DOI] |
| 28. | Blagosklonny MV, An WG, Romanova LY, Trepel J, Fojo T, Neckers L. p53 inhibits hypoxia-inducible factor-stimulated transcription. J Biol Chem. 1998;273:11995-11998. [PubMed] [DOI] |
| 29. | Khromova NV, Kopnin PB, Stepanova EV, Agapova LS, Kopnin BP. p53 hot-spot mutants increase tumor vascularization via ROS-mediated activation of the HIF1/VEGF-A pathway. Cancer Lett. 2009;276:143-151. [PubMed] [DOI] |
| 30. | Sumiyoshi Y, Kakeji Y, Egashira A, Mizokami K, Orita H, Maehara Y. Overexpression of hypoxia-inducible factor 1alpha and p53 is a marker for an unfavorable prognosis in gastric cancer. Clin Cancer Res. 2006;12:5112-5117. [PubMed] [DOI] |
| 31. | Sohda M, Ishikawa H, Masuda N, Kato H, Miyazaki T, Nakajima M, Fukuchi M, Manda R, Fukai Y, Sakurai H. Pretreatment evaluation of combined HIF-1alpha, p53 and p21 expression is a useful and sensitive indicator of response to radiation and chemotherapy in esophageal cancer. Int J Cancer. 2004;110:838-844. [PubMed] [DOI] |
| 32. | Zhang N, Zhang H, Xia L, Zheng Y, Yu Y, Zhu Y, Chen G, Di W. NSC606985 induces apoptosis, exerts synergistic effects with cisplatin, and inhibits hypoxia-stabilized HIF-1alpha protein in human ovarian cancer cells. Cancer Lett. 2009;278:139-144. [PubMed] [DOI] |
| 33. | Hu Y, Kirito K, Yoshida K, Mitsumori T, Nakajima K, Nozaki Y, Hamanaka S, Nagashima T, Kunitama M, Sakoe K. Inhibition of hypoxia-inducible factor-1 function enhances the sensitivity of multiple myeloma cells to melphalan. Mol Cancer Ther. 2009;8:2329-2338. [PubMed] [DOI] |