修回日期: 2010-08-18
接受日期: 2010-08-24
在线出版日期: 2010-10-18
目的: 探讨RASSF1A基因的异常表达与食管鳞癌(esophageal squamous cell carcinoma, ESCC)发生发展的关系.
方法: 应用实时RT-PCR方法及实时荧光甲基化特异性聚合酶链反应技术, 分别检测49例ESCC患者癌组织及癌旁正常组织中RASSF1A基因的转录表达情况和启动子区域5'-CpG岛的甲基化状态. 分析RASSF1A基因在ESCC中的转录表达情况、甲基化状态及与临床病理因素、预后之间的关系.
结果: 在49例ESCC标本中, 有26(53.06%)例RASSF1A mRNA表达下调, RASSF1A mRNA在食管鳞癌组织及相应的癌旁正常组织中的表达存在显著统计学差异(P<0.05), RASSF1A mRNA的表达缺失与ESCC患者的淋巴结转移、临床TNM分期及不良预后均存在显著相关性(均P<0.05); 有38(77.60%)例RASSF1A基因启动子区域5'-CpG岛高甲基化, 与之相对应的癌旁正常组织中仅有3(6.10%)例, 两者差异有统计学意义(P<0.05), RASSF1A基因的高甲基化状态与淋巴结转移、临床TNM分期及不良预后均存在显著相关性(均P<0.05); 在26例RASSF1A基因转录表达缺失的ESCC组织中有24例发生了启动子区域5'-CpG岛的高甲基化, RASSF1A基因在ESCC中的转录表达缺失与其启动子5'-CpG岛高甲基化显著相关(P<0.05).
结论: RASSF1A基因启动子5'-CpG岛高甲基化在ESCC是一高频分子事件, 与该基因的转录表达缺失显著相关, 是其转录表达缺失的主要机制之一.
引文著录: 郑秋青, 凌志强, 李沛, 程蕾, 毛伟敏. RASSF1A在食管鳞癌组织中的表达、甲基化状态及其与预后之间的关系. 世界华人消化杂志 2010; 18(29): 3134-3139
Revised: August 18, 2010
Accepted: August 24, 2010
Published online: October 18, 2010
AIM: To investigate the expression and methylation status of the RASSF1A gene in esophageal squamous cell carcinoma (ESCC) and to analyze their prognostic significance.
METHODS: The mRNA expression and DNA methylation of the promoter region of the RASSF1A gene in normal esophageal tissue samples and ESCC tissue samples taken from 49 ESCC patients were detected by real-time RT-PCR and real-time methylation-specific PCR (qMSP), respectively.
RESULTS: RASSF1A mRNA expression was down-regulated in 53.06% (26/49) of ESCC tissue samples. The level of RASSF1A mRNA expression in ESCC was significantly lower than that in adjacent normal tissue (P < 0.05). Down-regulation of RASSF1A mRNA expression was correlated with TNM stage, lymph node metastasis and poor prognosis in ESCC patients (all P < 0.05). Hypermethylation of the RASSF1A gene promoter region was detected in 77.60% (38/49) of ESCC patients. RASSF1A gene promoter hypermethylation was correlated with TNM stage, lymph node metastasis and poor prognosis in ESCC patients (all P < 0.05).
CONCLUSION: RASSF1A gene promoter hypermethylation is a very common molecular event in ESCC and may be responsible for the down-regulation of RASSF1A mRNA expression. Down-regulation of RASSF1A mRNA expression and hypermethylation of RASSF1A gene promoter region were significantly correlated with lymph node metastasis, TNM stage and poor prognosis in ESCC patients.
- Citation: Zheng QQ, Ling ZQ, Li P, Cheng L, Mao WM. Prognostic significance of RASSF1A expression and methylation status in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(29): 3134-3139
- URL: https://www.wjgnet.com/1009-3079/full/v18/i29/3134.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i29.3134
食管鳞癌(esophageal squamous cell carcinoma, ESCC)的形成与其他恶性肿瘤的发生相似, 是多因素作用、多基因变化和多阶段发展的过程. 近年来随着分子生物学技术的发展, ESCC的基础及临床研究取得了长足的进步, 然而术后5年生存率仍然很低, 表明其发生发展的机制仍有待进一步研究和探讨. RASSF1A基因是位于3p21.3上的一种新型的候选抑癌基因, 与多种人类肿瘤有关. 已有研究表明, RASSF1A基因是继P16基因以来所发现的在肿瘤中甲基化程度最高、最广泛的基因之一, 该基因的转录表达缺失与其启动子区域5'-CpG岛高甲基化有着广泛的肿瘤谱[1-5]. 我们应用real-time RT-PCR方法及实时甲基化特异性PCR(real-time methylation-specific PCR, qMSP)技术, 分别检测49例ESCC患者肿瘤组织及癌旁正常组织中RASSF1A基因的转录表达情况和启动子区域5'-CpG岛的甲基化状态, 以探讨RASSF1A基因在ESCC发生发展中的作用.
49例ESCC及相应癌旁正常组织中, 34例来源于2008-09/2009-02浙江省肿瘤医院ESCC手术后组织标本, 另外15例2003-01/2004-06由河南省郑州大学医学院附属医院提供. 癌旁正常组织取自肿瘤边缘5 cm外区域, 为肉眼下正常组织, 上述组织切除后, 其中一半的组织固定于40 g/L甲醛中作病理诊断及DNA提取用, 另一半则快速用液氮冷冻并储存在-80 ˚C冰箱中用作RNA提取. 全部肿瘤组织均经病理诊断为鳞状细胞癌, 肿瘤分级、TNM分期分别按照标准世界卫生组织(world health organization, WHO)和国际抗癌联盟(international union against cancer, UICC)的标准: 其中高分化1例、中分化13例、低分化35例; Ⅰ期7例、Ⅱ期16例、Ⅲ期23例、Ⅳ期3例. 所有肿瘤患者中, 男41例, 女8例; 年龄39-76(中位年龄62, 平均年龄60.3)岁. 术前均未接受化疗或放疗. 对本试验中49例ESCC患者进行术后随访, 随访时间截至2010-04-25. RNA提取试剂盒MiRNeasy Mini Kit购于Qiagen公司, 反转录试剂盒PrimeScriptTM RT reagent Kit和real time RT-PCR试剂盒SYBR Premix Taq Ex Taq kit购于TaKaRa公司, 甲基化试剂氢醌和亚硫酸氢钠均购于Sigma公司. 基因引物由上海Invitrogen公司合成. real time RT-PCR引物序列: GAPDH: 5'-GAAGGTGAAGGTCGGAGTC-3'(forward), 5'-GAAGATGGTGATGGGATTTC-3'(reverse); NAMA: 5'-CCCGTCTTCTTTTGATGACC-3'(forward), 5'-TGGGATGGCTGACTTGTGTA-3'(reverse). qMSP引物序列: 甲基化引物序列RASSF1A(M): 5'-GTGTTAACGCGTTGCGTATC-3'(forward), 5'-AACCCCGCGAACTAAAAACGA-3'(reverse); 非甲基化引物序列RASSFIA(U): 5'-TTTGGTTGGAGTGTGTTAATGTG-3'(forward), 5'-CAAACCCCACAAACTAAAAACAA-3'(reverse).
1.2.1 总RNA提取: 按照MiRNeasy Mini Kit试剂盒说明书提取肿瘤组织及对应的正常组织的总RNA, 紫外分光光度计测量, 判定所提取总RNA的浓度和纯度, 要求光密度值A260/A280>1.8. 取1 μL RNA溶液于2%的变性琼脂糖凝胶中进行电泳, 测定总RNA的完整性.
1.2.2 逆转录: 取1 μg总RNA使用PrimeScriptTM RT reagent Kit试剂盒进行cDNA的合成, 具体操作参照使用说明.
1.2.3 DNA提取: 按经典苯酚-氯仿方法提取肿瘤组织及对应的正常组织的基因组DNA, 紫外分光光度计测定DNA浓度和纯度.
1.2.4 DNA亚硫酸氢盐修饰: 10 μg基因组DNA内加入5 μL浓度为3 mol/L的NaoH裂解液, 37 ℃变性20 min后加入2 mol/L亚硫酸氢钠(pH5.0)520 μL和0.2 mol/L的氢醌30 μL, 50 ℃水浴16-18 h, 于l mL DNA纯化树脂中加入DNA样品及8%异丙醇2 mL滤析, 3 mol/L的醋酸钠与100%乙醇沉淀, 离心弃上清, 自然干燥, 加20 μL TE溶液溶解, -20 ℃保存.
1.2.5 PCR扩增: real time RT-PCR及qMSP方法的PCR扩增及熔解曲线分析均使用ABI 7500 PCR仪(Applied Biosystems), 采用20 μL的反应体系, 具体操作参照SYBR Premix Taq Ex Taq kit的说明书. 反应过程具体为: 50 ℃激活聚合酶2 min, 95 ℃预变性10 min; 95 ℃变性15 s, 60 ℃退火和延伸1 min, 扩增40个循环. 结束后通过95 ℃ 15 s, 60 ℃ 1 min, 85 ℃ 15 s, 60 ℃ 15 s制作熔解曲线.
统计学处理 应用SPSS16.0统计学软件, 各组间率的差异统计学意义比较采用χ2检验、似然比χ2检验或Fisher's确切概率法, 生存曲线采绘制用乘积极限法(Kaplan-Meier)进行单因素生存分析, 对数秩检验(Log-Rank test)进行生存曲线比较, P<0.05有统计学意义.
在49例ESCC标本中有26(53.06%)例出现了相对于正常食管组织的RASSF1A mRNA表达下调, 5(10.20%)例表达上调, 18(36.73%)例无明显差异, RASSF1A mRNA在ESCC与癌旁正常食管上皮组织中的表达具有显著性差异(P = 0.000). RASSF1A的转录表达缺失与淋巴结转移及临床TNM分期相关, 无淋巴结转移的ESCC组织中RASSF1A mRNA表达缺失率为18.2%, 有淋巴结转移者的ESCC组织中RASSF1A mRNA表达缺失率为81.5%, 两者比较存在显著统计学差异(P = 0.000); 早期(Ⅰ/Ⅱ期)ESCC组织中RASSF1A mRNA的表达缺失率为23.8%, 晚期(Ⅲ/Ⅳ期)ESCC组织中RASSF1A mRNA的表达缺失率为80.8%, 两者相比存在显著统计学差异(P = 0.000); 而与性别、肿瘤位置、分化程度、浸润深度、远处转移情况等均无显著相关(P>0.05, 表1).
| 临床病理参数 | n | 表达正常或上调 | 表达下调 | P值 |
| 性别 | 0.448 | |||
| 男 | 41 | 18 | 23 | |
| 女 | 8 | 5 | 3 | |
| 肿块位置 | 0.980 | |||
| 食管中上段 | 15 | 7 | 8 | |
| 食管下段 | 24 | 16 | 18 | |
| 分化程度 | 0.319 | |||
| G1-G2 | 14 | 5 | 9 | |
| G3 | 35 | 18 | 17 | |
| 浸润深度 | 0.128 | |||
| T1-T2 | 20 | 12 | 8 | |
| T3-T4 | 29 | 11 | 18 | |
| 淋巴结转移情况 | 0.000 | |||
| N0 | 19 | 15 | 4 | |
| N1 | 30 | 8 | 22 | |
| 远处转移情况 | 0.237 | |||
| M0 | 46 | 23 | 23 | |
| M1 | 3 | 0 | 3 | |
| 分期 | 0.000 | |||
| Ⅰ/Ⅱ期 | 23 | 18 | 5 | |
| Ⅲ/Ⅳ期 | 26 | 5 | 21 |
在49例ESCC标本中, RASSF1A基因启动子区域5'-CpG岛异常甲基化的有38(77.6.0%)例, 与之相对应的癌旁正常食管组织中仅有3(6.1%)例, 两者差异有统计学意义(P<0.05). RASSF1A基因启动子区域5'-CpG岛高甲基化与淋巴结转移及临床TNM分期相关, 无淋巴结转移的ESCC组织中RASSFIA基因启动子高甲基化发生率为36.4%, 有淋巴结转移的ESCC组织其发生率为83.3%, 两者之间的差异有统计学意义(P = 0.000); TNM分期中早期(Ⅰ/Ⅱ期)ESCC组织中RASSFIA基因启动子完全甲基化发生率为41.7%, 晚期(Ⅲ/Ⅳ期)的发生率为82.6%, 两者之间有显著的差异(P = 0.001); 而与性别、肿瘤位置、分化程度、浸润深度、远处转移情况等均无显著相关(P>0.05). 其中远处转移组织只有3例, 可能存在标本例数太少影响统计分析结果(表2).
| 临床病理特征 | RASSF1A | P值 | ||
| U(非甲基化) | U/M | M(甲基化) | ||
| 性别 | 0.345 | |||
| 男 | 10 | 10 | 21 | |
| 女 | 1 | 4 | 3 | |
| 肿块位置 | 0.352 | |||
| 食管中上段 | 6 | 2 | 17 | |
| 食管下段 | 5 | 12 | 7 | |
| 分化程度 | 0.911 | |||
| G1-G2 | 5 | 0 | 9 | |
| G3 | 6 | 14 | 15 | |
| 浸润深度 | 0.256 | |||
| T1-T2 | 6 | 7 | 7 | |
| T3-T4 | 5 | 7 | 17 | |
| 淋巴结转移情况 | 0.000 | |||
| 无 | 7 | 11 | 4 | |
| 有 | 4 | 3 | 20 | |
| 远处转移情况 | 0.106 | |||
| 无 | 11 | 14 | 21 | |
| 有 | 0 | 0 | 3 | |
| 分期 | 0.001 | |||
| Ⅰ/Ⅱ期 | 7 | 11 | 5 | |
| Ⅲ/Ⅳ期 | 4 | 3 | 19 | |
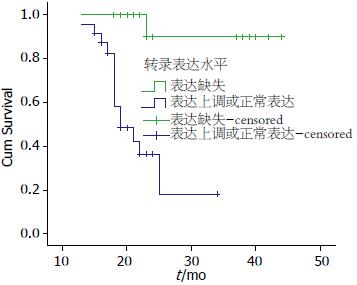
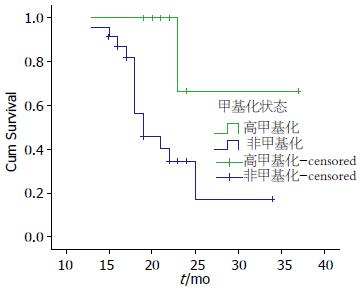
RASSF1A基因转录表达缺失的ESCC患者的中位生存时间为22.253 mo, 而与之相对应的RASSF1A mRNA无表达缺失的ESCC患者的中位生存时间为41.667 mo, 二者之间有显著统计学差异(χ2 = 18.460, P = 0.000, 图1); RASSF1A基因高甲基化状态的ESCC患者的中位生存时间为21.933 mo, 而与之相对应的RASSF1A基因非甲基化的ESCC患者的中位生存时间为32.333 mo, 二者之间有显著统计学差异(χ2 = 7.518, P = 0.006, 图2).
在26例RASSF1A基因转录表达缺失的ESCC组织中有24例发生了启动子区域的高甲基化, 23例没有RASSF1A mRNA表达缺失的ESCC组织中未发现有RASSF1A基因启动子区域5'-CpG岛高甲基化的情况, RASSF1A基因转录表达缺失与启动子高甲基化显著相关(P = 0.000).
RASSF1A基因是2000年从肺癌患者肿瘤组织中克隆出来的一个新型候选抑癌基因[6], 其抑制肿瘤发生发展的确切机制还不十分清楚, 目前很多学者认为主要通过以下机制发挥作用: (1)参与细胞凋亡[7]: 与Ras效应蛋白Norel通过非同源的氮末端片段相互形成异二聚体, 共同影响Ras相关的凋亡信号通路; (2)影响有丝分裂过程[8]: 与微管结合而改变微管的稳定性, 从而调节有丝分裂的进展; (3)调节细胞周期[9]: 抑制细胞周期蛋白D1(cyclin D1)的积聚而控制细胞周期G1期向S期转变, 使细胞周期停滞在G1/S期, 阻止细胞周期进展而抑制肿瘤生长. 故RASSF1A基因的表达缺失将会引起细胞恶变, 导致肿瘤形成. RASSF1A基因几乎在所有的正常组织中表达, 而在肺癌、乳腺癌、前列腺癌、肝癌等人类多种恶性肿瘤组织中表达缺失[3-5,10-11]. 因此, 被认为是一个广谱的抑癌基因.
本研究采用real time RT-PCR方法检测了49例原发ESCC组织及相应的癌旁正常食管组织中RASSF1A基因的转录表达水平. 结果发现, 相对于正常食管组织, 在49例ESCC标本中有26(53.06%)例出现了RASSF1A基因的转录表达下调, RASSF1A mRNA在ESCC组织及其对应的癌旁正常组织中的表达存在显著统计学差异(P<0.05). 在与临床病理等参数关系的统计学分析中发现, 有淋巴结有转移的ESCC标本中RASSF1A mRNA的表达缺失率明显高于无淋巴结转移组, 差异有统计学意义(81.5% vs 18.2%, P<0.05); RASSF1A基因转录水平的表达缺失与ESCC患者的临床TNM分期也密切相关, 分期越晚, 表达缺失率越高, Ⅰ/Ⅱ期与Ⅲ/Ⅳ期比较存在显著统计学差异(P<0.05). 该研究结果与之前其他学者的研究结果相仿[6,12-14], 再次证实了RASSF1A基因可能是ESCC的一个候选抑癌基因、预后相关的潜在因子.
对于ESCC中RASSF1A基因转录表达缺失的机制已有了一些初步的研究, 目前普遍认为与该基因启动子区域5'-CpG岛的高甲基化相关[12,15,16]. 体外实验研究发现[6], 对RASSF1A mRNA不表达、RASSF1A启动子区域5'-CpG岛的高甲基化的细胞给予药物(5'-氮-2'-脱氧胞苷)处理后可观察到RASSF1A的去甲基化及RASSF1A mRNA的重新表达. 因此, 在本研究中, 我们采用qMSP方法对49例ESCC患者的肿瘤组织及对应的癌旁正常食管组织进行甲基化状态观察. 结果显示, 在49例ESCC组织标本中RASSF1A基因启动子区域5'-CpG岛异常甲基化的发生率为77.6%, 高于其他学者的研究结果, 可能跟我们所采用的qMSP方法具有更高的灵敏性有关. 与临床病理等参数关系的统计学分析结果显示, 有淋巴结转移的、晚期(Ⅲ/Ⅳ期)的ESCC患者RASSF1A基因启动子区域5'-CpG岛高甲基化的发生率更高. 结合ESCC组织中RASSF1A基因转录表达情况和甲基化状态研究结果发现, RASSF1A基因转录表达缺失与启动子高甲基化显著相关(P = 0.000). 该结果提示, RASSF1A基因启动子区域5'-CpG岛高甲基化导致该基因转录表达缺失, 并且可能与ESCC的不良预后相关.
在预后的相关性方面, 之前的研究都是通过RASSF1A基因的转录表达缺失或异常甲基化与病理参数的相关性分析结果来推测RASSF1A基因与预后的关系[6,13-16], 而直接做患者术后生存情况随访进行RASSF1A基因与ESCC患者预后情况关系的分析的研究还不多. 我们采用Kaplan-Meier法绘制生存曲线、对数秩检验(Log-rank test)进行生存曲线比较, 分析RASSF1A基因的转录表达缺失和启动子区域5'-CpG岛高甲基化状态与ESCC患者预后之间的关系. 结果显示, RASSF1A基因转录表达缺失、启动子区域5'-CpG岛高甲基化的ESCC患者的术后生存时间均明显比对照组短. 因此, 本研究结果更直接的证实了RASSF1A基因是ESCC的一个预后不良因素.
总之, RASSF1A基因启动子5'-CpG岛高甲基化在ESCC中是一高频分子事件, 与该基因的转录表达缺失显著相关, 是RASSF1A基因转录表达缺失的主要机制之一. RASSF1A基因的转录表达缺失及其启动子区域5'-CpG岛的高甲基化与ESCC患者的淋巴结转移、TNM分期及预后不良显著相关, 提示RASSF1A基因可作为ESCC预后的预测因子之一. 相信随着RASSF1A基因在ESCC中的研究, 尤其是机制方面研究地进一步深入, 将会为ESCC预后评估及临床个性化治疗提供更加客观的理论依据.
RASSF1A基因是位于3p21.3上的一种新型的候选抑癌基因, 与多种人类肿瘤有关. 已有研究表明, RASSF1A基因是继P16基因以来所发现的在肿瘤中甲基化程度最高、最广泛的基因之一, 该基因的转录表达缺失与其启动子区域5'-CpG岛高甲基化有着广泛的肿瘤谱.
吕宾, 教授, 浙江中医学院附属医院消化科
RASSF1A基因是2000年从肺癌患者肿瘤组织中克隆出来的一个新型候选抑癌基因, 其抑制肿瘤发生发展的确切机制还不十分清楚.
Komori等在实验性炎症性肠病的大肠黏膜损伤部位见到外源的骨髓细胞定植.
本研究结果更直接地证实了RASSF1A基因是ESCC的一个预后不良因素.
RASSF1A基因启动子5'-CpG岛高甲基化在ESCC是一高频分子事件, 与该基因的转录表达缺失显著相关, 是其转录表达缺失的主要机制之一.
本文设计合理, 方法可靠, 结果可信, 对于进一步探明RASSF1A基因在食管癌发生发展中的作用和机制有重要的意义.
编辑: 李军亮 电编:何基才
| 1. | Qin YR, Wang LD, Fan ZM, Kwong D, Guan XY. Comparative genomic hybridization analysis of genetic aberrations associated with development of esophageal squamous cell carcinoma in Henan, China. World J Gastroenterol. 2008;14:1828-1835. [PubMed] [DOI] |
| 2. | De Jong WK, Verpooten GF, Kramer H, Louwagie J, Groen HJ. Promoter methylation primarily occurs in tumor cells of patients with non-small cell lung cancer. Anticancer Res. 2009;29:363-369. [PubMed] |
| 3. | Kioulafa M, Kaklamanis L, Mavroudis D, Georgoulias V, Lianidou ES. Prognostic significance of RASSF1A promoter methylation in operable breast cancer. Clin Biochem. 2009;42:970-975. [PubMed] [DOI] |
| 4. | Benbrahim-Tallaa L, Waterland RA, Dill AL, Webber MM, Waalkes MP. Tumor suppressor gene inactivation during cadmium-induced malignant transformation of human prostate cells correlates with overexpression of de novo DNA methyltransferase. Environ Health Perspect. 2007;115:1454-1459. [PubMed] |
| 5. | Serth J, Tezval H, Peters I, Atschekzei F, Rehmet K, Jurk S, Albrecht K, Kuczyk MA, Merseburger AS. [Methylation of the RASSF1A tumor suppressor gene promoter. Risk factor for carcinogenesis of urological tumors]. Urologe A. 2008;47:1117-1118, 1120-1121. [PubMed] |
| 6. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet. 2000;25:315-319. [PubMed] [DOI] |
| 7. | Agathanggelou A, Cooper WN, Latif F. Role of the Ras-association domain family 1 tumor suppressor gene in human cancers. Cancer Res. 2005;65:3497-3508. [PubMed] [DOI] |
| 8. | Shivakumar L, Minna J, Sakamaki T, Pestell R, White MA. The RASSF1A tumor suppressor blocks cell cycle progression and inhibits cyclin D1 accumulation. Mol Cell Biol. 2002;22:4309-4318. [PubMed] [DOI] |
| 9. | Baksh S, Tommasi S, Fenton S, Yu VC, Martins LM, Pfeifer GP, Latif F, Downward J, Neel BG. The tumor suppressor RASSF1A and MAP-1 link death receptor signaling to Bax conformational change and cell death. Mol Cell. 2005;18:637-650. [PubMed] [DOI] |
| 10. | Donninger H, Vos MD, Clark GJ. The RASSF1A tumor suppressor. J Cell Sci. 2007;120:3163-3172. [PubMed] [DOI] |
| 11. | Newell P, Toffanin S, Villanueva A, Chiang DY, Minguez B, Cabellos L, Savic R, Hoshida Y, Lim KH, Melgar-Lesmes P. Ras pathway activation in hepatocellular carcinoma and anti-tumoral effect of combined sorafenib and rapamycin in vivo. J Hepatol. 2009;51:725-733. [PubMed] [DOI] |
| 12. | Yamaguchi S, Kato H, Miyazaki T, Sohda M, Kimura H, Ide M, Asao T, Kuwano H. RASSF1A gene promoter methylation in esophageal cancer specimens. Dis Esophagus. 2005;18:253-256. [PubMed] [DOI] |
| 13. | Guo C, Tommasi S, Liu L, Yee JK, Dammann R, Pfeifer GP. RASSF1A is part of a complex similar to the Drosophila Hippo/Salvador/Lats tumor-suppressor network. Curr Biol. 2007;17:700-705. [PubMed] [DOI] |
| 14. | Cong DG, Wang SF, Zhang TW. [mRNA expression of RASSF1A in esophageal squamous cell carcinoma and clinical significance thereof]. Zhonghua Yixue Zazhi. 2006;86:1624-1627. [PubMed] |
| 15. | Kuroki T, Trapasso F, Yendamuri S, Matsuyama A, Alder H, Mori M, Croce CM. Promoter hypermethylation of RASSF1A in esophageal squamous cell carcinoma. Clin Cancer Res. 2003;9:1441-1445. [PubMed] |
| 16. | Lo PH, Xie D, Chan KC, Xu FP, Kuzmin I, Lerman MI, Law S, Chua D, Sham J, Lung ML. Reduced expression of RASSF1A in esophageal and nasopharyngeal carcinomas significantly correlates with tumor stage. Cancer Lett. 2007;257:199-205. [PubMed] [DOI] |