修回日期: 2010-08-17
接受日期: 2010-08-24
在线出版日期: 2010-10-08
目的: 探讨原发性食管非典型纤维黄色瘤患者的临床病理学特征、诊断、鉴别诊断、治疗方法和预后.
方法: 以中国人民解放军南京军区福州总医院收治的1例原发性食管非典型纤维黄色瘤患者为对象, 分析其临床表现及诊疗经过, 并进行随访, 同时对送检标本进行病理学检查, 结合有关文献探讨该病的临床病理学特点.
结果: 肿瘤位于中段食管, 呈膨胀性生长. 组织学上可见肿瘤细胞位于食管黏膜鳞状上皮下, 和上皮界限清楚. 肿瘤细胞呈梭形、上皮样、多角形或不规则形, 异型性明显, 易见单核、双核及多核瘤巨细胞, 且单核、双核及多核瘤巨细胞的形态有相似性, 胞质丰富, 淡染或略嗜伊红, 可见病理性核分裂像(<2个/50 HPF). 免疫组织化学显示肿瘤细胞呈CD68, CD163, S-100, 波形蛋白(vimentin)强阳性表达, α-SMA, h-caldesmon灶性表达, Ki-67(MIB-1)增殖指数约8%, 肿瘤细胞不表达Ckpan, EMA, CK(L), CK(H), F8, CD34, CD117, Dog-1, actin, desmin, CD10, CD99. 病理诊断为原发性食管非典型纤维黄色瘤.
结论: 原发性食管非典型纤维黄色瘤是一种十分罕见的良性间叶源性肿瘤, 临床与病理上均需要与食管肉瘤样癌、癌肉瘤、平滑肌瘤、胃肠道间质瘤、恶性纤维组织细胞瘤等相鉴别, 预后较好.
引文著录: 黄海建, 余英豪, 郑智勇. 原发性食管非典型纤维黄色瘤的临床病理特征. 世界华人消化杂志 2010; 18(28): 3020-3025
Revised: August 17, 2010
Accepted: August 24, 2010
Published online: October 8, 2010
AIM: To explore the clinical and pathological features of primary atypical fibrous xanthoma of the esophagus, and to analyze its diagnosis, treatment and prognosis.
METHODS: One case of primary atypical fibrous xanthoma of the esophagus treated at Fuzhou General Hospital of Nanjing Military Command of Chinese PLA was analyzed in this study. The diagnosis, treatment and follow-up data as well as histopathological and immunohistochemistry data for the disease were analyzed to reveal the clinicopathologic characteristics of the disease.
RESULTS: The tumor was located under the squamous epithelium of the upper esophagus, with a clear boundary. Histopathological analysis showed that the tumor was composed of cells of spindle, polygonal and irregular shape, collagen fibers, and esophageal glands. The tumor cells consisted of mononuclear, binuclear and polynuclear giant cells that shared some similar morphological characteristics. Mononuclear, binuclear and polynuclear giant cells could be detected in the transitional area. Some areas revealed pathological mitosis (< 2/50 HPF). Immunohistochemistry analysis showed that the tumor cells were strongly positive for CD68, CD163, S-100, and vimentin, weakly positive for α-SMA, h-caldesmon, and Ki-67 (proliferation index: ~8%), but negative of CKpan, EMA, CK (L), CK (H), F8, CD34, CD117, Dog-1, actin, desmin, CD10, and CD99.
CONCLUSION: Primary atypical fibrous xanthoma of the esophagus is an extremely rare mesenchymal tumor with benign behavior and good prognosis. A differential diagnosis should be made among atypical fibrous xanthoma of the esophagus, esophageal sarcomatoid carcinoma, carcinoma-sarcoma, leiomyoma, gastrointestinal stromal tumor, and malignant fibrous histiocytoma.
- Citation: Huang HJ, Yu YH, Zheng ZY. Clinicopathologic analysis of primary atypical fibrous xanthoma of the esophagus. Shijie Huaren Xiaohua Zazhi 2010; 18(28): 3020-3025
- URL: https://www.wjgnet.com/1009-3079/full/v18/i28/3020.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i28.3020
非典型纤维黄色瘤(atypical fibrous xanthoma, AFX)系指纤维组织细胞发生的良性肿瘤[1], 1963年由Helwig首次报道, 1973年Helwig再次总结了AFX的临床病理学特点, 此后AFX逐渐为人们所认识. AFX多见于老年人, 主要发生于皮肤及皮下软组织, 罕见于深部组织及器官[2]. AFX预后较好, 少部分可以复发和转移[3]. AFX可以单独发生, 也可以合并其他肿瘤, 如伴发于鳞状细胞癌、恶性黑色素瘤[4-6]、蕈样霉菌病等[7]. 原发于食管的AFX非常罕见, 通过CNKI和PubMed检索国内外文献至今未见报道. AFX的临床及组织学表现复杂多变, 尤其是发生于内脏器官者, 诊断困难[8]. 原发于食管的AFX在临床及影像学上均不具特异性, 容易误诊. 现对中国人民解放军南京军区福州总医院病理科近期诊断的1例原发性食管AFX进行报道, 并结合相关文献以提高对该病的认识, 为该病的治疗及预后提供依据.
男, 55岁, 因"进行性吞咽困难、胸痛1 mo余"于2009-12-5入院, 疼痛为阵发性胀痛, 无明显诱因. 本次入院后体检: 一般状态. 胸部CT检查食管中段管壁不规则增厚, 管腔狭窄, 考虑食管癌可能性大. 肿瘤标志物检查无异常. 治疗: 食管肿瘤切除、胃食管吻合术. 术中所见: 肿瘤位于中段食管黏膜下组织内, 大小约3.5 cm×2 cm×3 cm, 边界清楚, 遂将肿瘤予以剥离, 手术标本送病理检查. 术后1 mo痊愈出院, 手术后7 mo胸部增强CT扫描示食管未见异常.
手术: 结合术中超声, 将食管中段、食管病灶及少量胃组织切除. 手术标本经40 g/L甲醛固定, 常规石蜡包埋, 4 μm厚连续切片, HE染色. 采用EliVision法分别进行CD68, CD163, S-100, 波形蛋白(vimentin), 平滑肌肌动蛋白α(α-smooth muscle actin, α-SMA), 高分子质量钙调蛋白(the high molecular weight form of caldesmon, h-caldesmon), Ki-67(MIB-1), CKpan, EMA, CK(L), CK(H), F8, CD34, CD117, Dog-1, 肌动蛋白(actin), 肌间线蛋白(desmin), CD10, CD99免疫组织化学染色, 光镜观察. 所用一抗和EliVision试剂盒均购自福建迈新生物技术有限公司.
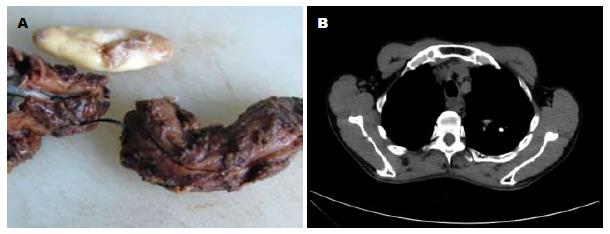
部分食管及胃切除标本: 食管一段, 长4 cm, 上切直径1 cm, 下切直径1.2 cm, 距上切1 cm食管黏膜表面见一缺损区域, 面积1 cm×0.8 cm. 余食管黏膜光滑, 灰白色, 未见肿物及溃疡. 部分胃组织: 大弯长4.5 cm, 小弯长3.5 cm, 食管贲门切缘直径1.5 cm, 胃切缘直径4 cm, 胃黏膜见少量黏液附着, 胃小凹清晰, 黏膜光滑, 未见肿物及溃疡. 另见一孤立灰黄色结节, 大小为4.5 cm×2 cm×2.7 cm, 包膜完整, 表面光滑, 切面灰白色, 编织状, 质硬, 其上见少量食管黏膜组织, 灰白色, 光滑(图1A).
胸部CT检查: 食管中段管壁不规则增厚区域, 管腔狭窄, 大小约为3.5 cm×2 cm×2.5 cm, 增强扫描呈重度强化, 平扫和增强扫描CT值约27-29 Hu, 63-74 Hu, 影像学及临床均考虑食管癌可能性大(图1B).
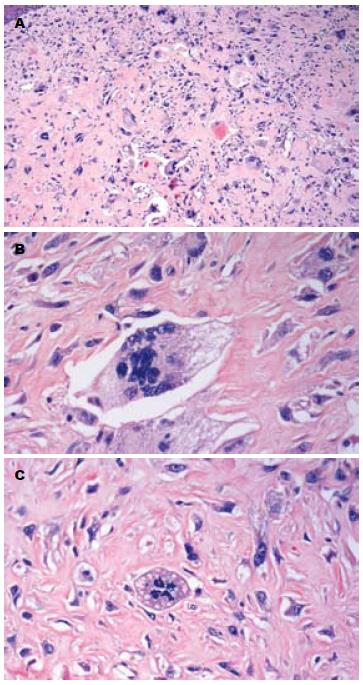
肿瘤细胞位于食管黏膜鳞状上皮下, 和上皮界限清楚(图2A); 肿瘤细胞呈梭形、多角形或不规则形, 异型性明显, 易见单核、双核及多核瘤巨细胞, 并且单核、双核及多核瘤巨细胞的形态有相似性, 均胞质丰富, 淡染或略嗜伊红(图2B), 可见病理性核分裂像(<2个/50 HPF, 图2C); 肿瘤细胞排列呈束状或不规则状, 部分区纤维组织增生伴玻璃样变; 间质内可见萎缩的食管腺体, 部分代偿性扩张伴黏液潴留, 肿瘤细胞排列于腺体的周边, 但无腺体侵犯. 胃组织为中度慢性萎缩性胃炎, 伴黏膜糜烂及幽门螺旋杆菌感染.
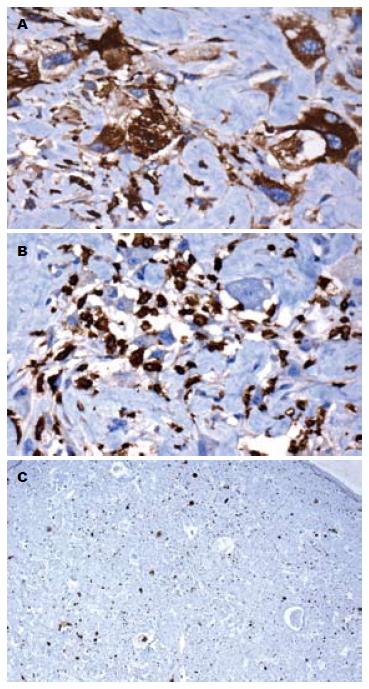
免疫组织化学显示肿瘤细胞中CD68(图3A), CD163(图3B), S-100, vimentin强阳性表达, 肿瘤细胞灶性表达α-SMA, h-caldesmon, Ki-67(MIB-1)增殖指数约8%(图3C), 肿瘤细胞不表达CKpan, EMA, CK(L), CK(H), F8, CD34, CD117, Dog-1, actin, desmin, CD10, CD99.
病理诊断其为原发性食管非典型纤维黄色瘤.
AFX是一种中间型纤维组织细胞瘤的亚型, 大多数呈良性发展过程, 约7%-12%可复发[9], 1%可发生远处转移[10]. 大样本回顾性的研究显示, AFX人群呈明显的双峰分布, 第1个高峰即少部分AFX, 见于中年人(40-50岁), 主要见于躯干和四肢, 且无日光照射及局部皮肤损伤病史; 第2个高峰则为大部分AFX, 见于老年人(70-80岁), 主要发生于脸、鼻及耳等部位, 且有日光照射及局部皮肤损伤病史[11]. 但是新近的研究显示AFX人群呈单峰分布特点, 以老年人为主, 55-95(中位年龄77)岁, 多见于男性, 好发于头颈部, 如脸、耳、鼻等日光照射部位. AFX罕见原发于内脏器官, 常呈膨胀性生长(36.4%), 极少数呈浸润性生长(6.1%), 可有短暂快速生长的病史[12]. 通常认为AFX和日光紫外线照射有关, 但少数病例和放射及灼伤有关. 86%的患者可检测到P53基因异常, 后者和许多肿瘤的发生有关, Bax和Gadd45是P53的效应蛋白, Bax是促细胞凋亡Bcl-2基因家族的一个亚型, Gadd45是DNA损伤修复基因相关蛋白, 在某些AFX病例中, Gadd45和Bax有过表达, 这和高级别的恶性纤维组织细胞瘤相似, 提示二者的组织发生有相似之处[13,14]. 个别病例有慢性白血病病史, 此外, 一些肾脏和心脏移植患者在使用了免疫抑制剂后, 也可出现AFX[15]. 目前国内外无食管原发性AFX的报道, 其发生发展的确切机制尚未阐明. 临床上AFX通常为孤立性息肉样或溃疡型肿块, 直径1-2 cm[11], 罕见多发性肿块, 可有局部不适等症状, 发生于食管者, 可有吞咽困难、食管异物感等症状.
食管原发性AFX的诊断主要依赖临床、影像学及病理组织学, 确诊需病理形态学和免疫组织化学. 核共振成像检查有利于早期发现病灶及食管以外的病变[16]. 病理学特点包括: (1)肿瘤位于食管黏膜下组织, 和上皮界限清楚. (2)易见单核、双核及多核瘤巨细胞, 并且单核、双核及多核瘤巨细胞的形态有相似性, 单核细胞呈梭形或上皮样. 根据细胞组成, AFX可以是上皮细胞和梭形细胞混合型(60.6%), 梭形细胞为主型(19.7%), 纯梭形细胞型(13.6%), 上皮细胞为主型(6.1%). 肿瘤可以有出血及假血管瘤(24.2%), 肉芽肿样(22.7%), 瘢痕样(9.1%), 黏液样(7.6%), 多核破骨巨细胞样(6.1%)及透明细胞型(4.6%)等[12]. 但最常见为上皮样和梭形细胞混合型[17]. (3)免疫组织化学显示肿瘤细胞表达组织细胞的免疫标志物, 如CD68(57%), CD163(79%)等[18], 其次α-SMA(41%)、EMA(24.4%)和CD31(9.5%)[12], CD10(22.5%), CD99(8%)也可灶性阳性[19], 肿瘤细胞一般不表达S-100、CK-MNF116、CKpan及desmin[20]. 另外透明细胞型可表达HMB-45[21]. (4)电镜及遗传学观察, 超微结构显示肿瘤细胞具有组织细胞和纤维母细胞的特点, 前者具有溶酶体、吞噬体、脂滴及稀疏的网状纤维, 而后者有丰富的网状纤维、分化好的高尔基体[22]. 比较基因组杂交技术显示AFX病例中9p和13p的缺失较为常见, 这和恶性纤维组织细胞瘤不同, 后者可检测到1q, 3p, 5q, 11p的缺失及7q, 12q的获得性增加, 且5q和11p缺失较为常见[23]. AFX一般无坏死、出血, 无血管、神经及肿瘤周围组织浸润, 出现时提示肿瘤恶性转化[24].
本例在诊断时, 临床及影像学均考虑为食管癌. 组织学上, 肿瘤细胞大小形态不一, 易见单核、双核及多核瘤巨细胞, 并且单核、双核及多核瘤巨细胞的形态有相似性, 胞质丰富, 淡染或略嗜伊红, 部分肿瘤细胞可见病理性核分裂像. 病理诊断时曾考虑AFX, 肉瘤样癌, 癌肉瘤, 平滑肌瘤, 胃肠道间质瘤, 恶性纤维组织细胞瘤等. 本例诊断为原发性食管AFX的依据是[25,26]: (1)临床及影像学均支持食管原发性肿瘤, 本例做了全身系统的影像学检查, 未发现食管以外的其他病变, 除外了皮肤AFX转移至食管的可能; (2)形态学符合AFX的典型特点; (3)免疫组织化学显示肿瘤细胞呈CD68, CD163, vimentin强阳性, Ki-67(MIB-1)增殖指数较低(约8%), 无出血坏死及组织浸润表现, 同时上皮(CKpan, EMA)和胃肠道间质瘤(CD34, CD117, Dog-1)免疫标志物阴性, 平滑肌瘤(α-SMA, h-caldesmon, actin, desmin)标记阴性或弱阳性.
本例瘤细胞呈单核、双核及多核瘤巨细胞, 胞质丰富, 淡染或略嗜伊红, 具有组织细胞的特点. 免疫组织化学显示瘤细胞呈vimentin, CD68, CD163强阳性表达, 支持肿瘤细胞由组织细胞分化而来, 但是瘤细胞呈S-100强阳性表达, 提示瘤细胞具有非一般组织细胞的特点, 目前文献对此现象未见有描述, 其意义尚不明. 其次文献报道CD10, CD99是AFX较为特异的免疫标志物, 具有诊断价值[27], 但是最近的研究显示CD10有较多的假阳性, 并不具特异性[28]. 本例肿瘤细胞不表达CD10, CD99, 这和文献的报道不尽一致[29]. actin是一种广谱的平滑肌肌动蛋白, 平滑肌源性肿瘤细胞常表达actin, 但本例瘤细胞呈actin阴性, 提示AFX瘤细胞无平滑肌细胞特征或无平滑肌方向分化[20], 这也说明肿瘤细胞不是由食管平滑肌分化而来. 另外本例易见病理性核分裂像, 提示肿瘤具有非典型性[30].
原发性食管AFX需结合肿瘤的发生部位及形态学特点与其他食管肿瘤进行鉴别. (1)肉瘤样癌, 又称梭形细胞癌, 肿瘤中应包含明确的恶性上皮性成分, 同时可见梭形细胞肉瘤样成分, 且两者之间有一定的移行. 免疫组织化学示肿瘤细胞上皮性标记CK(Pan), EMA等强阳性, 而间叶性标记弱阳性或阴性[31]. (2)癌肉瘤, 是指肿瘤中同时包含恶性上皮成分和间叶成分, 但二者之间没有移行; 上皮成分可以是腺癌、鳞状细胞癌或两者均有; 间叶成分表现为梭形细胞肉瘤, 包括骨肉瘤、软骨肉瘤、纤维肉瘤和横纹肌肉瘤等. 免疫组织化学显示肉瘤样细胞表达间叶性标记(vimentin), 而上皮性标记[CK(Pan), EMA]阴性[32]. (3)平滑肌瘤, 系平滑肌细胞发生的肿瘤, 形态学有时难与AFX鉴别, 但是前者表达肌源性标记, 如actin, α-SMA, h-caldesmon, desmin等可以与之鉴别[33]. (4)胃肠道间质瘤, 食管是胃肠道间质瘤的好发部位, 形态学主要为上皮样细胞和梭形细胞组成的软组织肿瘤, 所以需与AFX鉴别, 但前者有特异性的C-kit基因突变, 并表达间质瘤特异标志物CD117, 有助二者鉴别[34,35]. (5)恶性纤维组织细胞瘤, 系组织细胞发生的肿瘤, 尤其是分化好的恶性纤维组织细胞瘤, 形态学和AFX相似, 免疫表型也有重叠, 但是前者常呈浸润性生长, 侵犯血管、神经及横纹肌组织等, Ki-67(MIB-1)增殖指数高, 其次可检测到5q和11p的缺失, 可资鉴别[36]. (6)转移性食管AFX, 鉴于个别AFX可以发生远处转移, 因此, 诊断原发性食管AFX时, 需要排除转移性AFX可能, 鉴别的主要点是临床及影像学上均需排除原发病灶[37]. (7)恶性黑色素瘤(malignant melanoma, MM), 鉴于透明细胞型AFX不仅在组织学上和MM相似, 且可以表达HMB-45, 因此二者需要鉴别, 但是AFX总是表达组织细胞标志物, 如CD68, CD163等强阳性结果, 可与MM鉴别[18,38]. 此外, 还应根据肿瘤发生的部位和形态学表现及免疫组织化学结果与其他肿瘤, 如纤维组织细胞瘤、纤维肉瘤等相鉴别[24,39].
手术切除是治疗AFX的主要手段, 必要时可以辅以放疗和化疗[26], 也有学者建议应扩大手术切除, 但是近几年学者们多建议内镜治疗[40]. Ang等[41]通过对91例AFX的手术治疗进行20年的随访, 认为显微外科手术较扩大切除具有更大的优势. 大部分AFX呈惰性的发展过程, 生长缓慢, 手术完整切除后, 预后较好, 少数病例可局部复发, 个别可发生远处转移[42], 因此有必要对所有病例进行随访. 本例经手术完整切除后, 随访7 mo, CT检查无肿瘤复发及残留, 一般状况尚可.
志谢: 复旦大学附属肿瘤医院病理科朱雄增教授对本例的诊断给予了很大的帮助, 在此表示衷心感谢.
原发性食管非典型纤维黄色瘤(AFX)是一种罕见的食管间叶源性肿瘤, 与一般的食管肿瘤相比, 食管AFX的临床表现、形态学特征及预后等均有显著差异, 因此食管AFX的准确诊断对于提高该类肿瘤的认识显得尤为重要.
汪思应, 教授, 安徽医科大学实验动物中心
Ang等通过对91例AFX的手术治疗进行20年的随访, 认为显微外科手术较扩大切除具有更大的优势.
本文主要对1例接受手术治疗的原发性食管AFX的临床表现、CT影像学特征、病理形态学特征进行总结, 讨论原发性食管AFX的临床及病理形态学特征.
原发性食管AFX的临床及病理形态学表现均有一定的特征性, 肿瘤细胞位于食管黏膜鳞状上皮下, 和上皮界限清楚, 易见单核、双核及多核瘤巨细胞, 并且三者有相似性, 需病理形态学和免疫组织化学支持方能确诊.
本文新颖性较好, 病例罕见, 有助于临床鉴别诊断.
编辑: 曹丽鸥 电编:何基才
| 1. | Kim J, McNiff JM. Keloidal atypical fibroxanthoma: a case series. J Cutan Pathol. 2009;36:535-539. [PubMed] [DOI] |
| 2. | Sakamoto A. Atypical Fibroxanthoma. Clin Med Oncol. 2008;2:119-129. |
| 3. | Muenster MR, Hoang MP. Left facial mass in an elderly man. Metastasizing atypical fibroxanthoma of the skin. Arch Pathol Lab Med. 2006;130:735-736. [PubMed] |
| 4. | Wilsher MJ. Collision tumour: atypical fibroxanthoma and invasive melanoma. Pathology. 2009;41:699-701. [PubMed] [DOI] |
| 5. | Arsenovic N, Sen S, Naik V, Reed M, Moreira R. Trichilemmal cyst with carcinoma in situ within an atypical fibroxanthoma. Am J Dermatopathol. 2009;31:587-590. [PubMed] [DOI] |
| 6. | McGregor DH, Cherian R, Romanas MM, Ulusarac O, Mathur SC, Feldman MM. Amelanotic malignant melanoma: two collision tumors presenting as basal cell carcinoma and atypical fibroxanthoma. Ann Clin Lab Sci. 2008;38:157-162. [PubMed] |
| 7. | Avshalumov K, Williford P, Sangueza OP, Goldenberg G. Atypical fibroxanthoma presenting in a patient with stage III mycosis fungoides. J Dermatolog Treat. 2008;19:118-120. [PubMed] [DOI] |
| 8. | Paramanathan N, Gal A, Benger R. Paraffin histology sections and delayed repair in recurrent atypical fibroxanthoma of the eyelid. Orbit. 2009;28:380-382. [PubMed] [DOI] |
| 9. | Melendez MM, Xu X, McClain SA, Huang SI. Atypical fibroxanthoma in a young woman: An unusual case presentation. Can J Plast Surg. 2007;15:169-172. [PubMed] |
| 10. | Bugatti L, Filosa G. Dermatoscopic features of cutaneous atypical fibroxanthoma: three cases. Clin Exp Dermatol. 2009;34:e898-e900. [PubMed] [DOI] |
| 11. | Vandergriff TW, Reed JA, Orengo IF. An unusual presentation of atypical fibroxanthoma. Dermatol Online J. 2008;14:6. [PubMed] |
| 12. | Luzar B, Calonje E. Morphological and immunohistochemical characteristics of atypical fibroxanthoma with a special emphasis on potential diagnostic pitfalls: a review. J Cutan Pathol. 2010;37:301-309. [PubMed] [DOI] |
| 13. | Sakamoto A, Akieda S, Oda Y, Iwamoto Y, Tsuneyoshi M. Mutation analysis of the Gadd45 gene at exon 4 in atypical fibroxanthoma. BMC Dermatol. 2009;9:1. [PubMed] [DOI] |
| 14. | Sakamoto A, Oda Y, Tsuneyoshi M, Iwamoto Y. Expression of the UV-induced molecule, Gadd45, in atypical fibroxanthoma. Histopathology. 2007;50:939-941. [PubMed] [DOI] |
| 15. | Ferri E, Iaderosa GA, Armato E. Atypical fibroxanthoma of the external ear in a cardiac transplant recipient: case report and the causal role of the immunosuppressive therapy. Auris Nasus Larynx. 2008;35:260-263. [PubMed] [DOI] |
| 16. | Kalayanarooj S. Benign and malignant soft tissue mass: magnetic resonance imaging criteria for discrimination. J Med Assoc Thai. 2008;91:74-81. [PubMed] |
| 17. | Murali R, Palfreeman S. Clear cell atypical fibroxanthoma - report of a case with review of the literature. J Cutan Pathol. 2006;33:343-348. [PubMed] [DOI] |
| 18. | Pouryazdanparast P, Yu L, Cutlan JE, Olsen SH, Fullen DR, Ma L. Diagnostic value of CD163 in cutaneous spindle cell lesions. J Cutan Pathol. 2009;36:859-864. [PubMed] [DOI] |
| 19. | Mirza B, Weedon D. Atypical fibroxanthoma: a clinicopathological study of 89 cases. Australas J Dermatol. 2005;46:235-238. [PubMed] [DOI] |
| 20. | Morgan MB, Purohit C, Anglin TR. Immunohistochemical distinction of cutaneous spindle cell carcinoma. Am J Dermatopathol. 2008;30:228-232. [PubMed] [DOI] |
| 21. | Cai JP, Randall B. HMB-45 expression in a clear cell variant of atypical fibroxanthoma. J Cutan Pathol. 2006;33:186-188. [PubMed] [DOI] |
| 22. | Luzar B, Calonje E. Cutaneous fibrohistiocytic tumours - an update. Histopathology. 2010;56:148-165. [PubMed] [DOI] |
| 23. | Ashton KJ, Weinstein SR, Maguire DJ, Griffiths LR. Chromosomal aberrations in squamous cell carcinoma and solar keratoses revealed by comparative genomic hybridization. Arch Dermatol. 2003;139:876-882. [PubMed] [DOI] |
| 24. | Dettrick A, Strutton G. Atypical fibroxanthoma with perineural or intraneural invasion: report of two cases. J Cutan Pathol. 2006;33:318-322. [PubMed] [DOI] |
| 25. | Wollina U, Schönlebe J, Koch A, Haroske G. Atypical fibroxanthoma: a series of 25 cases. J Eur Acad Dermatol Venereol. 2010;24:943-946. [PubMed] [DOI] |
| 26. | Khong JJ, Muecke J. Complications of mitomycin C therapy in 100 eyes with ocular surface neoplasia. Br J Ophthalmol. 2006;90:819-822. [PubMed] [DOI] |
| 27. | Kemmerling R, Dietze O, Müller S, Neureiter D. Aspects of the differential diagnosis of clear-cell lesions of the skin in connection with the rare case of a clear-cell atypical fibroxanthoma. Pathol Res Pract. 2009;205:365-370. [PubMed] [DOI] |
| 28. | Clarke LE, Frauenhoffer E, Fox E, Neves R, Bruggeman RD, Helm KF. CD10-positive myxofibrosarcomas: a pitfall in the differential diagnosis of atypical fibroxanthoma. J Cutan Pathol. 2010;37:737-743. [PubMed] [DOI] |
| 29. | Kanner WA, Brill LB 2nd, Patterson JW, Wick MR. CD10, p63 and CD99 expression in the differential diagnosis of atypical fibroxanthoma, spindle cell squamous cell carcinoma and desmoplastic melanoma. J Cutan Pathol. 2010;37:744-750. [PubMed] [DOI] |
| 30. | Wright NA, Thomas CG, Calame A, Cockerell CJ. Granular cell atypical fibroxanthoma: case report and review of the literature. J Cutan Pathol. 2010;37:380-385. [PubMed] [DOI] |
| 31. | Gleason BC, Calder KB, Cibull TL, Thomas AB, Billings SD, Morgan MB, Hiatt KM, Smoller BR. Utility of p63 in the differential diagnosis of atypical fibroxanthoma and spindle cell squamous cell carcinoma. J Cutan Pathol. 2009;36:543-547. [PubMed] [DOI] |
| 32. | Zia-ur-Rehman , Pal I, Ahmed Z, Qureshi A. Carcinosarcoma of the esophagus. J Coll Physicians Surg Pak. 2010;20:282-284. [PubMed] |
| 33. | de Feraudy S, Mar N, McCalmont TH. Evaluation of CD10 and procollagen 1 expression in atypical fibroxanthoma and dermatofibroma. Am J Surg Pathol. 2008;32:1111-1122. [PubMed] [DOI] |
| 34. | Beer TW, Haig D. CD117 is not a useful marker for diagnosing atypical fibroxanthoma. Am J Dermatopathol. 2009;31:649-652. [PubMed] [DOI] |
| 35. | Grande C, Haller DG. Gastrointestinal stromal tumors and neuroendocrine tumors. Semin Oncol Nurs. 2009;25:48-60. [PubMed] [DOI] |
| 36. | Marcet S. Atypical fibroxanthoma/malignant fibrous histiocytoma. Dermatol Ther. 2008;21:424-427. [PubMed] [DOI] |
| 37. | Koch M, Dimmler A, Alexiou C. [Recurrent and metastasizing atypical fibroxanthoma]. HNO. 2008;56:1046-1051. [PubMed] |
| 38. | Jain M, Singh S, Agarwal K. Spindle cell neoplasm of skin: diagnostic dilemma. Indian J Pathol Microbiol. 2007;50:814-816. [PubMed] |
| 39. | Garrido-Ruiz MC, Ramos P, Enguita AB, Rodriguez Peralto JL. Subcutaneous atypical fibrous histiocytoma. Am J Dermatopathol. 2009;31:499-501. [PubMed] [DOI] |
| 40. | Thosani MK, Marghoob A, Chen CS. Current progress of immunostains in Mohs micrographic surgery: a review. Dermatol Surg. 2008;34:1621-1636. [PubMed] [DOI] |
| 41. | Ang GC, Roenigk RK, Otley CC, Kim Phillips P, Weaver AL. More than 2 decades of treating atypical fibroxanthoma at mayo clinic: what have we learned from 91 patients? Dermatol Surg. 2009;35:765-772. [PubMed] [DOI] |
| 42. | Mochizuki K, Yamada T, Mori Y, Sawada A, Mori I, Ohnishi Y. Case of atypical fibroxanthoma in the palpebral conjunctiva. Jpn J Ophthalmol. 2008;52:404-406. [PubMed] [DOI] |