修回日期: 2010-08-13
接受日期: 2010-08-17
在线出版日期: 2010-09-28
目的: 研究Pim-3基因的表达下调及其对食管鳞癌EC9706细胞增殖及凋亡的影响, 并探讨其可能的作用机制.
方法: 利用Pim-3 siRNA转染食管鳞癌EC9706细胞, 并利用RT-PCR和Western blot技术检测转染Pim-3 siRNA后食管鳞癌EC9706细胞中Pim-3的表达. 此外, 利用CCK-8试剂盒和流式细胞术分别研究下调Pim-3基因的表达对EC9706细胞增殖和凋亡的影响, 进一步利用RT-PCR和Western blot检测与增殖相关的P21基因, 与凋亡相关的Bcl-2、Bax基因的表达.
结果: 转染Pim-3后, Pim-3基因在食管鳞癌EC9706细胞中的表达明显下调(P<0.05). 与未处理组和对照siRNA组相比, Pim-3 siRNA组在转染24、48、72、96 h EC9706细胞的增殖均明显受到抑制(96 h: 0.878±0.061 vs 2.254±0.062, 2.219±0.064, 均P<0.05). 转染48 h后, Pim-3 siRNA组细胞早期凋亡率为19.70%±1.46%, 显著高于未处理组和对照siRNA组的早期凋亡率(5.35%±0.80%, 5.50%±0.61%, F = 195.692, P = 0.000). 此外, Pim-3表达的下调能引起P21和Bax基因表达的升高(均P<0.05), Bcl-2基因表达的下调(P<0.05).
结论: Pim-3可能在食管鳞癌EC9706细胞的增殖和凋亡中发挥重要作用.
引文著录: 王琛, 刘宇琼, 冯天平, 赵景志, 李惠翔. Pim-3基因表达下调及其对食管鳞癌EC9706细胞增殖和凋亡的影响. 世界华人消化杂志 2010; 18(27): 2846-2851
Revised: August 13, 2010
Accepted: August 17, 2010
Published online: September 28, 2010
AIM: To investigate the effect of down-regulation of Pim-3 expression on cell proliferation and apoptosis in esophageal squamous cell carcinoma (ESCC) cell line EC9706 and to explore possible molecular mechanisms involved.
METHODS: Small interfering RNA (siRNA) against the Pim-3 gene was transfected into EC9706 cells using LipofectamineTM 2000. After transfection, Pim-3 mRNA and protein expression was detected by RT-PCR and Western blot, respectively; cell proliferation was determined using Cell Counting Kit-8 (CCK-8); and apoptosis was measured by flow cytometry. Furthermore, the mRNA and protein expression of P21, Bcl-2 and Bax was detected by RT-PCR and Western blot, respectively.
RESULTS: Pim-3 mRNA and protein expression was significantly down-regulated after transfection with Pim-3 siRNA (both P < 0.05). Compared with untransfected cells and cells transfected with control siRNA, the proliferation of EC9706 cells was significantly restrained after transfection with Pim-3 siRNA for 24, 48, 72 and 96 h (96 h: 0.878 ± 0.061 vs 2.254 ± 0.062 and 2.219 ± 0.064, both P < 0.05), and the early apoptosis rate of EC9706 cells transfected with Pim-3 siRNA was significantly increased (19.70% ± 1.46% vs 5.35% ± 0.80% and 5.50% ± 0.61%, F = 195.692, P = 0.000). In addition, Pim-3 knockdown up-regulated P21 expression but down-regulated Bax and Bcl-2 expression in EC9706 cells (all P < 0.05).
CONCLUSION: Pim-3 plays an important role in the proliferation and apoptosis of EC9706 cells.
- Citation: Wang C, Liu YQ, Feng TP, Zhao JZ, Li HX. Pim-3 knockdown suppresses cell proliferation but promotes apoptosis in esophageal squamous cell carcinoma cell line EC9706. Shijie Huaren Xiaohua Zazhi 2010; 18(27): 2846-2851
- URL: https://www.wjgnet.com/1009-3079/full/v18/i27/2846.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i27.2846
Pim-3作为表达丝/苏氨酸激酶活性的原癌基因Pim家族中的一员, 首次在鼠嗜铬细胞瘤PC12细胞中作为去极化诱导基因KID-1被证实[1]. KID-1基因与原癌基因Pim-1和Pim-2序列高度一致, 于是命名为Pim-3[2]. 研究表明, Pim-3选择性在内皮起源的器官(包括肝脏[3]、胰腺[4])的恶性病变中表达, 但在正常组织中不表达[5]. 目前, 国内外研究者关于Pim-3的研究主要集中在肝癌[3]、胰腺癌[4]、结肠癌[5]等多种不同的肿瘤, 提示其与肿瘤的发生发展密切相关. 然而, 迄今为止, 在国内外均未见Pim-3在食管鳞癌中的研究报道. 因此在本研究中, 我们利用RNA干扰技术, 下调食管鳞癌细胞株EC9706细胞中Pim-3的表达, 通过RT-PCR和Western blot研究Pim-3 siRNA的转入对EC9706细胞中Pim-3 mRNA和蛋白表达的影响. 利用CCK-8(cell counting kit-8)细胞增殖试剂盒和流式细胞术分别研究下调Pim-3表达对EC9706细胞增殖和细胞凋亡的影响, 最后通过半定量RT-PCR和Western blot研究与细胞增殖相关的基因P21以及凋亡抑制因子Bcl-2和促凋亡基因Bax mRNAs和蛋白表达的变化, 以期为食管鳞癌的分子靶向治疗提供理论依据.
Pim-3 siRNA(h), Pim-3、P21、Bcl-2、Bax和β-actin抗体均购自美国Santa Cruz公司; 一步法RT-PCR试剂盒购自美国Promega公司; CCK-8购自中国Beyotime生物有限公司; 蛋白裂解液购自宝生物工程(大连)有限公司; Annexin V-FITC购自BD Biosciences公司; 用于RT-PCR的引物见表1, 引物均由上海生工生物工程技术服务有限公司合成.
| 引物名称 | 正反向引物(5'-3') | GenBank登录号 | 退火温度(℃) | 产物大小(bp) |
| Pim-3 | F: GCACGTGGTGAAGGAGCGGG | NM_001001852 | 56 | 499 |
| R: GAGAAGCACGCCCAGCGACC | ||||
| P21 | F: GCCCAGTGGACAGCGAGCAG | NM_000389 | 54 | 363 |
| R: GCCGCCGTTTTCGACCCTGA | ||||
| Bcl-2 | F: GTCCACCTGACCCTCCGCCA | NM_000633 | 54 | 285 |
| R: GGTGTGCAGGTGCCGGTTCA | ||||
| Bax | F: GCCGCCGTGGACACAGACTC | NM_138763 | 56 | 271 |
| R: GCCACGTGGGCGTCCCAAAG | ||||
| β-actin | F: ATATCGCCGCGCTCGTCGTC | NM_001101 | 55 | 125 |
| R: CACCATCACGCCCTGGTGCC |
1.2.1 细胞培养及转染: EC9706细胞生长于含100 mL/L胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI 1640培养液中, 置于37 ℃、50 mL/L CO2相对饱和的培养箱中传代培养, 实验细胞均处于对数生长期. 当EC9706细胞生长至大于90%融合时, 按LipofectamineTM 2000转染试剂说明书将对照siRNA和Pim-3 siRNA分别转染, 转染后细胞分为3组: 未处理组, 对照siRNA组及Pim-3 siRNA组, 将3组细胞分别用于下面实验, 如细胞增殖、细胞凋亡、RT-PCR及Western blot检测.
1.2.2 细胞增殖分析: CCK-8是一种灵敏的非放射性的比色分析方法, 在细胞增殖和细胞毒性实验中他可以检测活细胞的数量. CCK-8溶液可直接加入到细胞中进行检测, 具体的实验步骤为: 分别收集转染后24、48、72及96 h的细胞, 当测定生长速率时, 加入含10% CCK-8的等量新鲜培养基于37 ℃培养1-4 h, 然后用酶标仪测450 nm的吸光度.
1.2.3 Annexin V-FITC细胞凋亡分析: 转染后于48 h收获3组细胞, 预冷PBS洗涤, 按1×106/mL密度重悬, 然后取100 μL细胞置于流式管中, 加入Annexin V-FITC和碘化丙锭各5 μL, 避光孵育15 min后FCM检测1×104个细胞, CellQuest分析3组细胞凋亡情况.
1.2.4 半定量RT-PCR检测3组细胞RNA的表达: 利用TRIzol试剂分别从3组细胞中提取总RNA, 然后按照一步法RT-PCR试剂盒的操作说明书进行RT-PCR, 其反应程序为: 反转录反应50 ℃ 30 min, PCR初始变性94 ℃ 2 min, 然后35个循环94 ℃ 30 s, 退火30 s(不同基因退火温度见表1), 65 ℃延伸30 s. 实验中每个样品重复3次, Pim-3、P21、Bcl-2和Bax基因的相对表达量利用Image-Pro Plus软件进行分析, 其中β-actin作为内参.
1.2.5 Western blot检测3组细胞蛋白的表达: 收集48 h未处理和转染的EC9706细胞, 并在裂解缓冲液中进行裂解. 收集细胞提取物于12 000 r/min 5 min离心, 蛋白浓度用Bradford法进行测定. 60 µg总蛋白在上样缓冲液中煮沸5 min, 于10% SDS-PAGE电泳, 然后电转到硝酸纤维素膜上. 硝酸纤维素膜用含50 g/L脱脂奶粉的TBST于室温封闭2 h, 然后分别加一抗(和β-actin)于含5%脱脂奶粉的TBST中, 4 ℃过夜, 第2天, 用TBST清洗5 min×3次, 然后分别加合适的二抗作用1 h, 再次清洗5 min×3次, 曝光. 最后用Image-Pro Plus软件进行相对表达量分析.
统计学处理 应用SPSS13.0统计软件进行统计学处理, 统计学数据用mean±SD表示, 两样本均数比较采用t检验, 多个样本均数比较应用单因素方差分析, P<0.05表示具有统计学意义.
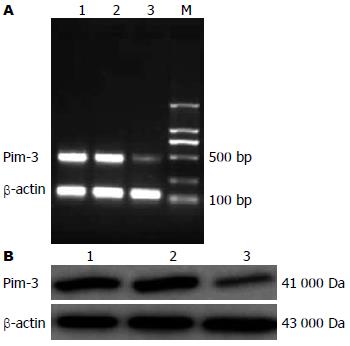
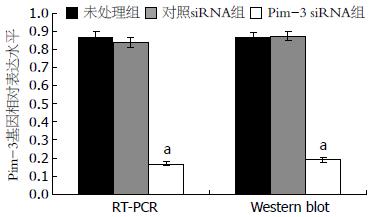
收集48 h 3组细胞, Pim-3 siRNA转染后, Pim-3基因的mRNA和蛋白均下降到约为未处理组和对照siRNA组的1/5, 未处理组和对照siRNA组之间Pim-3的表达无差异(P>0.05, 图1, 2). 这一结果表明, Pim-3 siRNA的转入能明显抑制Pim-3 mRNA和蛋白的表达.
分别收集24、48、72及96 h的3组细胞, 利用CCK-8进行细胞增殖分析, 结果表明, 在未处理组和对照siRNA组的EC9706细胞中, EC9706细胞的增殖没有差异(P>0.05). 但是, 与未处理组和对照siRNA组相比, Pim-3 siRNA组在转染24 h以后的各个不同时间点, EC9706细胞的增殖均明显受到抑制(P<0.05, 表2), 表明Pim-3基因表达的下调能明显抑制食管鳞癌EC9706细胞的增殖.
| 分组 | A450 | ||||
| 0 h | 24 h | 48 h | 72 h | 96 h | |
| 未处理组 | 0.435±0.051 | 0.757±0.046 | 1.266±0.039 | 1.813±0.057 | 2.254±0.062 |
| 对照siRNA组 | 0.443±0.043 | 0.779±0.041 | 1.275±0.044 | 1.801±0.062 | 2.219±0.064 |
| Pim-3 siRNA组 | 0.450±0.050 | 0.559±0.054a | 0.633±0.054a | 0.794±0.052a | 0.878±0.061a |
| F值 | 0.073 | 19.683 | 191.339 | 314.263 | 475.030 |
| P值 | 0.930 | 0.002 | 0.000 | 0.000 | 0.000 |
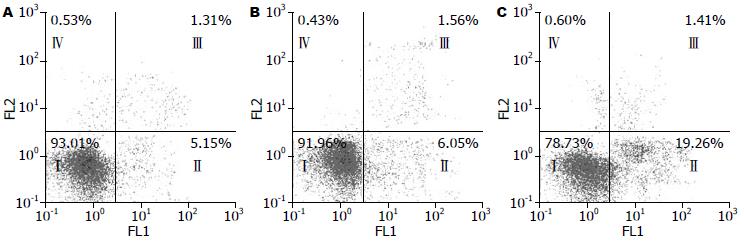
转染48 h后, Annexin V检测的Pim-3 siRNA组细胞早期凋亡率为19.70%±1.46%, 显著高于未处理组和对照siRNA组的早期凋亡率(5.35%±0.80%, 5.50%±0.61%, F = 195.692, P = 0.000), 而未处理组和对照siRNA组的EC9706的活细胞数分别为92.87%±1.52%和91.29%±2.01%, 显著高于Pim-3 siRNA组的活细胞数(78.03%±1.47%, F = 70.227, P<0.000, 图3, 4), 提示Pim-3基因表达下调能明显诱导EC9706细胞发生凋亡.
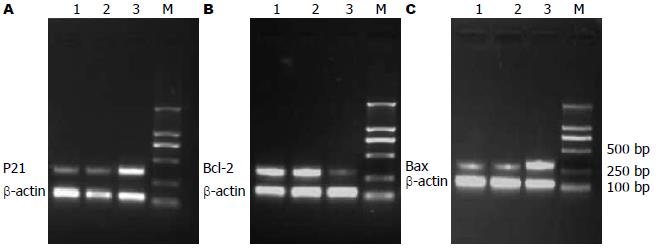
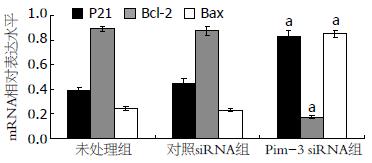
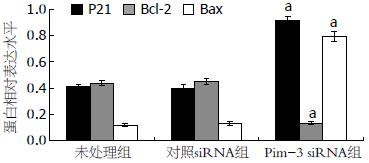
与未处理组和对照siRNA组相比, Pim-3 siRNA组中Bcl-2 mRNA和蛋白的表达均明显下调(P<0.05), 但P21和Bax mRNA和蛋白的表达水平明显上升, 且差异具有统计学意义(P<0.05). 此外, 未处理组和对照siRNA组之间上述基因的mRNA和蛋白的表达水平均没有差异(P>0.05, 图5-8).
食管鳞癌是一种侵袭性很强的恶性肿瘤, 多伴有转移, 且易复发, 其预后极差. 目前研究证明食管癌的发生发展是一个多阶段和多基因不断演变的过程, 但对其发病机制仍不十分清楚[6]. 长期以来, 如何从分子水平上来寻找食管癌可能的分子治疗靶点备受人们关注. Pim-3作为表达丝/苏氨酸激酶活性的原癌基因Pim家族中的一员, 近年来发现其与肿瘤的发生发展密切相关[3-5]. 但迄今为止, 国内外尚未见有关Pim-3在食管癌中的研究和报道. 因此在本研究中我们通过下调食管鳞癌细胞中Pim-3的表达, 分析其对食管鳞癌细胞EC9706增殖和凋亡的影响, 并初步探讨其可能的分子作用机制.
近年来, RNA干扰技术因具有高效、低毒、快捷等特点, 在抗肿瘤治疗中显示出巨大的应用前景. 在本研究中, 利用Pim-3 siRNA转染食管癌细胞, 通过半定量RT-PCR和Western blot检测转染前后Pim-3 mRNA和蛋白的表达. 结果表明, Pim-3的表达水平与未处理组和对照siRNA组相比, 大约下降了80%, 提示Pim-3 siRNA能有效地沉默食管鳞癌EC9706细胞中Pim-3基因的表达. 这为我们进一步研究Pim-3的下调对食管鳞癌EC9706细胞生物学行为的影响奠定了基础. 此外, 最近的研究显示, Pim-3与肿瘤的增殖、细胞周期改变以及细胞凋亡之间的关系十分密切[3,5]. 我们的结果显示, 转染Pim-3 siRNA后, 食管鳞癌EC9706细胞的增殖受到明显的抑制, 并诱导细胞发生凋亡. 因此, Pim-3有望成为肿瘤治疗的一个新的重要分子靶点, 抑制Pim-3活性有可能成为治疗肿瘤的重要手段.
P21作为一个潜在的普遍的细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)抑制剂, 其生物学作用是直接参与细胞生长抑制、DNA复制、发育和分化等调控过程, 与肿瘤的发生发展机制密切相关[7,8]. Bcl-2、Bax基因是现今研究较多、较重要的两个细胞凋亡相关基因. 此外有研究表明Pim激酶具有加速细胞周期进程的效应, 主要通过P21磷酸化, 促使休眠期细胞进入细胞周期[9]; 另外Pim激酶能够抑制Bcl-2家族的前凋亡基因Bad, 阻止Bad-Bcl-xL的相互作用, 从而抑制凋亡[10], 或者通过协同或调控Bcl-2家族的抗凋亡蛋白的功能, 抑制细胞凋亡的线粒体通路[11]. 这些研究提示Pim-3可能与P21、Bcl-2和Bax具有直接的关系. 为了深入了解Pim-3 siRNA介导的EC9706细胞增殖抑制和凋亡发生的可能作用机制, 我们转染Pim-3 siRNA后通过RT-PCR和Western blot研究与增殖有关的P21基因以及与细胞凋亡有关的Bcl-2、Bax基因的表达, 以期初步阐明Pim-3基因表达下调引发食管鳞癌EC9706细胞增殖抑制和凋亡发生的可能作用机制. 结果表明, Pim-3基因表达的下调能明显上调P21和Bax基因的表达, 下调Bcl-2的表达. 这可能是Pim-3基因表达下调介导的食管鳞癌细胞增殖抑制和凋亡发生的分子机制之一.
总之, 我们的研究结果表明, Pim-3 siRNA能有效下调Pim-3基因的表达, Pim-3表达水平的下调能引起食管鳞癌的增殖抑制和细胞凋亡的发生, 而通过干扰Pim-3基因的表达来治疗肿瘤, 使之成为治疗食管鳞癌新的分子靶点.
Pim-3作为表达丝/苏氨酸激酶活性的原癌基因Pim家族中的一员, 首次在鼠嗜铬细胞瘤PC12细胞中作为去极化诱导基因KID-1被证实. 后来越来越多的研究表明其与肿瘤的发生发展关系十分密切, 在多数已报道的肿瘤中呈现高表达, 但其在食管鳞癌中的作用尚未见报道.
钱睿哲, 教授, 复旦大学上海医学院生理与病理生理学系血管分子生物学实验室
Pim-3基因在介导肿瘤细胞的增殖与凋亡过程中发挥着极其重要的作用, 明确Pim-3在食管鳞癌中的作用是目前研究的重点.
本文首次采用RNA干扰技术研究下调食管鳞癌EC9706细胞中Pim-3的表达对EC9706细胞增殖和细胞凋亡的影响, 并探讨其可能的分子作用机制.
本研究在体外探讨Pim-3在食管鳞癌EC9706细胞中的可能作用, 有望为食管鳞癌的分子靶向治疗提供理论依据.
本文实验设计合理, 方法可行, 思路清晰, 具有一定的参考价值.
编辑: 李军亮 电编:何基才
| 1. | Feldman JD, Vician L, Crispino M, Tocco G, Marcheselli VL, Bazan NG, Baudry M, Herschman HR. KID-1, a protein kinase induced by depolarization in brain. J Biol Chem. 1998;273:16535-16543. [PubMed] [DOI] |
| 2. | Konietzko U, Kauselmann G, Scafidi J, Staubli U, Mikkers H, Berns A, Schweizer M, Waltereit R, Kuhl D. Pim kinase expression is induced by LTP stimulation and required for the consolidation of enduring LTP. EMBO J. 1999;18:3359-3369. [PubMed] [DOI] |
| 3. | Fujii C, Nakamoto Y, Lu P, Tsuneyama K, Popivanova BK, Kaneko S, Mukaida N. Aberrant expression of serine/threonine kinase Pim-3 in hepatocellular carcinoma development and its role in the proliferation of human hepatoma cell lines. Int J Cancer. 2005;114:209-218. [PubMed] [DOI] |
| 4. | Li YY, Popivanova BK, Nagai Y, Ishikura H, Fujii C, Mukaida N. Pim-3, a proto-oncogene with serine/threonine kinase activity, is aberrantly expressed in human pancreatic cancer and phosphorylates bad to block bad-mediated apoptosis in human pancreatic cancer cell lines. Cancer Res. 2006;66:6741-6747. [PubMed] [DOI] |
| 5. | Popivanova BK, Li YY, Zheng H, Omura K, Fujii C, Tsuneyama K, Mukaida N. Proto-oncogene, Pim-3 with serine/threonine kinase activity, is aberrantly expressed in human colon cancer cells and can prevent Bad-mediated apoptosis. Cancer Sci. 2007;98:321-328. [PubMed] [DOI] |
| 6. | Goan YG, Chang HC, Hsu HK, Chou YP. An audit of surgical outcomes of esophageal squamous cell carcinoma. Eur J Cardiothorac Surg. 2007;31:536-544. [PubMed] [DOI] |
| 7. | Harper JW, Adami GR, Wei N, Keyomarsi K, Elledge SJ. The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases. Cell. 1993;75:805-816. [PubMed] |
| 8. | Røtterud R, Berner A, Holm R, Skovlund E, Fosså SD. p53, p21 and mdm2 expression vs the response to radiotherapy in transitional cell carcinoma of the bladder. BJU Int. 2001;88:202-208. [PubMed] [DOI] |
| 9. | Bachmann M, Hennemann H, Xing PX, Hoffmann I, Möröy T. The oncogenic serine/threonine kinase Pim-1 phosphorylates and inhibits the activity of Cdc25C-associated kinase 1 (C-TAK1): a novel role for Pim-1 at the G2/M cell cycle checkpoint. J Biol Chem. 2004;279:48319-48328. [PubMed] [DOI] |