修回日期: 2010-07-09
接受日期: 2010-07-21
在线出版日期: 2010-09-08
目的: 探讨胃癌组织中HER2和EGFR基因扩增及其临床意义.
方法: 采用FISH技术和免疫组织化学SP法检测52例胃癌组织中HER2和EGFR基因及其蛋白的表达.
结果: FISH检测HER2基因扩增率17.3%(9/52), HER2基因无扩增的43例中三体者3例、四体者7例、多体者6例, HER2基因拷贝数增加和基因扩增者共48.1%(25/52). HER2蛋白表达率42.3%(22/52), 在HER2蛋白表达+++、++者中HER2基因扩增比例分别为2/3和4/7与+者3/12比较差异有统计学意义(P<0.05). FISH检测EGFR基因扩增率26.9%(14/52), EGFR基因无扩增的38例中三体者2例、四体者9例、多体者10例, EGFR基因拷贝数增加和基因扩增者共67.3%(35/52). EGFR蛋白表达率55.8%(29/52), 在EGFR蛋白表达+++、++者中EGFR基因扩增比例分别为4/5和6/8与+者4/16比较差异有统计学意义(P<0.05). HER2和EGFR基因二者均异常(基因扩增和拷贝数增高)36.5%(19/52). HER2和EGFR基因扩增率与胃癌的浸润深度、淋巴结有无转移差异有显著性; 与组织学类型、发病年龄、性别差异无显著性.
结论: HER2、EGFR基因异常有其相关性, 可作为胃癌诊断和预后的重要参考指标; 检测HER2、EGFR基因扩增对指导临床制定个体化治疗方案有重要意义.
引文著录: 王仰坤, 高春芳, 贠田, 张现伟, 赵文召, 郑国宝, 刘广洛. HER2和EGFR基因在胃癌组织中的状态及其与临床病理的关系. 世界华人消化杂志 2010; 18(25): 2642-2647
Revised: July 9, 2010
Accepted: July 21, 2010
Published online: September 8, 2010
AIM: To investigate the clinical significance of human epidermal growth factor receptor type 2 (HER2) and epidermal growth factor receptor (EGFR) abnormalities in gastric cancer.
METHODS: The gene amplification and protein expression of HER2 and EGFR in 52 cases of gastric cancer were detected by fluorescence in situ hybridization (FISH) and immunohistochemistry, respectively.
RESULTS: The rate of HER2 gene amplification in gastric cancer patients was 17.3% (9/52). Of 43 patients without HER2 gene amplification, 3 had HER2 trisomy, 7 had HER2 tetrasomy, and 6 had HER2 polysomy. Approximately 48.1% (25/52) of the patients showed increased HER2 gene copy number or gene amplification. The positive rate of HER2 protein expression in gastric cancer patients was 42.3% (22/52). The ratio of HER2 gene amplification was significantly higher in patients with high (+++) and moderate (++) HER2 expression than in those with low (+) HER2 expression (2/3 and 4/7 vs 3/12, both P < 0.05). The rate of EGFR gene amplification rate in gastric cancer patients was 26.9% (14/52). Of 38 patients without EGFR gene amplification, 2 had EGFR trisomy, 9 had EGFR tetrasomy, and 10 had EGFR polysomy. Approximately 67.3% (35/52) of the patients showed increased EGFR gene copy number or gene amplification. The ratio of EGFR gene amplification was significantly higher in patients with high (+++) and moderate (++) EGFR expression than in those with low (+) EGFR expression (4/5 and 6/8 vs 4/16, both P < 0.05). Approximately 36.5% (19/52) of patients showed both HER2 and EGFR gene abnormalities (gene amplification and increased copy number). The rates of HER2 and EGFR gene amplification were significantly correlated with the depth of tumor invasion and lymph node metastasis (both P < 0.05), but not with histological type, age at onset, and sex (all P > 0.05).
CONCLUSION: There is a significant correlation between HER2 and EGFR gene abnormalities in gastric cancer patients. Detection of HER2 and EGFR gene abnormalities can be used as an important parameter for diagnosis and prognostic evaluation of gastric cancer and for development of individualized treatment plan.
- Citation: Wang YK, Gao CF, Yun T, Zhang XW, Zhao WZ, Zheng GB, Liu GL. Correlation of HER2 and EGFR abnormalities with clinicopathological parameters in gastric cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(25): 2642-2647
- URL: https://www.wjgnet.com/1009-3079/full/v18/i25/2642.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i25.2642
HER2基因亦称C-erbB-2基因, 其表达的蛋白产物为人表皮生长因子受体2, 后者的高表达可活化细胞信号转导系统, 导致细胞转化、增殖[1]. HER2的结构与EGFR极其相似, 其胞内区的260个氨基酸残基(727-986)与EGFR的酪氨酸激酶区有95%以上的同源性. HER2与EGFR均具有跨膜酪氨酸及酶活性, 含有3个功能域; 细胞外配体结合区(1-632), 亲脂性的跨膜部分(633-654), 具有酪氨酸激酶活性的胞质内区域(655-1234)[2,3]. HER2过表达常见于乳腺癌、卵巢癌等, 与肿瘤的侵袭、转移、化疗耐药及预后不良有明显的相关性[4]. 我们采用荧光原位杂交(fluoresce in situ hybridization, FISH)技术检测胃癌组织中HER2和EGFR基因, 并结合组织病理学、免疫组织化学法(immunohistochemistry, IHC)特点, 分析与临床病理的特点及其意义.
收集中国人民解放军第150中心医院2008-07/2009-12病理科手术切除的胃癌根治标本52例. 其中乳头状腺癌5例、腺管状腺17例癌、黏液腺癌12例、低分化腺癌10例、印戒细胞癌8例. 年龄31-76(平均59.2)岁. 新鲜标本经10%中性甲醛固定, 分别进行常规HE染色、IHC染色和FISH基因扩增. 所用抗体及克隆号为HER2(SP3)、EGFR(H11). 即用型试剂盒和一抗均购自福州迈新生物技术开发有限公司. Paraffin Pretreatment KitⅡ试剂盒, 其中主要含有预处理溶液和蛋白酶溶液; Path VysionTM HER2探针试剂盒; LSI EGFR SpectrumOrange/CEP7 Spectrum Green探针组合; 均购自北京金菩嘉医疗科技有限公司.
1.2.1 石蜡包埋胃癌组织切片的预处理: (1)将含有胃癌组织的蜡块4 μm厚度切片, 65 ℃烤片过夜, 然后经二甲苯及100%乙醇、85%乙醇和70%乙醇中各5 min脱蜡; (2)90 ℃蒸馏水30 min, 处理完毕后将玻片置于37 ℃蛋白酶K(0.4 g/L, 2×SSC)溶液中消化10 min; (3)室温下于2×SSC(pH7.0)溶液中漂洗玻片2次, 每次5 min; (4)最后, 将玻片依次置于70%乙醇、85%乙醇和100%乙醇中各2 min脱水, 自然干燥玻片.
1.2.2 FISH操作: (1)在室温下将7 μL杂交缓冲液、1 μL 去离子水、2 μL探针加入到微量离心管中离心1-3 s; (2)将10 μL的探针混合物滴于玻片杂交区域, 立即加盖盖玻片, 用橡皮胶封边; (3)密封好后的玻片放入杂交仪, 探针在82 ℃-84 ℃变性5 min, 42 ℃孵育15 h; (4)玻片依次经65 ℃ 0.4×SSC/0.3NP-40%清洗1.5 min, 常温0.2×SSC/0.1NP-40清洗30 s, 然后将玻片放入70%乙醇中室温下浸泡, 3 min后取出玻片.然后暗处自然干燥; 最后滴加10 μL DAPI溶液, 在荧光显微镜下计数信号[5].
1.2.3 结果判断: (1)HER2基因扩增检测: 计数30个细胞, 统计Ratio值(Ratio值 = 30个细胞核中红信号总数/30个细胞核中绿信号总数). Ratio<1.8为阴性结果, 提示该样本无HER2基因扩增; Ratio>2.2为阳性结果, 提示样本中HER2基因发生扩增; Ratio为1.8-2.2时, 可以选择增加计数细胞至100个, 或重做FISH实验来判断最终结果; (2)EGFR基因扩增检测: 计数100个细胞, 统计Ratio值(Ratio值 = 100个细胞核中红信号总数/100个细胞核中绿信号总数). Ratio≥2为阳性结果, 提示样本中EGFR基因发生扩增; Ratio≥15个红色信号的细胞数占细胞总数的10%以上, 为阳性结果, 提示样本中EGFR基因发生扩增; 出现成团扩增的细胞, 为阳性结果, 提示样本中EGFR基因发生扩增; (3)EGFR高多倍体检测: Ratio<2, 但Ratio≥4个红色信号的细胞数占细胞总数的40%以上, 为阳性结果, 提示样本中EGFR基因发生高多倍体扩增.
1.2.4 免疫组织化学染色: 采用SP法, 结果判断, 以细胞相应部位出现黄棕色反应为阳性, 其阳性细胞数与显色强度的多少判断阳性等级. 阳性细胞数计数<5%为0分、5%-25%为1分、26%-50%为2分、>50%为3分. 显色强度不表达为0分、淡黄色为1分、黄或深黄色为2分、褐或棕褐色为3分. 然后将2项等级的计分相加, 确定为0分为阴性(-), 2分弱阳性(+), 3-4分中度阳性(++), 5-6分强阳性(+++). 分别DAB显色, 苏木精衬染, 用TBS液代替第一抗体作阴性对照.
统计学处理 采用SPSS13.0统计软件分析, 计数资料用χ2检验进行HER2和EGFR基因状态分析, 以P<0.05表示差异有统计学意义.
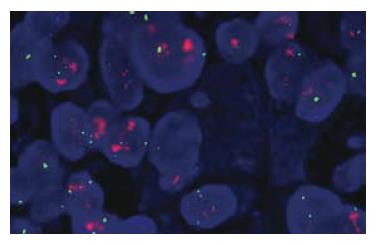
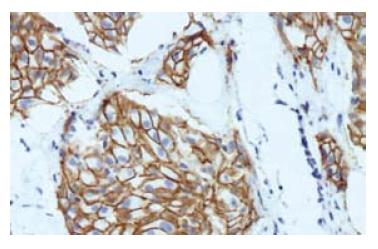
FISH检测HER2基因扩增率17.3%(9/52)(图1), HER2基因无扩增的43例中三体者3例、四体者7例、多体者6例, HER2基因拷贝数增加和基因扩增者共48.1%(25/52). HER2蛋白表达率42.3%(22/52)(图2), 在HER2蛋白表达+++、++者中HER2基因扩增比例分别为2/3和4/7与+者3/12比较差异有统计学意义(P<0.05, 表1).
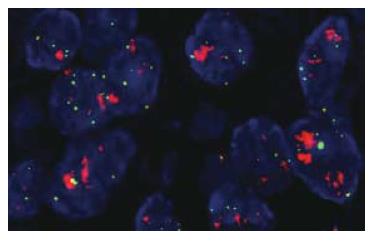
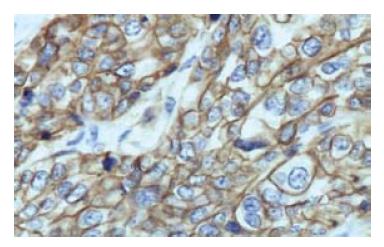
FISH检测EGFR基因扩增率26.9%(14/52)(图3), EGFR基因无扩增的38例中三体者2例、四体者9例、多体者10例, EGFR基因拷贝数增加和基因扩增者共67.3%(35/52). EGFR蛋白表达率55.8%(29/52)(图4), 在EGFR蛋白表达+++、++者中EGFR基因扩增比例分别为4/5和6/8与+者4/16比较差异有统计学意义(P<0.05, 表2).
HER2基因拷贝数增加和基因扩增者共53.8%(28/52), EGFR基因拷贝数增加和基因扩增者共67.3%(35/52), HER2和EGFR基因数目二者均异常(包括基因扩增和拷贝数增高)36.5%(19/52), HER2与EGFR二者基因异常有相关性.
HER2和EGFR基因扩增发生率与性别、发病年龄、组织学类型(P>0.05). HER2和EGFR基因扩增发生率与胃癌的浸润深度、淋巴结有无转移(P<0.05), 差异显著(表3).
| 类型 | n | HER2基因阳性 n(%) | χ2 值 | P值 | EGFR基因阳性 n(%) | χ2值 | P值 |
| 性别 | |||||||
| 男 | 33 | 6(18.2) | 0.048 | 0.826 | 9(27.3) | 0.006 | 0.940 |
| 女 | 19 | 3(15.8) | 5(26.3) | ||||
| 年龄(岁) | |||||||
| ≥60 | 29 | 5(17.2) | 0.000 | 0.989 | 8(27.6) | 0.015 | 0.904 |
| <60 | 23 | 4(17.4) | 6(26.1) | ||||
| 组织学分类 | |||||||
| 乳头状腺癌 | 5 | 0(0.0) | 1(20.0) | ||||
| 管状腺癌 | 17 | 3(17.6) | 4(23.5) | ||||
| 黏液腺癌 | 12 | 2(16.7) | 1.433 | 0.838 | 3(25.0) | 0.220 | 0.994 |
| 低分化腺癌 | 10 | 2(20.0) | 3(30.0) | ||||
| 印戒细胞癌 | 8 | 2(25.0) | 2(25.0) | ||||
| 胃癌分期 | |||||||
| T1/ T2 | 14 | 0(0.0) | 4.010 | 0.045 | 1(7.1) | 3.810 | 0.050 |
| T3/ T4 | 38 | 9(23.7) | 13(34.2) | ||||
| 淋巴结转移 | |||||||
| 有 | 28 | 8(28.6) | 5.378 | 0.020 | 12(42.9) | 5.802 | 0.016 |
| 无 | 24 | 1(4.7) | 2(8.3) |
EGFR是四个相关受体家族的一部分, 其家族成员包括EGFR(HER1)、HER2、HER3、HER4四种同源受体. EGFR基因定位于人类第7号染色体短臂上, 是一种相对分子质量为170 000 Da的糖蛋白, 对EGF具有高度亲和性[6]. 其结构分细胞外区, 跨膜区和细胞内区3部分, 细胞内区具有酪氨酸蛋白酶活性, 当与EGF结合后, 激活该受体的酪氨酸蛋白激酶, 导致受体本身及细胞内酪氨酸残基的磷酸化, 后者给细胞提供一个进行细胞分裂的信号, 从而引起细胞的分裂增殖[7]. EGFR能够介导多条信号转导通路, 将细胞外信号传递至细胞内, 以对核内基因的表达和细胞的生长分化产生调节作用. EGFR高表达可促进血管生成及肿瘤细胞的增殖、黏附、侵袭和转移, 抑制肿瘤细胞的凋亡[8]. 本组胃癌52例中HER2蛋白表达率42.3%(22/52), HER2基因扩增率17.3%(9/52), 有淋巴结转移的28例中HER2基因扩增率28.6%(8/28), 无淋巴结转移的24例中HER2基因扩增率4.7%(1/24). EGFR蛋白表达率55.8%(29/52), EGFR基因扩增率26.9%(14/52), 有淋巴结转移的28例中EGFR基因扩增率42.9%(12/28). 研究结果提示HER2和EGFR基因扩增发生率与蛋白表达率呈正相关; HER2和EGFR基因扩增发生率与胃癌淋巴结转移呈正相关. EGFR、HER2表达是胃黏膜上皮细胞发生恶变的标志, 并可作为胃癌诊断和预后的重要参考指标.
目前, 术后进行病理学检测, 是评价肿瘤细胞HER2表达水平的主要手段, 临床上常用的方法是IHC和FISH. IHC是目前应用最广泛的方法, 现有商品化的试剂盒可用, 进行半定量检测, HER2表达水平越高, 则越有可能从HER2为靶点的抗肿瘤药物治疗过程中受益[9]. 应用IHC方法评价肿瘤细胞HER2表达水平有其局限性, 易受主观印象干扰, 不能进行定量分析等. 应用FISH方法检测HER2基因扩增, 其特异性和敏感性均高于IHC方法, 并能提供定量数据, 能有效减少试验操作人员的主观印象干扰和实验室之间的变异[10]. 本组在HER2蛋白表达的22例中+++、++(6/10)者与HER2基因扩增+(3/12)比较差异有显著性(P<0.05); 在EGFR蛋白表达的29例中+++、++(9/13)者与EGFR基因扩增+(5/16)比较差异有显著性(P<0.05). 故可利用IHC筛选后, 再进行FISH检测, 对IHC ++以上均进行FISH检测, 尤其是阳性率极高.尽管IHC的方法应用更广泛, 但当HER2表达水平达到++时, 建议进行FISH检测, 因为该方法更准确可靠.
近年来随着对肿瘤生物学研究的不断深入, 新的分子靶向治疗药物也不断出现. 与传统的细胞毒性药物不同, 他们在分子、生物化学和基因水平上选择性作用于癌细胞, 特异性阻断癌细胞膜上的异常途径而对正常细胞功能仅有轻微影响. 阻断EGFR表达的靶向抑制剂能够增加肿瘤细胞的放射敏感性[11], 提高放射治疗的疗效, 其机制可能是EGFR的靶向制剂抑制了肿瘤细胞的EGFR表达, 阻断EGFR信号传导通路, 从而抑制了细胞的增殖, 加速了细胞凋亡, 干扰了细胞周期分布和延长了细胞辐射后DNA损伤的修复[12]. 本组FISH检测EGFR基因扩增率26.9%, IHC检测EGFR蛋白表达率55.8%, 说明胃癌组织中有部分病例对放射线抗拒, 因此, 针对EGFR为靶点放射增敏治疗, 具有重要的临床价值.
HER2与EGFR联合表达对胃癌的进展可能协同作用[13]. 本组胃癌52例中HER2基因扩增率17.3%(9/52), 其中有淋巴结转移的28例HER2基因扩增率28.6%(8/28), 无淋巴结转移的24例HER2基因扩增率4.7%(1/24), HER2基因扩增率在有无淋巴结转移间的比较差异有统计学意义(P<0.05). 胃癌52例中EGFR基因扩增率26.9%(14/52), 其中有淋巴结转移的28例EGFR基因扩增率42.9%(12/28), 无淋巴结转移的24例EGFR基因扩增率8.3%(2/24), EGFR基因扩增率在有无淋巴结转移间的比较差异有统计学意义(P<0.05). HER2和EGFR基因扩增率有相关性. HER2基因拷贝数增加和基因扩增者共48.1%(25/52), EGFR基因拷贝数增加和基因扩增者共67.3%(35/52), HER2和EGFR基因数目二者均异常(包括基因扩增和拷贝数增高)36.5%(19/52), HER2和EGFR二者基因异常有相关性. 提示HER2或EGFR基因拷贝数增加在胃癌中是较常发生的事件, 而且二基因拷贝数共同增加者占有相当高的比例.
总之, HER2与EGFR均具有跨膜酪氨酸及酶活性, 可促进肿瘤的发生、发展. HER2与EGFR密切相关, 通常在恶性上皮肿瘤细胞中过度表达, 而且表达水平与肿瘤浸润程度、预后及患者生存率相关, 是预后不良的重要指标. 其过表达的肿瘤常常对放射线抗拒, 因此, 针对EGFR为靶点放射增敏治疗, 具有重要的临床价值.
HER2的结构与EGFR极其相似, 其胞内区的260个氨基酸残基(727-986)与EGFR的酪氨酸激酶区有95%以上的同源性. 所以正确、准确评价肿瘤细胞HER2和EGFR表达水平是应用HER2和EGFR为靶点的抗肿瘤药物进行治疗的关键.
李淳, 副教授, 汕头大学医学院病理教研室
HER2和EGFR基因状态与肿瘤的发生、发展及恶性生物学行为密切相关, 以HER2和EGFR为靶点的抗肿瘤治疗研究成为热点, 并显示出广阔的应用前景. HER2和EGFR过表达常见于乳腺癌、卵巢癌等, 与胃癌组织中HER2和EGFR基因状态及其相关性亟待研究.
乳腺癌、卵巢癌、非小细胞肺癌组织中的HER2和EGFR基因状态与肿瘤的侵袭、转移、化疗耐药及预后不良有类似报道.
本文研究了胃癌组织中HER2和EGFR基因状态及其与临床病理的关系, HER2、EGFR基因异常有其相关性, 对胃癌诊断和预后, 以及指导临床制定个体化治疗方案有重要意义.
本研究结果为肿瘤患者个性化治疗提供了依据, 具有很好的科学意义和潜在应用价值.
编辑: 李军亮 电编:何基才
| 1. | Sebastian S, Settleman J, Reshkin SJ, Azzariti A, Bellizzi A, Paradiso A. The complexity of targeting EGFR signalling in cancer: from expression to turnover. Biochim Biophys Acta. 2006;1766:120-139. [PubMed] |
| 2. | Chen QQ, Chen XY, Jiang YY, Liu J. Identification of novel nuclear localization signal within the ErbB-2 protein. Cell Res. 2005;15:504-510. [PubMed] [DOI] |
| 3. | Nyati MK, Morgan MA, Feng FY, Lawrence TS. Integration of EGFR inhibitors with radiochemotherapy. Nat Rev Cancer. 2006;6:876-885. [PubMed] [DOI] |
| 4. | Dent R, Trudeau M, Pritchard KI, Hanna WM, Kahn HK, Sawka CA, Lickley LA, Rawlinson E, Sun P, Narod SA. Triple- negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res. 2007;13:4429-4434. [PubMed] [DOI] |
| 5. | 高 春芳. 实验室诊断新技术与临床. 第1版. 北京: 人民军医出版社 2010; 85-112. |
| 6. | Pérez-Soler R. HER1/EGFR targeting: refining the strategy. Oncologist. 2004;9:58-67. [PubMed] [DOI] |
| 7. | Roskoski R Jr. The ErbB/HER receptor protein-tyrosine kinases and cancer. Biochem Biophys Res Commun. 2004;319:1-11. [PubMed] [DOI] |
| 8. | Stonecypher MS, Chaudhury AR, Byer SJ, Carroll SL. Neuregulin growth factors and their ErbB receptors form a potential signaling network for schwannoma tumorigenesis. J Neuropathol Exp Neurol. 2006;65:162-175. [PubMed] [DOI] |
| 9. | Brabender J, Danenberg KD, Metzger R, Schneider PM, Park J, Salonga D, Hölscher AH, Danenberg PV. Epidermal growth factor receptor and HER2-neu mRNA expression in non-small cell lung cancer Is correlated with survival. Clin Cancer Res. 2001;7:1850-1855. [PubMed] |
| 10. | Penault-Llorca F, Cayre A. [Assessment of HER2 status in breast cancer]. Bull Cancer. 2004;91 Suppl 4:S211-S215. [PubMed] |
| 11. | Cao WG, Ma T, Li JF, Li H, Ji YB, Chen XH, Liu BY, Jin YN. [Effect of gefitinib on radiosensitivity of gastric cancer cell lines]. Ai Zheng. 2007;26:1330-1335. [PubMed] |
| 12. | Reuter CW, Morgan MA, Eckardt A. Targeting EGF-receptor-signalling in squamous cell carcinomas of the head and neck. Br J Cancer. 2007;96:408-416. [PubMed] [DOI] |
| 13. | Onn A, Correa AM, Gilcrease M, Isobe T, Massarelli E, Bucana CD, O'Reilly MS, Hong WK, Fidler IJ, Putnam JB. Synchronous overexpression of epidermal growth factor receptor and HER2-neu protein is a predictor of poor outcome in patients with stage I non-small cell lung cancer. Clin Cancer Res. 2004;10:136-143. [PubMed] [DOI] |