修回日期: 2010-07-08
接受日期: 2010-07-21
在线出版日期: 2010-08-28
目的: 探讨E-钙粘蛋白(E-cad)在大肠癌转移淋巴结中的再表达机制及临床价值.
方法: 采用免疫组织化学SP法, Western blot, 逆转录-多聚合酶链反应(RT-PCR)等方法联合检测32例大肠癌患者原发灶及相应转移淋巴结中E-cad的表达.
结果: 免疫组织化学结果显示: 大肠癌原发灶中E-cad的异常表达率为90.6%(29/32). 在转移淋巴结中, 37.5%(12/32)E-cad再表达阳性, 其中在高中分化、低分化腺癌E-cad再表达阳性率分别为55.6%(10/18)、14.3%(2/14), 差异显著(P<0.05). Western blot结果显示: 转移淋巴结组织中E-cad蛋白相对强度高于原发癌组织(P<0.05), 但低于正常大肠黏膜(P<0.05). 在转移淋巴结中, E-cad在高中分化、低分化腺癌蛋白相对强度分别为28-127(98.56±36.09)、11-62(66.21±29.74), 差异显著(P<0.05). 管状及乳头状腺癌转移淋巴结中E-cad蛋白相对强度高于黏液腺癌转移淋巴结(P<0.05). RT-PCR结果显示: 大肠癌原发灶E-cad mRNA表达量相对值明显低于在正常大肠黏膜的表达量(0.733±0.009 vs 0.796±0.016, P<0.05); 大肠癌转移淋巴结中E-cad mRNA表达量相对值明显高于在大肠癌原发灶的表达量(0.739±0.010 vs 0.733±0.009, P<0.05), 但低于正常大肠黏膜表达量(P<0.05). 高中分化腺癌转移淋巴结中E-cad mRNA表达量相对值高于低分化腺癌转移淋巴结(P<0.05), 管状及乳头状腺癌转移淋巴结中E-cad mRNA表达量高于黏液腺癌转移淋巴结(P<0.05).
结论: 大肠癌发生发展过程中E-cad在基因及蛋白水平的表达存在一定的变化特征, 这种特征可能使其成为大肠癌诊断与治疗的新靶点.
引文著录: 李冬斌, 李晓宁, 许香梅, 段国强, 王影, 陈晓峰, 王凤安. E-钙粘蛋白在进展期大肠癌转移淋巴结癌细胞中再表达的机制. 世界华人消化杂志 2010; 18(24): 2545-2551
Revised: July 8, 2010
Accepted: July 21, 2010
Published online: August 28, 2010
AIM: To investigate the re-expression of E-cadherin (E-cad) in metastatic lymph node of advanced colorectal carcinoma and its clinical importance.
METHODS: The expression of E-cad in 32 specimens of primary colorectal carcinoma and metastatic lymph nodes was examined by means of immunohistochemistry, Western blot and RT- PCR to analyze the mechanism behind the re-expression of E-cad in metastatic lymph nodes.
RESULTS: The abnormal expression rate of E-cad in primary colorectal carcinoma was 90.6% (29/32), and the re-expression rate of E-cad in metastatic lymph nodes was 37.5% (12/32). The re-expression rate of E-cad in metastatic lymph nodes was significantly higher in patients with well/moderately differentiated carcinoma than in those with poorly differentiated carcinoma (55.6% vs 14.3%, P < 0.05). Western blot analysis showed that the relative expression intensity of E-cad in metastatic lymph nodes was higher than that in primary carcinoma (P < 0.05). The relative expression intensity of E-cad protein in metastatic lymph nodes was significantly higher in patients with well/moderately differentiated adenocarcinoma than in those with poorly differentiated adenocarcinoma (98.56 ± 36.09 vs 66.21 ± 29.74, P < 0.05). The relative expression intensity of E-cad protein in metastatic lymph nodes is correlated with tumor histological type. RT-PCR analysis showed that the relative expression level of E-cad mRNA in primary carcinoma was significantly lower than that in metastatic lymph nodes and normal mucosal tissue (0.733 ± 0.009 vs 0.739 ± 0.010 and 0.796 ± 0.016, both P < 0.05). The re-expression of E-cad mRNA in metastatic lymph nodes is associated with tumor differentiation degree and tumor histological type (both P < 0.05).
CONCLUSION: E-cad expression shows characteristic changes during the development and progression of colorectal cancer. E-cad is a possible new target for diagnosis and treatment of colorectal cancer.
- Citation: Li DB, Li XN, Xu XM, Duan GQ, Wang Y, Chen XF, Wang FA. Re-expression of E-cadherin in metastatic lymph nodes of patients with advanced colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(24): 2545-2551
- URL: https://www.wjgnet.com/1009-3079/full/v18/i24/2545.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i24.2545
大肠癌在我国多见, 近年来发病率呈上升趋势. 目前大肠癌难以有效根治的主要原因就是肿瘤的复发和转移, 因此我们有必要深入研究与肿瘤浸润转移倾向有关的因素, 从而指导正确合适的诊疗措施. 淋巴结转移是大肠癌扩散的主要途径, 而且是影响大肠癌患者预后的最主要因素之一. 肿瘤细胞间黏附的丧失, 是肿瘤浸润转移的第一步, 也是关键的一步. E-钙粘蛋白(E-cadherin, E-cad)作为钙依赖性同型细胞黏附分子, 是分布在所有上皮组织中的跨膜糖蛋白, 介导同种细胞间、细胞与基质之间的黏附反应, 从而维持细胞极性和参与分化调节. 同种上皮细胞间的E-cad细胞外区以一种Ca2+依赖形式形成二聚体拉链式结构, 细胞内区必须与连接素(catenins)形成复合物并锚定于肌动蛋白细胞骨架上[1]才能发挥作用. 目前发现的catenins有4个亚型, 即a, b, g-catenin及P120. E-cad在癌细胞的异质性表达可影响癌细胞的脱落和再附着. 以往可见关于E-cad在肿瘤转移灶中再表达的报道, 但其机制尚未完全清楚. 我们拟采用免疫组织化学, 蛋白免疫印迹, RT-PCR等方法联合检测E-cad在大肠癌原发灶及转移淋巴结内癌细胞中的表达情况, 以期探讨E-cad在大肠癌转移淋巴结中的再表达机制及临床价值.
随机选择进展期大肠癌原发灶及相应转移淋巴结标本共32例, 均为河北医科大学第二医院2007-12/2009-06手术切除标本, 并选取对应的非肿瘤的正常大肠黏膜组织25例作对照, 标本在-80 ℃低温冰箱中冻存. 患者男29例, 女16例, 年龄29-78(中位年龄57.63)岁. 入选病例皆查实未进行化疗或放疗, 无长期服用非甾体类抗炎药、皮质激素药物史. 所有标本术后均经病理证实, 各例淋巴结转移癌组织的病理学类型与原发灶基本相同. 每份标本除部分经常规固定脱水后石蜡包埋切片外, 其他则分别提取蛋白质和mRNA. 依据大肠癌分化程度及生物学行为特征分为6组: (1)分化程度: 高中分化、低分化; (2)组织学类型: 管状及乳头状腺癌、黏液腺癌; (3)肿瘤大小: ≥5 cm, <5 cm; (4)浸润深度: 未侵入浆膜层, 已侵入浆膜层; (5)部位: 结肠, 直肠; (6)年龄<50岁, ≥50岁.
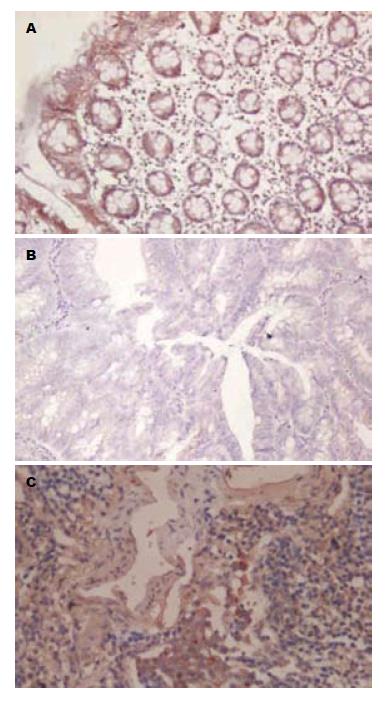
1.2.1 免疫组织化学染色: 标本经常规石蜡包埋切片后, 按说明书采用SP法进行免疫组织化学染色(SP试剂盒购自北京中山科技公司). 兔抗人多克隆E-cad抗体购于NeoMarkers公司. 原发灶切片内非癌性大肠黏膜细胞作为内部阳性对照. 染色完成后在光镜下观察结果, E-cad免疫组织化学正常情况下阳性染色定位于细胞膜, 即连续的细胞膜染色. 染色结果评价, 通过HE染色确认原发灶和转移淋巴结内癌细胞, 如癌细胞染色情况与临近非癌性黏膜细胞相近, 且没有胞质、胞核染色情况出现, 则被评定为正常染色; 如染色不连续, 明显减弱或缺失, 或出现胞质、胞核染色情况, 则被评定为不正常染色. 每张切片按其全部癌细胞中出现正常染色细胞的百分率评定为3级: 1级为0-50%; 2级为51%-80%; 3级为81%-100%[2]. 原发灶中E-cad 3级染色则被认为正常表达; 1级和2级染色被认为不正常表达; 转移淋巴结中如E-cad染色等级高于其原发灶中, 则被评定为再表达阳性.
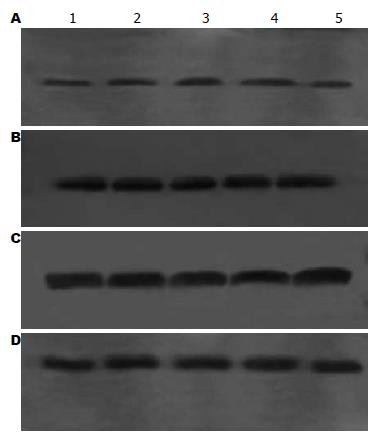
1.2.2 蛋白印迹分析: 将组织粉碎后加入裂解液(北京普利来公司). 蛋白提取过程按照说明书操作进行. 在提取出的蛋白中加入5% SDS煮沸10 min, 12 000 r/m离心10 min, 提取上清液. 测定各样本蛋白含量, 等量蛋白质加入SDS-PAGE中, 电泳约3 h后, 将凝胶中的蛋白转移到PVDF膜上. 用5%脱脂奶粉浸泡转移膜1 h, 以封闭非特异性蛋白结合位点. 采用的E-cad抗体种类和工作浓度与免疫组织化学染色所用抗体相同, 二抗为辣根过氧化物酶标记的抗兔IgG(北京博奥森公司), 工作浓度为1:1 000. 采用ECL化学发光法检测蛋白含量. 于暗室中用胶片显影、定影, 采用分析软件Optimas 6.0比较各个样本蛋白条带的显影强度, 以显影相对强度(Relative Intensity)作为蛋白表达的计量标准.
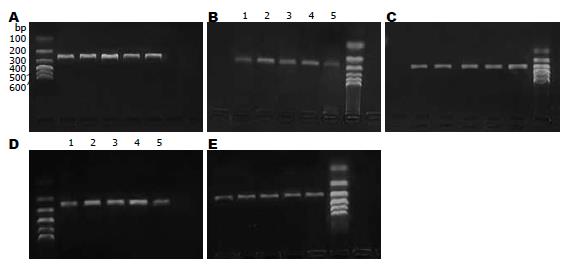
1.2.3 逆转录-多聚合酶链反应: 将组织标本研磨后, 采用TRIzol细胞裂解法按照说明书提取组织样本总RNA. 紫外分光光度计定量总RNA, 调整浓度为1 g/L. AMV逆转录试剂盒和Taq mDNA聚合酶购自Promega公司. 用b-actin作为内参照进行PCR. 步骤: (1)逆转录: 25 mL反应体系中加入等量的变性后的RNA(3 mg)及Oligo(dt) 0.1 mL、AMV 0.5 mL(20 U/mL)、5×Buffer 10 mL、RNsin 100 U及无RNA酶的水, 混匀、离心5 s, 42 ℃孵育1 h, 95 ℃ 5-7 min使逆转录酶失活后立即置冰浴, 待用或-20 ℃保存. (2)PCR反应: 参照文献设计E-cad引物, E-cad引物序列: 上游: 5'-TGCTGTTTCTGGTTTCTGTTGG-3',下游: 5'-CCTTCTCCGTATTCTCCTCCCT-3', 扩增长度250 bp; 以b-actin为对照, 上游: 5'-CTGTCTGGCGGCACCACCAT-3', 下游5'-GCAACTAAGTCATAGTCCGC-3', 扩增长度300 bp. 引物由北京生物制品研究所合成, 反应体系为10×Buffer 5 mL、25 mmol MgCl2 4 mL、dNTP 1 mL(各10 mmol/mL)、Taq酶0.3 mL(5 U/mL)、逆转录的cDNA为模板2 mL、上下游引物各0.5 mL(50 pmmol/mL)、加水至50 mL. 混匀、加入50 mL石蜡油覆盖液面, 离心10 s. 将反应管置于PCR仪内, 先95 ℃ 7 min变性, 再95 ℃变性90 s、54 ℃复性1 min、72 ℃延伸90 s, 共35个循环后, 72 ℃延伸10 min. 反应终止后置-20 ℃保存. (3)PCR产物定量: PCR扩增结束后, E-cad和b-actin各取10 mL样品于1.5%琼脂糖凝胶中电泳60 min, 电压为5-7 V/cm, 每毫升凝胶内含0.5 mg的溴化已啶, GelID凝胶图像分析系统摄片并测定分析其吸光度. 分别计算各个样本E-cad基因表达量的相对值(relative expression value) = 待测基因扩增条带的灰度值/b-actin基因扩增条带的灰度值.
统计学处理 数据用mean±SD表示, 采用SPSS17.0统计软件对所得数据进行t检验, P<0.05为差异有统计学意义.
根据免疫组织化学染色结果, 25例正常大肠黏膜E-cad均在细胞膜中正常表达(图1A). 对照临床病理学因素, 大肠癌原发灶32例中29例患者E-cad表达降低, 其中高中分化腺癌18例, 低分化腺癌14例, 管状腺癌及乳头状腺癌21例, 黏液腺癌11例. 高中分化腺癌18例中E-cad 1级染色10例, 2级染色5例, 3级染色2例, 正常染色1例, 14例低分化癌中E-cad 1级染色12例, 2级染色2例. 21例管状及乳头状腺癌中E-cad 1级染色12例, 2级染色6例, 正常染色3例, 11例黏液腺癌E-cad 1级染色9例, 2级染色2例. E-cad的再表达阳性率为34.4%(11/32), 其中高中分化腺癌的再表达阳性率为55.6%(10/18), 低分化腺癌的再表达阳性率分别为13.3%(2/14), 高中分化腺癌相对于低分化腺癌更易出现E-cad的再表达阳性(P<0.05). E-cad在管状及乳头状腺癌再表达阳性率为57.1%(12/21), 在黏液腺癌的再表达阳性率为9.1%(1/11), 差异显著(P<0.05). E-cad在转移淋巴结癌细胞中的再表达与肿瘤的大小、浸润深度、肿瘤部位及患者年龄无关(P>0.05, 表1, 图1).
| 病理组织学分型 | n | 转移灶(n) | 阳性率(%) | P 值 | |
| + | - | ||||
| 分化程度 | |||||
| 高中分化 | 18 | 10 | 8 | 55.6 | 0.0276 |
| 低分化 | 14 | 2 | 12 | 13.3 | |
| 组织学类型 | |||||
| 管状及 | 21 | 12 | 9 | 57.1 | 0.0109 |
| 乳头状腺癌 | |||||
| 黏液腺癌 | 11 | 1 | 10 | 9.1 | |
| 肿瘤大小(cm) | |||||
| ≥5 | 19 | 7 | 12 | 36.8 | 1.0000 |
| <5 | 13 | 5 | 8 | 38.5 | |
| 浸润深度 | |||||
| 侵及浆膜 | 23 | 8 | 15 | 37.8 | 0.0690 |
| 未侵及浆膜 | 9 | 4 | 5 | 44.4 | |
| 肿瘤部位 | |||||
| 结肠 | 15 | 5 | 10 | 33.3 | 0.7257 |
| 直肠 | 17 | 7 | 10 | 41.2 | |
| 年龄(岁) | |||||
| <50 | 10 | 3 | 7 | 30.0 | 0.7026 |
| ≥50 | 22 | 9 | 13 | 40.9 | |
大肠癌患者32例原发灶及转移淋巴结均检测到不同程度的E-cad蛋白表达(图2). 通过Optimas 6.0蛋白印迹分析软件对所有病例的蛋白条带进行分析后发现, E-cad蛋白相对强度在大肠癌转移淋巴结为13-149(84.41±36.75), 明显高于在大肠癌原发灶蛋白相对强度6-107(63.25±36.46, t = 2.2, P = 0.0314), 但低于正常大肠黏膜22-145(83.26±31.42, t = 2.51, P = 0.016). 在低分化腺癌转移淋巴结中E-cad蛋白相对强度为13-109(66.21±29.74), 在高中分化腺癌转移淋巴结中E-cad蛋白相对强度为43-149(98.56±36.09), 差异显著(t = 2.71, P = 0.011). 在管状及乳头状腺癌转移淋巴结E-cad蛋白相对强度为30-149(93.38±37.05), 黏液腺癌转移淋巴结中E-cad蛋白相对强度为13-113(67.09±31.24), 差异显著(t = 2.08, P = 0.046). E-cad在转移淋巴结癌细胞中蛋白相对强度与肿瘤的大小、浸润深度、肿瘤部位及患者年龄无关(表2).
| 病理特征 | n | E-cad蛋白相对强度 | P值 |
| 分化程度 | |||
| 高分化 | 18 | 98.56±36.09 | t = 2.71 |
| 中低分化 | 14 | 66.21±29.74 | P = 0.0110 |
| 组织学类型 | |||
| 管状及 | 21 | 93.38±37.05 | t = 2.08 |
| 乳头状腺癌 | |||
| 黏液腺癌 | 11 | 67.09±31.24 | P = 0.0460 |
| 肿瘤大小(cm) | |||
| ≥5 | 19 | 87.11±36.79 | t = 0.57 |
| <5 | 13 | 79.54±37.52 | P = 0.5750 |
| 浸润深度 | |||
| 侵及浆膜 | 23 | 80.78±38.85 | t = 0.80 |
| 未侵及浆膜 | 9 | 92.33±30.85 | P = 0.4321 |
| 部位 | |||
| 结肠 | 15 | 85.87±43.02 | t = 0.26 |
| 直肠 | 17 | 82.41±31.31 | P = 0.7952 |
| 年龄(岁) | |||
| <50 | 10 | 77.90±36.65 | t = 0.64 |
| ≥50 | 22 | 86.86±37.14 | P = 0.5300 |
E-cad和b-actin引物的扩增基因片段经电泳和EB染色后可见清晰电泳条带, 其扩增片段大小与所设计的大小完全一致, 分别为250、300 bp. E-cad mRNA表达量相对值在大肠癌转移淋巴结为0.739±0.010, 明显高于在大肠癌原发灶基因表达量(0.733±0.009, t = 2.15, P = 0.0362), 但低于在正常大肠黏膜基因表达量(0.796±0.016, t = 17.01, P<0.0001, 图3). E-cad mRNA表达量相对值在中低分化腺癌转移淋巴结组织中是0.734±0.008, 在高中分化腺癌转移淋巴结组织中是0.743±0.008, 两者比较有统计学意义(t = 3.12, P = 0.004). E-cad mRNA表达量相对值在管状及乳头状腺癌转移淋巴结中是0.742±0.009, 在黏液腺癌转移淋巴结中是0.733±0.008, 二者差异显著(t = 3.1, P = 0.0042). E-cad mRNA在转移淋巴结癌细胞中相对表达量与肿瘤的大小、浸润深度、肿瘤部位、患者年龄无关(P>0.05, 表3).
| 病理特征 | n | E-cad基因表达量相对值 | t值P值 |
| 分化程度 | |||
| 高中分化 | 18 | 0.743±0.008 | t = 3.12 |
| 低分化 | 14 | 0.734±0.008 | P = 0.004 |
| 组织学类型 | |||
| 管状及 | 21 | 0.742±0.009 | t = 3.10 |
| 乳头状腺癌 | |||
| 黏液腺癌 | 11 | 0.733±0.008 | P = 0.0042 |
| 肿瘤大小(cm) | |||
| ≥5 | 19 | 0.740±0.011 | t = 0.38 |
| <5 | 13 | 0.738±0.007 | P = 0.7054 |
| 浸入深度 | |||
| 侵及浆膜 | 23 | 0.739±0.010 | t = 0.27 |
| 未侵及浆膜 | 9 | 0.740±0.007 | P = 0.7862 |
| 肿瘤部位 | |||
| 结肠 | 15 | 0.740±0.007 | t = 0.87 |
| 直肠 | 17 | 0.737±0.009 | P = 0.3909 |
| 年龄(岁) | |||
| <50 | 10 | 0.739±0.008 | t = 0.14 |
| ≥50 | 22 | 0.738±0.008 | P = 0.8931 |
大肠癌严重威胁着人们的健康, 其具有的侵袭、转移的恶性生物学行为是影响临床治疗效果和导致死亡的主要原因. 肿瘤细胞从原发部位脱落作为肿瘤浸润和转移的重要环节, 与细胞黏附功能降低密切相关, 近年来已被广泛关注. 但通过免疫组织化学, Western blot, RT-PCR等方法联合检测E-cad在肿瘤原发灶及转移淋巴结的表达情况及意义, 国内外尚少见报道.
肿瘤浸润和转移是一个极为复杂的多步骤过程[3], 而整个过程的关键是钙黏附系统崩溃所致的细胞黏附异常而导致癌细胞脱离原发灶再附着于转移部位[4]. E-cad作为上皮细胞间连接的主要介导者, 其基因位于人染色体16q22.1, 是Ⅰ型钙粘蛋白超家族的单链跨膜糖蛋白分子, 全长4.8 kb, 编码884个氨基酸, 于1995年由Berx首先克隆[5]. 同种上皮间的E-cad胞外区在细胞间Ca2+的作用下形成反向平行的二聚体, 使相邻同种上皮黏附在一起[8].
E-cad已被公认在上皮源性恶性肿瘤的浸润转移过程中起重要作用[6]. E-cad失活可导致细胞间黏附下降及极性紊乱促使肿瘤细胞浸润和转移[7]. 而且, E-cad是上皮细胞的分化标记, 他的表达强度与多种恶性肿瘤的分化程度呈负相关[8]. 本研究结果显示, 大肠癌中普遍存在E-cad的表达下降, 随着肿瘤增殖程度增强、分化程度的下降, E-cad异常表达率逐渐增高, 且管状及乳头状腺癌E-cad异常表达率显著高于黏液腺癌(P<0.05). 因此我们认为E-cad与大肠癌的恶性行为和低分化有一定的相关性, 这是肿瘤细胞获得去分化和高浸润性的关键.
迄今, 绝大多数的研究都是关于肿瘤原发灶的, 很少涉及到转移灶. 临床流行病调查发现E-cad-cates复合物在众多恶性肿瘤中表达异常, 而该复合物在转移淋巴结癌细胞中会出现再表达. Nakamura等[9]通过分析黏膜、黏膜下及肿瘤浸润最深部位的E-cad免疫活性, 发现其在细胞分化和侵袭的过程中呈现动态变化. 癌细胞从原发部位分离时E-cad表达下调, 但癌细胞向远处侵袭和转移时, 他的内聚力和保持能力增加. Peter等[10]已经注意到乳腺癌患者转移灶内癌组织E-cad再表达的情况, 我们的免疫组织化学结果发现原发癌组织中E-cad呈膜表达减弱或丧失, 但相应的淋巴结转移灶中重新出现胞膜的表达, 且淋巴结转移灶E-cad的表达较原发癌组织显著增强(P<0.05). 有学者在非小细胞肺癌的研究中也提到类似的现象[11]. 提示这种现象是蛋白表达的一种动态调节过程, 可随微环境的变化而变化. 可以认为, 黏附分子在肿瘤细胞的侵袭和转移过程中发挥着双重作用, 原发灶E-cad在原发部位表达的下调使得癌细胞易于脱落而迁徙, 而当癌细胞到达转移的靶组织, 他们又会重新表达, 促进癌细胞定植于受侵组织, 开始增殖、侵袭形成转移灶, 极大影响患者预后.
同时, 我们还发现, E-cad在转移淋巴结内癌细胞中再表达阳性率与大肠癌的分化程度及组织学类型密切相关, 但与肿瘤大小、浸润深度, 肿瘤部位及患者年龄没有显著相关性, 原发灶中肿瘤分化程度越低, 恶性程度越高, E-cad的表达水平越低. 在转移淋巴结中分化程度越高越易出现E-cad再表达阳性, 且管状及乳头状腺癌较黏液腺癌更易出现E-cad再表达.
我们进一步通过RT-PCR检测E-cad在大肠癌原发灶与转移淋巴结癌组织中基因水平的变化, 采用Western blot法检测大肠癌原发灶与转移淋巴结癌组织中E-cad及b-actin蛋白水平的表达变化, 从而明确其在淋巴转移灶再表达的始动因素.
已有资料证明E-cad的合成和表达是在转录和翻译水平发生变化的[12]. Wang等[13]在研究胃癌侵袭、转移与E-cad-cats复合体的相关性时, 也证实了E-cad-cats复合体的异常表达和胃癌的侵袭转移显著相关(P<0.05). 我们的RT-PCR结果表明在进展期大肠癌原发灶及其相应转移淋巴结中均有不同程度的E-cad mRNA表达, 且在转移淋巴结中的表达量高于原发灶mRNA表达量, 但低于正常对照大肠黏膜表达量. 推测在肿瘤原发灶中由于突变等原因导致基因水平的改变, 从而造成E-cad表达水平的降低, 进而促进大肠癌浸润转移, 而在转移淋巴结中也是由于基因水平的变化造成两者再次出现表达升高. Western blot研究结果表明, 大肠癌原发灶及其相应转移淋巴结中均有不同程度的E-cad蛋白表达, 转移淋巴结癌细胞中E-cad蛋白表达量高于原发灶中癌细胞E-cad蛋白表达量. 以上结果显示, E-cad蛋白及其mRNA的表达显示出一定的一致性. 因此可以认为E-cad蛋白表达量的变化是由于基因水平的变化造成的.
通过大肠癌转移淋巴结中E-cad蛋白及mRNA表达水平与临床病理因素的分析, 表明肿瘤转移淋巴结内E-cad蛋白及mRNA的表达与肿瘤的分化程度紧密相关, 但与肿瘤的浸润深度、大小、部位及患者年龄无关, 同时E-cad蛋白的表达还与肿瘤的病理学类型有显著相关性, 这与免疫组织化学的研究结果相一致.
大肠癌的发生是遗传、环境、生物等多种因素造成癌基因激活以及抑癌基因失活的过程, 对E-cad的研究只是这个认知过程中的冰山一角, 但认识黏附分子在大肠癌侵袭和转移过程中作用的分子机制将为寻找抑制肿瘤侵袭的靶点提供希望, 这将为基因治疗作为一种崭新的肿瘤治疗手段应用于临床提供重要的理论基础.
E-钙粘蛋白作为钙依赖性同型细胞黏附分子, 是分布在所有上皮组织中的跨膜糖蛋白, 介导同种细胞间、细胞与基质之间的黏附反应, 维持细胞极性和参与分化调节. 研究表明, 肿瘤细胞E-cadherin表达水平下降, 而在转移淋巴结中出现再表达, 从而使肿瘤细胞在转移部位定植生长.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
大肠癌严重威胁着人们的健康, 其具有的侵袭、转移的恶性生物学行为是影响临床治疗效果和导致死亡的主要原因. 肿瘤细胞从原发部位脱落作为肿瘤浸润和转移的重要环节, 与细胞黏附功能降低密切相关, 近年来已被广泛关注.
Nakamura等通过分析黏膜、黏膜下及肿瘤浸润最深部位的E-cad免疫活性, 发现其在细胞分化和侵袭的过程中呈现动态变化. 癌细胞从原发部位分离时E-cad表达下调, 但癌细胞向远处侵袭和转移时, 他的内聚力和保持能力强.
以往研究只采用免疫组织化学实验方法研究钙粘蛋白复合体在肿瘤转移淋巴结再表达的情况, 而本研究同时联合使用免疫组织化学、Western blot、RT-PCR等方法检测E-cadherin在大肠癌转移淋巴结再表达情况.
本研究通过对E-cadherin在大肠癌转移淋巴结再表达机制的研究进一步明确其在转移淋巴结癌细胞再表达的始动因素, 可以为大肠癌分子水平的诊断、治疗提供线索及依据.
本研究新颖性尚可, 有一定的可读性, 对临床研究有较好的指导意义.
编辑: 李军亮 电编:何基才
| 1. | Wijnhoven BP, Dinjens WN, Pignatelli M. E-cadherin-catenin cell-cell adhesion complex and human cancer. Br J Surg. 2000;87:992-1005. [PubMed] [DOI] |
| 2. | Hao X, Tomlinson I, Ilyas M, Palazzo JP, Talbot IC. Reciprocity between membranous and nuclear expression of beta- catenin in colorectal tumours. Virchows Arch. 1997;431:167-172. [PubMed] [DOI] |
| 3. | Liotta LA, Steeg PS, Stetler-Stevenson WG. Cancer metastasis and angiogenesis: an imbalance of positive and negative regulation. Cell. 1991;64:327-336. [PubMed] |
| 4. | Gumbiner BM, McCrea PD. Catenins as mediators of the cytoplasmic functions of cadherins. J Cell Sci Suppl. 1993;17:155-158. [PubMed] |
| 5. | Berx G, Staes K, van Hengel J, Molemans F, Bussemakers MJ, van Bokhoven A, van Roy F. Cloning and characterization of the human invasion suppressor gene E-cadherin (CDH1). Genomics. 1995;26:281-289. [PubMed] [DOI] |
| 6. | Zhou YN, Xu CP, Han B, Li M, Qiao L, Fang DC, Yang JM. Expression of E-cadherin and beta-catenin in gastric carcinoma and its correlation with the clinicopathological features and patient survival. World J Gastroenterol. 2002;8:987-993. [PubMed] |
| 7. | Saito T, Nishimura M, Yamasaki H, Kudo R. Hypermethylation in promoter region of E-cadherin gene is associated with tumor dedifferention and myometrial invasion in endometrial carcinoma. Cancer. 2003;97:1002-1009. [PubMed] [DOI] |
| 8. | Hazan RB, Qiao R, Keren R, Badano I, Suyama K. Cadherin switch in tumor progression. Ann N Y Acad Sci. 2004;1014:155-163. [PubMed] [DOI] |
| 9. | Nakamura E, Sugihara H, Bamba M, Hattori T. Dynamic alteration of the E-cadherin/catenin complex during cell differentiation and invasion of undifferentiated-type gastric carcinomas. J Pathol. 2005;205:349-358. [PubMed] [DOI] |
| 10. | Peter M, Herskowitz I. Joining the complex: cyclin-dependent kinase inhibitory proteins and the cell cycle. Cell. 1994;79:181-184. [PubMed] |
| 12. | Becker KF, Reich U, Schott C, Becker I, Berx G, van Roy F, Höfler H. Identification of eleven novel tumor-associated E- cadherin mutations. Mutations in brief no. 215. Online. Hum Mutat. 1999;13:171. [PubMed] [DOI] |
| 13. | Wang CX, Chen J, Yang Z, Song W, Du ZL, Li ZH. [Correlation of E-cadherin, beta-catenin and gamma-catenin gene expression with the invasion and metastasis of gastric carcinoma]. Diyi Junyi Daxue Xuebao. 2003;23:1198-1201. [PubMed] |