修回日期: 2010-06-17
接受日期: 2010-06-22
在线出版日期: 2010-08-08
目的: 探讨溃疡性结肠炎大鼠β2AR-β-arrestin2-NF-κB信号转导通路及氧化苦参碱的干预作用.
方法: SD♂大鼠40只随机分为正常对照组、模型组、美沙拉嗪组和氧化苦参碱组4组, 每组10只. 正常对照组未造模, 其余3组大鼠均采用TNBS造模诱导实验性大鼠结肠炎. 其中氧化苦参碱组大鼠予苦参素(氧化苦参碱)注射液肌肉注射, 美沙拉嗪组大鼠予美沙拉嗪混悬液灌胃, 模型组和正常组大鼠均以3 mL蒸馏水灌胃. 注意观察实验大鼠腹泻、便血症状. 第7天, 每组随机处死2只大鼠, 比较各组结肠组织大体组织病理变化, 取病变明显的结肠组织石蜡包埋切片并HE染色, 镜下观察各组结肠病理组织学改变. 第16天禁食24 h后处死大鼠, 用免疫组织化学技术和Western blot检测实验大鼠结肠组织和脾脏淋巴细胞β2肾上腺素受体(β2AR)、β-arrestin2和NF-κB p65表达的变化.
结果: 与正常对照组比较, 模型组大鼠结肠黏膜组织及脾脏淋巴细胞NF-κB p65表达均显著上升(均P<0.01), β2AR和β-arrestin2表达均显著下降(均P<0.01). 与模型组比较, 美沙拉嗪组和氧化苦参碱组大鼠结肠黏膜组织NF-κB p65表达均显著下降(16.26±5.51, 18.34±3.34 vs 61.90±17.75, 均P<0.01), β2AR表达均显著上升(47.27±12.40, 61.75±10.40 vs 12.20±2.70, 均P<0.01), β-arrestin2表达均显著上升(70.71±12.84, 76.14±8.77 vs 16.80±7.17, 均P<0.01). 与模型组比较, 美沙拉嗪组和氧化苦参碱组大鼠脾脏淋巴细胞NF-κB p65表达均显著下降(114.23±11.56, 145.62±13.05 vs 249.70±18.94, 均P<0.01), β2AR表达均显著上升(1006.50±226.89, 1102.11±297.72 vs 594.97±209.59 均P<0.01), β-arrestin2表达均显著上升(189.97±21.12, 162.04±15.69 vs 111.77±19.43, 均P<0.01). 但美沙拉嗪组和氧化苦参碱组之间比较β2AR、β-arrestin2、NF-κB p65表达无显著差异.
结论: β2AR-β-arrestin2-NF-κB信号转导通路参与溃疡性结肠炎的病理过程, 氧化苦参碱可以通过调节β2AR-β-arrestin2-NF-κB信号转导通路减轻溃疡性结肠炎.
引文著录: 范恒, 廖奕, 陈小艳, 张丽娟, 刘星星, 钟敏, 唐庆. 溃疡性结肠炎大鼠β2AR-β-arrestin2-NF-κB信号转导通路及氧化苦参碱的干预作用. 世界华人消化杂志 2010; 18(22): 2308-2316
Revised: June 17, 2010
Accepted: June 22, 2010
Published online: August 8, 2010
AIM: To investigate whether the β2-adrenoceptor (β2AR)-β-arrestin2-NF-κB signaling pathway mediates the therapeutic effects of oxymatrine on ulcerative colitis in rats.
METHODS: Forty Sprague-Dawley rats were randomly and equally divided into four groups: normal control group, model group, mesalazine group and oxymatrine group. Experiment colitis was induced with TNBS in rats in each group except the normal control group. The rats in the oxymatrine group were intramuscularly injected with oxymatrine injection for 15 d, while those in the mesalazine group were lavaged with 3 mL mesalazine solution for the same duration. The rats in the normal control group and model group were lavaged with 3 mL water for 15 d. Diarrhea and bloody stools were carefully observed in experimental rats. Two rats in each group were randomly selected and executed on day 7 for observing colonic histological changes. On day 16, the remaining rats were executed after fasting 24 h to detect the expression of β2AR, β-arrestin2 and NF-κB p65 in colon tissue and splenic lymphocytes by immunohistochemistry and Western blotting, respectively.
RESULTS: Compared with the normal control group, the expression of NF-κB p65 was significantly increased (both P < 0.01) and the expression of β2AR and β-arrestin2 was significantly decreased (both P < 0.01) in colonic mucosa and splenic lymphocytes in the model group. Compared with the model group, the expression of NF-κB p65 was significantly decreased (16.26 ± 5.51 and 18.34 ± 3.34 vs 61.90 ± 17.75, both P < 0.01) and the expression of β2AR and β-arrestin2 was significantly increased in colonic mucosa in the mesalazine group and oxymatrine group (47.27 ± 12.40 and 61.75 ± 10.40 vs 12.20 ± 2.70, both P < 0.01; 70.71 ± 12.84 and 76.14 ± 8.77 vs 16.80 ± 7.17, both P < 0.01). Compared with the model group, the expression of NF-κB p65 was significantly decreased (114.23 ± 11.56 and 145.62 ± 13.05 vs 249.70 ± 18.94, both P < 0.01) and the expression of β2AR and β-arrestin2 was significantly increased in splenic lymphocytes in the mesalazine group and oxymatrine group (1 006.50 ± 226.89 and 1 102.11 ± 297.72 vs 594.97 ± 209.59, both P < 0.01; 189.97 ± 21.12 and 162.04 ± 15.69 vs 111.77 ± 19.43, both P < 0.01).
CONCLUSION: The β2AR-β-arrestin2-NF-κB signaling pathway participates in the pathogenesis of ulcerative colitis in rats. Oxymatrine attenuates ulcerative colitis by regulating the β2AR-β-arrestin2-NF-κB signaling pathway.
- Citation: Fan H, Liao Y, Chen XY, Zhang LJ, Liu XX, Zhong M, Tang Q. Oxymatrine attenuates ulcerative colitis by modulating the β2AR-β-arrestin2-NF-κB signaling pathway in rats. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2308-2316
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2308.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2308
炎症性肠病(inflammatory bowel disease, IBD)是特发性的慢性肠道炎症, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). IBD的病因和发病机制涉及遗传、环境和免疫等因素, 目前多数学者认为IBD的发病是由某些环境因素触发的肠道黏膜免疫调节功能的紊乱所致[1-3]. 促炎转录因子NF-κB的活化在IBD肠黏膜免疫反应紊乱中起着重要的作用, 在肠道炎症中的细胞信号转导过程中扮演着重要的角色. 活化的NF-κB参与炎性细胞的活化, 促进促炎细胞因子IL-1β、IL-6、IL-8和TNF等的表达. 抑制NF-κB的活化和表达可以减轻肠道炎症. 抑制NF-κB的活化和表达是治疗IBD的重要策略, 糖皮质激素、柳氮磺胺吡啶、美沙拉嗪和英夫利昔单抗都可以抑制NF-κB的活性, 治疗IBD[4-6]. β-arrestin2广泛存在于各种组织细胞中, 是参与调节G蛋白偶联受体(G protein-coupled receptor, GPCR)相关细胞信号通路信号转导的重要衔接蛋白. β-arrestin2生物功能多样, 可以通过多种途径抑制NF-κB的活性[7]. β2肾上腺素受体(β2-adrenoceptor, β2AR)参与交感神经系统对免疫系统的调节, β2AR介导的信号通路与NF-κB活化的信号通路之间存在交叉对话(cross talk)[8]. 氧化苦参碱是从中药苦参中提取的生物碱, 有激素样作用, 作为抗炎免疫调节剂能有效的治疗炎症性肠病[9-11]. 我们通过建立三硝基苯磺酸诱导的UC模型研究β-arrestin2在UC的病理机制中的作用, 结果表明β2AR-β-arrestin2-NF-κB信号转导通路参与UC的发病机制. 氧化苦参碱通过调节β-arrestin2的表达和β2AR-β-arrestin2-NF-κB信号转导通路, 减轻UC, 这是氧化苦参碱治疗UC的机制之一.
SD大鼠40只, ♂, SPF级, 体质量250 g±20 g, 由华中科技大学同济医学院实验动物中心提供, 实验动物生产许可证SCKY(鄂)2004-0007, 实验动物使用许可证SYXK(鄂)2004-0028; 三硝基苯磺酸(Sigma公司); β2AR多克隆抗体(Bioss, 公司, BS-0947R); β-arrestin2多克隆抗体(Bioss公司, BS-1332R); NF-κB p65多克隆抗体(Santa Cruz公司, sc-8008); 迈新公司免疫组织化学试剂盒(KIT-5020, 羊抗鼠/兔); 大鼠淋巴细胞分离液(武汉博士德, CM0100); RIPA细胞/组织总蛋白提取液(ProMab, Cat. No: SJ-200501); Bradford蛋白浓度测定试剂盒(碧云天, Cat. No: P0006); 美沙拉嗪(法国爱的发制药集团), 规格500 mg×10袋/盒; 苦参素注射液(江苏鹏鹞药业有限公司), 规格2 mL: 0.2 g, 主要成分为苦参素, 即氧化苦参碱.
1.2.1 分组: 健康♂SD大鼠40只随机分为正常对照组、模型组、美沙拉嗪组、氧化苦参碱组, 每组10只, 各组体质量比较无显著差异(P>0.05).
1.2.2 造模: 依据Morris等[12]及Fan等[13,14]提出的方法具体操作如下: SD大鼠禁食不禁水24 h后, 用10%水合氯醛按每100 mg体质量0.3 mL, 腹腔注射麻醉, 麻醉后将内径2 mm的橡胶导尿管由肛门轻缓插入约8 cm后, 将0.6 mL的5% TNBS液(溶于500 mL/L乙醇), 用注射器缓慢推入橡胶导尿管, 推入TNBS液后将大鼠尾巴提起, 持续倒置30 s, 防止药液流出. 造模结束后让动物平躺, 待其自然清醒, 给予自由饮食.
1.2.3 药物干预和处死: 氧化苦参碱组每只大鼠用苦参素注射液按63 mg/(kg•d)肌肉注射[10], 每天1次, 连续15 d. 美沙拉嗪组每只大鼠用美沙拉嗪0.5 g/(kg•d)的蒸馏水溶液3 mL灌胃, 每天1次, 连续15 d. 模型组、正常组: 每组每只大鼠均以蒸馏水3 mL灌胃, 每天1次, 连续15 d. 注意观察实验大鼠腹泻、便血症状. 第7天, 每组随机处死2只大鼠, 比较各组结肠组织大体组织病理变化, 取病变明显的结肠组织石蜡包埋切片并HE染色, 镜下观察各组结肠病理组织学改变. 第16天禁食24 h后将大鼠颈椎脱位处死. 实验过程中正常对照组、模型组、美沙拉嗪组各有2只大鼠在灌胃中死亡, 最后纳入统计为: 正常对照组6只、模型组6只、美沙拉嗪组6只和氧化苦参碱组8只.
1.2.4 大鼠脾脏淋巴细胞分离和蛋白质提取: 将处死的大鼠置于750 mL/L乙醇中浸泡3-5 min, 在超净工作台无菌取出脾脏, 并在盛有无小牛血清的RPMI 1640不完全培养液的培养皿中清洗干净. 将脾脏置于放置在盛有无小牛血清的RPMI 1640不完全培养液的培养皿上的200目不锈钢金属网上, 用10 mL注射器针柄轻柔研磨脾脏至留下白色纤维包膜组织, 收集网下的细胞悬液, 与Hank's液1:1混匀后, 小心加于2 mL的大鼠淋巴细胞分离液的液面上, 置离心机中, 2 000 r/min, 室温离心20 min, 收集界面上的细胞, 放入含Hank's液5 mL的试管中, 充分混匀后, 以2 000 r/min离心10 min, 吸去上清液, 沉淀再用不含小牛血清的RPMI 1640不完全培养液颠倒冲洗2次并重新悬浮为脾脏淋巴细胞悬液[15], 收集分离的淋巴细胞悬液置于EP管中, 用RIPA细胞/组织总蛋白提取液裂解细胞提取总蛋白. 在收集的淋巴细胞悬液中加入1 mL RIPA后充分吹打, 然后置冰上20 min, 再吹打20 min, 将匀浆液吸出放到1.5 mL离心管中, 超声3次破碎细胞, 每次3 s, 再9 000 r/min离心10 min, 用移液管将富含蛋白质的上清液转移到样品管中, -70 ℃存放备用.
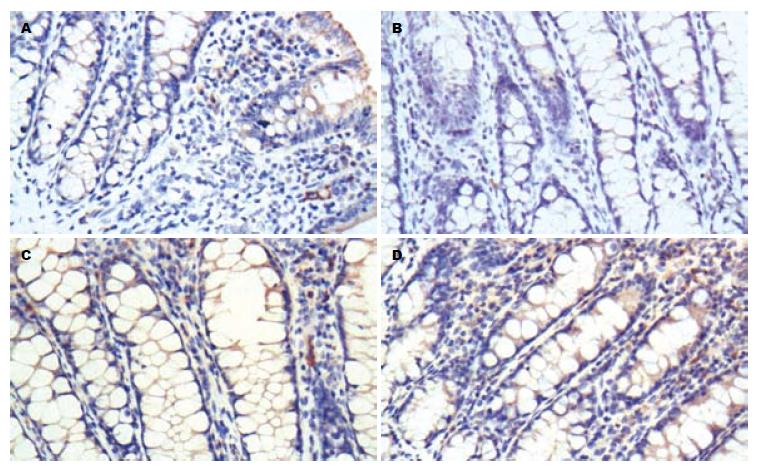
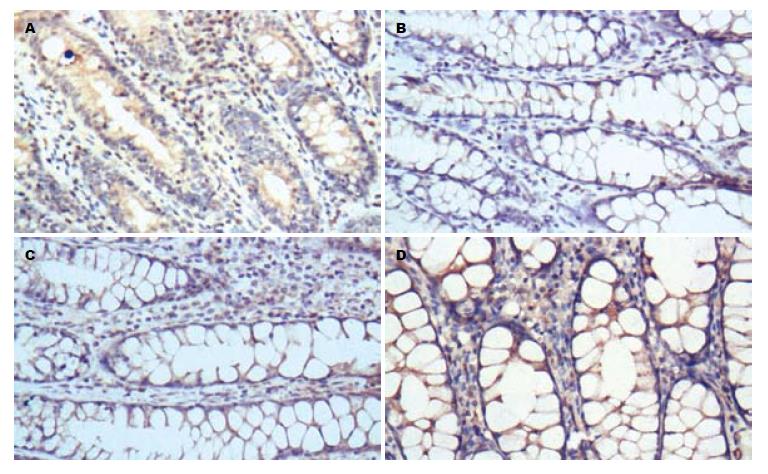
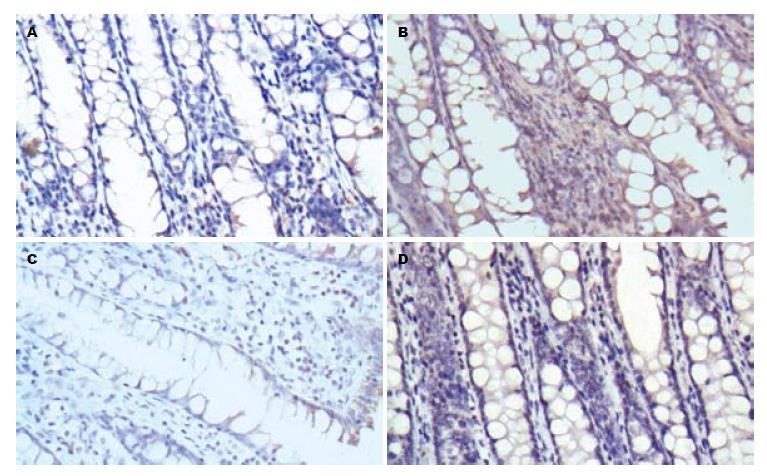
1.2.5 免疫组织化学分析大鼠结肠黏膜组织β2AR、β-arrestin2、NF-κB p65表达: 处死大鼠取出脾脏后, 剖腹暴露腹腔, 切取肛门至回盲部的结肠, 取出结肠后沿纵轴切开, 并用生理盐水冲洗干净, 观察大鼠结肠的大体病变情况, 然后将大鼠结肠置于40 g/L多聚甲醛溶液中固定, 石蜡包埋切片, 常规HE染色, 在显微镜下观察评估大鼠结肠黏膜损伤程度. 采用免疫组织化学法检测β2AR、β-arrestin2、NF-κB p65表达, 按免疫组织化学试剂盒(KIT-5020)说明书进行操作: 常规包埋, 切片, 厚度3 μm, 60 ℃-65 ℃烤片4 h. 切片脱蜡和水化. 1×PBS缓冲液(0.01 mol/L, pH7.2)洗涤切片3×5 min. 高压抗原修复, 取出抗原修复盒, 待修复液自然冷却30 min, 3%过氧化氢去离子水室温孵育10 min, 蒸馏水冲洗. PBS浸洗3×5 min. 滴加正常山羊血清封闭液, 室温孵育15 min, 甩去多余液体. 分别加入稀释度为1:200兔抗鼠β2AR多克隆抗体、1:200兔抗鼠β-arrestin2多克隆抗体、1:200小鼠抗大鼠NF-κB p65多克隆抗体, 各50 μL, 置于湿盒内, 4 ℃过夜, 防止切片干燥. 1×PBS洗3次各5 min. 滴加复合生物素标记的二抗(HRP-Polymer anti ms/rb IgG), 室温孵育20 min. DAB显色, 在显微镜下控制显色程度, 蒸馏水终止显色反应. 苏木素复染, 30-60 s. 脱水, 透明, 中性树胶封片. 在显微镜下观察免疫组织化学结果, 并用图像分析软件Image-Pro Plus 6.0进行图像分析, 以黄色或棕黄色染色为阳性表达, 测定平均吸光度值(mean density).
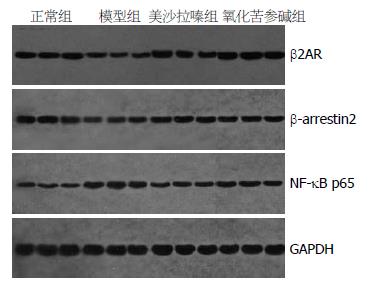
1.2.6 Western blot检测脾脏淋巴细胞β2AR、β-arrestin2、NF-κB p65蛋白表达: (1)测定蛋白浓度: 用Bradford蛋白浓度测定试剂盒测定样品蛋白浓度. (2)SDS-PAGE电泳: 在收集的蛋白样品中加入5×SDS-PAGE蛋白上样缓冲液(体积比为5:1), 混匀, 100 ℃加热5 min, 按设计加样顺序加入蛋白样品(考马斯亮蓝染色), 电压200 V电泳, 待溴酚蓝线条迁移到分离胶底部0.5 cm时关闭电源. (3)免疫印迹和转膜: 组装转膜夹子, 在转移槽中注满4 ℃预冷的转移缓冲液, 并将冰盒装入缓冲液槽, 恒流300 mA转移70 min. 电转完毕后用5%的脱脂奶粉(PBS配制)封闭, 4 ℃过夜. (4)免疫检测: 用PBST洗膜5 min×3次, 按标记切下3 mm宽的膜条, 置于加样槽中, 加入β2AR多克隆抗体(Rabbit β2AR antibody, 稀释度1:100)、β-arrestin2多克隆抗体(Rabbit β-arrestin 2 antibody, 稀释度1:100)、NF-κB p65多克隆抗体(Mouse NF-κB p65 antibody, 稀释度1:200)各1 mL孵育, 4 ℃过夜. 弃去一抗, 每个槽加2-3 mL PBST, 上摇床洗涤5-10 min, 换液, 反复4次, 再分别加入β2AR和β-arrestin2的二抗(稀释度1:40 000)和NF-κB p65的二抗(稀释度1:80 000)各1 mL, 室温下孵育1 h. 弃去二抗, 每槽加2-3 mL PBST, 上摇床洗涤5-10 min, 换液, 反复4次. (5)化学发光: 将膜置于压片盒中, 滴加发光液, 将X光片压于膜上5 min后取出, 在显影液中显影1 min, 在定影液中定影5 min. 阳性条带以Gel pro4.0版凝胶吸光度分析软件测其IA值.
统计学处理 采用SPSS17.0统计软件进行统计学分析. 实验数据以mean±SD表示, 组间比较采用方差分析和多个样本均数间比较的SNK-q检验, 以P<0.05为差异具有统计学意义.
正常对照组大鼠结肠黏膜纹理清晰, 无黏膜充血水肿, 未见黏膜糜烂和溃疡. 模型组大鼠结肠肠管明显变粗, 肠壁增厚, 由肛门至回盲部的肠管长度变短, 纵行切开病变肠管可见由肛门约3 cm以上至回盲部结肠黏膜可见多处片状充血、水肿、糜烂、浅表或线状溃疡和瘢痕组织形成, 并伴有局部结肠肠腔的扩张, 严重的出现肠壁间渗出和粘连. 与模型组相比, 美沙拉嗪组和氧化苦参碱组大鼠结肠黏膜组织病理改变明显减轻, 充血、水肿、糜烂和溃疡面积明显缩小, 溃疡较浅表, 肠壁增厚较模型组轻, 未见肠壁粘连. 实验大鼠病变结肠组织切片后常规苏木精-伊红(HE)染色, 镜下可见: 正常对照组: 大鼠结肠黏膜结构完整, 黏膜腺体排列整齐清晰, 黏膜内血管基质正常, 无充血水肿、溃疡形成和炎性细胞浸润; 模型组: 大鼠结肠黏膜结构异常, 黏膜腺体破坏, 排列不规则, 杯状细胞减少, 黏膜和黏膜下固有层明显充血水肿, 可见黏膜局灶糜烂和溃疡, 有的溃疡深及黏膜肌层, 在黏膜及黏膜下固有层可见大量淋巴细胞、粒细胞和巨噬细胞浸润. 美沙拉嗪组和氧化苦参碱组: 大鼠结肠黏膜结构尚完整, 黏膜层和黏膜下固有层充血、水肿较轻, 溃疡较浅表, 腺体增生活跃, 杯状细胞增多, 炎性细胞浸润减少(图1).
与正常对照组比较, 模型组结肠黏膜组织NF-κB p65表达显著上升(P<0.01), β2AR和β-arrestin2表达均显著下降(P<0.01); 与模型组比较, 美沙拉嗪组和氧化苦参碱组结肠黏膜组织NF-κB p65表达均显著下降(P<0.01), β2AR和β-arrestin2表达均显著上升(P<0.01), 但美沙拉嗪组和氧化苦参碱组之间比较β2AR、β-arrestin2、NF-κB p65表达无显著差异(P>0.05, 图2-4, 表1).
与正常对照组比较, 模型组脾脏淋巴细胞NF-κB p65蛋白表达水平显著上升(P<0.01), β2AR和β-arrestin2蛋白表达水平显著下降(P<0.01); 与模型组比较, 美沙拉嗪组和氧化苦参碱组脾脏淋巴细胞NF-κB p65蛋白表达水平均显著下降(P<0.01), β2AR和β-arrestin2蛋白表达水平显著上升(P<0.01), 但美沙拉嗪组和氧化苦参碱组之间比较β2AR、β-arrestin2、NF-κB p65蛋白表达无显著差异(P>0.05, 图5, 表2).
NF-κB是NF-κB/Rel家族成员, 通常以二聚体形式存在, 分别通过其氨基端Rel同源结构域内的DNA结合位点和抑制蛋白IκB结合位点与DNA和IκB结合, 抑制蛋白IκB与NF-κB形成复合物并掩盖NF-κB结构中的核定位信号序列, 使其保留在细胞质中. NF-κB是重要的转录因子, 在上游刺激信号的作用下IκB激酶(IκB kinase, IKK)使IκB降解, 暴露NF-κB的核定位信号序列, NF-κB进入细胞核内, 通过与细胞核内多种基因的增强子和启动子序列结合促进特定基因的转录和表达, 广泛参与免疫, 炎症, 细胞凋亡和增殖的调节. NF-κB的活化促进多种促炎细胞因子的表达和增强炎症细胞的募集, NF-κB是炎症反应中的关键调节因子[16,17]. Toll样受体信号是介导NF-κB活化的重要途径, TLR/NF-κB信号通路调节机制的破坏可以导致肠道炎症的发生, TLR/NF-κB信号通路参与IBD的发病机制. IBD患者的病变结肠组织中NF-κB表达增高, NF-κB促进多种促炎细胞因子的表达, NF-κB在IBD的病理机制中扮演着重要的角色, 阻断NF-κB的活化是治疗IBD的重要手段[6,18].
β-arrestin2通过多种机制抑制NF-κB的活化[7], β-arrestin2与IκBα和IKK的结合抑制了CK2和IKK对IκBα的磷酸化, 稳定了抑制蛋白IκBα, 继而减弱NF-κB p65的活化和核转位[8,19]. NF-κB的活化依赖TRAF6的泛素化和寡聚化, β-arrestin2与TRAF6结合阻止TRAF6的泛素化和寡聚化, 抑制NF-κB的活化[20]. 我们的研究表明三硝基苯磺酸诱导的实验性大鼠结肠炎结肠黏膜组织和脾脏淋巴细胞β-arrestin2表达与正常对照组大鼠相比明显降低(P<0.01), NF-κB p65的表达与正常对照组大鼠相比明显上升(P<0.01). 以上结果提示, β-arrestin2表达降低是UC中NF-κB过度活化的重要原因, NF-κB的过度活化是UC重要发病机制.
β2AR受体信号通路通过β-arrestin2调节NF-κB的活化过程, β2AR受体信号降低CK2磷酸化β-arrestin2和诱导β-arrestin2的特异性构象改变, 加强β-arrestin2与IκBα的结合, 稳定IκBα, 抑制NF-κB活化[8]. β2AR/β-arrestin2信号通路与TLR4/NF-κB信号通路存在交叉对话和相互调节. 脂多糖(lipopolysaccharide, LPS)激活的TLR信号通路是活化NF-κB的重要信号通路[21], TLR/NF-κB信号通路包括依赖衔接蛋白MyD88(髓分化因子88)调节的早期时相通路和依赖衔接蛋白TRAM(Toll receptor associated molecule)和TRIF(Toll receptor associated activator of interferon)调节的晚期时相通路. 在LPS激活的TLR4/NF-κB信号通路的晚期时相通过依赖TRIF的方式下调β2AR和β-arrestin2的表达, 诱导晚期时相NF-κB的持续活化. 而β2AR/β-arrestin2信号通路可以减弱TLR4/NF-κB信号通路早期时相诱导的IκBα降解和NF-κB活化[22,23]. 我们的研究表明β2AR/β-arrestin2信号转导通路通过调节TLR4/NF-κB信号通路参与IBD中炎症和免疫调节的过程, 在UC中β2AR和β-arrestin2的表达明显下降, 而NF-κB p65的表达上升, β2AR和β-arrestin2表达的下降减弱了β-arrestin2对NF-κB活性的抑制作用, 说明β2AR-β-arrestin2-NF-κB信号通转导通路参与UC的病理机制.
氧化苦参碱可以促进β2AR和β-arrestin2的表达, 抑制NF-κB的过度活化, 通过调节β2AR-β-arrestin2-NF-κB信号转导通路减轻UC的症状和组织病理改变. NF-κB的活化促进多种促炎细胞因子的表达, 抑制NF-κB的过度活化是治疗IBD的重要手段[6,16,18]. β-arrestin2通过抑制NF-κB的活化, 调节多种炎症相关基因的表达. 氧化苦参碱是喹嗪烷类生物碱, 具有细胞毒性作用和抗炎免疫调节功能, 氧化苦参碱可以抑制NF-κB的活性和下调NF-κB的表达[24-26], 并通过抑制NF-κB活性和降低促炎细胞因子的表达减轻UC[9-11]. 临床上我们用复方苦参肠溶胶囊(主要含氧化苦参碱)治疗UC取得良好的临床效果[27-30]. 动物实验中进一步研究发现氧化苦参碱可以显著提高三硝基苯磺酸诱导的实验性大鼠结肠炎模型结肠黏膜组织和脾脏淋巴细胞β2AR和β-arrestin2的表达, 降低NF-κB p65的表达, 说明氧化苦参碱可以促进β2AR和β-arrestin2表达, 增强β-arrestin2对NF-κB活化的抑制作用, 通过β2AR/β-arrestin2信号通路抑制NF-κB的活性, 这可能是氧化苦参碱减轻UC的机制之一.
总之, UC中β2AR和β-arrestin2的表达下降, β-arrestin2对NF-κB活化的抑制减弱, NF-κB过度活化和活性增强, 导致肠道炎症的发生和持续. 在UC中β2AR/β-arrestin2信号通路通过与TLR/NF-κB信号通路的交叉对话, 调节TLR活化的NF-κB活性, β2AR-β-arrestin2-NF-κB信号通路参与UC的病理过程. 氧化苦参碱促进UC中β2AR和β-arrestin2的表达, 抑制NF-κB的活化, 减轻UC的症状和组织病理改变. 本研究为氧化苦参碱治疗UC提供了新的理论依据和思路, 氧化苦参碱是否可以通过这一机制调节炎症相关细胞因子的表达有待进一步的研究.
溃疡性结肠炎是一种以肠道免疫功能紊乱为主的慢性非特异性炎症性肠道疾病. 近20年来我国发病率呈逐年增加. 其发病机制是遗传、环境和免疫因素相互作用的共同结果, 免疫功能紊乱起关键性作用, 是在遗传和环境因素的双重作用下, 机体对肠道菌群产生异常免疫反应, 最终导致肠道慢性炎症的发生. 但其确切的发病原因和机制还不明确, 治疗上也比较棘手, 因此对本病的发病机制和治疗上的研究显得十分必要.
孙学英, 教授, 哈尔滨医科大学第一附属医院黑龙江省肝脾外科中心
溃疡性结肠炎的发病机制与免疫异常有关, 具有免疫调节作用的细胞因子在UC的发病过程中起重要作用. 许多细胞因子的产生可能与NF-κB的信号转导和转录激活因子有关. NF-κB活化可能是UC发生发展的关键点.
临床上本课题组用复方苦参肠溶胶囊(主要含氧化苦参碱)治疗UC取得良好的临床效果.
本文通过研究大鼠结肠和脾脏中β2AR、β-arrestin2、NF-κB p65的表达来阐明溃疡性结肠炎的发病机制, 检测指标和UC密切相关, 为氧化苦参碱治疗溃疡性结肠炎提供了理论依据和研究思路.
本文研究发现氧化苦参碱和美莎拉嗪均可以有效治疗溃疡性结肠炎, 特别是中药提取物氧化苦参碱对该病有较好的治疗作用, 值得进一步研究和开发, 有一定的临床应用前景.
本课题新颖, 实验设计比较严谨, 讨论较充分, 有一定的科学意义.
编辑: 李军亮 电编:何基才
| 1. | Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease. Nat Rev Immunol. 2003;3:521-533. [PubMed] [DOI] |
| 2. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 3. | Neuman MG. Immune dysfunction in inflammatory bowel disease. Transl Res. 2007;149:173-186. [PubMed] [DOI] |
| 4. | Kucharzik T, Maaser C, Lügering A, Kagnoff M, Mayer L, Targan S, Domschke W. Recent understanding of IBD pathogenesis: implications for future therapies. Inflamm Bowel Dis. 2006;12:1068-1083. [PubMed] [DOI] |
| 5. | Sartor RB. Mechanisms of disease: pathogenesis of Crohn's disease and ulcerative colitis. Nat Clin Pract Gastroenterol Hepatol. 2006;3:390-407. [PubMed] [DOI] |
| 6. | Atreya I, Atreya R, Neurath MF. NF-kappaB in inflammatory bowel disease. J Intern Med. 2008;263:591-596. [PubMed] [DOI] |
| 7. | Chen F. Arresting NF-kappaB by beta-arrestin2. Cell Death Differ. 2004;11:1155-1156. [PubMed] [DOI] |
| 8. | Gao H, Sun Y, Wu Y, Luan B, Wang Y, Qu B, Pei G. Identification of beta-arrestin2 as a G protein-coupled receptor- stimulated regulator of NF-kappaB pathways. Mol Cell. 2004;14:303-317. [PubMed] [DOI] |
| 9. | Fan H, Chen R, Shen L, Lv J, Xiong P, Shou Z, Zhuang X. Oxymatrine improves TNBS-induced colitis in rats by inhibiting the expression of NF-kappaB p65. J Huazhong Univ Sci Technolog Med Sci. 2008;28:415-420. [PubMed] [DOI] |
| 10. | Zheng P, Niu FL, Liu WZ, Shi Y, Lu LG. Anti-inflammatory mechanism of oxymatrine in dextran sulfate sodium-induced colitis of rats. World J Gastroenterol. 2005;11:4912-4915. [PubMed] |
| 11. | 吕 建芳, 范 恒, 沈 霖, 寿 折星, 庄 雄. 氧化苦参碱对实验性结肠炎大鼠肠黏膜细胞因子和核因子-κB p65表达的影响. 世界华人消化杂志. 2008;16:896-899. [DOI] |
| 12. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 13. | Fan H, Qiu MY, Mei JJ, Shen GX, Liu SL, Chen R. Effects of four regulating-intestine prescriptions on pathology and ultrastructure of colon tissue in rats with ulcerative colitis. World J Gastroenterol. 2005;11:4800-4806. [PubMed] |
| 14. | Fan H, Shen L, Tang Q, Xiong PC, Shou ZX, Liang L, Liao Y, Chen XY. Effect of Wumeiwan on Cytokine TNF-α, IL-6, IL-8, IL-10 and expression of NF-κB p65 of Rats with Ulcerative Colitis. J Huazhong Univ Sci Technolog Med Sci. 2009;29:650-654. [DOI] |
| 16. | Karin M, Yamamoto Y, Wang QM. The IKK NF-kappa B system: a treasure trove for drug development. Nat Rev Drug Discov. 2004;3:17-26. [PubMed] [DOI] |
| 17. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] [DOI] |
| 18. | Karrasch T, Jobin C. NF-kappaB and the intestine: friend or foe? Inflamm Bowel Dis. 2008;14:114-124. [PubMed] [DOI] |
| 19. | Witherow DS, Garrison TR, Miller WE, Lefkowitz RJ. beta-Arrestin inhibits NF-kappaB activity by means of its interaction with the NF-kappaB inhibitor IkappaBalpha. Proc Natl Acad Sci U S A. 2004;101:8603-8607. [PubMed] [DOI] |
| 20. | Wang Y, Tang Y, Teng L, Wu Y, Zhao X, Pei G. Association of beta-arrestin and TRAF6 negatively regulates Toll-like receptor-interleukin 1 receptor signaling. Nat Immunol. 2006;7:139-147. [PubMed] [DOI] |
| 21. | Abreu MT, Fukata M, Arditi M. TLR signaling in the gut in health and disease. J Immunol. 2005;174:4453-4460. [PubMed] |
| 22. | Kizaki T, Izawa T, Sakurai T, Haga S, Taniguchi N, Tajiri H, Watanabe K, Day NK, Toba K, Ohno H. Beta2-adrenergic receptor regulates Toll-like receptor-4-induced nuclear factor-kappaB activation through beta-arrestin 2. Immunology. 2008;124:348-356. [PubMed] [DOI] |
| 23. | Kizaki T, Shirato K, Sakurai T, Ogasawara JE, Oh-ishi S, Matsuoka T, Izawa T, Imaizumi K, Haga S, Ohno H. Beta2- adrenergic receptor regulate Toll-like receptor 4-induced late-phase NF-kappaB activation. Mol Immunol. 2009;46:1195-1203. [PubMed] [DOI] |
| 24. | Zhang CQ, Feng J, Yan XN, Li WB, Hu G. Effects of Oxymatrine on the NF-kappa B expression of HaCaT cells. J Nanjing Med Univ. 2008;22:178-182. [DOI] |
| 25. | 张 彩晴, 郭 宏林, 冯 捷, 闫 小宁, 李 文彬, 胡 刚. 氧化苦参碱对HaCaT细胞核转录因子κB表达及一氧化氮分泌的影响. 中国组织工程研究与临床康复. 2008;12:3847-3852. |
| 26. | Liu Y, Zhang XJ, Yang CH, Fan HG. Oxymatrine protects rat brains against permanent focal ischemia and downregulates NF-kappaB expression. Brain Res. 2009;1268:174-180. [PubMed] [DOI] |
| 28. | 范 恒, 寿 折星, 吕 建芳, 沈 霖, 杨 胜兰, 陈 瑞. 复方苦参结肠溶胶囊治疗溃疡性结肠炎11例. 中国中西医结合消化 杂志. 2007;15:60-61. |
| 30. | Fan H, Zhao J, Shen L, Tang Q, Shou ZX, Liang L, Liao Y, Chen XY. Effect of Compound Sophorae Flavescentis Jiechangrong Capsule on Expression of NF-κBp65 and STAT6 in the intestinal mucosa of patients with ulcerative colitis. Front Med China. 2009;3:480-484. [DOI] |