修回日期: 2010-06-15
接受日期: 2010-06-22
在线出版日期: 2010-07-18
目的: 探讨选择性环氧合酶-2(COX-2)抑制剂尼美舒利对食管癌Eca-109裸鼠移植瘤的生长抑制作用及对COX-2、过氧化物酶体增殖因子活化受体γ(PPARγ)表达的影响, 分析其可能机制.
方法: 采用免疫组织化学方法, 检测18例食管正常鳞状上皮及59例食管鳞状细胞癌中PPARγ及COX-2的表达, 分析其在食管癌发生中的意义; 建立食管癌裸鼠移植瘤模型, 给予尼美舒利4 wk, 剥离瘤结节, 计算瘤体体积和肿瘤生长抑制率; FCM法检测细胞凋亡率; RT-PCR和免疫组织化学方法检测COX-2和PPARγ mRNA和蛋白的表达变化.
结果: PPARγ在食管鳞状细胞癌和正常鳞状上皮的免疫组织化学染色平均积分分别为2.88±2.23和6.29±2.17, 鳞状细胞癌的PPARγ蛋白表达显著低于正常鳞状上皮(P<0.05); 食管鳞状细胞癌的COX-2平均积分为2.12±1.77, 显著高于正常鳞状上皮的0.82±0.46, 差异有显著性(P<0.05); 食管鳞状细胞癌的PPARγ及COX-2蛋白表达与肿瘤分化程度有关, PPARγ的表达随肿瘤分化程度降低而逐渐降低(P<0.05), 高、中分化鳞状细胞癌的COX-2表达显著高于低分化鳞状细胞癌(P<0.05). 尼美舒利对裸鼠移植瘤的生长有明显的抑制作用, 给药4 wk后, 尼美舒利组的移植瘤体积及瘤质量分别为807.68 mm3±217.76 mm3及0.81 g±0.21 g, 显著低于对照组(2 116.77 mm3±362.47 mm3, 1.45 g±0.39 g, P<0.05), 肿瘤抑制率为44.14%±6.3%; 尼美舒利组的肿瘤细胞的凋亡率32.21%±5.98%, 显著高于对照组(15.86%±2.57%); 尼美舒利组的COX-2 mRNA及蛋白的表达显著降低, 而PPARγ mRNA及蛋白的表达则显著增高(P<0.05); COX-2与PPARγ的表达呈显著负相关(P<0.05).
结论: PPARγ表达降低、COX-2表达上调与食管癌的发生有关; COX-2抑制剂尼美舒利能抑制食管癌裸鼠移植瘤的生长并诱导凋亡, 其机制部分与抑制COX-2表达及上调PPARγ表达有关.
引文著录: 刘俊茹, 杨建柱, 刘淑霞, 左连富. 尼美舒利调控PPARγ信号通路抑制食管癌裸鼠移植瘤生长的分子机制. 世界华人消化杂志 2010; 18(20): 2102-2108
Revised: June 15, 2010
Accepted: June 22, 2010
Published online: July 18, 2010
AIM: To detect the expression of cyclooxygenase-2 (COX-2) and peroxisome proliferator-activated receptor γ (PPARγ) in human esophageal carcinoma, to investigate the inhibitory effects of nimesulide on tumor growth in esophageal carcinoma xenografts in nude mice, and to explore potential mechanisms involved.
METHODS: The expression of PPARγ and COX-2 in 18 normal esophageal epithelial specimens and 59 esophageal squamous cell carcinoma (ESCC) specimens were examined by immunohistochemistry. A nude mouse model bearing Eca-109 cell xenografts was established. The mice were divided randomly into control group and nimesulide group [treated with nimesulide at a dose of 20 mg/(kg•d) for 4 wk]. The tumor volume and reduced rate of tumor growth were calculated according to the length and width of xenograft tumors. Cell apoptosis was detected by flow cytometry. The expression of COX-2 and PPARγ mRNAs and proteins was detected by RT-PCR and immunohistochemistry, respectively.
RESULTS: The immunohistochemical score of PPARγ was significantly lower in ESCC than in normal esophageal epithelium (2.88 ± 2.23 vs 6.29 ± 2.17, P < 0.05), while that of COX-2 was significantly higher in ESCC than in normal esophageal epithelium (2.12 ± 1.77 vs 0.82 ± 0.46, P < 0.05). The immunohistochemical score of PPARγ decreased as tumor pathological grade increased. The immunohistochemical score of PPARγ was closely related to tumor differentiation degree (P < 0.05). The expression level of COX-2 was significantly higher in well and moderately differentiated ESCC than in poorly differentiated ESCC (P < 0.05). Nimesulide significantly inhibited tumor growth in esophageal carcinoma xenografts when compared with the control group (tumor volume: 807.68 mm3 ± 217.76 mm3 vs 2116.77 mm3 ± 362.47 mm3; tumor weight: 0.81 g ± 0.21 g vs 1.45 g ± 0.39 g; both P < 0.05), and the reduced rate of tumor growth was 44.14% ± 6.3%. Nimesulide treatment increased the apoptosis rate from 15.86% ± 2.57% to 32.21% ± 5.98%. COX-2 expression was down-regulated, and PPARγ expression up-regulated in the nimesulide group when compared with the control group. A negative correlation was noted between the expression of COX-2 and PPARγ.
CONCLUSION: Down-regulation of PPARγ expression and up-regulation of COX-2 expression are related to the carcinogenesis of ESCC. Nimesulide inhibits tumor growth and induces apoptosis in esophageal carcinoma xenografts possibly by down-regulating COX-2 expression and up-regulating PPARγ expression.
- Citation: Liu JR, Yang JZ, Liu SX, Zuo LF. Nimesulide, a selective cyclooxygenase-2 inhibitor, inhibits the growth of esophageal carcinoma in vivo by modulating PPARγ signal transduction pathway. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2102-2108
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2102.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2102
目前研究证实选择性环氧合酶-2(cyclooxygenase-2, COX-2)与肿瘤的发生、发展过程密切相关, 已成为肿瘤诊断及治疗的一个重要的作用靶点[1-5]. 近年来, 过氧化物酶体增殖因子活化受体γ(peroxisome proliferator-activated receptors γ, PPARγ)在肿瘤发生、发展中的作用已受到广泛关注, 研究表明许多恶性肿瘤存在PPARγ的异常表达[6-10], PPARγ是否与食管癌的发生有关? PPARγ与COX-2间是否有相关性? 为此, 我们检测了食管癌组织及食管正常鳞状上皮中PPARγ及COX-2蛋白的表达, 并进一步以体内构建食管癌裸鼠移植瘤模型为研究对象, 观察尼美舒利的抗肿瘤作用, 采用多种实验技术检测PPARγ及COX-2 mRNA及蛋白的表达变化, 为尼美舒利应用于食管癌的治疗提供试验性理论依据.
收集河北医科大学第四医院2004-09/2004-12食管癌手术切除并经病理诊断证实的浸润型食管鳞癌标本59例, 每例标本分别取癌组织及正常食管组织. 其中男37例, 女22例, 年龄42-72(中位年龄为59)岁; 高分化鳞状细胞癌19例, 中分化鳞状细胞癌25例, 低分化鳞状细胞癌15例; 正常食管组织18例. 所有患者术前均未接受化疗、放疗及其他抗癌治疗. 人食管癌Eca109细胞中国人民解放军第四军医大学实验动物中心提供; 健康BALB/C/nu/nu裸小鼠, 4 wk, ♂, 体质量16-18 g, 购自中国医学科学院实验动物研究所繁殖场(京动许字017), 动物饲养于本校实验动物中心, 实验动物使用许可证号: SYXK(冀)2003-0026, 清洁级动物室内(SPF级), 该研究经学校实验动物管理部门批准. 尼美舒利为美国Caymen公司产品, 用0.5%羧甲基纤维素钠溶解; 鼠抗人COX-2抗体、鼠抗人PPARγ单克隆抗体均为美国Santa Cruz公司产品, TRIzol为美国Sigma公司产品, 反转录酶AMV及Taq DNA聚合酶为美国Promega公司产品, RPMI 1640、胰蛋白酶为Gibco公司产品.
1.2.1 人食管癌裸鼠移植瘤实验: 常规培养并收集食管癌Eca109细胞, 分别将2×106个细胞接种于12只裸鼠的左前和右后腋皮下, 随机分为对照组(0.5%羧甲基纤维素钠)和尼美舒利用药组20 mg/(kg•d), 每组6只. 尼美舒利用药组于接种后第2天灌胃给药, 对照组只给予同剂量的羧甲基纤维素钠溶液, 连续给药4 wk. 从出现瘤结节开始定期用游标卡尺测量肿瘤的最长径(a)和最短径(b), 计算其体积(V = ab2/2), 每周2次, 绘制肿瘤生长曲线. 4 wk后处死裸鼠, 剥离皮下肿瘤, 称瘤质量, 计算抑瘤率. 抑瘤率 = (对照组瘤质量-实验组瘤质量)/对照组瘤质量×100%. 取出瘤体后, 一份液氮冻存, 以备提取RNA, 进行RT-PCR, 另一份10%中性甲醛固定后, 经常规病理切片, 以备HE及免疫组织化学染色.
1.2.2 流式细胞术检测肿瘤细胞凋亡率: 用网搓法将肿瘤制备成单细胞悬液, 加入10%鸡红细胞作为内参标准, 与样品同步染色, 加入碘化丙啶一步插入DNA荧光染色, 在4 ℃冰箱避光染色30 min, 以500目铜网过滤, 使样品成为合格的单细胞悬液, 采用美国Beckman Coulter公司生产的Epics-XLⅡ型流式细胞仪进行DNA检测, 以二倍体峰(G0/1)前出现亚G1峰表示凋亡细胞峰位, 根据亚G1峰的分布组方图计算细胞凋亡率.
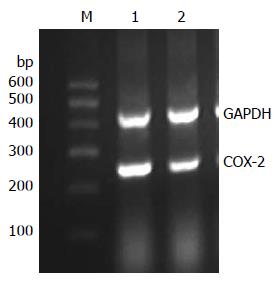
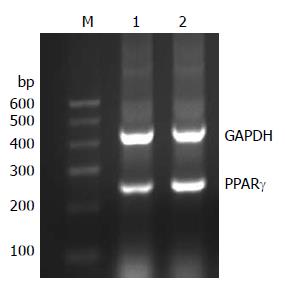
1.2.3 RT-PCR检测移植瘤组织中PPARγ、COX-2 mRNA的表达: TRIzol试剂盒说明一步法提取肿瘤组织总RNA, 紫外分光光度仪测定RNA纯度并定量. 用M-MLV逆转录酶反转录合成cDNA后进行PCR扩增, PPARγ(250 bp)引物上游序列: 5'-GAGCCCAAGTTTGAGTTTGCT-3', 下游序列: 5'-CCGTGACAATCTGTCTGAGGT-3'. COX-2(255 bp)引物上游序列: 5'-AGAATGCATTGGAAACATCGACAG-3', 下游序列: 5'-CCTGTTGCGGAGAAAGGAGTC-3'. GAPDH(414 bp)引物上游序列: 5'-CAACAGCCTCAAGATCATCAGC-3', 下游序列: 5'-TTCTAGACGGCAGCTCAGGTC-3'. 反应条件为: 95 ℃预变性5 min后, 95 ℃变性1 min, 55 ℃退火50 s, 72 ℃延伸50 s, 共35个循环, 最后72 ℃延伸10 min. 5 μL PCR产物在1.5%琼脂糖凝胶中电泳, 溴化乙锭显色, 目的条带用凝胶成像分析系统做吸光度测定, PPARγ、COX-2与GAPDH吸光度的比值作为目的基因mRNA的相对含量.
1.2.4 免疫组织化学检测PPARγ和COX-2蛋白的表达: 厚4 μm石蜡切片, 常规脱蜡水化, 应用免疫组织化学SP(streptavidin-peroxidase)法, 即链霉菌抗生物素蛋白-过氧化物酶连结法, 鼠抗人PPARγ、COX-2单克隆抗体(1:150稀释), 以PBS代替一抗作为阴性对照, DAB显色, 光镜观察阳性信号.
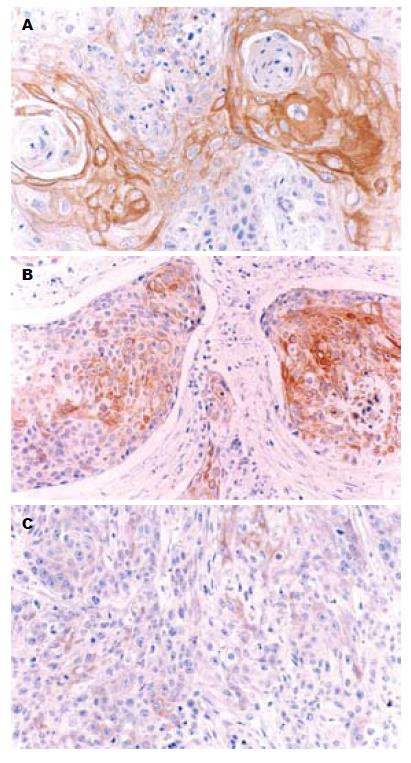
1.2.5 结果判定: 以细胞质内出现棕黄色细颗粒为阳性细胞. COX-2及PPARγ的免疫组织化学染色表达情况采用半定量法推算, 分别按以下比例计分: 细胞染色阳性率在0%-4%计0分, 5%-24%计1分, 25%-49%计2分, 50%-74%计3分, 75%-100%计4分; 染色强度用0(阴性)、1(弱阳性)和2(强阳性)来表示. 各指标的表达水平用细胞染色阳性率与染色强度评分的乘积来表示, 具体结果统计按 Krajewska等[11]推荐的方法进行.
统计学处理 所有数据用mean±SD表示, 应用SPSS16.0统计软件进行统计, 采用t检验和方差分析, 双变量的相关分析采用Pearson相关分析, P<0.05有统计学意义.
PPARγ及COX-2的阳性反应物质均呈棕黄色, 位于细胞质中(图1, 2). 食管鳞状细胞癌的PPARγ表达(2.88±2.23), 显著低于正常鳞状上皮(6.29±2.17, P<0.05), 在食管鳞状细胞癌中, PPARγ蛋白的免疫组织化学平均积分随肿瘤分化程度降低而降低, 不同分化程度食管鳞状细胞癌的PPARγ表达有显著性差异(P<0.05). 相反, 食管鳞状细胞癌的COX-2平均积分(2.12±1.77)则显著高于食管正常鳞状上皮(0.82±0.46, P<0.05), 高分化与中分化鳞状细胞癌的COX-2表达显著高于低分化鳞状细胞癌(P<0.05, 表1).
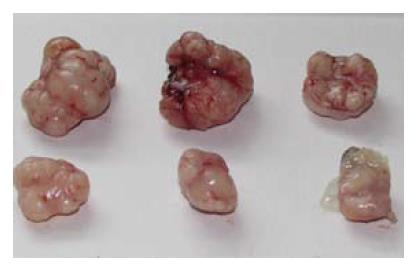
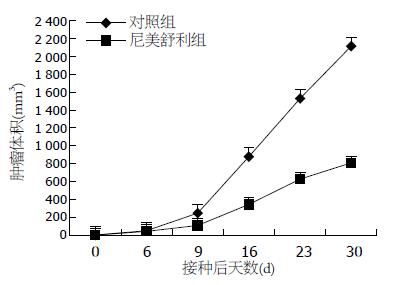
裸鼠皮下接种食管癌Eca-109细胞后, 5 d后可见肿瘤形成, 成瘤率达100%. 随时间延长, 对照组的移植瘤持续增长, 体积明显增大, 而尼美舒利组肿瘤生长缓慢, 除第6天外, 尼美舒利处理组的裸鼠移植瘤体积均显著低于对照组(P<0.05). 用药4 wk后, 尼美舒利处理组的裸鼠移植瘤瘤体的平均瘤质量为0.81 g±0.21 g, 显著低于对照组的1.45 g±0.39 g(P<0.05), 抑制率为44.14%±6.3%(图3, 4).
FCM结果显示, 尼美舒利组的细胞凋亡率显著高于对照组(32.21%±5.98% vs 15.86%±2.57%, P<0.05), 表明尼美舒利可增加移植瘤肿瘤细胞的凋亡率.
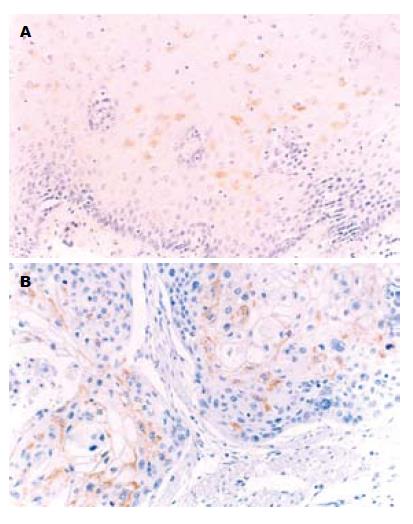
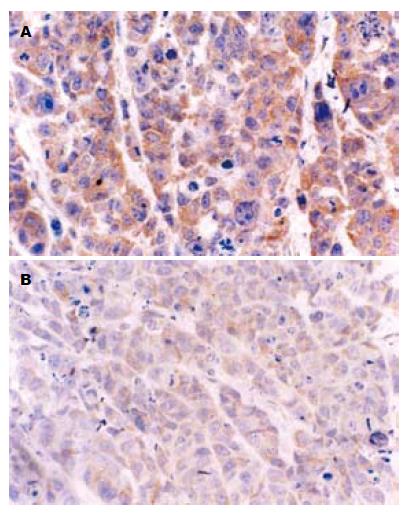
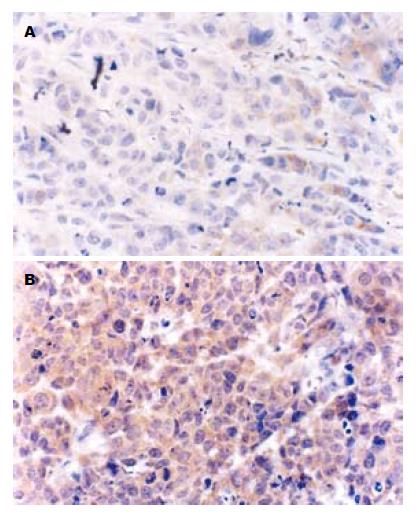
RT-PCR显示, COX-2 mRNA在对照组瘤组织内表达较高, 相对表达量为0.95±0.12, 在尼美舒利处理组相对表达量为0.60±0.07, 显著低于对照组(P<0.05, 图5). 免疫组织化学染色显示, 对照组瘤组织COX-2平均积分为4.83±0.82, 而在尼美舒利处理组瘤组织COX-2染色变浅, COX-2平均积分为2.83±0.75, 显著低于对照组(P<0.05, 图6).
RT-PCR结果显示, PPARγ mRNA在对照组瘤组织的相对表达量0.49±0.10, 尼美舒利组的相对表达量为0.93±0.11, 尼美舒利处理后, PPARγ mRNA的表达明显增高(P<0.05, 图7). 同样, 免疫组织化学结果显示PPARγ蛋白在对照组表达较弱, 平均积分为1.83±0.75, 尼美舒利处理后, PPARγ表达明显增高, 平均积分为4.50±0.55, 显著高于对照组(P<0.05, 图8).
经Pearson相关性分析显示, 从食管正常鳞状上皮到鳞状细胞癌, COX-2表达增高, 而PPARγ表达则显著降低, 两间呈显著负相关(P<0.05). 同样, 体内实验结果显示, COX-2抑制剂尼美舒利可显著抑制COX-2 mRNA及蛋白表达, 同时上调PPARγ mRNA及蛋白表达, 二者呈显著负相关(P<0.05).
越来越多的研究结果表明, COX-2表达上调是肿瘤发生的重要生物分子基础, 在多种恶性肿瘤如结肠癌、胃癌、肺癌、前列腺癌等组织中表达上调. 流行病学调查发现, 口服非甾体类抗炎药和COX-2抑制剂可降低结直肠癌、乳腺癌等的发病风险[12-14], 抑制COX-2可抑制肿瘤细胞生长[15,16], 我们前期的研究结果表明, COX-2选择性剂尼美舒利能够诱导食管癌Eca-109细胞凋亡, 从而抑制其生长[17,18]. 但对于这个肿瘤靶向分子在肿瘤中的表达与信号传导通路的关系目前尚不明确.
PPARγ是一类配体激活的转录因子, 属于核激素受体超家族的一员, 与配体结合后导致PPAR靶基因的mRNA水平改变从而调节其功能, PPARγ可被许多不同结构的化合物包括长链脂肪酸、贝特类降血脂药、抗糖尿病药物等活化, 尽管化学结构不同, 但都有一特定的结构即亲脂的骨架和酸性碳水化合物部分. 一些非甾体类抗炎药具有这些结构特点因此能活化PPARs[19]. 研究显示, PPARγ与肿瘤关系密切, 但其在肿瘤发生、发展中的生物学作用研究结果不一, 有细胞培养及动物实验研究结果显示, PPARγ被配体激活不仅可抑制肿瘤细胞的增殖, 而且可导致肿瘤细胞的凋亡[20-23], 但也有结果表明, PPARγ有促进肿瘤生长作用[24,25].
COX-2与PPARγ都与肿瘤密切相关, 二者间是否有关, Badawi等[26]研究结果表明COX-2抑制剂和PPARγ配体在鼠乳腺癌形成过程中可下调COX-2表达、上调PPARγ表达. 而且, 激活PPARγ后可诱导人结肠癌HT-29细胞凋亡并下调COX-2蛋白表达[27], 余力伟等[28]研究表明COX-2抑制剂可能通过非COX-2途径调控PPARs信号转导通路而抑制结肠癌细胞增殖, 提示COX-2与PPARγ可能具有一定关系. PPARγ是否参与食管癌的发生、发展? 他们的相关性如何? 本研究结果显示食管癌组织中COX-2表达明显高于正常食管上皮, 而PPARγ表达则显著低于食管正常鳞状上皮, 双变量相关分析显示二者呈显著负相关. 但在食管癌组织中, 肿瘤分化越差, 二者表达越低, 表明COX-2与PPARγ表达可能有关.
为阐明PPARγ是否参与尼美舒利的抗肿瘤作用机制, 我们进行了体内水平实验, 结果表明COX-2抑制剂尼美舒利可抑制食管癌裸鼠移植瘤生长并诱导肿瘤细胞凋亡, 尼美舒利作用后, 肿瘤组织中COX-2 mRNA及蛋白表达降低, 同时PPARγ mRNA及蛋白表达升高, COX-2与PPARγ表达之间呈显著负相关, 尼美舒利可上调PPARγ表达, 与Nikitakis等[29]和Sun等[30]的研究结果一致. 关于尼美舒利上调PPARγ表达的机制, 我们推测尼美舒利可能通过抑制COX-2活性, 降低PGE2水平使花生四烯酸蓄积, 从而使PPARγ的天然配体15d-PGJ2水平增高而活化PPARγ.
总之, 在食管癌发生过程中, COX-2表达上调, 而PPARγ表达下调, COX-2抑制可通过抑制抑制裸鼠移植瘤生长从而发挥抗肿瘤作用, 其机制与抑制COX-2表达, 激活PPARγ从而诱导肿瘤细胞凋亡有关, COX-2抑制剂可能具有PPARγ配体的作用, 为COX-2抑制剂的抗肿瘤作用提供了新的理论依据.
COX-2与肿瘤的发生、发展密切相关, COX-2抑制剂可通过多种途径抑制肿瘤细胞生长并诱导凋亡, 但其机制并不局限于COX-2. PPARγ也与肿瘤的发生有关, 二者间是否有关, 进一步探讨COX-2抑制剂的抗食管癌作用机制具有重要意义.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室
近年来, COX-2、PPARγ与肿瘤的关系日益受到人们的重视, COX-2抑制剂的抗食管癌机制研究多侧重于细胞培养, 其体内抗肿瘤效果及机制尚不清楚.
有研究显示,抑制COX-2、激活PPARγ表达可抑制肿瘤细胞生长, COX-2与PPARγ二者间的表达具有相关性, COX-2抑制剂可通过抑制COX-2表达并上调PPARγ而抑制肿瘤细胞生长, 也有研究有不同结果.
本研究首先分析COX-2及PPARγ在食管癌发生过程中的表达变化, 进而建立食管癌裸鼠移植瘤模型, 灌胃给予尼美舒利, 观察尼美舒利的体内抗肿瘤作用并探讨其机制, 为选择性COX-2抑制剂的临床抗肿瘤治疗提供实验参考.
本文研究结果显示, COX-2表达上调及PPARγ表达下调与食管鳞癌的发生有关, COX-2抑制剂尼美舒利可通过抑制COX-2表达并上调PPARγ表达而发挥其抗肿瘤作用, COX-2与PPARγ表达呈负相关.
本文选题新颖, 内容充实, 具有一定的临床应用价值.
编辑: 李军亮 电编:何基才
| 1. | Buchanan FG, Holla V, Katkuri S, Matta P, DuBois RN. Targeting cyclooxygenase-2 and the epidermal growth factor receptor for the prevention and treatment of intestinal cancer. Cancer Res. 2007;67:9380-9388. [PubMed] [DOI] |
| 2. | Tuynman JB, Vermeulen L, Boon EM, Kemper K, Zwinderman AH, Peppelenbosch MP, Richel DJ. Cyclooxygenase-2 inhibition inhibits c-Met kinase activity and Wnt activity in colon cancer. Cancer Res. 2008;68:1213-1220. [PubMed] [DOI] |
| 3. | Uddin S, Ahmed M, Hussain A, Assad L, Al-Dayel F, Bavi P, Al-Kuraya KS, Munkarah A. Cyclooxygenase-2 inhibition inhibits PI3K/AKT kinase activity in epithelial ovarian cancer. Int J Cancer. 2010;126:382-394. [PubMed] [DOI] |
| 4. | Menczer J. Cox-2 expression in ovarian malignancies: a review of the clinical aspects. Eur J Obstet Gynecol Reprod Biol. 2009;146:129-132. [PubMed] [DOI] |
| 5. | Baek JY, Hur W, Wang JS, Bae SH, Yoon SK. Selective COX-2 inhibitor, NS-398, suppresses cellular proliferation in human hepatocellular carcinoma cell lines via cell cycle arrest. World J Gastroenterol. 2007;13:1175-1181. [PubMed] |
| 6. | Krishnan A, Nair SA, Pillai MR. Biology of PPAR gamma in cancer: a critical review on existing lacunae. Curr Mol Med. 2007;7:532-540. [PubMed] [DOI] |
| 7. | Kristiansen G, Jacob J, Buckendahl AC, Grützmann R, Alldinger I, Sipos B, Klöppel G, Bahra M, Langrehr JM, Neuhaus P. Peroxisome proliferator-activated receptor gamma is highly expressed in pancreatic cancer and is associated with shorter overall survival times. Clin Cancer Res. 2006;12:6444-6451. [PubMed] [DOI] |
| 8. | Han S, Roman J. Peroxisome proliferator-activated receptor gamma: a novel target for cancer therapeutics? Anticancer Drugs. 2007;18:237-244. [PubMed] [DOI] |
| 9. | Ma XM, Yu H, Huai N. Peroxisome proliferator-activated receptor-gamma is essential in the pathogenesis of gastric carcinoma. World J Gastroenterol. 2009;15:3874-3883. [PubMed] [DOI] |
| 10. | Nakamura Y, Suzuki T, Sugawara A, Arai Y, Sasano H. Peroxisome proliferator-activated receptor gamma in human prostate carcinoma. Pathol Int. 2009;59:288-293. [PubMed] [DOI] |
| 11. | Krajewska M, Krajewski S, Epstein JI, Shabaik A, Sauvageot J, Song K, Kitada S, Reed JC. Immunohistochemical analysis of bcl-2, bax, bcl-X, and mcl-1 expression in prostate cancers. Am J Pathol. 1996;148:1567-1576. [PubMed] |
| 12. | Konturek PC, Rembiasz K, Burnat G, Konturek SJ, Tusinela M, Bielanski W, Rehfeld J, Karcz D, Hahn E. Effects of cyclooxygenase-2 inhibition on serum and tumor gastrins and expression of apoptosis-related proteins in colorectal cancer. Dig Dis Sci. 2006;51:779-787. [PubMed] [DOI] |
| 13. | Harris RE, Beebe-Donk J, Alshafie GA. Reduction in the risk of human breast cancer by selective cyclooxygenase-2 (COX-2) inhibitors. BMC Cancer. 2006;6:27. [PubMed] [DOI] |
| 14. | Harris RE, Beebe-Donk J, Alshafie GA. Reduced risk of human lung cancer by selective cyclooxygenase 2 (COX-2) blockade: results of a case control study. Int J Biol Sci. 2007;3:328-334. [PubMed] |
| 15. | Harris RE. Cyclooxygenase-2 (cox-2) blockade in the chemoprevention of cancers of the colon, breast, prostate, and lung. Inflammopharmacology. 2009;17:55-67. [PubMed] [DOI] |
| 16. | Xu XF, Xie CG, Wang XP, Liu J, Yu YC, Hu HL, Guo CY. Selective inhibition of cyclooxygenase-2 suppresses the growth of pancreatic cancer cells in vitro and in vivo. Tohoku J Exp Med. 2008;215:149-157. [PubMed] [DOI] |
| 17. | 刘 俊茹, 齐 凤英, 左 连富, 李 丽, 张 玉军, 郭 建文, 刘 江惠. 尼美舒利对人食管癌Eca-109细胞凋亡及Survivin和 Caspase-3表达的影响. 中国肿瘤临床. 2006;33:16-19. |
| 18. | 刘 俊茹, 齐 凤英, 左 连富, 李 丽, 郭 建文, 刘 江惠. 尼美舒利对食管癌Eca-109细胞增殖及COX-2和P27kip1表达的影响. 基础医学与临床. 2006;26:729-733. |
| 19. | Lehmann JM, Lenhard JM, Oliver BB, Ringold GM, Kliewer SA. Peroxisome proliferator-activated receptors alpha and gamma are activated by indomethacin and other non-steroidal anti-inflammatory drugs. J Biol Chem. 1997;272:3406-3410. [PubMed] [DOI] |
| 20. | Takashima T, Fujiwara Y, Hamaguchi M, Sasaki E, Tominaga K, Watanabe T, Oshitani N, Higuchi K, Arakawa T. Relationship between peroxisome proliferator-activated receptor-gamma expression and differentiation of human esophageal squamous cell carcinoma. Oncol Rep. 2005;13:601-606. [PubMed] |
| 21. | Nagata D, Yoshihiro H, Nakanishi M, Naruyama H, Okada S, Ando R, Tozawa K, Kohri K. Peroxisome proliferator-activated receptor-gamma and growth inhibition by its ligands in prostate cancer. Cancer Detect Prev. 2008;32:259-266. [PubMed] [DOI] |
| 22. | Mustafa A, Kruger WD. Suppression of tumor formation by a cyclooxygenase-2 inhibitor and a peroxisome proliferator- activated receptor gamma agonist in an in vivo mouse model of spontaneous breast cancer. Clin Cancer Res. 2008;14:4935-4942. [PubMed] [DOI] |
| 23. | Shim J, Kim BH, Kim YI, Kim KY, Hwangbo Y, Jang JY, Dong SH, Kim HJ, Chang YW, Chang R. The peroxisome proliferator-activated receptor gamma ligands, pioglitazone and 15-deoxy-Delta(12,14)-prostaglandin J(2), have antineoplastic effects against hepatitis B virus-associated hepatocellular carcinoma cells. Int J Oncol. 2010;36:223-231. [PubMed] |
| 24. | Choi IK, Kim YH, Kim JS, Seo JH. PPAR-gamma ligand promotes the growth of APC-mutated HT-29 human colon cancer cells in vitro and in vivo. Invest New Drugs. 2008;26:283-288. [PubMed] [DOI] |
| 25. | Saez E, Rosenfeld J, Livolsi A, Olson P, Lombardo E, Nelson M, Banayo E, Cardiff RD, Izpisua-Belmonte JC, Evans RM. PPAR gamma signaling exacerbates mammary gland tumor development. Genes Dev. 2004;18:528-540. [PubMed] [DOI] |
| 26. | Badawi AF, Eldeen MB, Liu Y, Ross EA, Badr MZ. Inhibition of rat mammary gland carcinogenesis by simultaneous targeting of cyclooxygenase-2 and peroxisome proliferator-activated receptor gamma. Cancer Res. 2004;64:1181-1189. [PubMed] [DOI] |
| 27. | Yang WL, Frucht H. Activation of the PPAR pathway induces apoptosis and COX-2 inhibition in HT-29 human colon cancer cells. Carcinogenesis. 2001;22:1379-1383. [PubMed] [DOI] |
| 29. | Nikitakis NG, Hebert C, Lopes MA, Reynolds MA, Sauk JJ. PPARgamma-mediated antineoplastic effect of NSAID sulindac on human oral squamous carcinoma cells. Int J Cancer. 2002;98:817-823. [PubMed] [DOI] |
| 30. | Sun WH, Chen GS, Ou XL, Yang Y, Luo C, Zhang Y, Shao Y, Xu HC, Xiao B, Xue YP. Inhibition of COX-2 and activation of peroxisome proliferator-activated receptor gamma synergistically inhibits proliferation and induces apoptosis of human pancreatic carcinoma cells. Cancer Lett. 2009;275:247-255. [PubMed] [DOI] |