修回日期: 2010-05-25
接受日期: 2010-06-02
在线出版日期: 2010-07-18
目的: 研究miR-200b对胃癌MGC-803细胞Bcl-2蛋白及mRNA表达的调节作用, 探讨miR-200b对胃癌MGC-803细胞增殖的影响.
方法: 用人工合成的miR-200b相应的双链互补DNA片段, 插入miRNASelectTM pEGP-miR载体, 经测序鉴定后作为microRNA的表达质粒; 用脂质体将miR-200b高表达质粒转染进MGC-803胃癌细胞, 经嘌呤霉素筛选获得阳性克隆. 构建Bcl-2高表达质粒, 转染入MGC-803胃癌细胞和含有miR-200b高表达质粒的MGC-803细胞中. 用RT-PCR技术和Western blot方法分别检测Bcl-2的mRNA和蛋白表达; 用MTT法检测胃癌MGC-803细胞增殖的变化.
结果: Western blot结果显示, 与正常MGC-803细胞相比, 转染了miR-200b的胃癌MGC-803细胞中, Bcl-2蛋白的表达降低了56.91%, RT-PCR分析显示Bcl-2 mRNA表达降低了32.29%; MTT结果显示转染了miR-200b的细胞增殖受到显著抑制. 进一步的实验结果显示, 转染了Bcl-2高表达质粒的胃癌细胞增殖受到促进, 48 h最明显增加了16.82%, 然而转染了miR-200b和Bcl-2高表达质粒的MGC-803细胞增殖却下降了7.97%; Western blot结果显示, 与转染了pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞组相比, 转染了pEGP-miR-200b高表达质粒的MGC-803细胞中Bcl-2蛋白的表达降低了4.84倍, 而转染了pEGP-miR-200b和pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞中Bcl-2蛋白的表达量降低了1.76倍.
结论: 过表达的miR-200b抑制MGC-803胃癌细胞增殖, 这种抑制作用至少部分与Bcl-2基因的低表达有关.
引文著录: 王驰, 钟鹰, 粟滔, 黄靓, 毛振江, 肖祥. miR-200b对胃癌MGC-803细胞增殖的影响以及对Bcl-2表达的调节. 世界华人消化杂志 2010; 18(20): 2077-2083
Revised: May 25, 2010
Accepted: June 2, 2010
Published online: July 18, 2010
AIM: To investigate the effect of miR-200b overexpression on Bcl-2 expression and cell proliferation in human gastric cancer cell line MGC-803.
METHODS: A double-stranded DNA oligonucleotide synthesized based on the sequence of the miR-200b was inserted into the miRNASelectTM pEGP-miR vector to result in a recombinant plasmid expressing miR-200b. After the miR-200b recombinant plasmid was transfected into MGC-803 cells with Lipofectamine 2000, cell strains that stably expressed miR-200b were screened with puromycin. Bcl-2 expression vector was then constructed and introduced into MGC-803 cells that highly expressed miR-200b. The levels of Bcl-2 mRNA and protein were measured by RT-PCR and Western blotting, respectively. Methyl thiazolyl tetrazolium (MTT) assay was used to analyze the proliferation of MGC-803 cells.
RESULTS: Compared with untransfected MGC-803 cells, the expression of Bcl-2 protein and mRNA decreased by 56.91% and 32.29%, respectively, and cell proliferation was significantly inhibited in MGC-803 cells transfected with the miR-200b expression plasmid. The proliferation of MGC-803 cells was promoted by transfection with the Bcl-2 expression plasmid, which was most obvious at 48 h (increased by 16.82%). Cell proliferation only decreased by 7.97% in MGC-803 cells transfected with both the miR-200b and Bcl-2 expression plasmids. Compared with MGC-803 cells transfected with the Bcl-2 expression plasmid, the expression of Bcl-2 protein decreased by 4.84 times in MGC-803 cells transfected with the miR-200b expression plasmid, and by 1.76 times in those cells transfected with both the miR-200b and Bcl-2 expression plasmids.
CONCLUSION: miR-200b overexpression inhibits MGC-803 cell proliferation, at least in part, by down-regulating Bcl-2 expression.
- Citation: Wang C, Zhong Y, Su T, Huang L, Mao ZJ, Xiao X. miR-200b overexpression down-regulates Bcl-2 expression and inhibits cell proliferation in human gastric cancer cell line MGC-803. Shijie Huaren Xiaohua Zazhi 2010; 18(20): 2077-2083
- URL: https://www.wjgnet.com/1009-3079/full/v18/i20/2077.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i20.2077
microRNAs是长度为18-25碱基(basic group, bp)的内源性非编码小分子RNA, 其通过与靶mRNA 3'端相结合导致mRNA降解或翻译受抑制从而调节基因的表达[1]. 随着研究的不断深入, 越来越多的证据证明microRNAs具有内源性的调节作用, 在个体发育[2,3]、细胞增殖或凋亡[4,5]、细胞分化[6,7]、病毒复制表达[8,9]、生殖[10,11]以及肿瘤[12,13]中都具有一定的调控作用. 大量的实验证明, 特异性表达的microRNAs参与调控癌症的发生发展. 最近有研究发现, 在间质细胞MDA-MB-231和BT-549乳腺癌中, miR-200家族介导的上皮细胞钙粘蛋白的转录因子上调, 与ZEB1的翻译直接相关, 与组蛋白H3乙酰化增加间接相关[14]. 为进一步研究 miR-200b参与调节癌症的发生发展, 本实验通过构建miR-200b和Bcl-2高表达质粒, 用脂质体将该质粒转染胃癌MGC-803, 检测细胞系中Bcl-2蛋白和mRNA表达情况, 并观察胃癌MGC-803细胞增殖的变化情况.
1640细胞培养基, 美国Gibco公司; 胎牛、小牛血清, 杭州四季青生物有限公司; 质粒提取试剂盒, 天根生化科技(北京)有限公司; 总RNA提取试剂盒(TRIzol法), 北京百泰克生物技术有限公司; RT试剂盒, 美国MBI公司; PCR试剂盒, 天根生化科技有限公司; LipofectamineTM 2000转染试剂盒, Invitrogen公司; 嘌呤霉素, Sigma公司; 引物合成, 上海生工生物工程服务有限公司; 脂联素兔多克隆抗体, Cell Signaling公司; 载体miRNASelectTM pEGP-miR, 美国Cell Biolabs公司; 胃癌MGC-803细胞系(上海拜力生物公司); E.coli DH5α, Tiangen公司; Bcl-2抗体, Santa Cruz公司; 载体pCMV6-XL5, OriGene公司.
1.2.1 miR-200b和Bcl-2高表达质粒的构建和鉴定: 根据miR-200b的核苷酸序列5'-TAGCAGCACAGAAATATTGGC-3', 首先用DNA合成技术得到第一链DNA, 接着通过DNA连接反应合成双链DNA, 之后经过PCR扩增后进行体外重组, 插入载体miRNASelectTM pEGP-miR, 构建的质粒pEGP-200-mi, 随后转化E.coli DH5α宿主菌. 同样, 将Bcl-2序列插入载体pCMV6-XL5构建高表达质粒, 转化到宿主菌中. 挑取经酶切初步证实插入正确的单克隆菌落, 将阳性菌液1.5 mL寄上海生工进行DNA序列测定(表1).
| 名称 | 扩增长度(bp) | 引物序列(5'-3') |
| β-actin | 480 | 正义链: CATCCTGCGTcTGGACCT |
| 反义链: CAGGAGGAGCAATGATCTTG | ||
| Bcl-2 | 318 | 正义链: CGACGACTTCTCCCGCCGCTACCGC |
| 反义链: CCGCTAGCTGGGGCCGTACAGTTCC |
1.2.2 重组质粒的转染: 摇菌扩增质粒之后, 提取质粒. 用100 mL/L胎牛血清1640培养基培养24 h, 换为优化培养基, 采用LipofectamineTM 2000试剂盒转染, 将脂质体和质粒按照比例孵育, 形成脂质复合体, 均匀的加到细胞培养板中, 6 h后换成含100 mL/L胎牛血清的1640培养基. 待转染48 h后加puromycin筛选阳性克隆, 观察转染情况.
1.2.3 稳定转染细胞中miR-200b的表达鉴定: 提取经初步筛选的细胞总RNA以及microRNA, 用12.5%变性聚丙烯酰胺凝胶室温进行电泳(130 V, 2 h). 之后电转移至尼龙膜上, 用合成的反义寡核苷酸探针进行检测, 该探针在5'末端带有[γ-32P]ATP标志物, 其他步骤与标准的Northern blot方法相同.
1.2.4 Western blot检测蛋白表达: 提取细胞总蛋白, 定量, 与上样缓冲液按比例混匀, 100 ℃煮5 min, 8% SDS-PAGE电泳后电转移至PVDF膜上, 5%脱脂牛奶室温封闭1 h, 加入一抗, 4 ℃孵育过夜, TBST洗涤3次, 每10 min换液1次. 加入二抗, 37 ℃孵育45 min, TBST洗涤3次, 每15 min换液1次, 在暗室中压片, 然后显影、定影. 图像应用AlphaImager 2200软件进行分析.
1.2.5 RT-PCR检测mRNA表达: 分别提取总RNA, 定量后逆转录进行聚合酶链反应, 以β-actin为内参, 其PCR条件: 94 ℃预变性5 min, 然后94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸40 s, 30个循环后再72 ℃终末延伸5 min; Bcl-2的PCR条件: 94 ℃预变性3 min, 94 ℃变性30 s、57.9 ℃退火30 s、72 ℃延伸1 min, 30个循环后再72 ℃延伸5 min.
1.2.6 MTT法检测细胞的增殖: 取对数生长期的胃癌MGC-803细胞, 以每孔2×103个细胞接种于96孔培养板中. 待细胞长到50%融合时更换无血清的1640培养基同步化24 h, 后加100 mL/L胎牛血清, 在不同时间段测值时往培养板中加入10×MTT, 继续培养4 h, 用Elx-800酶联免疫检测仪测定A570nm值. 计算细胞生长抑制率, 生长抑制率 = (1-实验组A570值/对照组A570值)×100%.
统计学处理 所有实验重复3次, 结果以mean±SD表示, 用SPSS13.0统计软件进行分析, 组内采用One-way ANOVA进行方差分析, 组间采用LSD或者Dunnett's T3检验进行比较, 以P<0.05为有统计学意义.
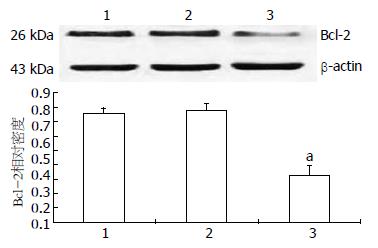
与MGC-803细胞组相比, 转染了pEGP-miR-200b高表达质粒的MGC-803细胞中Bcl-2蛋白表达明显减少, 降低了56.91%(0.3289±0.042 vs 0.7632±0.057, P<0.05). 而转染了pEP-miR Null Control的MGC-80细胞组与正常组组间无统计学意义(P>0.05). 结果表明转染了miR-200b的MGC-803细胞Bcl-2蛋白的表达水平明显减少(图1).
与对照组相比, 转染了pEGP-miR-200b高表达质粒的MGC-803细胞的Bcl-2 mRNA表达水平明显减少, 降低了32.29%(0.5603±0.05 vs 0.8276±0.07, P<0.05), 而转染了pEP-miR Null Control的MGC-803细胞组与正常组组间无统计学意义(P>0.05). 结果表明转染了miR-200b的MGC-803细胞Bcl-2的mRNA水平明显减少(图2).
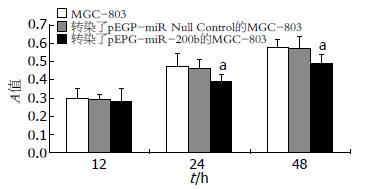
由结果可知转染了pEPG-miR-200b高表达质粒的MGC-803细胞的增殖情况受到抑制, 其中在48 h增殖抑制效果最强(增殖抑制率15.52%, P<0.05). 而转染了pEP-miR Null Control的MGC-803细胞组与正常组组间无统计学意义(P>0.05, 图3).
2.4.1 Bcl-2对胃癌MGC-803细胞增殖的影响: 与MGC-803组相比, 转染了pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞的增殖受到促进, 在48 h增殖抑制效果最强, 增加了16.82%(P<0.05); 转染了pEPG-miR-200b高表达质粒的MGC-803的增殖情况受到抑制, 在48 h降低了15.77%(P<0.05); 而转染了pEGP-miR-200b和pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞组, 其48 h的增殖抑制率相对于正常组降低了7.97%(P<0.05). 与pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞组相比, 转染了pEGP-miR-200b和pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞组在48h其增殖抑制率降低了21.21%(P<0.05). 而转染了pEP-miR Null Control的MGC-803细胞组与正常组组间无统计学意义(P>0.05, 表2). 实验结果提示Bcl-2的高表达可能与细胞增殖存在密切联系, 同时也间接验证了miR-200b至少部分通过打靶Bcl-2影响细胞的增殖.
| 12 h | 24 h | 48 h | |
| 转染了pEPG-miR-200b的MGC-803 | 0.286±0.032 | 0.382±0.053a | 0.486±0.050a |
| 转染了pEGP-miR-200b和pCMV6-XL5-Bcl-2的MGC-803 | 0.289±0.041 | 0.413±0.044ac | 0.531±0.044ac |
| MGC-803 | 0.293±0.053 | 0.451±0.064a | 0.577±0.043a |
| 转染了pCMV6-XL5 Control的 MGC-803 | 0.299±0.065 | 0.453±0.031 | 0.581±0.049 |
| 转染了pCMV6-XL5-Bcl-2的MGC-803 | 0.307±0.045 | 0.524±0.060a | 0.674±0.065a |
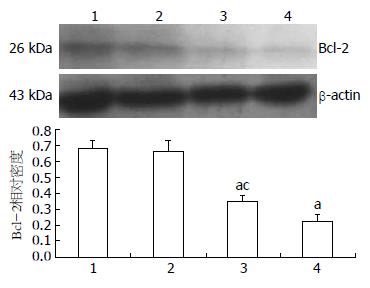
2.4.2 Western blot检测Bcl-2蛋白表达: 与转染了pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞组相比, 转染了pEGP-miR-200b高表达质粒的MGC-803细胞的Bcl-2蛋白明显减少, 降低了4.84倍(0.1176±0.065 vs 0.6863±0.043, P<0.05, 图4), 而转染了pEGP-miR-200b和pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞中, Bcl-2蛋白的表达量降低了1.76倍(0.2484±0.047 vs 0.6863±0.043, P<0.05). 相对于转染了pEGP-miR-200b的MGC-803细胞组, 转染了pEGP-miR-200b和pCMV6-XL5-Bcl-2高表达质粒的MGC-803细胞组Bcl-2蛋白的表达量增加了52.65%(0.2484±0.047 vs 0.1176±0.065, P<0.05). 转染了pEP-miR Null Control的MGC-80细胞组与正常组组间无统计学意义(P>0.05). 实验结果提示了Bcl-2是miR-200b的靶位点之一.
胃癌是全球高发的恶性肿瘤之一, 但目前我们对胃癌的发病机制尚缺乏全面和深入的了解. 现有研究证明, microRNAs可能作为癌基因或者抑癌基因参与癌症的发生发展. 本文通过实验发现, 转染了miR-200b高表达质粒的MGC-803细胞增殖受到了抑制; 过表达的miR-200b在MGC-803人胃癌细胞中对Bcl-2具有明显的调节作用; 通过转染Bcl-2高表达质粒进一步研究发现, miR-200b对MGC-803细胞增殖的抑制作用, 至少部分是通过调节Bcl-2实现的.
越来越多的证据显示, 人类的一些恶性肿瘤组织中microRNAs基因的表达发生改变, 如肺癌[15,16]、肝癌[17]、结肠癌[18,19]、鼻咽癌[20]、卵巢癌[21]、乳腺癌[22]. microRNA在胃癌中的调节作用也被越来越多的实验证实, Wan等[23]发现miR-9在人类胃癌中下调, 过表达的miR-9抑制人胃癌MGC-803细胞的生长, miR-9打靶NF-kappaB1, 并且调节胃癌细胞的生长. miR-150在胃癌细胞系和组织中高表达, 异位表达的miR-150促进肿瘤和胃癌细胞扩散. 荧光素酶报告基因分析表明, EGR2是miR-150的直接靶位点[24]. 胆管癌细胞系中miR-21, miR-141, miR-200b过表达, 抑制miR-21和miR-200b会增加对吉西他滨的敏感性, 但是抑制miR-141的表达会抑制细胞增长[25]. 人类结肠癌细胞系中, miR-200b表达上调, 加入5-氟尿嘧啶处理之后miR-200b表达下调. miR-200b抑制络氨酸磷酸酶蛋白-PTPN12, 从而使c-Abl, Src和Ras等癌基因失活[26]. 本实验发现, miR-200b对胃癌MGC-803细胞的增殖具有调节作用, 过表达的miR-200b能够抑制胃癌MGC-803细胞的增殖.
癌基因Bcl-2位于染色体18q上, 编码相对分子质量26 000 Da蛋白质. 由于染色体易位(14, 18)导致14号染色体上的免疫球蛋白重链基因(IgH)与18号染色体上的Bcl-2的融合, 从而使Bcl-2蛋白质过表达, 通过将细胞阻滞在G0/G1期而抑制细胞凋亡, 促进肿瘤生长和演进[27-29]. Bcl-2过度表达与多种上皮性肿瘤的发生发展密切相关, 可导致DNA受损的细胞持续生存、突变产物聚集. Pan等[30]报道1 196例日本早期胃癌Bcl-2表达与淋巴结转移的关系, 结果显示Bcl-2表达增加更易导致胃癌的浸润发展和淋巴结转移. 在肝癌细胞中, Bcl-2和Mcl-1是miR-29的直接靶位点, 沉默Bcl-2和Mcl-1的表达能够增强miR-29的作用, 然而过表达的Bcl-2和Mcl-1则会降低miR-29的作用. 高表达的miR-29导致线粒体的丢失和细胞色素C向细胞质的释放, 提示miR-29可能通过Mcl-1和Bcl-2参与的线粒体途径促进凋亡[31].
在我们的实验中, 我们选取Bcl-2为研究对象, 观察miR-200b对Bcl-2的调节作用, 实验结果显示, 用脂质体转染miR-200b高表达质粒到胃癌MGC-803细胞后, 过表达的miR-200b使Bcl-2蛋白和mRNA的表达降低. 为了进一步验证miR-200b, Bcl-2与胃癌MGC-803细胞增殖之间的关系, 我们构建了Bcl-2高表达质粒, 转染进MGC-803胃癌细胞和含有miR-200b高表达质粒的阳性细胞系, MTT结果显示Bcl-2高表达质粒组的胃癌细胞增殖受到促进, Western blot结果提示miR-200b至少部分通过打靶Bcl-2基因并抑制其蛋白表达, 进而抑制细胞增殖.
本实验通过构建miR-200b高表达细胞系, 分析miR-200b对胃癌细胞增殖的影响及Bcl-2表达的调节作用, 并且通过Bcl-2高表达质粒的构建, 进一步确定miR-200b, Bcl-2与细胞增殖之间的关系. 我们的结果显示, 转染了miR-200b高表达质粒的胃癌细胞中Bcl-2在蛋白和mRNA水平都受到了不同程度的抑制, 并且细胞增殖受到抑制, 这种抑制作用至少部分通过miR-200b打靶Bcl-2实现的. 本实验的完成为我们进一步研究探索microRNAs对癌症的调节作用及其临床治疗提供了理论依据.
microRNAs是一类长约22个核苷酸左右、进化保守的内源性非编码单链小分子RNA. 自1993年发现第一个被称为lin-4的microRNA 以来, 研究者对 microRNAs的生物合成、功能及作用机制进行了大量研究. 近年来许多研究表明, microRNAs具有内源性的调节作用, 在个体发育、细胞增殖或凋亡、细胞分化、病毒复制表达、生殖以及肿瘤的发生发展中都具有一定的调控作用.
姜春萌, 教授, 大连医科大学附属第二医院消化科
越来越多的实验表明, microRNAs可能作为癌基因或者抑癌基因参与癌症的发生发展, 在多种肿瘤当中, 如慢性淋巴白血病、肺癌、乳腺癌、恶性胶质瘤当中均有明显的特征性的microRNAs的表达种类和量的变化.
本实验将miR-200b高表达质粒转染到MGC-803细胞中, 探讨其对MGC-803细胞增殖及Bcl-2表达的影响, 并且构建了Bcl-2高表达质粒, 进一步研究miR-200b、Bcl-2以及细胞增殖三者之间的关系.
本研究发现过表达的miR-200b抑制MGC-803胃癌细胞增殖, 这种抑制作用至少部分与Bcl-2基因的低表达有关, 提示microRNAs可能成为临床肿瘤治疗方面的新手段.
本文内容新颖性强, 实验设计基本可行, 方法恰当, 有较好的学术价值.
编辑: 李军亮 电编:何基才
| 2. | Yin VP, Thomson JM, Thummel R, Hyde DR, Hammond SM, Poss KD. Fgf-dependent depletion of microRNA-133 promotes appendage regeneration in zebrafish. Genes Dev. 2008;22:728-733. [PubMed] [DOI] |
| 3. | Dore LC, Amigo JD, Dos Santos CO, Zhang Z, Gai X, Tobias JW, Yu D, Klein AM, Dorman C, Wu W. A GATA-1-regulated microRNA locus essential for erythropoiesis. Proc Natl Acad Sci U S A. 2008;105:3333-3338. [PubMed] [DOI] |
| 4. | Meng F, Henson R, Wehbe-Janek H, Ghoshal K, Jacob ST, Patel T. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer. Gastroenterology. 2007;133:647-658. [PubMed] [DOI] |
| 5. | Li W, Xie L, He X, Li J, Tu K, Wei L, Wu J, Guo Y, Ma X, Zhang P. Diagnostic and prognostic implications of microRNAs in human hepatocellular carcinoma. Int J Cancer. 2008;123:1616-1622. [PubMed] [DOI] |
| 6. | Cordes KR, Sheehy NT, White MP, Berry EC, Morton SU, Muth AN, Lee TH, Miano JM, Ivey KN, Srivastava D. miR-145 and miR-143 regulate smooth muscle cell fate and plasticity. Nature. 2009;460:705-710. [PubMed] |
| 7. | Conaco C, Otto S, Han JJ, Mandel G. Reciprocal actions of REST and a microRNA promote neuronal identity. Proc Natl Acad Sci U S A. 2006;103:2422-2427. [PubMed] [DOI] |
| 8. | Sullivan CS, Grundhoff AT, Tevethia S, Pipas JM, Ganem D. SV40-encoded microRNAs regulate viral gene expression and reduce susceptibility to cytotoxic T cells. Nature. 2005;435:682-686. [PubMed] [DOI] |
| 9. | Lecellier CH, Dunoyer P, Arar K, Lehmann-Che J, Eyquem S, Himber C, Saïb A, Voinnet O. A cellular microRNA mediates antiviral defense in human cells. Science. 2005;308:557-560. [PubMed] [DOI] |
| 10. | Tang F, Kaneda M, O'Carroll D, Hajkova P, Barton SC, Sun YA, Lee C, Tarakhovsky A, Lao K, Surani MA. Maternal microRNAs are essential for mouse zygotic development. Genes Dev. 2007;21:644-648. [PubMed] [DOI] |
| 11. | Novotny GW, Sonne SB, Nielsen JE, Jonstrup SP, Hansen MA, Skakkebaek NE, Rajpert-De Meyts E, Kjems J, Leffers H. Translational repression of E2F1 mRNA in carcinoma in situ and normal testis correlates with expression of the miR-17-92 cluster. Cell Death Differ. 2007;14:879-882. [PubMed] [DOI] |
| 12. | Liu X, Sempere LF, Galimberti F, Freemantle SJ, Black C, Dragnev KH, Ma Y, Fiering S, Memoli V, Li H. Uncovering growth-suppressive MicroRNAs in lung cancer. Clin Cancer Res. 2009;15:1177-1183 [PMID: 738222]. [PubMed] [DOI] |
| 13. | Schetter AJ, Leung SY, Sohn JJ, Zanetti KA, Bowman ED, Yanaihara N, Yuen ST, Chan TL, Kwong DL, Au GK. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma. JAMA. 2008;299:425-436. [PubMed] |
| 14. | Tryndyak VP, Beland FA, Pogribny IP. E-cadherin transcriptional down-regulation by epigenetic and microRNA-200 family alterations is related to mesenchymal and drug-resistant phenotypes in human breast cancer cells. Int J Cancer. 2010;126:2575-2583. [PubMed] |
| 15. | Hayashita Y, Osada H, Tatematsu Y, Yamada H, Yanagisawa K, Tomida S, Yatabe Y, Kawahara K, Sekido Y, Takahashi T. A polycistronic microRNA cluster, miR-17-92, is overexpressed in human lung cancers and enhances cell proliferation. Cancer Res. 2005;65:9628-9632. [PubMed] [DOI] |
| 16. | Lebanony D, Benjamin H, Gilad S, Ezagouri M, Dov A, Ashkenazi K, Gefen N, Izraeli S, Rechavi G, Pass H. Diagnostic assay based on hsa-miR-205 expression distinguishes squamous from nonsquamous non-small-cell lung carcinoma. J Clin Oncol. 2009;27:2030-2037. [PubMed] [DOI] |
| 17. | Su H, Yang JR, Xu T, Huang J, Xu L, Yuan Y, Zhuang SM. MicroRNA-101, down-regulated in hepatocellular carcinoma, promotes apoptosis and suppresses tumorigenicity. Cancer Res. 2009;69:1135-1142. [PubMed] [DOI] |
| 18. | Bandrés E, Cubedo E, Agirre X, Malumbres R, Zárate R, Ramirez N, Abajo A, Navarro A, Moreno I, Monzó M. Identification by Real-time PCR of 13 mature microRNAs differentially expressed in colorectal cancer and non-tumoral tissues. Mol Cancer. 2006;5:29. [PubMed] [DOI] |
| 19. | Michael MZ, O' Connor SM, van Holst Pellekaan NG, Young GP, James RJ. Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol Cancer Res. 2003;1:882-891. [PubMed] |
| 20. | Sengupta S, den Boon JA, Chen IH, Newton MA, Stanhope SA, Cheng YJ, Chen CJ, Hildesheim A, Sugden B, Ahlquist P. MicroRNA 29c is down-regulated in nasopharyngeal carcinomas, up-regulating mRNAs encoding extracellular matrix proteins. Proc Natl Acad Sci U S A. 2008;105:5874-5878. [PubMed] [DOI] |
| 21. | Laios A, O'Toole S, Flavin R, Martin C, Kelly L, Ring M, Finn SP, Barrett C, Loda M, Gleeson N. Potential role of miR-9 and miR-223 in recurrent ovarian cancer. Mol Cancer. 2008;7:35. [PubMed] [DOI] |
| 22. | Kondo N, Toyama T, Sugiura H, Fujii Y, Yamashita H. miR-206 Expression is down-regulated in estrogen receptor alpha-positive human breast cancer. Cancer Res. 2008;68:5004-5008. [PubMed] [DOI] |
| 23. | Wan HY, Guo LM, Liu T, Liu M, Li X, Tang H. Regulation of the transcription factor NF-kappaB1 by microRNA-9 in human gastric adenocarcinoma. Mol Cancer. 2010;9:16. [PubMed] [DOI] |
| 24. | Wu Q, Jin H, Yang Z, Luo G, Lu Y, Li K, Ren G, Su T, Pan Y, Feng B. MiR-150 promotes gastric cancer proliferation by negatively regulating the pro-apoptotic gene EGR2. Biochem Biophys Res Commun. 2010;392:340-345. [PubMed] [DOI] |
| 25. | Meng F, Henson R, Lang M, Wehbe H, Maheshwari S, Mendell JT, Jiang J, Schmittgen TD, Patel T. Involvement of human micro-RNA in growth and response to chemotherapy in human cholangiocarcinoma cell lines. Gastroenterology. 2006;130:2113-2129. [PubMed] [DOI] |
| 26. | Rossi L, Bonmassar E, Faraoni I. Modification of miR gene expression pattern in human colon cancer cells following exposure to 5-fluorouracil in vitro. Pharmacol Res. 2007;56:248-253. [PubMed] [DOI] |
| 27. | Su JD, Mayo LD, Donner DB, Durden DL. PTEN and phosphatidylinositol 3'-kinase inhibitors up-regulate p53 and block tumor-induced angiogenesis: evidence for an effect on the tumor and endothelial compartment. Cancer Res. 2003;63:3585-3592. [PubMed] |
| 28. | Hou Q, Cymbalyuk E, Hsu SC, Xu M, Hsu YT. Apoptosis modulatory activities of transiently expressed Bcl-2: roles in cytochrome C release and Bax regulation. Apoptosis. 2003;8:617-629. [PubMed] [DOI] |
| 29. | Prayson RA. Cyclooxygenase-2, Bcl-2, and chromosome 1p analysis in protoplasmic astrocytomas. Hum Pathol. 2004;35:317-321. [PubMed] [DOI] |
| 30. | Pan W, Ishii H, Ebihara Y, Gobe G. Prognostic use of growth characteristics of early gastric cancer and expression patterns of apoptotic, cell proliferation, and cell adhesion proteins. J Surg Oncol. 2003;82:104-110. [PubMed] [DOI] |
| 31. | Xiong Y, Fang JH, Yun JP, Yang J, Zhang Y, Jia WH, Zhuang SM. Effects of microRNA-29 on apoptosis, tumorigenicity, and prognosis of hepatocellular carcinoma. Hepatology. 2010;51:836-845. [PubMed] |