修回日期: 2010-05-06
接受日期: 2010-05-18
在线出版日期: 2010-06-28
目的: 探讨microRNA-377(miR-377)与组蛋白甲基转移酶SMYD3在肝癌中的表达规律及与肝癌的相关性.
方法: 利用实时定量PCR分别检测不同肝组织及肝细胞系中miR-377表达水平, 应用实时定量PCR和Western blot分别检测不同肝组织及肝细胞系中SMYD3 mRNA和蛋白水平的表达情况. 通过转染miR-377模拟物上调其在肝癌细胞株HepG2中表达后, 应用实时定量PCR、Western blot分别检测转染前后HepG2中SMYD3 mRNA和蛋白表达的变化.
结果: MiR-377 mRNA在人肝癌旁组织和肝癌组织中的表达较正常肝脏明显降低(0.331±0.059, 0.139±0.064 vs 0.874±0.178, 均P<0.05); 在HepG2中的表达较L-02明显降低(0.145±0.021 vs 0.868±0.194, P<0.05). SMYD3 mRNA和蛋白质在人肝癌旁组织和肝癌组织中的表达较正常肝脏明显升高(mRNA: 3.836±0.137, 5.836±0.965 vs 1.235±0.332; 蛋白: 0.381±0.020, 0.484±0.030 vs 0.252±0.015; 均P<0.05). SMYD3 mRNA和蛋白质在肝癌细胞系HepG2中的表达较正常肝细胞系L-02明显升高(mRNA: 0.845±0.047 vs 0.348±0.134; 蛋白: 0.575±0.008 vs 0.259±0.007, 均P<0.05). 转染miRNA-377模拟物上调HepG2中miR-377表达后转染组SMYD3 mRNA和蛋白表达较空白组和阴性对照组均明显下降(mRNA: 0.125±0.010 vs 0.857±0.163, 0.779±0.167; 蛋白: 0.092±0.026 vs 0.347±0.040, 0.383±0.054, 均P<0.05).
结论: miRNA-377在肝癌中表达明显下调, 其靶基因SMYD3表达上调; 表达下调的miRNA-377丧失对SMYD3表达的抑制可能是肝癌发生的重要机制.
引文著录: 王冬冬, 江红, 赵文月, 宋孟锜, 由法平, 杨永飞, 陈立波, 杨炼. MicroRNA-377和组蛋白甲基转移酶SMYD3在肝细胞癌中的表达及两者的相关性. 世界华人消化杂志 2010; 18(18): 1902-1906
Revised: May 6, 2010
Accepted: May 18, 2010
Published online: June 28, 2010
AIM: To investigate the expression of microRNA-377 (miR-377) and histone methyltransferase SMYD3 in hepatocellular carcinoma (HCC) and to analyze their correlation.METHODS: Quantitative real-time PCR was performed to detect miR-377 expression in different liver tissues and cell lines. Quantitative real-time PCR and Western blot were employed to detect the expression of SMYD3 (a target gene of miR-377) mRNA and protein, respectively. After transfection of HepG2 cells with a miR-377 mimic, quantitative real-time PCR and Western blot were used to detect the expression of SMYD3 mRNA and protein, respectively.
RESULTS: MiR-377 mRNA was underexpressed in HCC and tumor-adjacent tissue compared to normal liver tissue (0.331 ± 0.059 and 0.139 ± 0.064 vs 0.874 ± 0.178, both P < 0.05). MiR-377 mRNA was also underexpressed in HepG2 cells compared to L-02 cells (0.145 ± 0.021 vs 0.868 ± 0.194, P < 0.05). SMYD3 mRNA and protein were overexpressed in HCC and tumor-adjacent tissue compared to normal liver tissue (mRNA: 3.836 ± 0.137 and 5.836 ± 0.965 vs 1.235 ± 0.332, both P < 0.05; protein: 0.381 ± 0.020 and 0.484 ± 0.030 vs 0.252 ± 0.015, both P < 0.05). SMYD3 mRNA and protein were overexpressed in HepG2 cells compared to L-02 cells (mRNA: 0.845 ± 0.047 vs 0.348 ± 0.134, P < 0.05; protein: 0.575 ± 0.008 vs 0.259 ± 0.007, P < 0.05). SMYD3 mRNA and protein expression in HepG2 cells was down-regulated after transfection of an miR-377 mimic (mimic vs empty control & negative control: mRNA, 0.125 ± 0.010 vs 0.857 ± 0.1635 and 0.779 ± 0.167; protein, 0.092 ± 0.026 vs 0.347 ± 0.040 and 0.383±0.054; all P < 0.05).
CONCLUSION: miR-377 is down-regulated and its target gene SMYD3 is overexpressed in HCC, which suggests that miR-377 down-regulation promotes the carcinogenesis of hepatocellular carcinoma by up-regulating SMYD3 expression.
- Citation: Wang DD, Jiang H, Zhao WY, Song MQ, You FP, Yang YF, Chen LB, Yang L. Correlation between microRNA-377 and histone methyltransferase SMYD3 expression in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1902-1906
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1902.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1902
微小RNA(microRNA, miRNA)是一类大约22 nt大小的保守非编码小RNA, 主要通过转录后水平对其靶基因表达进行负性调控[1]. 大量研究发现多种恶性肿瘤中均有miRNA的异常表达. SMYD3是具有催化组蛋白H3-K4发生甲基化作用的组蛋白甲基转移酶, 通过使组蛋白甲基化, 活化下游癌基因, 在肝细胞癌、大肠癌等多种恶性肿瘤的发生和发展中发挥重要的调控作用[2], 但在恶性肿瘤中miRNA和SMYD3之间是否具有表达相关性未见报道. 我们在不同的肝脏组织及细胞系中检测miR-377及SMYD3的表达差异, 并通过在HepG2细胞中上调miR-377表达检测miR-377对SMYD3表达的影响, 初步探讨肝细胞癌中SMYD3的表达异常与miR-377表达的相关性.
15例正常肝组织, 43例肝癌旁组织及肝癌组织来源于2009-08-15/2010-02-08在我院行门诊肝组织活检及肝癌切除病例, 所有病例均为35-45岁男性患者, 术前均未接受放化疗, 组织性质均经过病理学确诊, 组织收集后立即放入-80 ℃保存备用. L-02细胞和HepG2细胞由我院普外科实验室冻存; SMYD3一抗(兔抗人)购自美国Santa Cruz公司; miRNA实时定量PCR检测试剂盒购自GeneCopoeia公司; 引物由Invitrogen公司合成.
1.2.1 实时定量PCR检测各肝脏组织及细胞中miR-377 mRNA表达: 应用TRIzol一步法分别提取组织和细胞中总RNA, 逆转录得到cDNA后进行实时定量PCR反应, miR-377正向引物5'-ATCACACAAAGGCAAC-3', 反向引物5'-GTGCAGGGTCCGAGGT-3', 内参U6正向引物5'-CTCGCTTCGGCAGCACA-3', 反向引物5'-AACGCTTCACGAATTTGCGT-3', 反应参数设置: 95 ℃ 5 min; 95 ℃ 10 s, 60 ℃ 20 s, 72 ℃ 10 s, 循环40次, 所得数据用2-ΔΔCt公式校正后用来评定各样本间的差异.
1.2.2 实时定量PCR检测各肝脏组织及细胞中SMYD3 mRNA表达: 应用TRIzol一步法分别提取组织和细胞中总RNA, 逆转录得到cDNA后进行实时定量PCR反应, SMYD3正向引物5'-TGAATGTGACTGTTTCCGTTGC-3', 反向引物5'-ATTGCTGCTTATGATCGCCTGG-3', 产物172 bp, 内参β-actin正向引物5'-GAACGGTGAAGGTGACAG-3', 反向引物5'-TAGAGAGAAGTGGGGTGG-3', 产物168 bp, 反应参数设置: 95 ℃ 2 min; 94 ℃ 30 s, 57 ℃ 30 s; 72 ℃ 30 s, 循环45次; 72 ℃ 5 min[3], 所得数据用2-ΔΔCt公式校正后用来评定各样本间的差异.
1.2.3 L-02和HepG2细胞培养: 两种细胞均在含100 mL/L胎牛血清(四季青)的改良型RPMI 1640培养基(Hyclone), 50 mL/L CO2, 37 ℃饱和湿度条件下培养, 每2-3 d用0.25%胰酶消化传代一次.
1.2.4 Western blot检测各肝脏组织及细胞中SMYD3蛋白表达: 各肝脏组织取0.5 mg, 收集六孔板中融合达80%的细胞, 分别提取总蛋白. 应用Bradford蛋白浓度试剂盒(碧云天)测定总蛋白浓度. 将定量后的蛋白质样品以每孔20 μg点样于SDS-PAGE凝胶上样孔中, 200 V电泳至溴酚蓝迁移到距分离胶底部0.5 cm处, 300 mA转膜70 min, 将转好的硝酸纤维素膜至于5%的脱脂奶粉中, 室温振荡封闭2 h, 然加入1∶400 SMYD3一抗, 4 ℃孵育过夜, TBS缓冲液漂洗3次, 每次10 min, 再加入1∶10 000 HRP标记的二抗, 37 ℃于摇床孵育1 h, TBS缓冲液漂洗3次, 每次10 min,化学发光显影, 胶片曝光, 结果用UVP扫描仪扫描成像.
1.2.5 转染miR-377 mimics上调HepG2细胞中miR-377表达: 取稳定生长的对数生长期HepG2细胞消化计数后, 以每孔3.0×105个细胞密度种植于6孔细胞培养板中, 分为空白组、实验组、阴性对照组, 空白组加入无血清无抗生素的Opti-MEM培养基2 mL, 实验组加入终浓度为50 nmol/L的miR-377 mimics(广东锐博)和5 μL Lipofectamine 2000(Invitrogen), 阴性对照组加入终浓度为50 nmol/L的阴性对照试剂(广东锐博)和5 μL Lipofectamine 2000(Invitrogen), 最后各组均用Opti-MEM培养基调至每孔2 mL, 转染步骤严格按照说明书进行. 转染24 h后应用实时定量PCR检测各组SMYD3 mRNA表达情况; 48 h后应用Western blot检测各组SMYD3蛋白表达情况.
统计学处理 各组实验重复3次, 数据经SPSS16.0软件分析, 计量资料采用mean±SD表示, 组间计量资料应用t检验和方差分析(One-Way ANOVA, LSD method), 以P<0.05为具有统计学意义.
实时定量PCR结果显示miR-377 mRNA在正常肝脏, 肝癌旁组织, 肝癌组织中的表达量分别为0.874±0.178、0.331±0.059、0.139±0.064, miR-377 mRNA在肝癌旁组织和肝癌组织中的表达较正常肝脏明显降低(均P<0.05), 而肝癌旁组织和肝癌组织之间无明显差异(图1A). miR-377mRNA在HepG2中的表达明显低于在L-02的表达(0.145±0.021, 0.868±0.194, P<0.05, 图1B).
实时定量PCR结果和Western blot结果显示在正常肝脏, 肝癌旁组织, 肝癌组织中SMYD3 mRNA表达量分别为: 1.235±0.332、3.836±0.137、5.836±0.965, 蛋白表达量分别为: 0.252±0.015、0.381±0.020、0.484±0.030;在L-02和HepG2中SMYD3 mRNA表达量分别为: 0.348±0.134、0.845±0.047; 蛋白表达量分别为: 统计结果显示SMYD3 mRNA和蛋白在肝癌旁组织和肝癌组织中的表达较正常肝脏明显升高(均P<0.05), 且在肝癌组织中较肝癌旁组织亦明显升高(均P<0.05). SMYD3 mRNA和蛋白在HepG2中表达较L-02明显升高(均P<0.05).
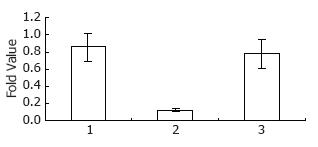
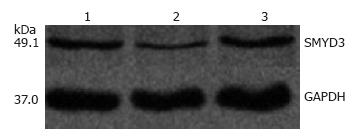
转染miR-377 mimics 24 h后提取总RNA进行实时定量PCR检测, 空白组、实验组、阴性对照组SMYD3 mRNA表达量分别为0.857±0.163、0.125±0.010、0.779±0.167; 48 h后提取总蛋白行Western blot检测各组SMYD3蛋白表达量分别为0.347±0.040、0.092±0.026、0.383±0.054, 统计结果显示相对于空白组和阴性对照组, 实验组中SMYD3 mRNA和蛋白的表达明显降低(均P<0.05), 而空白组和阴性对照组之间无明显差异(图2, 3).
组蛋白修饰包括组蛋白的甲基化, 乙酰化, 磷酸化, 泛素化等是基因表观遗传学调控的重要内容, 其中SMYD3是具有催化组蛋白发生甲基化作用的组蛋白甲基转移酶, 能特异性的使组蛋白H3第四位赖氨酸残基(H3-K4)发生二甲基化和三甲基化, 从而对其下游的靶基因起到活化作用[2]. 研究表明SMYD3在肝癌, 大肠癌, 宫颈癌, 乳腺癌等大量恶性肿瘤中异常高表达, 激活下游癌基因, 从而导致肿瘤的发生和发展[2,4-7]; 应用RNAi特异性的抑制肝癌细胞HepG2中SMYD3的表达后, 肝癌细胞的增殖受到明显的抑制, 且细胞凋亡明显增加[8-10]. 另外, 降低肝癌细胞HepG2中SMYD3的表达后其下游癌基因c-Met表达下调且由肝细胞生长因子(hepatocyte growth factor, HGF)介导的肝癌细胞的迁移和侵袭受到明显的抑制[11]. 我们前期研究亦发现乙型肝炎相关肝癌中SMYD3高表达与乙肝病毒感染关系密切[12,13]. 所有这些均表明SMYD3的异常高表达与肿瘤发生关系密切, 但SMYD3的异常高表达的原因尚不明确, 是否受肿瘤中miRNA异常表达的调控还不清楚.
MicroRNA作为一类大约22 nt大小的保守的非编码单链小RNA, 通过序列部分互补结合抑制目的基因的表达, 调控分化, 增殖, 凋亡, 迁移等细胞行为, 在肿瘤的发生和发展过程中起着类似癌基因或抑癌基因的作用[14]. 目前认为miRNA在肿瘤发生中的主要作用机制为: 成熟miRNA引导RNA介导的基因沉默复合物(RNA-induced gene silencing complexes, RISCs)靶定mRNA, miRNA与mRNA的3'非编码区互补, 通过裂解或抑制mRNA翻译, 进而下调靶基因的表达[15-18]. 大量研究表明异常表达的miRNA在许多肿瘤中发挥重要的调控作用, 如在肝癌中, miR-1, miR-223, miR-29等低表达促进肝癌细胞增殖, 抑制凋亡[19-21], 而miR-122低表达促进肝癌肝内转移[22], 特定microRNA表达谱与肝癌病因, 病理, 转移, 生存, 癌基因表达等特性相
关[23-25]. 另外, 在肝细胞癌中有些miRNA高表达, 发挥癌基因作用, 比如miR-221, miR-222, miR-602等[26-28]. 除此之外, 胃癌中miR-143, miR-145表达下调[29], 宫颈癌中miR-218表达下调[30]等, 这些研究均表明miRNA与肿瘤之间有密切关系, 但miR-377的生物学特性及与肝细胞癌之间的关系尚未见报道, 而且肿瘤中miRNA异常表达的机制尚不明确, 是否受到其他表观遗传学改变如DNA甲基化, 组蛋白甲基化的影响尚不清楚.
我们通过MicroCosm Targets Version 5预测miR-377可能为作用于SMYD3的miRNA基础上, 发现相对于正常肝脏组织, 肝癌旁组织及肝癌组织中的miR-377 mRNA表达均明显降低, 且相对于正常肝细胞L-02, 肝癌细胞HepG2中的miR-377 mRNA亦明显降低, 而肝癌组织SMYD3 mRNA表达明显升高, 提示我们异常表达的miR-377和SMYD3可能在肝癌发生进展中发挥调控作用. 利用mimic技术上调miR-377功能后进一步验证了miR-377可以抑制SMYD3的表达. 结合我们既往发现SMYD3在肝癌表达异常增加, 提示我们表达下降的miR-377丧失对SMYD3抑制作用导致的SMYD3在肝癌组织的异常高表达可能是肝癌发生进展的重要机制, 但肝癌中miRNA-377异常低表达的机制尚不明确, 是否受到DNA甲基化或组蛋白甲基化的调控将是我们下一步的研究内容.
MicroRNA作为一类大约22 nt大小的保守的非编码单链小RNA, 通过调控分化, 增殖, 凋亡, 迁移等细胞行为, 在肿瘤的发生和发展过程中起着类似癌基因或抑癌基因的作用. SMYD3作为一种组蛋白甲基转移酶, 通过组蛋白甲基化修饰在肝癌, 大肠癌等多种肿瘤发生和进展中发挥重要调控作用. 但关于miR-377和SMYD3在肝癌发生和进展中的相互关系尚缺乏研究.
秦建民, 副教授, 上海中医药大学附属普陀医院肝胆外科
目前关于miRNA的研究热点主要集中在miRNA在肿瘤发生和进展中所参与的具体信号通路及miRNA本身的表达变化与其他表观遗传学的关系.
大量研究发现大量肿瘤中都有miRNA表达异常, 如肝癌中miR-1, miR-223, miR-29表达下调促进肝癌细胞增殖, 抑制凋亡, 而miR-221, miR-222却在肝细胞癌中表达上调, 这说明miRNA确实在肝细胞癌中起着癌基因或抑癌基因的作用. 另外, 应用RNAi特异性的抑制肝癌细胞HepG2中SMYD3的表达后, 肝癌细胞的增殖受到明显的抑制, 且细胞凋亡明显增加, 说明SMYD3在肝细胞癌发生中起着重要的促进作用, 但是关于miR-377和SMYD3在肝癌发生和进展中的相互关系未见报道.
本文首次将miR-377和SMYD3联系到一起, 证实两者在肝细胞癌的发生和进展中的相互关系, 从而为肿瘤中表观遗传学的作用机制提供了新的依据.
本文初步证实了在肝细胞癌的发生和发展过程中可能是由于miRNA-377的表达下调导致其靶基因SMYD3表达上调, 从而促进了肝癌的发生和发展, 提示人为增强miRNA-377的表达可能成为一种有价值的预防和治疗肝细胞癌的方法.
本研究采用实时定量PCR、Western blot和基因转染技术等分子生物学技术揭示miRNA-377与组蛋白甲基转移酶SMYD3在肝癌发生中作用, 具有一定的研究意义.
编辑 李军亮 电编 何基才
| 1. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 2. | Hamamoto R, Furukawa Y, Morita M, Iimura Y, Silva FP, Li M, Yagyu R, Nakamura Y. SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells. Nat Cell Biol. 2004;6:731-740. [PubMed] [DOI] |
| 4. | Wang SZ, Luo XG, Shen J, Zou JN, Lu YH, Xi T. Knockdown of SMYD3 by RNA interference inhibits cervical carcinoma cell growth and invasion in vitro. BMB Rep. 2008;41:294-299. [PubMed] |
| 5. | Hamamoto R, Silva FP, Tsuge M, Nishidate T, Katagiri T, Nakamura Y, Furukawa Y. Enhanced SMYD3 expression is essential for the growth of breast cancer cells. Cancer Sci. 2006;97:113-118. [PubMed] [DOI] |
| 6. | Luo XG, Xi T, Guo S, Liu ZP, Wang N, Jiang Y, Zhang TC. Effects of SMYD3 overexpression on transformation, serum dependence, and apoptosis sensitivity in NIH3T3 cells. IUBMB Life. 2009;61:679-684. [PubMed] [DOI] |
| 7. | Luo XG, Zou JN, Wang SZ, Zhang TC, Xi T. Novobiocin decreases SMYD3 expression and inhibits the migration of MDA-MB-231 human breast cancer cells. IUBMB Life. 2010;62:194-199. [PubMed] |
| 9. | Chen LB, Xu JY, Yang Z, Wang GB. Silencing SMYD3 in hepatoma demethylates RIZI promoter induces apoptosis and inhibits cell proliferation and migration. World J Gastroenterol. 2007;13:5718-5724. [PubMed] |
| 10. | Xu JY, Chen LB, Xu JY, Yang Z, Wei HY, Xu RH. [Suppression of SMYD3 expression in HepG2 cell by shRNA interference]. Zhonghua Ganzangbing Zazhi. 2006;14:105-108. [PubMed] |
| 11. | Zou JN, Wang SZ, Yang JS, Luo XG, Xie JH, Xi T. Knockdown of SMYD3 by RNA interference down-regulates c-Met expression and inhibits cells migration and invasion induced by HGF. Cancer Lett. 2009;280:78-85. [PubMed] [DOI] |
| 13. | Yang L, He J, Chen L, Wang G. Hepatitis B virus X protein upregulates expression of SMYD3 and C-MYC in HepG2 cells. Med Oncol. 2009;26:445-451. [PubMed] [DOI] |
| 14. | Ventura A, Jacks T. MicroRNAs and cancer: short RNAs go a long way. Cell. 2009;136:586-591. [PubMed] |
| 15. | Gregory RI, Chendrimada TP, Cooch N, Shiekhattar R. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing. Cell. 2005;123:631-640. [PubMed] |
| 16. | Tang F, Hajkova P, O'Carroll D, Lee C, Tarakhovsky A, Lao K, Surani MA. MicroRNAs are tightly associated with RNA-induced gene silencing complexes in vivo. Biochem Biophys Res Commun. 2008;372:24-29. [PubMed] [DOI] |
| 17. | Cho WC. OncomiRs: the discovery and progress of microRNAs in cancers. Mol Cancer. 2007;6:60. [PubMed] [DOI] |
| 18. | Lawrie CH. MicroRNAs and haematology: small molecules, big function. Br J Haematol. 2007;137:503-512. [PubMed] [DOI] |
| 19. | Datta J, Kutay H, Nasser MW, Nuovo GJ, Wang B, Majumder S, Liu CG, Volinia S, Croce CM, Schmittgen TD. Methylation mediated silencing of MicroRNA-1 gene and its role in hepatocellular carcinogenesis. Cancer Res. 2008;68:5049-5058. [PubMed] [DOI] |
| 20. | Wong QW, Lung RW, Law PT, Lai PB, Chan KY, To KF, Wong N. MicroRNA-223 is commonly repressed in hepatocellular carcinoma and potentiates expression of Stathmin1. Gastroenterology. 2008;135:257-269. [PubMed] [DOI] |
| 21. | Xiong Y, Fang JH, Yun JP, Yang J, Zhang Y, Jia WH, Zhuang SM. Effects of microRNA-29 on apoptosis, tumorigenicity, and prognosis of hepatocellular carcinoma. Hepatology. 2010;51:836-845. [PubMed] |
| 22. | Tsai WC, Hsu PW, Lai TC, Chau GY, Lin CW, Chen CM, Lin CD, Liao YL, Wang JL, Chau YP. MicroRNA-122, a tumor suppressor microRNA that regulates intrahepatic metastasis of hepatocellular carcinoma. Hepatology. 2009;49:1571-1582. [PubMed] [DOI] |
| 23. | Murakami Y, Yasuda T, Saigo K, Urashima T, Toyoda H, Okanoue T, Shimotohno K. Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues. Oncogene. 2006;25:2537-2545. [PubMed] [DOI] |
| 24. | Ladeiro Y, Couchy G, Balabaud C, Bioulac-Sage P, Pelletier L, Rebouissou S, Zucman-Rossi J. MicroRNA profiling in hepatocellular tumors is associated with clinical features and oncogene/tumor suppressor gene mutations. Hepatology. 2008;47:1955-1963. [PubMed] [DOI] |
| 25. | Budhu A, Jia HL, Forgues M, Liu CG, Goldstein D, Lam A, Zanetti KA, Ye QH, Qin LX, Croce CM. Identification of metastasis-related microRNAs in hepatocellular carcinoma. Hepatology. 2008;47:897-907. [PubMed] [DOI] |
| 26. | Pineau P, Volinia S, McJunkin K, Marchio A, Battiston C, Terris B, Mazzaferro V, Lowe SW, Croce CM, Dejean A. miR-221 overexpression contributes to liver tumorigenesis. Proc Natl Acad Sci U S A. 2010;107:264-269. [PubMed] [DOI] |
| 27. | Yang L, Ma Z, Wang D, Zhao W, Chen L, Wang G. MicroRNA-602 regulating tumor suppressive gene RASSF1A is overexpressed in hepatitis B virus-infected liver and hepatocellular carcinoma. Cancer Biol Ther. 2010;9:803-808. [PubMed] |
| 28. | Wong QW, Ching AK, Chan AW, Choy KW, To KF, Lai PB, Wong N. MiR-222 overexpression confers cell migratory advantages in hepatocellular carcinoma through enhancing AKT signaling. Clin Cancer Res. 2010;16:867-875. [PubMed] [DOI] |