修回日期: 2010-05-04
接受日期: 2010-05-10
在线出版日期: 2010-06-08
目的: 评价二甲双胍治疗非酒精性脂肪性肝病(non alcoholic fatty liver disease, NAFLD)的疗效.
方法: 在Medline、Embase、OVID、Cochrane Library、Cinahl、CESJ、ASP、VIP和CNKI中国期刊全文数据库中检索已发表的关于二甲双胍联合饮食控制与单纯饮食控制比较治疗NAFLD的随机对照临床试验. 利用Stata 9.0软件和Review Manager 5.0.14软件进行荟萃分析.
结果: 按入选标准, 共纳入9个随机对照临床试验. 荟萃分析表明: 与单纯饮食控制相比, 二甲双胍联合饮食控制可以明显降低NAFLD患者的ALT、AST和GGT, WMD值分别为-12.12 U/L(95%CI: -22.13, -2.12, P = 0.02)、-11.38 U/L(95%CI: -22.86, 0.11, P = 0.05)和-19.91 U/L(95%CI: -37.01, -2.82, P = 0.02); 二甲双胍联合饮食控制与单纯饮食控制相比, 可以明显改善NAFLD患者的胰岛素抵抗, 使HOMA-IR降低, WMD值为-0.67(95%CI: -0.80, -0.55, P<0.00001); 但二甲双胍联合饮食控制对NAFLD患者肝脏组织学的改善作用并不优于单纯饮食控制, 并不能明显降低肝脏炎症评分和肝脏纤维化评分, SMD分别为-0.08(95%CI: -0.51, 0.35, P = 0.71)和-0.32(95%CI: -0.75, 0.11, P = 0.14).
结论: 二甲双胍可以加快NAFLD患者ALT、AST和GGT生化指标的恢复, 并可以明显改善胰岛素抵抗, 但对NAFLD患者肝脏组织学的改善作用并不明显.
引文著录: 张智峰, 赵钢, 朱英, 王丽霞, 朱磊. 二甲双胍治疗成年人非酒精性脂肪性肝病的荟萃分析. 世界华人消化杂志 2010; 18(16): 1717-1723
Revised: May 4, 2010
Accepted: May 10, 2010
Published online: June 8, 2010
AIM: To evaluate the efficacy of metformin in the treatment of nonalcoholic fatty liver disease (NAFLD).
METHODS: Randomized controlled clinical trials (RCTs) comparing the efficacy of metformin in combination with dietary control and dietary control alone in the treatment of NAFLD were retrieved by searching Medline, Embase, OVID, Cochrane Library, Cinahl, CESJ, ASP, VIP and National Knowledge Infrastructure. Stata 9.0 and Review Manager 5.0.14 were used for meta-analysis.
RESULTS: Nine RCTs were selected for analysis in accordance with inclusion criteria. Compared with dietary control alone, metformin in combination with dietary control decreased serum ALT, AST and GGT significantly, and the weighted mean differences (WMDs) were -12.12 U/L (95%CI: -22.13, -2.12, P = 0.02), -11.38 U/L (95%CI: -22.86, 0.11, P = 0.05) and -19.91 U/L (95%CI: -37.01, -2.82, P = 0.02), respectively. In addition, metformin in combination with dietary control also decreased the homeostasis model assessment of the insulin resistance (HOMA-IR) significantly when compared with dietary control alone, and the WMD was -0.67 (95%CI: -0.80, -0.55, P < 0.00001). Metformin in combination with dietary control was not superior to dietary control alone in reducing necro-inflammatory score and fibrosis score, and the standardized mean differences (SMDs) were -0.08 (95%CI: -0.51, 0.35, P = 0.71) and -0.32 (95%CI: -0.75, 0.11, P = 0.14), respectively.
CONCLUSION: Metformin is effective in decreasing serum ALT, AST and GGT levels and in reducing HOMA-IR in NAFLD patients. Metformin has no significant impact in improving hepatic histology in NAFLD patients.
- Citation: Zhang ZF, Zhao G, Zhu Y, Wang LX, Zhu L. Efficacy of metformin in the treatment of adult nonalcoholic fatty liver disease: a meta-analysis. Shijie Huaren Xiaohua Zazhi 2010; 18(16): 1717-1723
- URL: https://www.wjgnet.com/1009-3079/full/v18/i16/1717.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i16.1717
非酒精性脂肪性肝病(non alcoholic fatty liver disease, NAFLD)是一组与胰岛素抵抗和肥胖有关的, 以肝细胞内脂质过度沉积为主要表现的综合征. NAFLD包括单纯性非酒精性脂肪肝, 非酒精性脂肪性肝炎和非酒精性脂肪性肝硬化. NAFLD在美国已成为成年人中导致转氨酶升高的常见病因[1]. NAFLD在西方发达国家的发病率可达30%[2], 随着肥胖人口和糖尿病患者的增加, NAFLD的发病率在西方国家会进一步升高. 我国的一项研究表明, NAFLD在我国1 654例健康体检者中的发病率可达37.7%[3]. 单纯性非酒精性脂肪肝大多呈良性过程, 但如果肝细胞内脂质(尤其三酰甘油)含量进一步增加, 肝细胞内游离脂肪酸经β氧化产生活性氧自由基增多. 在氧自由基和其他炎性因子的作用下, 单纯性脂肪肝将发展为脂肪性肝炎. 脂肪性肝炎如得不到控制, 可以进展为肝硬化, 甚至肝癌[4]. 虽然人们对NAFLD的发病机制进行了研究, 并提出了"二次打击"学说[5], 但NAFLD发生的机制仍有待进一步阐明. 目前对NAFLD的治疗主要为减轻体质量和改变不良生活习惯[6], 药物治疗的效果存在争议. 二甲双胍是近年来研究较多的治疗NAFLD的药物, 但各研究的结果并不一致, 且多数研究的样本量较小. Meta分析可以通过整合小样本研究而得出可靠的结论. 本次荟萃分析旨在评价二甲双胍对NAFLD的治疗效果和安全性, 为合理选用治疗NAFLD的药物提供依据.
在Medline、EMBase、OVID、Cochrane Library、Cinahl、CESJ、ASP、VIP和CNKI中国期刊全文数据库(1994-2010年)中检索2010-03-09之前已发表的随机对照临床试验研究. 英文检索词为: fatty liver, non alcoholic fatty liver disease, steatosis, steatohepatitis, metformin, biguanide. 中文检索词为: 脂肪肝, 非酒精性脂肪性肝病, 脂肪性肝炎, 二甲双胍, 甲福明, 甲福生, 格华止, 双胍. 并通过阅读综述查找相关文献. 手工检索2002-01/2010-02《中国新药杂志》、《中华消化杂志》、《中华肝脏病杂志》、《中华医学杂志》、《中华内科杂志》、《世界华人消化杂志》已发表的关于二甲双胍治疗NAFALD的随机对照临床试验研究.
1.2.1 资料选择: 对所查得的文章进行二次选取. 选取标准如下: 有关口服二甲双胍治疗NAFLD的随机对照临床试验研究. NAFALD的临床诊断标准为: (1)无饮酒史或饮酒折合乙醇量男性每周<140 g, 女性每周<70 g; (2)除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等可导致脂肪肝的特定疾病; (3)除原发疾病临床表现外, 可有乏力、消化不良、肝区隐痛、肝脾肿大等非特异性症状及体征; (4)可有超质量和(或)内脏性肥胖、空腹血糖增高、血脂紊乱、高血压等代谢综合征相关组分; (5)血清转氨酶和γ-谷氨酰转肽酶水平可有轻至中度增高(<5倍正常值上限), 通常以丙氨酸氨基转移酶(ALT)增高为主; (6)肝脏影像学表现符合弥漫性脂肪肝的影像学诊断标准; (7)肝活体组织检查组织学改变符合脂肪性肝病的病理学诊断标准. 凡具备以上第1-5项和第6或第7项中任何一项者即可诊断为NAFLD[7]. 非酒精性脂肪性肝炎诊断标准为: (1)具备临床诊断标准1-3项; (2)存在代谢综合征或不明原因性血清ALT水平升高持续4 wk以上[7]; (3)影像学表现符合弥漫性脂肪肝诊断标准; (4)肝脏组织学表现符合脂肪性肝炎诊断标准. 凡具备上述第1-3项或第1项和第4项者即可诊断. 治疗组为口服二甲双胍联合饮食控制, 对照组为单纯饮食控制, 且治疗时间至少6 mo. 随机对照临床试验研究对象年龄>18岁. 研究应提供入选研究对象的一般情况, 并且治疗组和对照组研究对象的一般情况之间无统计学差异. 除外二甲双胍联合其他药物治疗NAFLD的研究, 除外一项研究的重复发表, 对一项研究不同阶段发表的文章选取最近发表的研究结果进行分析.
1.2.2 入选文献的质量评价: 由研究者进行文献质量评价, 应用Cochrane协作网推荐的方法进行评价, 主要内容为: (1)随机分配方法是否合理充分; (2)分配隐藏是否合理充分; (3)盲法是否采用; (4)是否合理描述了失访和退出情况, 是否进行了意向性分析[8]. 同时应用Jadad评分对入选文献进行评分, 1-2分为低质量文章, 3-5分为高质量文章[9].
统计学处理 选取各研究的结果进行意向性治疗分析, 因为意向性治疗分析可以最大程度地保持各研究的随机对照性. 利用Stata 9.0软件和Review Manager 5.0.14软件对结果进行分析. 采用广义倒方差法(generic inverse variance method), 通过加权均差(weight mean difference, WMD)或标准均差(standard mean difference, SMD)进行结局变量比较. 对采用相同标准计算的结局变量应用均差(mean difference, MD)和均差标准误(standard error of mean difference, SEMD)对结局变量进行比较[10]. 对采用不同标准进行计算的结局变量应用标准均差(standard mean difference, SMD)进行结局变量比较[10]. 应用统计量I2对各研究间的异质性进行检验, 如果I2<40%, 则应用固定效应模型进行分析; 如果I2>40%, 则采用随机效应模型进行分析. 利用Egger等提出的偏倚线性回归方法分析发表偏倚[11], P<0.05有统计学意义.
共有9篇研究纳入分析[12-20]. 英文文章5篇, 中文文章4篇. 3篇描述了具体的随机方法, 2篇采用随机数字表法[12,15], 1篇采用计算机随机法[14]. 2篇采用双盲法[13,14], 9篇描述了基线可比[12-20], 6篇描述了退出失访情况[12-17], 5篇对结果进行意向性治疗分析[12,13,18-20]. Jadad评分为5分的有1篇[14], 4分的有1篇[13], 3分的有2篇[12,15], 2分的有5篇[16-20], 具体见表1. 共包含2 644例NAFLD患者.
| 研究者 | 样本量 | 随机方法 | 盲法 | 分配隐藏 | Jadad评分 | 治疗组 | 对照组 |
| Bugianesi等[12] | 23 | 随机数字 | 非盲法 | 充分 | 3 | 二甲双胍每日2.0 g联合饮控食控制12 mo | 单纯饮食控制 12 mo |
| Krakoff等[13] | 2 153 | 不清楚 | 双盲 | 不清楚 | 4 | 二甲双胍每日1.7 g联合饮控食控制38.4 mo | 单纯饮食控制38.4 mo |
| Haukeland等[14] | 48 | 计算机随机 | 双盲 | 不清楚 | 5 | 二甲双胍每日2.5-3.0 g 6 mo | 安慰剂6 mo |
| Uygun等[15] | 36 | 随机数字表法 | 不清楚 | 不清楚 | 3 | 二甲双胍每日1.7 g联合饮控食控制6 mo | 单纯饮食控制6 mo |
| Garinis等[16] | 50 | 不清楚 | 不清楚 | 不清楚 | 2 | 二甲双胍每日1.0 g联合饮控食控制6 mo | 单纯饮食控制6 mo |
| 窦艳玲等[17] | 141 | 不清楚 | 不清楚 | 不清楚 | 2 | 二甲双胍每日1.5 g联合饮控食控制6 mo | 单纯饮控食控制6 mo |
| 赵文芬等[18] | 57 | 不清楚 | 不清楚 | 不清楚 | 2 | 二甲双胍每日0.75 g联合饮控食控制6 mo | 单纯饮控食控制6 mo |
| 刘秀玲等[19] | 60 | 不清楚 | 不清楚 | 不清楚 | 2 | 二甲双胍每日1.5 g联合饮控食控制6 mo | 安慰剂6 mo |
| 赵以芳等[20] | 76 | 不清楚 | 不清楚 | 不清楚 | 2 | A二甲双胍每日0.75 g联合饮控食控制6 mo | 单纯饮控食控制6 mo |
| B二甲双胍每日1.5 g联合饮控食控制6 mo |
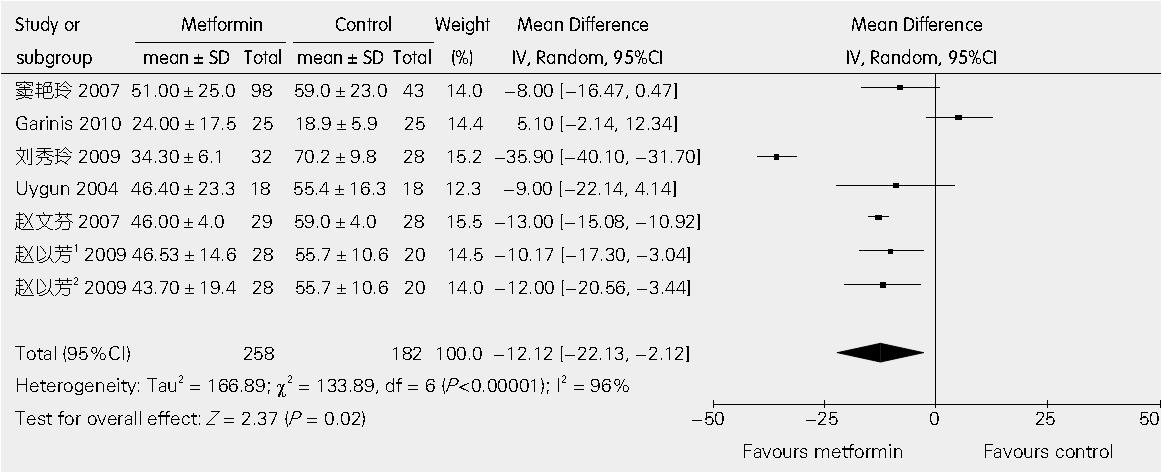
7篇文章提供了二甲双胍联合饮食控制与单纯饮食控制相比较对ALT影响的具体数据[13,15-20]. 异质性检验I2 = 96%, 表明各研究是异质的, 应用随机效应模型进行分析. 经Egger线性回归检验P值为0.141, 表明不存在发表偏倚, WMD值为-12.12 U/L(95%CI: -22.13, -2.12; P = 0.02, 图1).
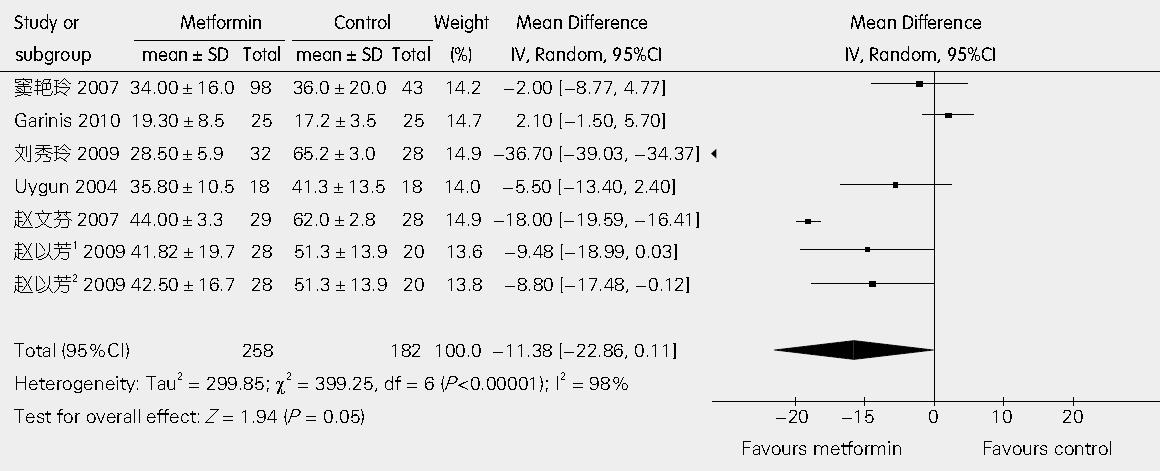
6篇文章提供了二甲双胍联合饮食控制与单纯饮食控制相比较对AST影响的具体数据[15-20]. 异质性检验I2 = 98%, 表明各研究是异质的, 应用随机效应模型进行分析. 经Egger线性回归检验P值为0.23, 表明不存在发表偏倚, WMD值为-11.38 U/L(95%CI: -22.86, 0.11; P = 0.05, 图2).
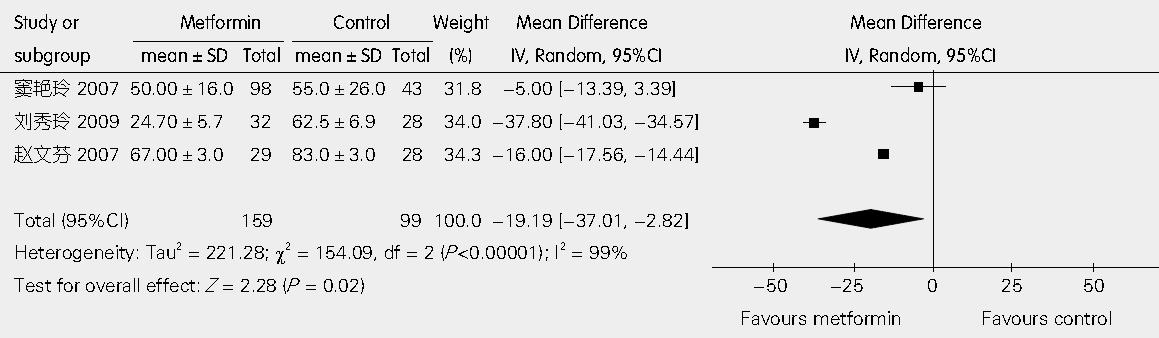
3篇文章提供了二甲双胍联合饮食控制与单纯饮食控制相比较对GGT影响的具体数据[17-19]. 异质性检验I2 = 99%, 表明各研究是异质的, 应用随机效应模型进行分析. 经Egger线性回归检验P值为0.836, 表明不存在发表偏倚, WMD值为-19.91 U/L(95%CI: -37.01, -2.82; P = 0.02, 图3).
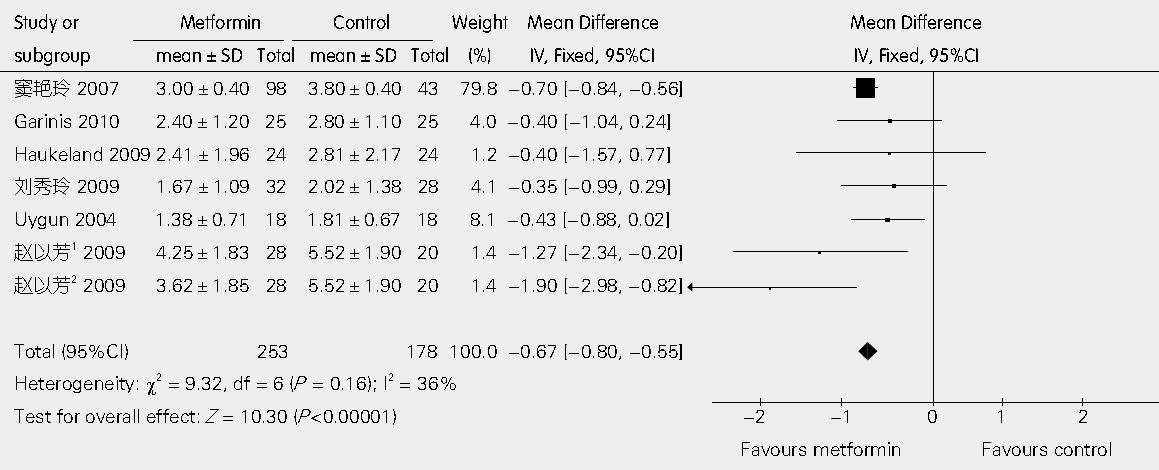
6篇文章提供了二甲双胍联合饮食控制与单纯饮食控制相比较对HOMA-IR影响的具体数据[14-17,19,20]. 异质性检验I2 = 36%, 表明各研究是同质的, 应用固定效应模型进行分析. 经Egger线性回归检验P值为0.801, 表明不存在发表偏倚, WMD值为-0.67(95%CI: -0.80, -0.55; P<0.00001, 图4).
2篇文章提供了二甲双胍联合饮食控制与单纯饮食控制相比较对肝组织炎症评分影响的具体数据[14,15]. 各研究采用不同肝组织炎症评分标准对肝组织进行评分, 故采用SMD对肝组织炎症评分进行分析. 异质性检验I2 = 0%, 表明各研究是同质的, 应用固定效应模型进行分析. 纳入研究较少, 无法评价发表偏倚, SMD值为-0.08(95%CI: -0.51, 0.35; P = 0.71). 3篇文章提供了二甲双胍联合饮食控制治疗NAFLD治疗前后肝组织炎症评分的具体数据[12,14,15]. 各研究采用不同肝组织炎症评分标准对肝组织进行评分, 故采用SMD对肝组织炎症评分进行分析. 异质性检验I2 = 88%, 表明各研究是异质的, 应用随机效应模型进行分析. 经Egger线性回归检验P值为0.985, 表明不存在发表偏倚, SMD值为0.33(95%CI: -0.45, 1.11; P = 0.41).
2篇文章提供了二甲双胍联合饮食控制与单纯饮食控制相比较对肝组织纤维化评分影响的具体数据[14,15]. 各研究采用不同肝组织纤维化评分标准对肝组织进行评分, 故采用SMD对肝组织纤维化评分进行分析. 异质性检验I2 = 0%, 表明各研究是同质的, 应用固定效应模型进行分析. 纳入研究较少, 无法评价发表偏倚, SMD值为-0.32(95%CI: -0.75,0.11; P = 0.14). 3篇文章提供了二甲双胍联合饮食控制治疗NAFLD治疗前后肝组织纤维化评分的具体数据[12,14,15]. 各研究采用不同肝组织纤维化评分标准对肝组织进行评分, 故采用SMD对肝组织纤维化评分进行分析. 异质性检验I2 = 56%, 表明各研究是异质的, 应用随机效应模型进行分析. 经Egger线性回归检验P值为0.355, 表明不存在发表偏倚, SMD值为0.27(95%CI: -0.19, 0.73; P = 0.25).
本次荟萃分析表明: 二甲双胍联合饮食控制与单纯饮食控制相比, 可以明显降低NAFLD患者的ALT、AST和GGT. 二甲双胍联合饮食控制与单纯饮食控制相比, 可以明显改善NAFLD患者的胰岛素抵抗. 表明二甲双胍对NAFLD有一定的治疗作用. 但二甲双胍联合饮食控制对NAFLD患者肝脏组织学的改善作用并不优于单纯饮食控制. 二甲双胍对NAFLD患者肝脏组织学的改善作用仍有待进一步研究. 二甲双胍不良反应主要包括: 高乳酸血症、腹胀、腹痛、恶心、反酸和腹泻. 高乳酸血症需降低药物剂量, 其余不良反应均不影响患者继续服用二甲双胍. 二甲双胍在治疗NAFLD的过程中并未发生严重不良反应及危及患者生命的不良事件. 这表明二甲双胍应用于治疗NAFLD是安全的.
目前认为胰岛素抵抗和脂代谢紊乱是NAFLD发生过程中的第一次打击. 在此基础上发生的氧化应激等成为第二次打击. 二次打击起动了肝组织炎症反应, 造成脂肪性肝炎[5]. 过氧化物酶体增殖物启动受体(peroxisome proliferators activated receptor, PPAR)在活性氧产生和炎症反应过程中起重要作用. PPAR-α对NAFLD的炎症反应有抑制作用[21], 而PPAR-γ则能促进NAFLD的炎症反应[22]. 二甲双胍可以增加肝组织中PPAR-α的表达, 减少肝组织中PPAR-γ的表达, 从而起到抑制炎症反应的作用[23]. 二甲双胍可以通过减少肝糖输出, 增加外周组织对葡萄糖利用, 抑制脂肪分解和降低游离脂肪酸浓度降低胰岛素抵抗[24]. 基于目前对NAFLD的认识, 二甲双胍可以通过影响二次打击而起到治疗NAFLD的作用. 本次荟萃分析表明二甲双胍可改善肝脏的转氨酶水平, 支持二甲双胍可以减轻肝组织炎症的理论. 但二甲双胍对肝组织炎症评分的影响并不明显, 这可能与肝活检取材的随意性造成的选择偏倚有关. 目前肝组织活检虽然被认为是诊断和评价NAFLD的金标准, 但肝脂肪变性在肝组织中的分布并不均一, 这也影响应用肝组织学活检评价肝组织炎症的可靠性. 目前肝组织学评分仍为人为分级评分, 带有一定主观性. 肝组织学评分系统仍有待完善. 这也可以影响应用组织学评分对治疗效果评价的可靠性.
肝纤维化的发生过程主要与肝内星状细胞激活有关. 而转化生长因子β1(transforming growth factor-β1, TGF-β1)和PPAR-γ对肝内星状细胞激活起重要作用[25,26], 二甲双胍可以通过减少肝组织中PPAR-γ的表达及前述抑制炎症反应[23]减少TGF-β1的表达达到抗肝纤维化的作用. 但本次荟萃分析并未显示出二甲双胍的抗纤维化作用. 二甲双胍对肝纤维化的作用仍有待进一步研究.
总之, 本次荟萃分析表明二甲双胍对改善肝组织炎症有一定的作用, 且二甲双胍不良反应并不严重, 安全性好, 可以作为治疗NAFLD的药物. 二甲双胍并未显示出明显的对非酒精性脂肪性肝纤维化的治疗作用, 二甲双胍能否用于治疗脂肪肝所致肝纤维化仍有待进一步研究.
NAFLD在美国已成为成年人中导致转氨酶升高的常见病因. NAFLD在西方发达国家的发病率可达30%, 随着肥胖人口和糖尿病患者的增加, NAFLD的发病率在西方国家会进一步升高. 我国的一项研究表明, NAFLD在我国1 654例健康体检者中的发病率可达37.7%.
迟宝荣, 教授, 吉林大学第一医院消化内科
目前对NAFLD的治疗主要为减轻体质量和改变不良生活习惯, 药物治疗的效果存在争议. 二甲双胍是近年来研究较多的治疗NAFLD的药物, 但各研究的结果并不一致.
二甲双胍是近年来研究较多的治疗NAFLD的药物, 但各研究的结果并不一致, 且多数研究的样本量较小. Meta分析可以通过整合小样本研究而得出可靠的结论. 本次荟萃分析旨在评价二甲双胍对NAFLD的治疗效果和安全性, 为合理选用治疗NAFLD的药物提供依据.
本次荟萃分析表明二甲双胍对改善肝组织炎症有一定的作用, 且二甲双胍不良反应并不严重, 安全性好, 可以作为治疗NAFLD的药物. 二甲双胍并未显示出明显的对非酒精性脂肪性肝纤维化的治疗作用, 二甲双胍能否用于治疗脂肪肝所致肝纤维化仍有待进一步研究.
本文具有一定创新性, 研究方法得当, 结果结论较可信, 文章的科学性、创新性和可读性能较好地反映我国该领域研究的先进水平.
编辑: 李军亮 电编: 何基才
| 1. | Daniel S, Ben-Menachem T, Vasudevan G, Ma CK, Blumenkehl M. Prospective evaluation of unexplained chronic liver transaminase abnormalities in asymptomatic and symptomatic patients. Am J Gastroenterol. 1999;94:3010-3014. [PubMed] [DOI] |
| 2. | Björnsson E, Angulo P. Non-alcoholic fatty liver disease. Scand J Gastroenterol. 2007;42:1023-1030. [PubMed] [DOI] |
| 4. | Bugianesi E, Leone N, Vanni E, Marchesini G, Brunello F, Carucci P, Musso A, De Paolis P, Capussotti L, Salizzoni M. Expanding the natural history of nonalcoholic steatohepatitis: from cryptogenic cirrhosis to hepatocellular carcinoma. Gastroenterology. 2002;123:134-140. [PubMed] [DOI] |
| 5. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 6. | Hickman IJ, Jonsson JR, Prins JB, Ash S, Purdie DM, Clouston AD, Powell EE. Modest weight loss and physical activity in overweight patients with chronic liver disease results in sustained improvements in alanine aminotransferase, fasting insulin, and quality of life. Gut. 2004;53:413-419. [PubMed] [DOI] |
| 9. | Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, McQuay HJ. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17:1-12. [PubMed] [DOI] |
| 10. | Higgins JPT, Green S, editors . Cochrane Handbook for Systematic Reviews of Interventions Version 5.0.0 [updated February 2008]. The Cochrane Collaboration, 2008. Available from: www.cochrane-handbook.org. |
| 11. | Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997;315:629-634. [PubMed] [DOI] |
| 12. | Bugianesi E, Gentilcore E, Manini R, Natale S, Vanni E, Villanova N, David E, Rizzetto M, Marchesini G. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol. 2005;100:1082-1090. [PubMed] [DOI] |
| 13. | Krakoff J, Clark JM, Crandall JP, Wilson C, Molitch ME, Brancati FL, Edelstein SL, Knowler WC. Effects of metformin and weight loss on serum alanine aminotransferase activity in the diabetes prevention program. Obesity (Silver Spring). 2010;18:1762-1767. [PubMed] |
| 14. | Haukeland JW, Konopski Z, Eggesbø HB, von Volkmann HL, Raschpichler G, Bjøro K, Haaland T, Løberg EM, Birkeland K. Metformin in patients with non-alcoholic fatty liver disease: a randomized, controlled trial. Scand J Gastroenterol. 2009;44:853-860. [PubMed] [DOI] |
| 15. | Uygun A, Kadayifci A, Isik AT, Ozgurtas T, Deveci S, Tuzun A, Yesilova Z, Gulsen M, Dagalp K. Metformin in the treatment of patients with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2004;19:537-544. [PubMed] [DOI] |
| 16. | Garinis GA, Fruci B, Mazza A, De Siena M, Abenavoli S, Gulletta E, Ventura V, Greco M, Abenavoli L, Belfiore A. Metformin versus dietary treatment in nonalcoholic hepatic steatosis: a randomized study. Int J Obes (Lond). 2010;34:1255-1264. [PubMed] |
| 18. | 赵 文芬. 二甲双肌治疗非酒精性脂肪肝的临床观察. 山西医药杂志(下半月版). 2007;36:499-500. |
| 21. | Kallwitz ER, McLachlan A, Cotler SJ. Role of peroxisome proliferators-activated receptors in the pathogenesis and treatment of nonalcoholic fatty liver disease. World J Gastroenterol. 2008;14:22-28. [PubMed] [DOI] |
| 22. | Kashireddy PV, Rao MS. Lack of peroxisome proliferator-activated receptor alpha in mice enhances methionine and choline deficient diet-induced steatohepatitis. Hepatol Res. 2004;30:104-110. [PubMed] [DOI] |
| 23. | Raso GM, Esposito E, Iacono A, Pacilio M, Cuzzocrea S, Canani RB, Calignano A, Meli R. Comparative therapeutic effects of metformin and vitamin E in a model of non-alcoholic steatohepatitis in the young rat. Eur J Pharmacol. 2009;604:125-131. [PubMed] [DOI] |
| 24. | Kirpichnikov D, McFarlane SI, Sowers JR. Metformin: an update. Ann Intern Med. 2002;137:25-33. [PubMed] [DOI] |
| 25. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 26. | Chen H, He YW, Liu WQ, Zhang JH. Rosiglitazone prevents murine hepatic fibrosis induced by Schistosoma japonicum. World J Gastroenterol. 2008;14:2905-2911. [PubMed] [DOI] |