修回日期: 2010-05-05
接受日期: 2010-05-10
在线出版日期: 2010-05-28
目的: 探讨野生型XPD基因对人胆管癌QBC939细胞的生物学影响.
方法: 用碱裂解法提取空载质粒pEGFP-N2和重组质粒pEGFP-N2-XPD, 提取出的质粒以KPNⅠ、BGIⅡ和SPHⅠ酶切鉴定. 实验分4组, 重组质粒pEGFP-N2-XPD组、空载质粒pEGFP-N2组、脂质体组, 并用具有相同遗传背景和代数的QBC939细胞作为空白对照. 用脂质体转染法瞬时转染四组细胞. 荧光显微镜下观察转染后绿色荧光蛋白报告基因表达情况. 提取各组细胞总RNA, 合成cDNA, 用聚合酶链反应(PCR)检测4组细胞中XPD、p53、cyclin D1、c-myc表达情况. 并用四甲基偶氮唑盐(MTT)和流式细胞仪检测细胞增殖及其细胞周期的变化.
结果: pEGFP-N2-XPD细胞与pEGFP-N2、脂质体组和空白对照组相比, XPD mRNA表达量明显增加(0.778±0.018 vs 0.561±0.039, 0.544±0.035, 0.542±0.034, 均P<0.01). pEGFP-N2-XPD细胞中p53 mRNA相对表达量与pEGFP-N2、脂质体组和空白对照组比较具有统计学意义(0.421±0.019 vs 0.256±0.014, 0.267±0.015, 0.274±0.018, 均P<0.01). pEGFP-N2-XPD细胞与其他组相比, cyclin D1 mRNA相对表达量明显降低(0.339±0.041 vs 0.560±0.039, 0.558±0.050, 0.560±0.041, 均P<0.01). pEGFP-N2-XPD细胞与其他组相比, c-myc mRNA相对表达量明显降低(0.355±0.045 vs 0.570±0.075, 0.560±0.041, 0.537±0.050, 均P<0.01). 流式细胞仪检测pEGFP-N2-XPD组细胞周期G1期为81.65%, S期为11.83%, 其他组Gl期分别为65.54%、56.61%、63.26%; S期分别为24.10%、29.52%、27.28%, 结果具有统计学意义(P<0.05). MTT检测示pEGFP-N2-XPD细胞生长率为0.249±0.02, 与其他组相比, 细胞增殖力明显减弱(P<0.01).
结论: 野生型XPD基因可以抑制胆管癌细胞的生长, XPD基因可抑制c-myc、cyclin D1基因的表达, 增加p53基因表达.
引文著录: 王振杰, 龚辉, 龚丹, 朱水山. 野生型XPD转染对胆管癌QBC939细胞生物学行为的影响. 世界华人消化杂志 2010; 18(15): 1531-1536
Revised: May 5, 2010
Accepted: May 10, 2010
Published online: May 28, 2010
AIM: To investigate the impact of tranfection of the wild-type xeroderma pigmentosum group D (XPD) gene on the biological behavior of human cholangiocarcinoma cell line QBC939.
METHODS: Empty plasmid pEGFP-N2 and recombinant plasmid pECFP-N2-XPD were digested with KPN I, BGI II and SPH I for plasmid identification. Cells were divided into four groups: pEGFP-N2-XPD group, pEGFP-N2 group, Lipofectamine (Lip) group, and blank control group. Cells were transfected with Lipofectamine. The expression of green fluorescent protein (GFP) was observed under a fluorescence microscope. The mRNA expression of wild-type XPD, p53, cyclin D1 and c-myc was detected by reverse transcription-polymerase chain reaction (RT-PCR). Flow cytometry (FCM) was employed for examining the cell cycle of transfected QBC939 cells. Cell proliferation was detected by methyl thiazolyl tetrazolium (MTT) assay.
RESULTS: The relative expression level of XPD mRNA in the pEGFP-N2-XPD group was significantly higher than those in the pEGFP-N2 group, Lip group and blank control group (0.778 ± 0.018 vs 0.561 ± 0.039, 0.544 ± 0.035 and 0.542 ± 0.034, respectively; all P < 0.01). The relative expression level of p53 mRNA in the pEGFP-N2-XPD group was also significantly higher than those in the pEGFP-N2 group, Lip group and blank control group (0.421 ± 0.019 vs 0.256 ± 0.014, 0.267 ± 0.015 and 0.274 ± 0.018, respectively; all P < 0.01). The relative expression level of cyclin D1 mRNA in the pEGFP-N2-XPD group was significantly lower than those in the pEGFP-N2 group, Lip group and blank control group (0.339 ± 0.041 vs 0.560 ± 0.039, 0.558 ± 0.050 and 0.560 ± 0.041, respectively; all P < 0.01). The relative expression level of c-myc mRNA in the pEGFP-N2-XPD group was also significantly lower than those in the pEGFP-N2 group, Lip group and blank control group (0.355 ± 0.045 vs 0.570 ± 0.075, 0.560 ± 0.041 and 0.537 ± 0.050, respectively; all P < 0.01). FCM results showed that the percentage of cells in G1 phase was significantly higher (81.65% vs 65.54%, 56.61% and 63.26%, respectively; all P < 0.05) and that in S1 phase was significantly lower (11.83% vs 24.10%, 29.52% and 27.28%; all P < 0.05) in the pEGFP-N2-XPD group than in the pEGFP-N2 group, Lip group and blank control group. MTT assay revealed that the growth rate of cells in the pEGFP-N2-XPD group was significantly lower than those in the other three groups (all P < 0.01).
CONCLUSION: Transfection of the wild-type XPD gene can inhibit the proliferation of human QBC939 cells in vitro, down-regulate the expression of cyclin D1 and c-myc mRNAs, and up-regulate the expression of p53 mRNA.
- Citation: Wang ZJ, Gong H, Gong D, Zhu SS. Transfection of the wild-type xeroderma pigmentosum group D gene alters the biological behavior of human cholangiocarcinoma cell line QBC939. Shijie Huaren Xiaohua Zazhi 2010; 18(15): 1531-1536
- URL: https://www.wjgnet.com/1009-3079/full/v18/i15/1531.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i15.1531
胆管癌(cholangiocarcinoma, CCA)是指来源于胆管系统上皮组织的恶性肿瘤, 包括肝内胆管癌和肝外胆管癌, 由于胆管癌起病隐匿、缺乏典型的症状和体征, 早期诊断困难, 且由于所处解剖位置的特殊性及其向周围组织、血管神经浸润的特点; 临床上手术切除率低, 预后差[1-3]. 近年来, 胆管癌的发病率与死亡率有递增趋势, 已成为胆道学科研究的热点之一[4]. 因此, 开辟一条新的有效治疗途径显得尤为重要. XPD蛋白是哺乳动物基本转录因子ⅡH(TFⅡH)复合物的第二大亚基, 他与XPB、TTDA共同构成转录因子TFIIH的10个亚单位, 除具有核酸切除修复、基础转录和细胞周期调控作用[5], 并影响多种癌基因及抑癌基因的表达, 还与肿瘤的形成甚至化疗药物耐药性的产生等多种生理及病理机制有关[6]. 本研究通过瞬时转染本实验室首次在国内构建带绿色荧光蛋白表达的pEGFP-N2-XPD重组表达质粒, 探讨XPD、p53、cyclin D1与c-myc之间相互作用, 以及转染野生型XPD基因前后胆管癌QBC939细胞生物学变化.
人胆管癌细胞QBC-939购自中国典型培养物保藏中心. 重组带绿色荧光蛋白质粒pEGFP-N2-XPD是本实验室国内首次构建的. RPMI 1640培养基(美国Gibco BRL公司), 胎牛血清(南非Hyclone公司), 胰蛋白酶(美国Sigma公司), M-MLV Reverse Transcriptase、Rnasin、dNTP、Oligo(dT)15(美国Promega公司), Lipofectamine 2000TM、TRIzolTM试剂(美国Invetrogen公司), DMSO、DEPC(美国Amresco公司), PCR引物由上海生物工程技术服务有限公司合成, Taq酶(日本TaKaRa公司), DNA 2000 Ladder Marker(北京华美生物工程公司), 北京天根无内毒素质粒大提试剂盒, 四甲基偶氮唑盐(MTT)为上海普飞生物技术有限公司生产.
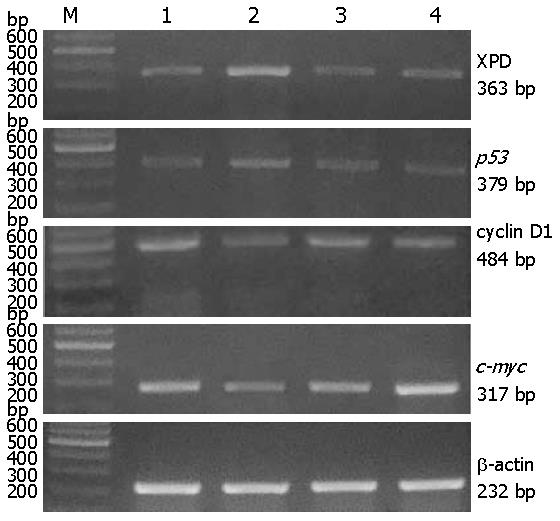
1.2.1 引物设计: 根据Genbank上公布的人类XPD mRNA序列、p53 mRNA序列、cyclin D1 mRNA序列以及c-myc mRNA序列, 应用Primer Primier 5软件设计引物, 由上海生工生物工程公司合成, XPD上下游引物分别为5'-TCT GCCTCTGCCCTATGAT-3'及5'-CGATTCCCTCGGACACTTT-3', 扩增产物363 bp; p53上下游引物分别为5'-CCCAAGCAATGGATGAT-3'及5'-TGACAGGAAGCCAAAGG-3', 扩增产物379 bp; cyclin D1上下游引物分别为5'-GCGAGGAACAGAAGTGCG-3'及5'-AGGCGGTAGTAGGACAGGAA-3', 扩增产物484 bp; c-myc上下游引物分别为5'-AACCCTTGCCGCATCCAC-3'及5'-CCTCCTCGTCGCAGTAGAAA-3', 扩增产物317 bp. 同一标本扩增以β-actin作为内参照. β-actin上下游引物分别为5'-CTTCCTGGGCATGGAGTC-3'、5'- GCCGATCCACACGGAGTA-3', 扩增产物232 bp.
1.2.2 分组及处理: 常规方法培养及转染胆管癌QBC-939细胞, 实验分为4组: (1)pEGFP-N2-XPD组; (2)pEGFP-N2组; (3)脂质体组; (4)空白对照组. 将胆管癌细胞QBC939种于六孔板内, 每孔细胞数2×105, 待细胞覆盖率达70%后, 用0.01 mol/L磷酸盐缓冲液洗涤细胞2次, 于4孔中分别加入无血清1640培养液2 mL培养24 h后, 于2、3、4处理组中分别用Lipofectamine 2000加入pEGFP-N2-XPD、pEGFP-N2、脂质体(Lip)转染各组细胞, 置孵箱内培养48 h后, 收集细胞做逆转录聚合酶链反应(RT-PCR).
1.2.3 RT-PCR法检测各组细胞mRNA表达: 采用TRIzol试剂提取细胞总RNA, 合成cDNA. PCR扩增XPD、p53、cyclin D1及c-myc, 应用Primer Primier 5软件设计引物, 由上海生工生物工程公司合成, XPD上下游引物分别为5'-TCTGCCTCTGCCCTATGAT-3'及5'-CGATTCCCTCGGACACTTT-3', 扩增产物363 bp; p53上下游引物分别为5'-CCCAAGCAATGGATGAT-3'及5'-TGACAGGAAGCCAAAGG-3', 扩增产物379 bp; cyclin D1上下游引物分别为5'-GCGAGGAACAGAAGTGCG-3'及5'-AGGCGGTAGTAGGACAGGAA-3', 扩增产物484 bp; c-myc上下游引物分别为5'-AACCCTTGCCGCATCCAC-3'及5'-CCTCCTCGTCGCAGTAGAAA-3', 扩增产物317 bp. 同一标本扩增以β-actin作为内参照. β-actin上下游引物分别为5'-CTTCCTGGGCATGGAGTC-3、5'- GCCGATCCACACGGAGTA-3', 扩增产物232 bp. PCR通过94 ℃预变性5 min, 94 ℃ 45 s, 55 ℃ 60 s, 72 ℃ 45 s, 35个循环后72 ℃终末延伸10 min. PCR产物经1.5%琼脂糖凝胶电泳(含5 mg/L溴化乙啶)后, 在紫外灯下观察结果. 通过FR200图像分析软件(上海复日公司)读取目的电泳条带的斑点密度扫描值, 以各组β-actin条带的扫描值为标准, 测算其相应组的XPD、p53、cyclin D1以及c-myc的mRNAs表达量.
1.2.4 四甲基偶氮唑盐(MTT)法检测细胞活性: 用酶联免疫检测仪在490 mn波长处测定其吸光度(A)值, 以间接反映各组活细胞数量.
1.2.5 流式细胞仪检测细胞周期: 用胰酶消化收集上述各组转染后的细胞, 应用FACSCalibar流式细胞仪(Beckton Dickinson, USA)分析, 氩离子激光器激发波长为488 nm, 在流式细胞仪上进行细胞周期分析, 得出细胞各周期的百分率.
统计学处理 数据以mean±SD表示, 应用SPSS12.0统计软件进行数据处理, 采用单因素方差分析, 并用LSD法行两两比较, 检验显著性水准取α = 0.05, 以P<0.05为差异有统计学意义.
RT-PCR法检测结果显示, pEGFP-N2-XPD组中XPD的相对表达量为0.778±0.018, 而pEGFP-N2组、Lip组、空白对照组的XPD相对表达量分别为0.561±0.040、0.544±0.035、0.542±0.034. pEGFP-N2-XPD组与其他3组比较差异均有统计学意义(F = 198, q分别为18.94、20.42和20.58, 均P<0.01). p53的表达量pEGFP-N2-XPD组均较pEGFP-N2组、脂质体(Lip)组、空白对照组增高明显(P<0.01), 而cyclin D1及c-myc的表达量pEGFP-N2-XPD组较pEGFP-N2组、脂质体(Lip)组、空白对照组明显降低(P<0.01). pEGFP-N2组、脂质体(Lip)组、空白对照组之间XPD、p53、cyclin D1以及c-myc的表达差异无统计学意义(表1, 图1).
| 分组 | XPD | p53 | cyclin D1 | c-myc |
| pEGFP-N2-XPD组 | 0.778±0.018 | 0.421±0.019 | 0.339±0.041 | 0.355±0.045 |
| pEGFP-N2组 | 0.561±0.039 | 0.256±0.014 | 0.560±0.039 | 0.570±0.075 |
| Lip组 | 0.544±0.035 | 0.267±0.015 | 0.558±0.050 | 0.566±0.048 |
| 空白对照组 | 0.542±0.034 | 0.274±0.018 | 0.560±0.041 | 0.537±0.050 |
| F值 | 198.00 | 63.45 | 12.93 | 15.67 |
pEGFP-N2-XPD组、pEGFP-N2组、脂质体组及空白对照组A值分别为0.249±0.022、0.382±0.025、0.375±0.028及0.387±0.033, 差异有统计学意义(F = 46.71, P<0.01), pEGFP-N2-XPD组的A值明显低于pEGFP-N2组、脂质体组及空白对照组(t = 11.30、10.01、9.841, 均P<0.01).
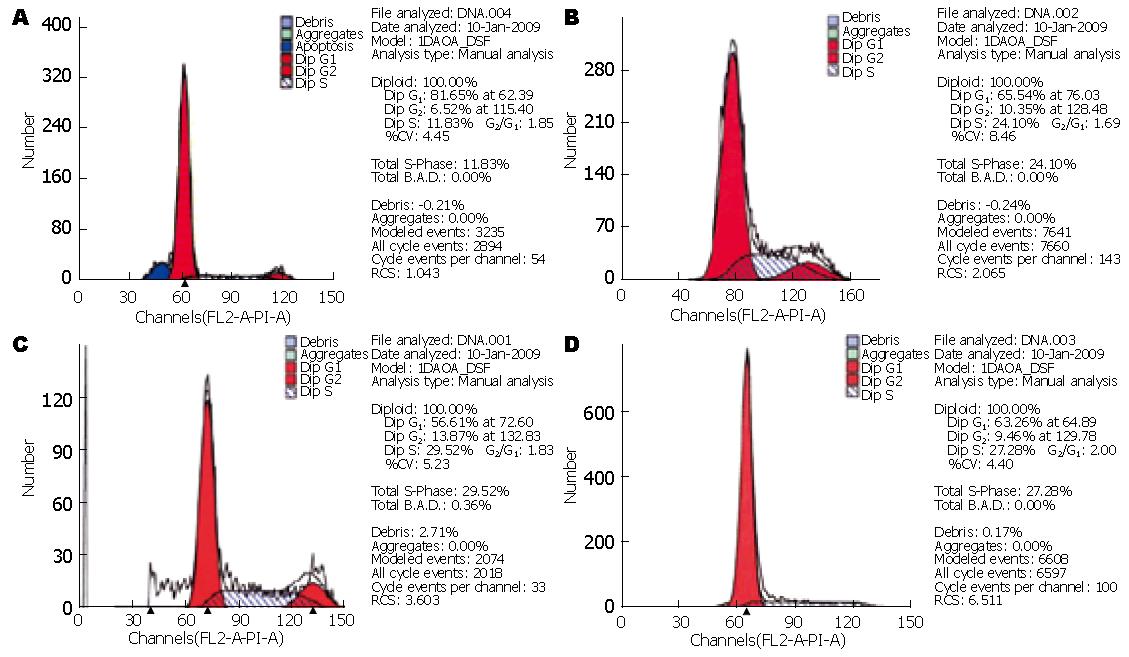
pEGFP-N2-XPD组细胞周期G1期为81.65%, S期为11.83%, pEGFP-N2组、Lip组、空白对照组Gl期分别为65.54%、56.61%、63.26%; S期分别为24.10%、29.52%、27.28%(图2). 由此可见, pEGFP-N2-XPD组细胞停滞Gl期的细胞明显增多, 而进入S期的细胞则显著减少.
肿瘤的发生是由于致癌物质、多基因协同作用的结果, 表现为基因突变、缺失、扩增、重排或表达失调, 从而使正常细胞分裂增殖能力增强和成熟分化能力减弱或分化异常. 环境致癌物及其代谢产物攻击机体细胞引起DNA损伤, 而DNA修复是维持人类基因组完整性的核心, 当DNA损伤不能及时有效地修复, 积累到一定程度导致基因组不稳定性升高, 引起细胞增殖和分化失控, 导致肿瘤的发生. 因此, DNA修复与肿瘤发生有着密不可分的联系, DNA修复能力的个体差异是决定肿瘤易感性的重要因素, DNA修复能力的下降常易发生癌变[7]. XPD是哺乳动物基本TFⅡH核心成分之一, 参与基因转录、核苷酸切除修复(NER)及细胞周期调控, 并影响多种抑癌基因和癌基因的表达[8]. 研究表明, XPD基因还可激活p53, 并且影响其生物活性[9]. XPD基因发生突变时, 机体发生肿瘤几率升高.
野生型p53功能的缺失是癌症发生的一个重要阶段. 野生型p53是公认的抑癌基因, 正常野生型p53活化后可诱导多种细胞生物学行为, 如调控细胞周期、诱导细胞凋亡、DNA修复以及抑制血管生成等, p53已发展为肿瘤基因治疗中非常有利的靶基因[10]. p53是DNA损伤检控点中最关键的激活因子, 在细胞周期中, P53蛋白通过阻止G1期细胞进入S期, 使受损的DNA或染色体有时间得以修复, 细胞周期中G1/S期或G2期的调控, 依赖于p53的活性[11]. p53通常依靠对其下游因子的激活或抑制来调节细胞的生长与凋亡. p53可在多种信号因素作用下活化, 其中包括致癌因素诱导的DNA损伤和不正常的增殖信号. 现已研究表明多种人体肿瘤有p53基因突变或表达降低[12]. 也有实验提示某些抗肿瘤药物对胆管癌细胞QBC939作用机制与其诱导p53上调相关[13]. p53功能异常引起细胞癌变有两个途径: (1)失去适当的细胞周期停滞将引起不适当的DNA修复, 并且将固定的DNA损伤通过突变传给子细胞; (2)当p53不再具有诱导凋亡作用, 这将使带有固定DNA损伤的细胞残存下来, 并再导致基因突变, 从而使细胞生长失控, 最终发展为癌[14]. 抑癌基因p53不仅具有转录和DNA修复的重要作用, 而且与TFⅡH存在物理上和功能上的相互联系[15].
同时, 肿瘤也是一种细胞周期性疾病. 异常的G1-S细胞周期是胆管癌发生的主要机制之一[16]. 正常细胞在生长因子的刺激下G1期cyclin D1可与他的伴侣分子CDK4或CDK6结合进入胞核并被激活形成cyclin D1与CDK4/6的复合物, 使下游的蛋白质Rb(retinoblastoma protein; pRb)及其相关蛋白磷酸化, 磷酸化的pRb可解除对E2F等基因转录因子的抑制作用, 从而启动细胞DNA复制, 细胞通过G1期进入S期. pRb作为cyclin D1与CDK4/CDK6的底物, 其磷酸化对细胞周期在G1期的控制起关键作用. 当培养细胞中cyclin D1过度表达时可提高细胞周期转换速度, 促进细胞从G1期进入S期, 细胞增殖失控, 发展为癌[17]. 有研究提示胆管癌细胞中cyclin D1常常出现过表达, 且cyclin D1的表达与胆管癌临床预后密切相关[18]. 若cyclin D1过表达, 结合p53的失活, 则将导致细胞的无限增殖化, 乃至肿瘤的发生. 有研究应用野生型p53结合反义cyclin D1可明显增强对肿瘤的凋亡诱导效果, 表明二者具有协同效应[19].
c-myc在多种肿瘤中常常过表达, 如肝癌、胃癌、乳腺癌、宫颈癌等, 现在认为c-myc是重要的细胞调控基因, 其表达产物是细胞增殖信号转导的必需因子, 也是G1期到S期的启动子. c-myc在多种肿瘤中常常过表达, 影响细胞的生长与增殖, 阻断细胞分化, 过表达时可促使肿瘤形成[11]. 已有研究表明[21], XPD突变可以阻断叶酸结合蛋白(FBP)的活化, 而后者的活化可以使c-myc表达下降. 当XPD发生缺陷或突变时, c-myc表达量常增加. p53缺乏或突变也可以促使c-myc过表达, 促进癌细胞生长, 细胞凋亡减少.
本研究把野生型XPD基因瞬时转染胆管癌QBC939细胞, 发现胆管癌QBC939细胞中c-myc、cyclin D1基因在转录水平表达量明显下降(P<0.01), 而p53基因在转录水平明显升高(P<0.01), 细胞周期停滞在G1期, 不能进入S期, 胆管癌细胞QBC939增殖明显受抑(P<0.01). XPD抑制胆管癌QBC939细胞增殖可能是通过与其他癌基因及抑癌基因相互作用而实现的, 其可能的机制: (1)XPD基因可以激活p53, 进一步激活DNA损伤检控点, 并且XPD基因与野生型p53结合促使损伤的基因得到修复; (2)XPD基因通过激活p53, 在DNA损伤时, 野生型p53积累, 上调其下游p21靶基因表达, p21表达产物P21WAF1蛋白是一种依赖cyclin激酶(cdk)的抑制剂[22]. 作为对p53的高表达和DNA损伤的应答, P21WAF1蛋白主要结合于G1期和S期的cyclin-cdk复合体, 与cyclin D1竞争结合CDK4/6, 使pRb无法磷酸化而抑制细胞周期进程, 导致Gl期阻滞, 使细胞在进入S期之前得以修复损伤的DNA. 再者, cyclin D1又是p53的间接靶基因, 一方面p53可通过诱导PC3基因介导的直接或间接抑制pRb功能来抑制cyclin D1转录和cyclin D1启动子活性从而下调cyclin D1表达并使细胞停滞于G1期[23]; 另一方面p53还可以选择性下调Bcl-3蛋白水平和诱导增加P52 NF-kappaB亚单位活性, 抑制cyclin D1启动子活性, 降低cyclin D1蛋白和mRNA的表达水平, 进而导致细胞在G1阻滞[24], 抑制细胞增殖; (3)XPD基因与野生型p53相互作用抑制c-myc转录, p53能通过结合转录因子E2F, 使E2F不能与c-myc的启动子结合, 致c-myc的表达量下降, 实现对细胞周期的阻滞, 且XPD活化Fuse结合蛋白(fuse binding protein, FBP), FBP是c-myc基因表达所必需的蛋白, 而FBP活化后结合c-myc基因单链上游活化元件来使c-myc的表达下降[25], 使细胞的生长能力减弱, 抑制胆管癌的增殖. 本组认为XPD抑制胆管癌细胞增殖的机制可能是多方面的, XPD与p53、cyclin D1、c-myc之间的相互作用具体机制尚未完全明了, 有待于以后进一步深入研究.
胆管癌由于其解剖位置特殊, 恶性程度高, 且起病隐匿, 早期诊断率很低. 胆管癌5年生存率不足5%. 中位生存期为18-30 mo. 早期手术根治切除为唯一治愈方法, 然而术后5年再发率高. 对于晚期胆管癌, 常选择化疗, 但效果甚微. 近年胆管癌发病率升高, 且病因不明. 因此, 积极寻找一条有效的新的胆管癌治疗途径, 显得尤为重要.
邰升, 副教授, 哈尔滨医科大学附属二院肝胆外科.
近30年来胆管癌发病率增高趋势明显, 但治疗效果不佳, 目前尚无统一的治疗标准, 已成为消化系统疾病的研究热点, 现阶段仍无有效的治疗手段.
梁刚等研究报道, XPD 312Asn等位基因以及751Gln等位基因可能是中国上海地区人群胆管癌尤其是壶腹部癌的遗传易感因素.
本文以野生型XPD基因转染胆管癌QBC939细胞, 观察转染前后p53、cyclin D1、c-myc基因表达及细胞的生物学变化, 初步探讨XPD、p53、cyclin D1及c-myc之间的相互作用关系.
XPD蛋白: 基础转录因子TFⅡH复合物的第二大亚基, 在核苷酸切除修复(NER)中, 从5'→3'方向解开受损DNA双链, 使损伤特异性核酸酶切下受损DNA. 大量研究发现, XPD在TFⅡH 介导的和转录过程中发挥重要作用, 并与细胞增殖、凋亡、肿瘤的发生甚至化疗药物抗药性的产生等多种生理及病理机制有关.
本研究立题新颖, 方法合理, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Shen FZ, Zhang BY, Feng YJ, Jia ZX, An B, Liu CC, Deng XY, Kulkarni AD, Lu Y. Current research in perineural invasion of cholangiocarcinoma. J Exp Clin Cancer Res. 2010;29:24. [PubMed] [DOI] |
| 2. | Blechacz BR, Gores GJ. Cholangiocarcinoma. Clin Liver Dis. 2008;12:131-50, ix. [PubMed] |
| 3. | Yang J, Yan LN. Current status of intrahepatic cholangiocarcinoma. World J Gastroenterol. 2008;14:6289-6297. [PubMed] [DOI] |
| 4. | Ustundag Y, Bayraktar Y. Cholangiocarcinoma: a compact review of the literature. World J Gastroenterol. 2008;14:6458-6466. [PubMed] [DOI] |
| 5. | Lehmann AR. XPD structure reveals its secrets. DNA Repair (Amst). 2008;7:1912-1915. [PubMed] [DOI] |
| 6. | Zárate RN, Arias F, Bandres E, Cubedo E, Malumbres R, García-Foncillas J. Xeroderma pigmentosum group D 751 polymorphism as a predictive factor in resected gastric cancer treated with chemo-radiotherapy. World J Gastroenterol. 2006;12:6032-6036. [PubMed] [DOI] |
| 7. | Clarkson SG, Wood RD. Polymorphisms in the human XPD (ERCC2) gene, DNA repair capacity and cancer susceptibility: an appraisal. DNA Repair (Amst). 2005;4:1068-1074. [PubMed] [DOI] |
| 8. | Li X, Urwyler O, Suter B. Drosophila Xpd regulates Cdk7 localization, mitotic kinase activity, spindle dynamics, and chromosome segregation. PLoS Genet. 2010;6:e1000876. [PubMed] [DOI] |
| 9. | Dumaz N, Drougard C, Quilliet X, Mezzina M, Sarasin A, Daya-Grosjean L. Recovery of the normal p53 response after UV treatment in DNA repair-deficient fibroblasts by retroviral-mediated correction with the XPD gene. Carcinogenesis. 1998;19:1701-1704. [PubMed] [DOI] |
| 10. | Levine AJ, Oren M. The first 30 years of p53: growing ever more complex. Nat Rev Cancer. 2009;9:749-758. [PubMed] [DOI] |
| 11. | Chung JH, Bunz F. Cdk2 is required for p53-independent G2/M checkpoint control. PLoS Genet. 2010;6:e1000863. [PubMed] [DOI] |
| 12. | Robles AI, Harris CC. Clinical outcomes and correlates of TP53 mutations and cancer. Cold Spring Harb Perspect Biol. 2010;2:a001016. [PubMed] [DOI] |
| 13. | Han P, Kang JH, Li HL, Hu SX, Lian HH, Qiu PP, Zhang J, Li WG, Chen QX. Antiproliferation and apoptosis induced by tamoxifen in human bile duct carcinoma QBC939 cells via upregulated p53 expression. Biochem Biophys Res Commun. 2009;385:251-256. [PubMed] [DOI] |
| 14. | Hoogervorst EM, van Steeg H, de Vries A. Nucleotide excision repair- and p53-deficient mouse models in cancer research. Mutat Res. 2005;574:3-21. [PubMed] [DOI] |
| 15. | Ford JM. Regulation of DNA damage recognition and nucleotide excision repair: another role for p53. Mutat Res. 2005;577:195-202. [PubMed] [DOI] |
| 16. | Kang YK, Kim WH, Jang JJ. Expression of G1-S modulators (p53, p16, p27, cyclin D1, Rb) and Smad4/Dpc4 in intrahepatic cholangiocarcinoma. Hum Pathol. 2002;33:877-883. [PubMed] [DOI] |
| 17. | Sugimachi K, Aishima S, Taguchi K, Tanaka S, Shimada M, Kajiyama K, Sugimachi K, Tsuneyoshi M. The role of overexpression and gene amplification of cyclin D1 in intrahepatic cholangiocarcinoma. J Hepatol. 2001;35:74-79. [PubMed] [DOI] |
| 18. | Briggs CD, Neal CP, Mann CD, Steward WP, Manson MM, Berry DP. Prognostic molecular markers in cholangiocarcinoma: a systematic review. Eur J Cancer. 2009;45:33-47. [PubMed] [DOI] |
| 19. | Sauter ER, Takemoto R, Litwin S, Herlyn M. p53 alone or in combination with antisense cyclin D1 induces apoptosis and reduces tumor size in human melanoma. Cancer Gene Ther. 2002;9:807-812. [PubMed] [DOI] |
| 20. | Wang H, Mannava S, Grachtchouk V, Zhuang D, Soengas MS, Gudkov AV, Prochownik EV, Nikiforov MA. c-Myc depletion inhibits proliferation of human tumor cells at various stages of the cell cycle. Oncogene. 2008;27:1905-1915. [PubMed] [DOI] |
| 21. | Liu J, Akoulitchev S, Weber A, Ge H, Chuikov S, Libutti D, Wang XW, Conaway JW, Harris CC, Conaway RC. Defective interplay of activators and repressors with TFIH in xeroderma pigmentosum. Cell. 2001;104:353-363. [PubMed] [DOI] |
| 22. | Zhang MF, Zhang ZY, Fu J, Yang YF, Yun JP. Correlation between expression of p53, p21/WAF1, and MDM2 proteins and their prognostic significance in primary hepatocellular carcinoma. J Transl Med. 2009;7:110. [PubMed] [DOI] |
| 23. | Rocha S, Martin AM, Meek DW, Perkins ND. p53 represses cyclin D1 transcription through down regulation of Bcl-3 and inducing increased association of the p52 NF-kappaB subunit with histone deacetylase 1. Mol Cell Biol. 2003;23:4713-4727. [PubMed] [DOI] |
| 24. | Guardavaccaro D, Corrente G, Covone F, Micheli L, D'Agnano I, Starace G, Caruso M, Tirone F. Arrest of G(1)-S progression by the p53-inducible gene PC3 is Rb dependent and relies on the inhibition of cyclin D1 transcription. Mol Cell Biol. 2000;20:1797-1815. [DOI] |
| 25. | Hu GM, Liu LM, Zhang JX, Hu XD, Duan HJ, Deng H, He M, Luo ZJ, Liu JM, Luo J. The role of XPB in cell apoptosis and viability and its relationship with p53, p21(waf1/cip1) and c-myc in hepatoma cells. Dig Liver Dis. 2006;38:755-761. [PubMed] [DOI] |