修回日期: 2010-03-29
接受日期: 2010-04-07
在线出版日期: 2010-05-18
目的: 探讨聚腺苷二磷酸核糖聚合酶-1(PARP-1)Val762Ala, Lys940Arg基因多态性与甘肃省地区汉族人群胃癌易感性的关系.
方法: 采用多重单碱基延伸SNP分型技术(Multiplex SNaPshot)对甘肃省胃癌高发区河西地区汉族人群中经病理确诊的原发性胃癌150例, 健康对照组152例进行PARP-1基因2个SNP位点基因分型. 使用ELISA法检测H.pylori感染.
结果: 发现PARP-1 940Lys/Arg基因型分布在胃癌组明显高于对照组(OR = 2.917, 95%CI: 1.430-5.947, P = 0.002); PARP-1 762 Val/Ala基因型分布在胃癌组明显高于对照组(OR = 1.685, 95%CI: 1.040-2.729, P = 0.034). 分层分析显示, 在吸烟人群中, PARP-1 940Lys/Arg基因型携带者患胃癌的风险是Lys/Lys型携带者的8.430倍(OR = 8.340; 95%CI: 2.664-26.144, P = 0.000); 在饮酒人群中, PARP-1 940Lys/Arg基因型携带者患胃癌的风险是Lys/Lys型携带者的3.333倍(OR = 3.333, 95%CI: 1.214-9.155, P = 0.015), 在H.pylori感染阳性人群中, PARP-1 762Ala/Ala基因型携带者患胃癌的风险是Val/Val携带者的2.360倍(OR = 2.360, 95%CI: 1.256-4.433, P = 0.007). 同时携带PARP-1 940 Lys/Arg和PARP-1 762Ala/Ala+Val/Ala基因型的个体患胃癌的发病风险是PARP-1 940Lys/Lys和PARP-1 762Val/Val基因型携带者的4.2倍(OR = 4.200, 95%CI: 1.430-12.338, P = 0.006).
结论: PARP-1 940Lys/Arg和PARP-1 762Ala/Ala或Ala/Ala基因型与中国甘肃地区汉族人群胃癌发病风险增高相关; PARP-1 Lys940Arg与吸烟, 饮酒, PARP-1 Val762Ala与H.pylori感染以及PARP-1 Lys940Arg与PARP-1 Val762Ala在胃癌的发病风险中都各自存在着加乘交互效应.
引文著录: 康士亮, 李玉民, 何雯婷, 刘涛, 李汛, 周文策, 易剑锋, 曾祥挺. PARP-1基因多态性与胃癌易感性的关系. 世界华人消化杂志 2010; 18(14): 1434-1441
Revised: March 29, 2010
Accepted: April 7, 2010
Published online: May 18, 2010
AIM: To investigate the association between the Val762Ala and Lys940Arg polymorphisms of the poly(ADP-ribose) polymerase-1 (PARP-1) gene and susceptibility to gastric cancer in a Chinese Han population in He'xi area of Gansu Province.
METHODS: All investigated subjects were divided into two groups: 150 gastric cancer patients and 152 controls. The SNaPshot single nucleotide polymorphism (SNP) genotyping method was used to analyze the genotypes of PARP-1 Val762Ala and Lys940Arg. Helicobacter pylori (H.pylori) IgG antibody was detected by enzyme-linked immunosorbent assay (ELISA). The results were analyzed using the SPSS16.0 software package.
RESULTS: PARP-1 940 Lys/Arg and 762 Val/Ala genotypes were overrepresented in gastric cancer patients compared with controls (OR = 2.917 and 1.685; 95%CI: 1.430-5.947 and 1.040-2.729; P = 0.002 and 0.034, respectively). In smoking subjects, the risk of gastric cancer in PARP-1 940 Lys/Arg genotype carriers was 8.430-fold higher than that in Lys/Lys carriers (OR = 8.340, 95%CI: 2.664-26.144, P = 0.000). In drinking subjects, PARP-1 940 Lys/Arg genotype carriers had a 3.333-fold higher risk of gastric cancer than Lys/Lys carriers (OR = 3.333, 95%CI: 1.214-9.155, P = 0.015). In H.pylori IgG-positive subjects, PARP-1 762 Ala/Ala genotype carriers had a 2.360-fold increased risk of gastric cancer than Val/Val carriers (OR = 2.360, 95%CI: 1.256-4.433, P = 0.007). The subjects carrying PARP-1 940 Lys/Arg and PARP-1 Ala/Ala or Val/Ala genotypes had a 4.2-fold increased risk of gastric cancer compared with those carrying PARP-1 940 Lys/Lys and PARP-1 762Val/Val genotypes (OR = 4.200, 95%CI: 1.430-12.338, P = 0.006).
CONCLUSION: PARP-1 940Lys/Arg and PARP-1 762Ala/Ala or Ala/Ala genotypes are associated with a higher risk of gastric cancer. There are multiplicative joint effects between PARP-1 940 Lys/Arg genotype and smoking or drinking, between PARP-1 762 Val/Ala or Ala/Ala genotypes and H.pylori infection, and between PARP-1 Lys940Arg and PARP-1 Val762Ala genotypes in increasing the risk of gastric cancer.
- Citation: Kang SL, Li YM, He WT, Liu T, Li X, Zhou WC, Yi JF, Zeng XT. Association between PARP-1 polymorphisms and susceptibility to gastric cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(14): 1434-1441
- URL: https://www.wjgnet.com/1009-3079/full/v18/i14/1434.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i14.1434
胃癌是严重危害人类健康的最常见的恶性肿瘤之一, 目前, 在全球范围内, 胃癌发病率居恶性肿瘤第4位, 其死亡率仅次于肺癌居恶性肿瘤第2位[1], 在我国胃癌的发病率和死亡率居全部恶性肿瘤第3位[2]. 甘肃河西地区是我国胃癌的一个高发区, 该地区胃癌检出率为7.79%[3], 高于北京丁士刚等报道的1.95%. 胃癌的发生是遗传因素与环境因素相互作用的结果, 在不良环境因素的长期刺激下人体内易感基因发生变化而引起胃癌. 在胃癌发生的遗传因素中, 聚腺苷二磷酸核糖聚合酶[poly(ADP ribose) polymerase, PARP]有重要的作用, 聚腺苷二磷酸核糖聚合酶[poly (ADP ribose) polymerase, PARP]是一个能选择性识别并结合DNA缺口的DNA结合蛋白酶, 主要通过修复DNA单链及双链断裂在维持基因组的完整性方面发挥作用[4,5]. PARP家族共有7个成员, PARP-1是迄今研究得最清楚的一个成员. PARP-1基因存在多个单核苷酸多态性位点, 其中某些位点被报道与恶性肿瘤的易感性相关[6]. 在环境因素中, 幽门螺杆菌(Helicobacter pylori, H.pylori)感染与胃癌的发生密切相关. 世界卫生组织国际癌症研究机构将H.pylori定为Ⅰ类致癌原[7]. 我国H.pylori感染率较高, 在甘肃河西地区胃癌患者中H.pylori感染率高达73.5%[8]. 有研究表明, 吸烟, 饮酒等与胃癌发病有关[9]. 本研究选择胃癌高发区甘肃河西地区胃癌患者作为研究对象, 同时取相同地理条件、年龄性别相近的健康人作对照, 对PARP-1 Val762Ala, Lys940Arg多态性与H.pylori感染, 吸烟, 饮酒在胃癌发病风险中的作用进一步做分层分析, 从而把遗传和环境两个因素综合起来探索胃癌发生的分子机制.
胃癌组150例, 来自甘肃省河西三地区(张掖, 武威, 酒泉), 20岁以上, 在当地居住满20年以上, 三代无族外通婚的汉族居民, 2008-09/2009-11经"二甲"以上医院住院或接受胃镜检查并满足上述条件的汉族居民, 均经组织病理学确诊. 健康对照组152例, 来自同一时期该地区的按性别、年龄(±5岁)配对, 并排除肿瘤和消化系统疾病的健康汉族志愿者. 征得研究对象同意, 并采集以下信息: (1)人口学特征, 如年龄、性别等; (2)吸烟(每日吸2支以上, 连续吸1年以上), 饮酒史(每周饮酒≥2次, 每次≥100 g, 持续时间至少达半年). 每位研究对象自愿贡献外周静脉血5 mL(EDTA抗凝), -70 ℃冰箱保存.
1.2.1 血清H.pylori免疫印迹分型检测: 血清H.pylori免疫印迹试剂盒购自深圳伯劳特公司, 使用幽门螺杆菌IgG酶联免疫吸附试验(ELISA)试剂盒检测是否有H.pylori感染, 按实验操作步骤进行.
1.2.2 基因多态性位点分型: 采用全血基因组DNA提取系统(非离心柱型)抽提外周血基因组DNA(TaKaRa Bio, Japan). DNA样本取1 μL 1% agarose电泳对其样本进行质量检查以及浓度估计, 然后根据估计的浓度将样本稀释到工作浓度5-10 mg/L. 利用多重单碱基延伸SNP分型技术(Multiplex SNaPshot)对302个样本进行PARP-1基因Val762Ala, Lys940Arg2个SNP位点分型. (1)PARP-1基因Val762Ala, Lys940Arg的PCR引物及其延伸引物用Primer3软件设计(http://frodo.wi.mit.edu/cgi-bin/primer3/primer3_http://www.cgi). PARP-1Val762Ala的PCR引物及延伸引物分别为: rs1136410F 5'-GCAGGAGGGTTTGCCATTCAC-3'; rs1136410R 5'-CAGACCCTCCCCTGAGCAGAC-3'; 延伸引物: 5'-TTTTTTTTTTTTTTTTTTTTTTTTTAGCAGGTTGTCAAGCATTTCC-3'; PARP-1 Lys940Arg的PCR引物及延伸引物分别为rs3219145F 5'-gcccagtgtgaaggcctcttct-3'; rs3219145R 5'-tttgacactgtgcttgcccttg-3'; 延伸引物: 5'-TTTTTTTTTGTGCTTGCCCTTGGGTAAC-3'; (2)PCR反应体系(20 μL): ddH2O 13 μL, 10×BufferⅠ 2 μL, dNTP(10 mmol/L), MgCl2(25 mmol/L)1.2 μL, Primer(s)2 μL, HotTaq(5 U/μL)0.2 μL, Template(1-5 mg/L)1 μL, DNA. 反应体系中各对引物的浓rs1136410F/R 1 μmol/L, rs3219145F/R 1 μmol/L. PCR循环程序: 95 ℃变性15 min; 94 ℃变性40 s, 63 ℃退火1 min, 每个循环下降0.5 ℃, 72 ℃延伸C 1 min 40 s, 共15个循环. 然后94 ℃变性20 s, 56 ℃退火30 s, 72 ℃延伸1.5 min, 共24个循环. 最后72 ℃延伸2 min. 结束后4 ℃保存. (3)PCR产物纯化: 在10 μL PCR产物中加入1 U SAP酶(Promega)和1 U ExonucleaseⅠ酶(Epicentre), 37 ℃温浴1 h, 然后75 ℃灭活15 min. (4)SNaPshot多重单碱基延伸反应: 延伸反应体系(10 μL)包括5 μL SNaPshot Multiplex Kit(ABI), 2 μL纯化后多重PCR产物, 1 μL延伸引物混合物, 2 μL超纯水. 反应体系中各对引物的浓度: rs1136410SF 0.8 μmol/L, rs3219145SR 0.6 μmol/L. PCR循环程序: 96 ℃变性1 min; 然后96 ℃变性10 s, 50 ℃退火5 s, 60 ℃延伸30 s, 共28个循环. 最后60 ℃延伸1 min. 结束后4 ℃保存. (5)延伸产物纯化: 在10 μL延伸产物中加入1 U SAP酶, 37 ℃温浴1 h, 然后75 ℃灭活15 min. (6)DNA测序仪(ABI3130XL)测序: 取0.5 μL纯化后的延伸产物, 与0.5 μL Liz120 SIZE STANDARD, 9 μL Hi-DiFormamide(高纯甲酰胺)混匀, 95 ℃变性5 min后上ABI3130XL测序仪, 收集的原始数据用GeneMapper 4.0(AppliedBiosystems Co., Ltd., USA)来分析.
统计学处理 χ2检验比较各基因型在两组中的分布差异. 以非条件Logistic回归计算比值比(odds ratio, OR)及其95%可信区间(confidence interval, CI)评价各基因型与胃癌发病风险的关系. 所用统计学分析软件为SPSS16.0. 所有统计检验均为双侧概率检验.
两组间的年龄, 性别, 吸烟, 饮酒无统计学意义(P>0.05). 胃癌组H.pylori感染率明显高于对照组(P = 0.000, 表1).
| 基本特征 | 正常对照组 | 胃癌组 | P值 |
| 年龄(岁) | |||
| (mean±SD) | 58.7±11.2 | 59.7±9.6 | 0.394 |
| <60 | 65(42.8) | 61(40.7) | 0.712 |
| ≥60 | 87(57.2) | 89(59.3) | |
| 性别 | |||
| 女 | 49(32.2) | 46(30.7) | 0.769 |
| 男 | 103(67.8) | 104(69.3) | |
| 吸烟 | |||
| 不吸 | 86(56.6) | 90(60.0) | 0.547 |
| 吸 | 60(40.0) | ||
| 饮酒 | |||
| 不饮 | 74(48.7) | 81(54.0) | 0.355 |
| 饮 | 78(51.3) | 69(46.0) | |
| H. pylori感染 | |||
| 阳性 | 68(44.7) | 102(68.0) | 0.000 |
| 阴性 | 84(55.3) | 48(32.0) |
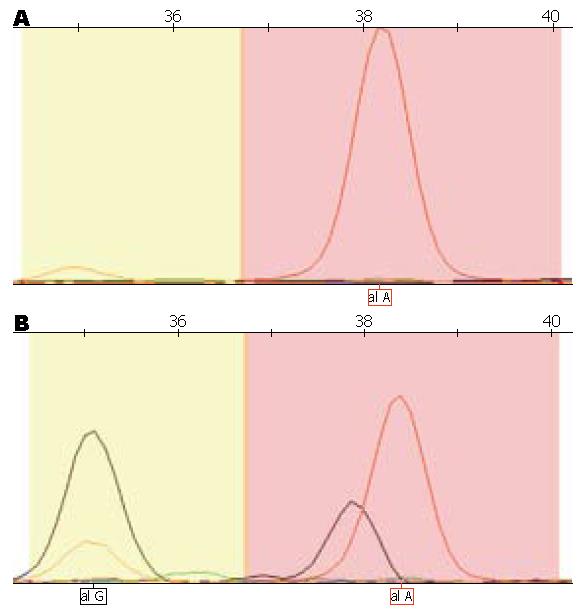
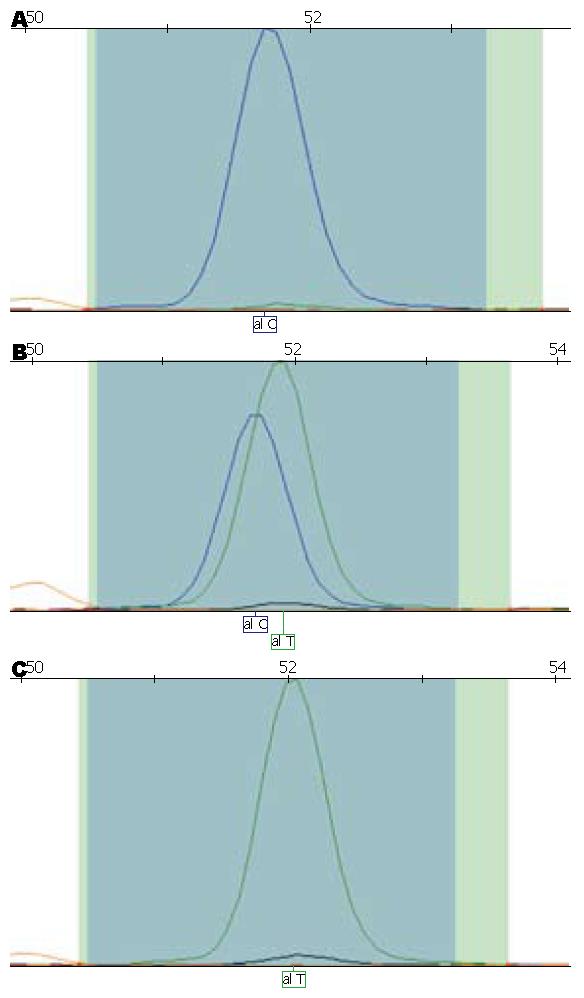
PARP-1Lys940Arg多态位点有AA, GA, GG3种基因型, 本次实验无基因型为GG的样本(图1). Val762Ala多态位点有TT, TC, CC3种基因型(图2). Lys940Arg和Val762Ala的基因型频率分布均符合Hardy-Weinberg平衡规律(P = 0.612, 0.174; P = 0.089, 0.589). 以PARP-1Lys940Arg基因型AA的OR为1.00, PARP-1Lys940Arg基因型GA有显著增高的胃癌发病风险(OR = 2.917, 95%CI: 1.430-5.947, P = 0.002). 以PARP-1Val762Ala基因型TT的OR为1.00, Val762Ala基因型TC有显著增高的胃癌发病风险(OR = 1.685, 95%CI: 1.040-2.729, P = 0.034, 表2).
| Val762Ala(%) | Lys940Arg(%) | ||||||
| TT | TC | CC | TC+CC | AA | GA | GG | |
| 正常对照组 | 88(57.9) | 50(32.9) | 14(9.2) | 64(42.1) | 140(92.1) | 12(7.9) | 0(0) |
| 胃癌组 | 70(46.7) | 67(44.7) | 13(8.7) | 80(53.3) | 120(80.0) | 30(20.0) | 0(0) |
| OR | 1.000 | 1.685 | 1.167 | 1.571 | 1.000 | 2.917 | - |
| 95%CI | - | 1.040-2.729 | 0.515-2.644 | 0.997-2.476 | - | 1.430-5.947 | - |
| P值 | 0.034 | 0.711 | 0.051 | 0.002 | - | ||
PARP-1Lys940Arg基因多态性与胃癌相关性的分层分析(表3): 在吸烟, 饮酒人群中, Lys940Arg基因型GA患胃癌风险分别是AA型的8.436, 3.333倍(OR = 8.436, 95%CI: 2.664-26.144, P = 0.000; OR = 3.333, 95%CI: 1.214-9.155, P = 0.015). PARP-1Val762Ala基因多态性与胃癌相关性的分层分析(表4), 在H.pylori感染人群中, Val762Ala基因型TC+CC患胃癌风险是TT型的2.360倍(OR = 2.360, 95%CI: 1.256-4.433, P = 0.007), 在吸烟, 饮酒中无明显差异.
| 分层 | 正常对照组n | 胃癌组n | P值 | OR | 95%CI | ||
| AA | GA+GG | AA | GA+GG | ||||
| H. pylori感染 | |||||||
| 阳性 | 60 | 8 | 78 | 24 | 0.055 | 2.308 | 0.969-5.498 |
| 阴性 | 80 | 4 | 42 | 6 | 0.106 | 2.875 | 0.764-10.686 |
| 吸烟 | |||||||
| 不吸 | 78 | 8 | 81 | 9 | 0.876 | 1.083 | 0.398-2.950 |
| 吸 | 62 | 4 | 39 | 21 | 0.000 | 8.436 | 2.664-26.144 |
| 饮酒 | |||||||
| 不饮 | 68 | 6 | 66 | 15 | 0.059 | 2.567 | 0.942-7.070 |
| 饮 | 72 | 6 | 54 | 15 | 0.015 | 3.333 | 1.214-9.155 |
| 分层 | 正常对照组n | 胃癌组n | P值 | OR | 95%CI | ||
| TT | TC+CC | TT | TC+CC | ||||
| H. pylori感染 | |||||||
| 阳性 | 43 | 25 | 43 | 59 | 0.007 | 2.36 | 1.256-4.433 |
| 阴性 | 45 | 39 | 27 | 21 | 0.314 | 1.447 | 0.704-2.973 |
| 吸烟 | |||||||
| 不吸 | 37 | 29 | 27 | 33 | 0.215 | 1.559 | 0.772-3.151 |
| 吸 | 51 | 35 | 43 | 47 | 0.126 | 1.593 | 0.877-2.893 |
| 饮酒 | |||||||
| 不饮 | 42 | 32 | 36 | 45 | 0.126 | 1.641 | 0.869-3.097 |
| 饮 | 46 | 32 | 34 | 35 | 0.239 | 1.480 | 0.770-2.843 |
与对照组相比, 在胃癌组中携带PARP-1940Lys/Arg基因型者更可能同时携带PARP-1762Ala/Ala+Val/Ala基因型. 而同时携带PARP-1940Lys/Arg和PARP-1762Ala/Ala+Val/Ala基因型的个体患胃癌的发病风险是PARP-1Lys/Lys和PARP-1Val/Val基因型(野生型)携带者的4.2倍(OR = 4.200; 95%CI: 1.430-12.338; P = 0.006). 此OR值明显高于PARP-1940Lys/Arg基因型与PARP-1Lys/Lys基因型相比的OR值, 也高于PARP-1762Ala/Ala+Val/Ala基因型与Val/Val基因型相比的OR值. 这一结果表明: PARP-1940Lys/Arg基因型和PARP-1762Ala/Ala+Val/Ala基因型在胃癌的发病风险中存在着明显的加乘交互效应(表5).
| 基因型 | 正常对照组 | 胃癌组 | P值 | OR | 95%CI | |
| Lys940Arg | Val762Ala | |||||
| Lys/Lys | Val/Val | 81 | 54 | 1.000 | ||
| Lys/Lys | Val/Ala+Ala/Ala | 59 | 66 | 0.039 | 1.678 | 0.026-2.744 |
| Lys/Arg | Val/Val | 7 | 16 | 0.008 | 3.429 | 1.323-8.888 |
| Lys/Arg | Val/Ala+Ala/Ala | 5 | 14 | 0.006 | 4.200 | 1.430-12.338 |
胃癌发生的机制复杂, 目前研究认为他与遗传因素和环境因素有关, 这二者因素在胃癌的发生中相互作用, 相互影响. 仅有个体的遗传变异, 并不造成细胞的癌变, 而是需要适当的环境因素参与. 个体的遗传易感性是由于一些与肿瘤发生相关的基因存在多态性, 其遗传学基础是人类基因组DNA序列的变异性, 其中最常见的是单核苷酸多态性(single nucleotide polymorphism, SNP)[10]. SNP是指染色体基因组水平单个核苷酸变异引起的DNA序列多态性, 在人群中发生率大于1%, 是基因组变异最丰富的一种DNA序列变化形式. SNP是一种较好地反映个体遗传差异的分子标记, 他能反映个体表型、疾病易感性和对药物、环境因子反应的差异. 单核苷酸多态性与肿瘤易感性关系的研究只有充分考虑环境、生物、遗传、种族、地域等诸多因素, 才能建立起与某一特定肿瘤易感性之间较为明确的关系, 为肿瘤的预防和治疗提供依据.
在抑制基因变异, 癌症发生过程中, DNA修复基因在保护维持基因组的完整性修复方面发挥作用, PARP-1是一个能选择性识别并结合DNA缺口的DNA结合蛋白酶, 参与因电离辐射和氧化损伤引起的碱基切除修复和单链断裂. Lockett等[6]研究显示PARP-1Val762Ala的Ala/Ala基因型能增加前列腺癌的易感性, 降低酶的活性. Cao等[11]研究发现PARP-1基因变异与法国人群乳腺癌增高相关. 研究发现, PARP-1的多态性与多种肿瘤易感性相关, 在其高度保守的接触反应区存在的两个多态位点Val762Ala和Lys940Arg, 与生殖细胞肿瘤易感性增高相关[12]、与吸烟的交互作用可明显增高肺癌易感性[13]. PARP-1以NAD为底物可以催化多种蛋白的聚ADP核糖基化, 包括组蛋白、XRCC1、NF-κB、P53及PARP-1自身[14]. PARP-1通过其N末端的锌指DNA结合区及其中央的BRCT区与XRCC1发生作用, DNA损伤后, PARP-1被DNA缺口激活, 以XRCC1作为脚手架蛋白, 通过直接与聚合酶β、DNA连接酶Ⅲ形成复合物, 合成并转运长链ADP核糖多聚体到DNA修复蛋白上, 参与因电离辐射和氧化损伤引起的碱基切除修复和单链断裂修复[15]. 在肿瘤治疗尤其是恶性肿瘤治疗方面, 其策略是对肿瘤细胞的特异杀伤, 而对正常细胞DNA影响甚微的靶向治疗, PARP-1有望成为有效而特异的抗肿瘤靶分子之一[16]. 利用siRNA干扰PARP-1, 从而改变PARP-1和聚ADP核糖水解酶[poly (ADP-ribose) glycohydrolase, PARG]的平衡, PARG活性相对增强因而聚腺苷酸二磷酸核糖(PAR)降解过多, 这种作用相当于PARP抑制剂[17]. 研究发现PARP-1基因缺陷的小鼠对烷化物诱发的肿瘤的易感性增高[12].
本研究发现携带PARP-1940Lys/Arg基因型的个体患胃癌的风险是Lys/Lys携带者的2.917倍(OR = 2.917, 95%CI: 1.430-5.947, P = 0.002). PARP-1762Val/Ala基因型个体患胃癌的风险是Val/Val携带者的1.685倍(OR = 1.685, 95%CI: 1.040-2.729, P = 0.005), 这一研究结果与先前Lockett等和Zhang等的报道基本一致. 通过数据分析, 我们认为PARP-1Lys940Arg, Val762Ala多态性与胃癌的发病风险相关. 而且通过分层分析, 发现在吸烟, 饮酒的人群中, 携带PARP-1 940Lys/Arg基因型者与胃癌的发病风险存在着更强的关系, 在H.pylori IgG阳性的人群中, 携带PARP-1762Ala/Ala+Val/Ala基因型者与胃癌的发病风险存在着更强的关系. 这一结果证实了在胃癌的发生中, 基因-环境的交互作用是很重要的. 长期吸烟的个体, 发生糜烂性胃炎、萎缩性胃炎和溃疡等癌前病变的风险明显增大[18]. 国外很多实验室研究成果认为吸烟是胃癌的危险因素, 吸烟可能导致个体罹患胃癌的风险增加到1.62倍[9], 最近的研究发现, 吸烟会减少胃黏膜合成前列腺素进而使胃黏膜微循环血管产生障碍, 导致胃上皮细胞损伤, 从而增加了胃癌发生的风险[19]. 酒精与辛辣食物[20,21]对胃黏膜的刺激相当大, 长期大量饮酒及进食辛辣食物, 会损伤胃黏膜, 使胃黏膜充血、水肿、甚至糜烂, 慢性胃炎发生率明显增高, 细菌繁殖增加, 促进了致癌物亚硝胺类的合成[22]. 循证医学Meta分析的研究数据也表明饮酒高危人群患胃癌的归因危险百分比为50.74%, 而一般人群只为17.784%[23]. 研究表明酒精在代谢过程中不但生成乙醛、乙酸、大量自由基等因素, 还会扰乱体内一碳单位的代谢、进而干扰DNA甲基化、影响核酸合成等生理活动, 可能是酒精导致胃癌危险增高的一个重要原因[24]. H.pylori是胃癌的主要发病原因之一, 个体感染H.pylori后只有一部分发生胃炎、胃溃疡继而进一步发展成胃癌, 这可能与H.pylori携带不同致病因子有关[25,26]. 大量研究提示患病风险增高的原因是由细菌的毒力因素(VacA和CagA等)[27,28], 宿主的反应性(遗传易感性、肠上皮化生)和环境因素(饮食、获得感染的年龄)等多种因素相互作用的复杂结果. H.pylori通过其毒力因子会氧化损伤胃黏膜上皮细胞的DNA. H.pylori产生的毒力因子包括菌毛、鞭毛、尿素酶、细胞毒素、空泡细胞毒素等[29], 临床根据H.pylori的Cag致病岛和VacA基因型将H.pylori分为高毒力株和低毒力株[30]. 其中研究证明CagA基因是H.pylori高毒力株的标志基因, 与慢性胃炎、消化性溃疡、胃癌的发生密切相关[31,32]. CagA因子可以损害胃黏膜, 导致胃黏膜上皮细胞更新加速, 进而增加DNA损伤的机会, 从而引起细胞突变最终导致癌细胞的形成[33]. H.pylori可能是慢性胃炎向胃黏膜不典型增生及胃癌发展的重要启动因子[34], 感染后引起的炎细胞浸润及黏膜的损害与细胞因子的产生密切相关[35,36].
在本实验中, 通过对PARP-1 Val762Ala, Lys940Arg的交互作用分析发现: 同时携带PARP-1940Lys/Arg和PARP-1762Ala/Ala+Val/Ala基因型的个体患胃癌的发病风险是同时携带PARP-1940Lys/Lys和PARP-1762Val/Val基因型携带者4.2倍, 这一结果表明: PARP-1940Lys/Arg基因型和PARP-1762Val/Val+Val/Ala基因型在胃癌的发病风险中存在着明显的加乘交互效应, 这说明在胃癌的发生是基因多位点共同参与的结果. PARP-1的Val762Ala或Lys940Arg的基因变异可导致PARP-1酶活性下降, 修复DNA损伤的能力降低, 他们共存时则更加增高了个体对胃癌的发病风险.
由于涉及癌变过程的基因-基因、基因-环境因素相互作用关系错综复杂, 本研究只能视为初步研究, 而且本研究显示PARP-1Lys940Arg的C等位基因频率较低(在正常对照组, 胃癌组分别为0.039, 0.100), 有关结论有必要进一步扩大样本验证.
在我国胃癌的发病率和死亡率居各种恶性肿瘤第3位, 甘肃河西地区是我国胃癌的一个高发区, 胃癌的发生是遗传因素与环境因素相互作用的结果, 把遗传和环境两个因素综合探讨胃癌危险因素、发病机制及预防措施是当前科学研究的重要任务.
郑鹏远, 教授, 郑州大学第二附属医院消化科; 王小众, 教授, 福建医科大学附属协和医院消化内科
聚腺苷二磷酸核糖聚合酶(PARP)作为一种非常重要的DNA修复基因被广泛关注, 目前对于PARP-1的SNP与肿瘤的易感性的研究, 主要集中生殖系肿瘤、肺癌及乳腺癌等方面, 但有关PARP-1的SNP与胃癌易感性的关系尚不明确.
Lockett等研究显示PARP-1Val762Ala的Ala/Ala基因型能增加前列腺癌的易感性, 降低酶的活性. 曹文辉等研究发现PARP-1基因变异与法国人群乳腺癌增高相关. Motoko Shiokawa等研究发现, PARP-1的多态性与多种肿瘤易感性相关, 在其高度保守的接触反应区存在的两个多态位点Val762Ala和Lys940Arg.
本研究对PARP-1 Val762Ala, Lys940Arg两个对PARP-1基因功能有重要影响的位点对PARP-基因SNP与胃癌关系进行研究, 具有明显的创新性, 同时, 本研究采用国内很少应用的多重单碱基延伸SNP分型技术(multiplex SNaPshot), 准确性高, 方法新颖.
本文通过对PARP-1基因多态性与胃癌易感性的关系进行研究, 揭示了中国甘肃省河西地区胃癌患者PARP-1基因多态性及胃癌发病风险, 对胃癌防治具有一定意义.
本研究从遗传角度对胃癌易感性进行研究, 资料详实, 内容丰富, 具有一定的理论意义和潜在的临床价值.
编辑: 李军亮 电编: 何基才
| 1. | Brenner H, Rothenbacher D, Arndt V. Epidemiology of stomach cancer. Methods Mol Biol. 2009;472:467-477. [PubMed] [DOI] |
| 2. | Yang L. Incidence and mortality of gastric cancer in China. World J Gastroenterol. 2006;12:17-20. [PubMed] [DOI] |
| 3. | 李 玉民, 石 斌, 柴 琛, 李 汛, 周 文策, 刘 虎, 米 登海, 段 国学, 王 芳, 徐 创贵. 甘肃省河西地区胃癌发病状况的调查. 中华普通外科杂志. 2004;19:183-184. |
| 4. | Tsutsumi M, Masutani M, Nozaki T, Kusuoka O, Tsujiuchi T, Nakagama H, Suzuki H, Konishi Y, Sugimura T. Increased susceptibility of poly(ADP-ribose) polymerase-1 knockout mice to nitrosamine carcinogenicity. Carcinogenesis. 2001;22:1-3. [PubMed] [DOI] |
| 5. | Nguewa PA, Fuertes MA, Valladares B, Alonso C, Pérez JM. Poly(ADP-ribose) polymerases: homology, structural domains and functions. Novel therapeutical applications. Prog Biophys Mol Biol. 2005;88:143-172. [PubMed] [DOI] |
| 6. | Lockett KL, Hall MC, Xu J, Zheng SL, Berwick M, Chuang SC, Clark PE, Cramer SD, Lohman K, Hu JJ. The ADPRT V762A genetic variant contributes to prostate cancer susceptibility and deficient enzyme function. Cancer Res. 2004;64:6344-6348. [PubMed] [DOI] |
| 7. | Yea SS, Yang YI, Jang WH, Lee YJ, Bae HS, Paik KH. Association between TNF-alpha promoter polymorphism and Helicobacter pylori cagA subtype infection. J Clin Pathol. 2001;54:703-706. [PubMed] [DOI] |
| 9. | Ladeiras-Lopes R, Pereira AK, Nogueira A, Pinheiro-Torres T, Pinto I, Santos-Pereira R, Lunet N. Smoking and gastric cancer: systematic review and meta-analysis of cohort studies. Cancer Causes Control. 2008;19:689-701. [PubMed] [DOI] |
| 10. | Finishing the euchromatic sequence of the human genome. Nature. 2004;431:931-945. [PubMed] [DOI] |
| 11. | Cao WH, Wang X, Frappart L, Rigal D, Wang ZQ, Shen Y, Tong WM. Analysis of genetic variants of the poly(ADP-ribose) polymerase-1 gene in breast cancer in French patients. Mutat Res. 2007;632:20-28. [PubMed] [DOI] |
| 12. | Shiokawa M, Masutani M, Fujihara H, Ueki K, Nishikawa R, Sugimura T, Kubo H, Nakagama H. Genetic alteration of poly(ADP-ribose) polymerase-1 in human germ cell tumors. Jpn J Clin Oncol. 2005;35:97-102. [PubMed] [DOI] |
| 13. | Zhang X, Miao X, Liang G, Hao B, Wang Y, Tan W, Li Y, Guo Y, He F, Wei Q. Polymorphisms in DNA base excision repair genes ADPRT and XRCC1 and risk of lung cancer. Cancer Res. 2005;65:722-726. [PubMed] |
| 14. | Yi SY, Lee WJ. A p53 genetic polymorphism of gastric cancer: difference between early gastric cancer and advanced gastric cancer. World J Gastroenterol. 2006;12:6536-6539. [PubMed] [DOI] |
| 15. | Zhang ZW, Newcomb P, Hollowood A, Moganaden J, Feakins R, Storey A, Farthing MJ, Alderson D, Holly J. A comparison study of gastric cancer risk in patients with duodenal and gastric ulcer: roles of gastric mucosal histology and p53 codon 72 polymorphism. Dig Dis Sci. 2004;49:254-259. [PubMed] [DOI] |
| 17. | Haince JF, Rouleau M, Hendzel MJ, Masson JY, Poirier GG. Targeting poly(ADP-ribosyl)ation: a promising approach in cancer therapy. Trends Mol Med. 2005;11:456-463. [PubMed] [DOI] |
| 19. | Levi F, Lucchini F, La Vecchia C. Trends in cancer mortality in Switzerland, 1980-2001. Eur J Cancer Prev. 2006;15:1-9. [PubMed] [DOI] |
| 20. | Zickute J, Strumylaite L, Dregval L, Petrauskiene J, Dudzevicius J, Stratilatovas E. [Vegetables and fruits and risk of stomach cancer]. Medicina (Kaunas). 2005;41:733-740. [PubMed] |
| 21. | Liu C, Russell RM. Nutrition and gastric cancer risk: an update. Nutr Rev. 2008;66:237-249. [PubMed] [DOI] |
| 22. | Franke A, Teyssen S, Singer MV. Alcohol-related diseases of the esophagus and stomach. Dig Dis. 2005;23:204-213. [PubMed] [DOI] |
| 24. | Tanaka K, Kiyohara Y, Kubo M, Matsumoto T, Tanizaki Y, Okubo K, Ninomiya T, Oishi Y, Shikata K, Iida M. Secular trends in the incidence, mortality, and survival rate of gastric cancer in a general Japanese population: the Hisayama study. Cancer Causes Control. 2005;16:573-578. [PubMed] [DOI] |
| 25. | Romo-González C, Salama NR, Burgeño-Ferreira J, Ponce-Castañeda V, Lazcano-Ponce E, Camorlinga-Ponce M, Torres J. Differences in genome content among Helicobacter pylori isolates from patients with gastritis, duodenal ulcer, or gastric cancer reveal novel disease-associated genes. Infect Immun. 2009;77:2201-2211. [PubMed] [DOI] |
| 26. | Wen S, Moss SF. Helicobacter pylori virulence factors in gastric carcinogenesis. Cancer Lett. 2009;282:1-8. [PubMed] [DOI] |
| 27. | Wu CC, Chou PY, Hu CT, Liu ZC, Lin CY, Tseng YH, Lin NT. Clinical Relevance of the vacA, iceA, cagA, and flaA genes of Helicobacter pylori strains isolated in Eastern Taiwan. J Clin Microbiol. 2005;43:2913-2915. [PubMed] [DOI] |
| 28. | Yokoyama K, Higashi H, Ishikawa S, Fujii Y, Kondo S, Kato H, Azuma T, Wada A, Hirayama T, Aburatani H. Functional antagonism between Helicobacter pylori CagA and vacuolating toxin VacA in control of the NFAT signaling pathway in gastric epithelial cells. Proc Natl Acad Sci U S A. 2005;102:9661-9666. [PubMed] [DOI] |
| 29. | 黄 德旺, 磨 庆福, 蔡 永林, 陈 康部, 李 军, 汤 敏中, 成 积儒, 谢 宁. 血清幽门螺杆菌抗体谱与上消化道疾病相关性研究. 现代消化及介入诊疗. 2008;13:168-170. |
| 30. | Atherton JC. The pathogenesis of Helicobacter pylori-induced gastro-duodenal diseases. Annu Rev Pathol. 2006;1:63-96. [PubMed] [DOI] |
| 31. | López-Vidal Y, Ponce-de-León S, Castillo-Rojas G, Barreto-Zúñiga R, Torre-Delgadillo A. High diversity of vacA and cagA Helicobacter pylori genotypes in patients with and without gastric cancer. PLoS One. 2008;3:e3849. [PubMed] [DOI] |
| 32. | Nguyen LT, Uchida T, Murakami K, Fujioka T, Moriyama M. Helicobacter pylori virulence and the diversity of gastric cancer in Asia. J Med Microbiol. 2008;57:1445-1453. [PubMed] [DOI] |
| 33. | Ławniczak M, Starzyńska T. [Helicobacter pylori CagA(+) infection in gastric cancer patients]. Pol Merkur Lekarski. 2002;13:216-220. [PubMed] |
| 34. | 李 琦, 范 忠泽, 孙 珏, 刘 宁宁, 周 利红, 吴 琼, 王 炎, 隋 华, 高 虹. 幽门螺杆菌对人胃癌MKN45细胞p38MAPK信号转导通路激活作用的研究. 中国癌症杂志. 2008;18:801-805. |
| 35. | Malfertheiner P, Schultze V, Rosenkranz B, Kaufmann SH, Ulrichs T, Novicki D, Norelli F, Contorni M, Peppoloni S, Berti D. Safety and immunogenicity of an intramuscular Helicobacter pylori vaccine in noninfected volunteers: a phase I study. Gastroenterology. 2008;135:787-795. [PubMed] [DOI] |
| 36. | Lundin BS, Enarsson K, Kindlund B, Lundgren A, Johnsson E, Quiding-Järbrink M, Svennerholm AM. The local and systemic T-cell response to Helicobacter pylori in gastric cancer patients is characterised by production of interleukin-10. Clin Immunol. 2007;125:205-213. [PubMed] [DOI] |