修回日期: 2009-02-19
接受日期: 2009-02-23
在线出版日期: 2009-03-18
目的: 研究红景天甙对肝纤维化大鼠肝组织ROCK基因表达的影响, 了解其干预肝纤维化的机制.
方法: 健康雄性SD大鼠, 随机分为3组: 对照组(n = 10), 红景天甙干预组(n = 40)和肝纤维化模型组(n = 40). 大鼠肝纤维化采用CCl4皮下注射法(300 mL/L, 3 mL/kg, 每周2次, 共8 wk)诱导. 红景天甙干预采用腹腔注射法, 剂量5 mg/kg, 每周2次. 肝脏胶原沉积状况采用Masson胶原染色以及HE染色观察, ROCKⅠ、ROCKⅡ表达水平分别采用原位杂交(in situ hybridization, ISH) 和免疫组化(immunohistochemistry, IH)方法检测. 实验图像经电子计算机扫描, 数据采用专业图像分析软件统计分析.
结果: 肝纤维化大鼠肝脏肝细胞坏死、再生明显, 假小叶形成, 胶原纤维沉积明显增加, 肝实质结构紊乱. 红景天甙干预组大鼠肝组织胶原沉积明显减少, 组织学积分平均胶原面积降低(2.1±0.3 vs 3.6±0.8, 74.82±21.51 μm2vs 290.86±89.37 μm2, 均P<0.05). 与模型组比较, 红景天甙干预性治疗组ROCKⅠ, Ⅱ蛋白表达水平均明显下降(0.203±0.068 vs 0.357±0.182, 0.237±0.056 vs 0.394±0.238, 均P<0.05), ROCKⅠ, Ⅱ mRNA表达水平明显下降(0.197±0.019 vs 0.394±0.238, 0.185±0.031 vs 0.279±0.112, 均P<0.01).
结论: 红景天甙可能通过调节Rho-ROCK信号传导通路, 减少肝脏胶原纤维的合成与沉积, 有效干预CCl4诱导的大鼠肝纤维化.
引文著录: 吴晓玲, 曾维政, 蒋明德, 秦建平, 徐辉, 王钊. 红景天甙对肝纤维化大鼠肝组织ROCK表达的影响. 世界华人消化杂志 2009; 17(8): 765-769
Revised: February 19, 2009
Accepted: February 23, 2009
Published online: March 18, 2009
AIM: To observe the effects of salidroside on the expression of ROCK in liver tissue of CCl4-induced liver fibrosis in rats, and to explore its probable mechanism.
METHODS: Ninety healthy SD rats were randomly divided into 3 groups: control group (n = 10), salidroside group (n = 40) and liver fibrosis group (n = 40). Experimental liver fibrosis was induced by (with the concentration of 300 mL/L soluted in liquid paraffin) subcutaneous injection of CCl4 (at the dosage of 3 mL/kg, twice per wk, 8 wks). The salidroside was injected into the peritoneal cavity at the dosage of 5 mg/kg, twice per week for 8 weeks. Liver tissues from each group were stained with Masson and HE staining to observe the collagen deposition. Expressions of ROCKⅠand ROCKⅡ in the liver tissue were detected with in situ hybridization (ISH) and immunohistochemistry (IH) respectively. All the figures were scanned with electronic computer, and the data were analyzed with Image-Plus software.
RESULTS: A significant collagen deposition and rearrangement of the parenchyma were noted in liver tissue of CCl4-treated rats. There were lots of pseudolobule in liver tissue. The semiquantitative histological scores and average area of collagen were significantly increased when compared with control rats (2.1 ± 0.3 vs 3.6 ± 0.8, 74.82 ± 21.51 μm2vs 290.86 ± 89.37 μm2, both P < 0.05). Compared with control group, the expressions of ROCKⅠ, ROCKⅡ and ROCKⅠmRNA, ROCKⅡmRNA were decreased significantly in salidroside group (0.203 ± 0.068 vs 0.357 ± 0.182, 0.237 ± 0.056 vs 0.394 ± 0.238; 0.197 ± 0.019 vs 0.394 ± 0.238, 0.185 ± 0.031 vs 0.279 ± 0.112, P < 0.05 or 0.01).
CONCLUSION: The expressions of ROCKⅠand ROCKⅡ in liver tissues are inhibited significantly with salidroside treatment. Salidroside could interfere with the signal transduction of Rho-ROCK pathway and then inhibit liver fibrosis in rats.
- Citation: Wu XL, Zeng WZ, Jiang MD, Qin JP, Xu H, Wang Z. Effects of salidroside on expression of ROCK in rats with liver fibrosis. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 765-769
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/765.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.765
肝纤维化是多种慢性肝脏疾病发展至肝硬化的必经之路, 肝硬化病变不可逆, 而肝纤维化则可能逆转, 因此, 积极地防治肝纤维化具有极为重要的临床意义, 寻找切实有效的干预肝纤维化药物是目前肝病领域研究的难点和热点[1-2]. 红景天具有抗氧化、抑制自由基形成、保护肝细胞、调节免疫等多种功效, 大量的前期实验表明红景天具有良好的干预CCl4诱导的动物肝纤维化作用[3-5]. 本实验研究红景天的主要单体成分-红景天甙对CCl4诱导的肝纤维化大鼠肝组织Rho相关卷曲螺旋形成蛋白激酶(rho associated coiled coil forming protein kinase, ROCK)基因表达与胶原沉积的影响, 从分子水平进一步探讨红景天甙干预实验性大鼠肝纤维化的机制.
健康♂SD大鼠质量150±10 g, 购自华西医科大学实验动物中心; 化学纯CCl4(成都联合化工试剂研究所), 红景天甙(纯度99%, 昆明同持医药有限公司, 批号2003011016), ROCKⅠ、Ⅱ mRNA探针及原位杂交试剂盒(上海申能生物工程公司), 山羊抗大鼠ROCKⅠ、ROCKⅡ多克隆抗体(美国Santa Cruz生物工程公司), 免疫组化试剂盒(武汉博士德生物工程公司).
健康♂SD大鼠90只随机分为3组: 正常对照组(C组)10只, 红景天甙干预组(T组)40只, 模型组(M组)40只, 各组间暴露因素无差别. 用300 mL/L CCl4石蜡油溶液, 剂量3 mL/kg, 每周2次sc, 共8 wk诱导大鼠肝纤维化. 干预组大鼠在造模的同时给予100 g/L红景天甙灭菌水溶液ip, 5 mg/kg, 每周2次共8 wk, 模型组在造模同时仅给与生理盐水ip, 对照组予等量石蜡油sc和生理盐水ip处理. 各组动物在最后一次注射后48 h处死, 取肝组织以中性甲醛溶液固定、石蜡包埋, 多聚赖氨酸涂布的载玻片制作5 μm组织切片, 进行HE染色和Masson胶原染色作组织病理学检查; 免疫组织化学(immunohistochemistry, IH)方法检测ROCKⅠ、Ⅱ蛋白表达水平, 原位杂交法(in situ hybridization, ISH)检测ROCKⅠ、Ⅱ mRNA表达水平, 检测步骤参考试剂说明书进行. ROCKⅠ mRNA探针序列(5'→3'): Digoxin-GGT AAG TAT CTA CGA TTG CTA TAA TAT GTA AAT CCT(1185-1220 bp, GC% = 30.56); ROCKⅡ mRNA探针序列(5'→3'): Digoxin-CAA TAA CTT TTA CAA CAT CAT AGT CTT CCG CTT(263-295 bp, GC% = 30.30), 均以地高辛标记探针, 辣根过氧化物酶搭桥, DAB显色, 显微镜下观察结果. 胶原纤维染色、ROCKⅠ、Ⅱ表达水平的ISH, IH检测结果均使用日本Nikon TE2000-H倒置显微镜采集图像, 美国Image-Plus专业图像分析软件进行数据采集和分析.
统计学处理 胶原面积、IH, ISH表达结果均以mean±SD表示, 组间比较采用SPSS10.0统计软件进行t检验.
肝脏组织HE显示, CCl4 sc使大鼠肝脏结构破坏明显, 肝细胞脂肪变性、坏死, 间质炎性细胞浸润, 胶原纤维显著增生, 组织学积分高达3.6±0.8, 红景天甙干预性治疗组肝脏病理损害较轻微, 组织学积分2.1±0.3. 胶原染色结果显示, 正常肝组织仅于中央静脉周围显示少量蓝色纤维, 为中央静脉的结缔组织着色, 肝细胞索显示为橘红色, 显色对比鲜明, 计算胶原面积仅为56.12±21.45 μm2; CCl4 sc使大鼠肝脏胶原沉积量显著增加, 染成蓝色的胶原纤维间隔粗大, 胶原面积增加至290.86±89.37 μm2, 与正常大鼠比较差异非常显著(P<0.01); 红景天甙干预组大鼠肝脏胶原面积减少为74.82±21.51 μm2, (P<0.05 vs 模型组), 表明红景天甙干预性治疗能够使大鼠肝脏胶原沉积减少, 肝纤维化明显减轻(表1).
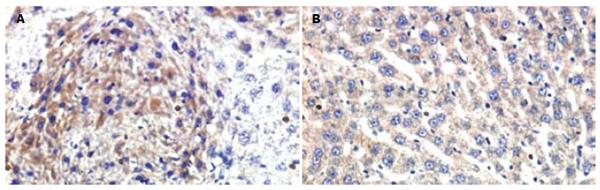
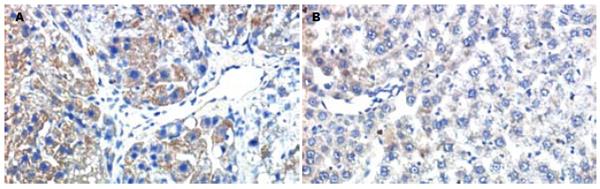
免疫组化检测显示, ROCKⅠ、ROCKⅡ在正常大鼠肝脏仅有少许间质细胞显示微弱阳性结果, CCl4 sc使大鼠肝脏ROCKⅠ、Ⅱ表达明显增加, 间质细胞和肝细胞均有表达, 计算机图像分析其A值为0.62±0.23, 而红景天甙干预性治疗使大鼠肝组织ROCKⅠ、Ⅱ表达A值下降为0.18±0.03, 与模型组比较差异显著(P = 0.026, P<0.05, 表2, 图1).
原位杂交检测表明, 空白对照组大鼠肝脏ROCKⅠ、ROCKⅡ mRNA表达水平低下, 显色信号微弱; CCl4 sc使大鼠肝脏ROCKⅠ、ROCKⅡ mRNA表达明显增加, A值分别为0.327±0.216, 0.279±0.112, 棕黄色的阳性颗粒主要定位于肝实质细胞和间质细胞的胞质, 且着色深、表达强度高; 红景天甙干预性治疗使ROCKⅠ、ROCKⅡ mRNA表达水平明显下降, 计算机图像分析其A值分别为0.197±0.019, 0.185±0.031(P = 0.00012, P<0.01, 表2, 图2).
Rho-ROCK信号通路的关键分子包括Rho、GTP酶、ROCK和肌球蛋白磷酸酶. Rho属于小G蛋白家族, 有RhoA、RhoB、RhoC、RhoE等成员, 与G蛋白一样类似分子按钮在GTP结合(活化)状态与GDP结合(失活)状态之间转换, 触发下游激酶的级联反应而发挥生物学效应. ROCK属于丝氨酸/苏氨酸蛋白激酶, 是Rho-ROCK信号通路下游的靶效应分子, 可接受Rho分子传递的活化信号, 发生多个氨基酸位点磷酸化而激活, 并介导下游分子的磷酸化/脱磷酸化反应, 参与平滑肌运动、胶原纤维合成等生物效应, 与哮喘、高血压、动脉硬化、肿瘤浸润与转移以及多种器官纤维化等疾病密切相关[1-9]. 研究发现, 特异性ROCK阻断剂Y-27632能够明显抑制肝星状细胞活化, 具有抗大鼠肝纤维化作用[10-20]. 对Rho-ROCK信号通路及其关键分子表达状况的深入研究不仅有助于进一步阐明肝纤维化发病的分子机制, 也为肝纤维化的防治研究提供了一个新的途径[21-25].
红景天具有抗氧化、抑制自由基形成等功效, 在抗缺氧、抗疲劳、调节免疫、抗缺血等方面广为应用. 前期的研究证实, 红景天能保护肝细胞、减少肝脏胶原合成, 有效地抑制CCl4诱导的实验性大鼠肝纤维化[26-27]. 红景天甙是红景天的主要活性成分, 细胞实验显示红景天甙能够抑制肝星状细胞增殖、活化, 减少其合成胶原. 我们以红景天甙溶液腹腔注射干预大鼠肝纤维化, 研究红景天甙干预作用下ROCKⅠ、ROCKⅡ的表达状况, 初步探讨红景天甙对肝纤维化大鼠Rho-ROCK信号通路的干预作用, 结果表明红景天甙能有效抑制CCl4诱导的大鼠肝组织损害和肝脏胶原沉积, 大鼠肝脏胶原平均面积由691 μm2减少为138 μm2(P<0.01); ROCKⅠ蛋白表达A值由62下降为18(P<0.05), ROCKⅡ蛋白表达平均光密度值由0.235下降为0.092(P<0.01); 同时, ROCKⅠmRNA表达A值则由2.86%下降为4.27%(P<0.05), ROCKⅡ mRNA表达A值则由2.86上升为4.27(P<0.05), 表明红景天甙干预性治疗能够有效抑制Rho-ROCK信号转导通路中关键的效应分子ROCKⅠ、ROCKⅡ的基因表达, 减弱Rho-ROCK信号通路介导的肝纤维化信号向细胞内传递及下游靶基因的表达, 该信号转导通路的分子传导细节以及红景天甙对其作用的分子机制有待进一步研究阐明. 相信随着肝纤维化分子机制的深入研究, 人类有望最终攻克肝硬化难题[28-30].
红景天具有抗氧化、抑制自由基形成、保护肝细胞、调节免疫等多种功效, 大量的前期实验表明红景天具有良好的干预CCl4诱导的动物肝纤维化作用.
张晓岚, 教授, 河北医科大学第二医院消化内科; 石统东, 副教授, 重庆医科大学附属第二医院感染病科
Rho-ROCK信号通路是近年研究的热点, 该通路与众多器官的纤维化病变有关, 干预该信号通路可能有助于控制器官纤维化.
研究发现, ROCK特异性阻断剂Y-27632可有效阻止实验性肝纤维化, 为干预该信号通路作为抗肝纤维化新途径提供了理论依据.
本文章是红景天甙干预实验性肝纤维化系列研究的一部分, 其创新之处在于首先采用红景天制剂作为干预肝纤维化的新药物, 且从Rho-ROCK信号通路这一新视角观察其效果, 从而更深入探索红景天制剂干预肝纤维化的分子机制.
红景天制剂干预肝纤维化的研究取得了初步可喜的实验结果, 将来有望开发红景天制剂作为抗肝纤维化的新药物, 具有实际临床应用价值及开发前景.
本研究内容新颖, 对中医药在肝脏纤维化治疗方面有一定的科学意义.
编辑: 李军亮 电编:何基才
| 3. | 孙 骅, 陈 荣华. 小G蛋白Rho/Rock信号转导通路与疾病. 国外医学•儿科学分册. 2004;31:261-263. |
| 9. | 孙 俊萍, 张 娟, 宋 兆峰, 李 晓星, 季 晓平. Rho激酶在乳鼠心肌细胞模拟缺血再灌注损伤细胞凋亡中的作用. 山东大学学报(医学版). 2008;46:498-502. |
| 10. | Wettschureck N, Offermanns S. Rho/Rho-kinase mediated signaling in physiology and pathophysiology. J Mol Med. 2002;80:629-638. [PubMed] [DOI] |
| 11. | Kitamura K, Tada S, Nakamoto N, Toda K, Horikawa H, Kurita S, Tsunematsu S, Kumagai N, Ishii H, Saito H. Rho/Rho kinase is a key enzyme system involved in the angiotensin II signaling pathway of liver fibrosis and steatosis. J Gastroenterol Hepatol. 2007;22:2022-2033. [PubMed] [DOI] |
| 12. | Hennenberg M, Trebicka J, Biecker E, Schepke M, Sauerbruch T, Heller J. Vascular dysfunction in human and rat cirrhosis: role of receptor-desensitizing and calcium-sensitizing proteins. Hepatology. 2007;45:495-506. [PubMed] [DOI] |
| 13. | Hennenberg M, Biecker E, Trebicka J, Jochem K, Zhou Q, Schmidt M, Jakobs KH, Sauerbruch T, Heller J. Defective RhoA/Rho-kinase signaling contributes to vascular hypocontractility and vasodilation in cirrhotic rats. Gastroenterology. 2006;130:838-854. [PubMed] [DOI] |
| 14. | Zhou Q, Hennenberg M, Trebicka J, Jochem K, Leifeld L, Biecker E, Sauerbruch T, Heller J. Intrahepatic upregulation of RhoA and Rho-kinase signalling contributes to increased hepatic vascular resistance in rats with secondary biliary cirrhosis. Gut. 2006;55:1296-1305. [PubMed] [DOI] |
| 15. | Kanno K, Tazuma S, Nishioka T, Hyogo H, Chayama K. Angiotensin II participates in hepatic inflammation and fibrosis through MCP-1 expression. Dig Dis Sci. 2005;50:942-948. [PubMed] [DOI] |
| 16. | Murata T, Arii S, Mori A, Imamura M. Therapeutic significance of Y-27632, a Rho-kinase inhibitor, on the established liver fibrosis. J Surg Res. 2003;114:64-71. [PubMed] [DOI] |
| 17. | Murata T, Arii S, Nakamura T, Mori A, Kaido T, Furuyama H, Furumoto K, Nakao T, Isobe N, Imamura M. Inhibitory effect of Y-27632, a ROCK inhibitor, on progression of rat liver fibrosis in association with inactivation of hepatic stellate cells. J Hepatol. 2001;35:474-481. [PubMed] [DOI] |
| 18. | Tada S, Iwamoto H, Nakamuta M, Sugimoto R, Enjoji M, Nakashima Y, Nawata H. A selective ROCK inhibitor, Y27632, prevents dimethylnitrosamine-induced hepatic fibrosis in rats. J Hepatol. 2001;34:529-536. [PubMed] [DOI] |
| 19. | Kawada N, Seki S, Kuroki T, Kaneda K. ROCK inhibitor Y-27632 attenuates stellate cell contraction and portal pressure increase induced by endothelin-1. Biochem Biophys Res Commun. 1999;266:296-300. [PubMed] [DOI] |
| 20. | Zhang AL, Yang Z, Xiao L, Li DJ, Niu LW. [Regulatory effects of RhoGTPase on transition of liver sinusoidal capillarization: experiment with mice of schistosomal hepatic fibrosis]. Zhonghua Yixue Zazhi. 2007;87:1564-1569. [PubMed] |
| 23. | 苏 明, 万 钧, 黄 志强, 周 宁新, 吴 德斌, 范 上达. 肝星状细胞的激活和Rho-ROCK信号通路在纤维化大鼠小肝移植中的作用. 中华实验外科杂志. 2005;22:1452-1455. |