修回日期: 2009-02-01
接受日期: 2009-02-09
在线出版日期: 2009-03-18
目的: 探讨吡格列酮(pioglitazone, PIO)对SD大鼠非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)形成的干预作用及机制.
方法: ♂SD大鼠72只, 随机分为正常饮食组(NG)、高脂饮食组(HG)和PIO干预组(PIOG)各24只. PIOG喂饲高脂饲料, 并同时予PIO药物灌胃8 wk. 正糖高胰岛素钳夹实验检测IR水平, 放免法和全自动生化仪检测血清生化指标, RT-PCR检测过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor γ, PPARγ)mRNA表达, Western blot检测肝组织c-Jun氨基末端激酶(c-Jun amino-terminal kinase 1, JNK1)和PPARγ蛋白表达.
结果: HG大鼠GIR水平降低和JNK1蛋白表达增高, 均呈明显时间依赖性(均P<0.05); 8 wk末HG大鼠肝细胞出现明显脂肪变性, 与NG相比, 体质量、肝指数, TG、ALT、AST、FFAs、FINS、TNF-α水平明显增高, IR加重, JNK1蛋白表达明显升高, 肝组织PPARγ表达明显降低(TG: 1.23±0.08 vs 0.62±0.12, ALT: 92.80±7.09 vs 51.34±8.12; AST: 153.22±20.65 vs 119.26±13.61; FFAs: 511.94±24.88 vs 335.31±15.71; FINS: 41.23士1.84 vs 22.65士2.25; TNF-α: 1.02±0.12 vs 0.34±0.07, 均P<0.05); 而PIOG大鼠, 上述各项指标均得到明显改善, 但仍不能完全达到NG大鼠水平(均P<0.05).
结论: PIO对于由高脂饮食诱导的NAFLD的形成及其他IR相关疾病有预防作用.
引文著录: 张佳妮, 陈金虎, 谭莺, 刘慧霞. 吡格列酮对SD大鼠非酒精性脂肪肝病形成的预防作用及其机制. 世界华人消化杂志 2009; 17(8): 758-764
Revised: February 1, 2009
Accepted: February 9, 2009
Published online: March 18, 2009
AIM: To explore the prevention effect and mechanism of pioglitazone (PIO) on nonalcoholic fatty liver disease (NAFLD) in rats.
METHODS: Seventy two Sprague-Dawley rats were randomly divided into three groups: normal diet group (NG), high fat diet group (HG) and PIO group (PIOG), with 24 rats in every group. PIOG were fed with high fat diet and PIO for eight weeks. IR was tested by euglycemic-hyperinsulinemic clamp; TG, ALT, AST, FFAs, FINS and TNF-α were tested by biochemistry automatic analyzer or RIA; mRNA expression of peroxisome proliferator-activated receptor (PPARγ) was detected using RT-PCR. The expression of PPARγ and c-Jun amino-terminal kinase 1 (JNK1) were detected by Western blot.
RESULTS: The glucose infusion rate (GIR) decreased and JNK1 increased in HG rats in a time-dependent manner from 1st to 8th week (P < 0.05). Compared with NG, at the end of 8th week, the hepatic steatosis was significant in HG group. The weight, liver index, serum levels of TG, ALT, AST, FFAs, FINS and TNF-α increased, while IR was aggravated. Meanwhile, the JNK1 protein expression in liver tissue was up-regulated, while expression of PPARγ was decreased (TG: 1.23 ± 0.08 vs 0.62 ± 0.12; ALT: 92.80 ± 7.09 vs 51.34 ± 8.12; AST: 153.22 ± 20.65 vs 119.26 ± 13.61; FFAs: 511.94 ± 24.88 vs 335.31 ± 15.71; FINS: 41.23 ± 1.84 vs 22.65 ± 2.25; TNF-α: 1.02 ± 0.12 vs 0.34 ± 0.07, all P < 0.05). In PIOG, all the indexes were improved, but didn't completely return to the same as those of NG group.
CONCLUSION: PIO could prevent NAFLD induced by a high-fat diet and other IR-related diseases.
- Citation: Zhang JN, Chen JH, Tan Y, Liu HX. Preventive effect of pioglitazone against nonalcoholic fatty liver disease in Sprague-Dawley rats and its mechanism. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 758-764
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/758.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.758
随着人们日常膳食中以脂肪为代表的高热量食物成分所占比例明显增加, 非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)的发病率呈逐年上升趋势. 目前发达国家成年人口患病率为20%-30%, 发展中国家人口患病率也明显增加[1-2], 同时在肥胖及2型糖尿病(diabetes mellitus, DM)患者中更高达60%-75%左右. 目前认为NAFLD是代谢综合征(metabolic syndrome, MS)的重要组成部分, 是MS在肝脏的表现[3-5], 他不但使肝脏对其他损伤因素更加易感, 且与MS、DM相关的心脑血管疾病的发生、发展及死亡密切相关[4,6-7]. 因此, NAFLD的高发病率及对人类的危害已成为全球医学关注和研究的热点.
研究表明, NAFLD与胰岛素抵抗(insulin resistance, IR)密切相关, 而IR可能在NAFLD形成中起关键作用[8-10]. 因此, 目前虽无肯定的NAFLD防治方法, 但改善IR可能成为防治NAFLD的一个主要方向[11]. 吡格列酮(pioglitazone, PIO)作为噻唑烷二酮类(thiozolidinediones, TZDs)胰岛素(insulin, INS)增敏剂, 可改善大鼠由高脂饮食喂养所产生的IR, 但具体机制尚不清楚[12]. c-Jun氨基末端激酶(c-Jun amino-terminal kinase, JNK)信号通路是丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)家族中重要的通路[3,13-14], 由肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等炎性因子激活, 对INS信号传导的负向调节起重要作用[15-16]. 而TNF-α主要通过JNK信号通路作用于INS信号通路而产生IR. 据报道TZDs可以同时对抗体内与体外因TNF-α诱导而产生的IR[17-21], 但PIO与JNK有何联系, JNK在NAFLD形成中有何作用尚不完全清楚. 故在本研究中, 我们使用PIO进行干预, 观察其对JNK信号通路、IR和脂代谢的影响, 及其预防NAFLD形成的分子机制, 为NAFLD预防提供新的思路和手段.
SD大鼠72只, 体质量100-120 g, 均为♂. 购自中南大学湘雅医学院实验动物中心. 主要试剂和仪器包括: 凯基全蛋白提取试剂盒(南京凯基生物科技有限公司)、BCA蛋白浓度测定试剂盒(美国Sigma公司)、离心机(德国Eppendoff公司)、蛋白电泳转移槽(美国Biorad公司)、PPARγ抗体(美国CST公司)、JNK1小鼠IgG mAb(美国R&D公司)、驴抗鼠二抗及羊抗兔二抗(美国Sant Cruz公司)、Olympus光学显微镜(日本Olympus公司)、-70℃低温冰箱(德国西门子公司)、ECL发光检测盒(南京凯基生物科技有限公司).
1.2.1 动物模型的建立: 实验大鼠随机分为3组: 正常饮食组(NG)、高脂饮食组(HG)和PIO干预组(PIOG), 每组各24只. NG喂饲普通饲料, 其蛋白质、脂肪、碳水化合物提供能量分别为21.52%, 19.03%, 59.45%; HG及PIOG均喂饲高脂饲料, 其蛋白质、脂肪、碳水化合物提供能量分别为14.81%, 44.84%, 40.35%. 三组分别于1 wk和4 wk末随机抽取6只大鼠, 进行正糖高胰岛素钳夹实验(钳夹实验), 观察其IR情况, 处死后留取肝组织标本作相关检测. 8 wk末从三组中随机抽取6只大鼠, 进行钳夹实验, 其余大鼠抽取门静脉血作相关指标检测, 处死后留取肝组织标本观察病理变化及相关指标检测. PIOG从实验第1 wk开始给予PIO药物ig, 剂量为10 mg/(kg·d), PIO碾成粉末后, 用生理盐水配置成悬浊液, 浓度为10 g/L; NG和HG大鼠用生理盐水作为安慰剂ig, 每天上午9时左右灌胃给药.
1.2.2 血清生化指标检测: 血清甘油三酯(TG)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、空腹血糖(FBS)、游离脂肪酸(FFAs)均使用全自动生化分析仪检测; 空腹胰岛素(FINS)、TNF-α检测采用放免法由全自动放免γ测量仪测定.
1.2.3 病理学检查: 部分新鲜肝组织以100 g/L甲醛溶液固定, 制成石蜡切片, 采用HE染色; 部分制成冰冻切片, 采用苏丹三染色. 均由2个病理科医生在光学显微镜下检查, 作出双盲判断. 每张切片观察5个肝小叶, 以平均每个肝小叶内脂肪变性的肝细胞所占百分比表示肝脏脂肪变性程度. 根据美国肝病协会(AASLD)2002年拟定的NAFLD诊断标准中的组织学诊断标准[22]进行.
1.2.4 IR水平判定: 采用评价IR的金标准即正糖高胰岛素钳夹实验(钳夹实验)[23]评价INS敏感性, 方法为: 大鼠均禁食过夜12 h, 用戊巴比妥钠1 mg/kg ip麻醉后, 进行颈动脉和颈静脉插管并留置. INS和葡萄糖分别用两个微电脑数字式微量泵由颈静脉泵入, 血液标本由颈动脉导管获取. INS输注率为10.0 mU/(kg·min), 从颈动脉取血, 用微型血糖仪检测血糖值, 维持稳态血糖在5.0±0.5 mmol/L的范围内, 持续上述过程达2 h完成. 钳夹实验结束后, 计算灌流2 h的葡萄糖输注率(glucose infusion rate, GIR), 判断大鼠的INS敏感性.
1.2.5 RT-PCR检测肝组织PPARγ mRNA表达: 使用TRIzol试剂盒从SD大鼠肝组织中提取总RNA, 逆转录获得cDNA. PPARγ mRNA上游引物5'-CCTTGCTGTGGGGATGTCTC-3', 下游引物5'-CAGCGGGAAGGACTTTATGTATGA-3', 产物为175 bp; GAPDH mRNA上游引物5'-TTCTTGTGCAGTGCCAGCCTCGTC-3', 下游引物5'-GCCGTTGAACTTGCCGTGGGTAGA-3', 产物为203 bp. 取1.5 μL cDNA和相应引物在Taq合成酶作用下扩增, 先预变性4 min, 共扩增35个循环, 每个循环包括94℃变性40 s→58℃退火1 min→72℃延伸1 min, 最后在72℃再延伸10 min.PCR产物通过含溴化乙锭的琼脂糖凝胶电泳, 应用Gel Doc2000凝胶分析系统扫描分析, 通过软件分析光密度值.
1.2.6 Western blot检测PPARγ和JNK1蛋白表达: 取肝右叶组织100 mg, 使用凯基全蛋白提取试剂盒4℃匀浆后提取胞质蛋白, BCA法测定蛋白浓度. 蛋白变性后, 行聚丙烯酰胺凝胶电泳, 转移至PVDF膜, 50 g/L脱脂奶粉室温封闭2 h, 分别加入PPARγ抗体(1:750)和JNK1抗体(1:500), 室温作用2 h, 洗涤后加入辣根过氧化酶结合的抗鼠IgG(1:4000), 作用1 h再洗膜. 然后化学发光试剂检测, X光片显影. 定量分析采用分子生物学图像分析系统测定各目的带积分灰度值, 所测结果为扣除背景的积分吸光度.
统计学处理 计量资料均以mean±SD表示, 采用秩和检验, P<0.05有统计学差异. 应用SPSS12.0统计软件进行数据处理分析.
8 wk末, 与NG相比, HG大鼠的TG, ALT, AST, FFAs, FINS和TNF-α均明显增高, 比较有显著性差异(均P<0.05); 使用PIO干预组, 与HG相比, TG, ALT, AST, FFAs, FINS和TNF-α均明显降低, 但仍高于NG, 两两比较均有显著性差异(均P<0.05); HG, NG和PIOG大鼠的FBS相近, 两两比较均无显著性差异(P>0.05,表1).
| 分组 | TG(mmol/L) | ALT(U/L) | AST(U/L) | TNF-α(μg/L) | FFAs(U/mg) | FBS(mmol/L) | FINS(mU/L) |
| NG | 0.62±0.12 | 51.34±8.12 | 119.26±13.61 | 0.34±0.07 | 335.31±15.71 | 4.58±0.56 | 22.65±2.25 |
| HG | 1.23±0.08a | 92.80±7.09a | 153.22±20.65a | 1.02±0.12a | 511.94±24.88a | 5.05±0.74 | 41.23±1.84a |
| PIOG | 0.79±0.09ac | 60.12±8.01ac | 130.24±11.57ac | 0.73±0.08ac | 401.26±19.39ac | 4.58±0.87 | 25.08±2.52ac |
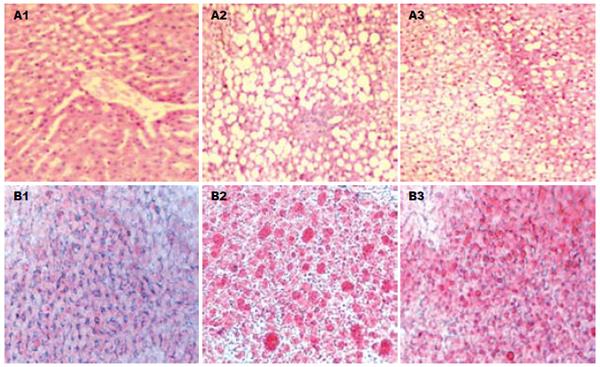
8 wk末, 光镜下HE染色可见NG肝索结构正常, 无肝细胞脂肪变性和炎症细胞浸润; HG出现以大泡性为主的脂肪变性, 胞质中有大量脂滴空泡, 核居边, 偶可见小叶内炎症细胞浸润; 而PIOG偶可见散在脂肪变性, 但无炎症细胞浸润. 苏丹三染色见HG肝细胞内有大量橘红色脂滴, 肝小叶内脂肪变性的肝细胞所占比例为40.27%±3.62%, 达到了脂肪肝的标准; 而PIOG仅可见散在分布的橘红色脂滴, 未达到脂肪肝标准(图1).
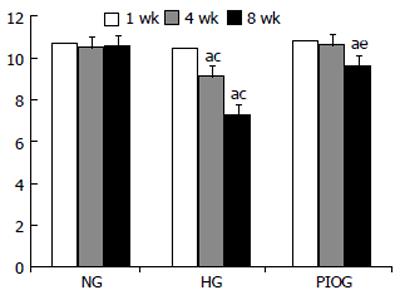
HG大鼠1、4、8 wk GIR[mg/(kg·min)]水平随喂养时间延长而逐渐降低, 两两比较有显著性差异(均P<0.05); 1 wk末, 三组大鼠GIR水平比较无显著性差异; 4 wk末, 与NG和PIOG比较, HG大鼠GIR水平降低, 比较有显著性差异(P<0.05), 而NG和PIOG大鼠GIR水平无明显下降, 比较无显著性差异; 8 wk末, 与NG和PIOG比较, HG大鼠GIR水平明显降低, 比较有显著性差异(P<0.05), 而PIOG大鼠GIR水平较HG增高, 但低于NG, 两两比较均有显著性差异(P<0.05, 图2).
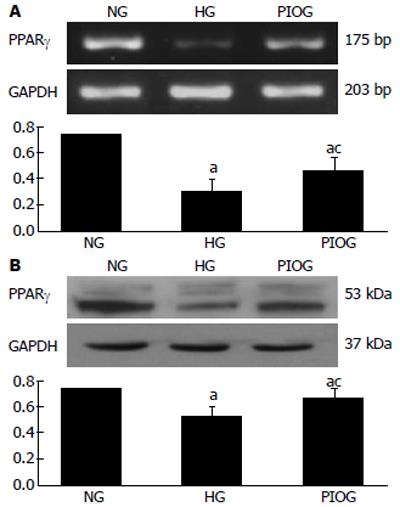
HG大鼠8 wk末与NG比较, PPARγ mRNA和蛋白表达明显减低, 比较有显著性差异(P<0.05), PIO干预能明显增强高脂饮食引起的PPARγ mRNA和蛋白表达, 但仍低于NG, 两两比较有显著性差异(P<0.05, 图3).
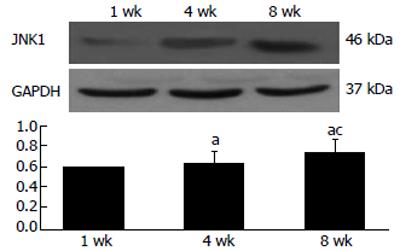
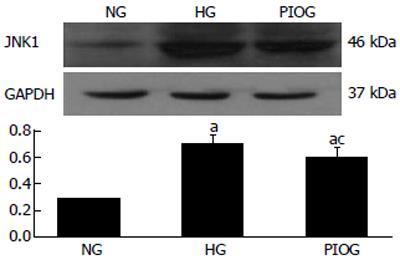
HG大鼠1, 4, 8 wk JNK1蛋白表达随喂养时间的延长而逐渐增强, 两两比较有显著性差异(均P<0.05); 8 wk末, 与NG和PIOG比较, HG大鼠肝组织JNK1蛋白表达明显增高, 比较有显著性差异(P<0.05); 而PIO干预后, JNK1蛋白表达较HG明显降低, 但仍高于NG, 两两比较有显著性差异(P<0.05, 图4-5).
本研究通过高脂饲料饲养SD大鼠8 wk, 成功构建了SD大鼠NAFLD模型. 该模型的代谢特征为IR、高INS血症、高脂血症、血清转氨酶升高. 与其他研究脂肪肝的动物模型(如先天性、转基因、化学物质诱导等方法[24-28])相比, 高脂饮食诱导NAFLD大鼠模型具备人类脂肪肝特征, 造模方法简便易行, 模型形成率高. 故本研究采用的是单纯高脂饮食来构建动物NAFLD模型[29].
研究表明: NAFLD的发生、发展是由于"二次打击"所引起[30-32], 而IR贯穿于这"二次打击"的始终, 并起关键作用[28]. IR又与TNF-α产生异常及脂代谢失调等相互作用促进了NAFLD的发生发展. 因此, 构建具有IR特征的NAFLD动物模型也就显得尤为重要. 研究结果显示: INS代谢信号通路的信号转导过程中任何环节发生障碍均可引起IR, 而绝大多数IR是INS与INS受体结合后信号传导过程发生障碍, 即INS受体后缺陷的结果. 胰岛素受体底物(insulin receptor substrate, IRSs)是INS敏感组织中一组与INS生物效应调节关系极为密切的信号蛋白, 其中IRS-1丝氨酸307位点的过度磷酸化对INS信号传递发挥着极为重要的负性调控作用[33-35]. 但IRS-1丝氨酸307位点的磷酸化水平受到JNK的调控. JNK是一种重要的蛋白激酶, 他可以被TNF-α, FFAs等多种因素激活.研究表明, JNK信号通路在NAFLD形成中起重要作用. 由于IRSs蛋白分子含有JNK1结合基本序列, 故增高的JNK1可与IRS1蛋白结合, 并诱导IRS-1丝氨酸307位点的磷酸化水平增高, 抑制IRSs正常的酪氨酸磷酸化, 干扰INS信号经INS受体/IRSs/PI3-K通路下传至效应器, 进而诱发IR[36-37]. 我们的研究发现, 在高脂饮食诱导NAFLD动物模型至4 wk时, JNK1蛋白表达就已增高, IR也已出现, 且JNK1蛋白表达的增强与IR的加重均呈明显的时间依赖性. 同时我们也发现, 使用PIO对高脂喂养大鼠进行干预, 4 wk时JNK1的表达并没有明显的增强, IR也没有出现, 而即使到8 wk末, 该组大鼠IR程度仍明显较HG大鼠轻, 虽然肝组织有肝脂肪变性, 但仍未达到NAFLD诊断标准. 以上结果说明, 高脂饮食可使JNK1蛋白表达增强, 而增强的JNK1通过负向调控INS信号转导通路, 可诱导IR的产生. 而PIO可以阻止由高脂饮食喂养导致的JNK1蛋白表达增强, 从而抑制IR, 最终延缓NAFLD的发生.
目前认为TNF-α是引起机体的IR和介导肝损伤的主要细胞因子, 并且在NAFLD的发病中起重要作用[21,38]. 而TNF-α、FFAs和脂代谢异常主要通过作用于细胞内JNK通路, 引起肝脏JNK1表达增高, 减弱INS的生理作用, 导致IR. 在本实验NAFLD SD大鼠血清中, TNF-α, FFAs和血脂水平均升高, 证实TNF-α, FFAs和脂代谢参与了NAFLD的形成, 推测其可能机制为: TNF-α和FFAs的表达增加及脂代谢的异常, 激发了细胞内JNK通路, 导致JNK1蛋白表达明显增高, 进而产生和加重了IR. 而8 wk末, 尽管PIOG大鼠血清TNF-α, FFAs和血脂水平较NG大鼠增高, 但明显低于HG大鼠, 证明由于PIO的干预, 使TNF-α, FFAs和脂代谢异常得到了部分改善.
PPARγ是脂肪细胞基因表达和INS细胞内信号传递的主要调节者, 参与脂肪细胞分化和糖脂代谢调节, 与IR密切相关. Kawaguchi et al[17]在食物诱导的肥胖伴肝纤维化大鼠中发现, 肝脏PPARγ表达及活性均降低, PPARγ的高效激动剂PIO治疗不仅改善了肝纤维化, 还提高了肝脏PPARγ的表达及活性. 我们的研究显示, 高脂饮食诱导大鼠NAFLD模型中, 肝组织PPARγ mRNA和蛋白表达均明显减低, 而使用PIO能激活肝组织PPARγ, 使PPARγ表达增强, 与Kawaguchi et al的结果一致. 研究显示, TZDs对INS信号通路的调节作用主要通过JNK信号通路发挥作用[39]. 在遗传和饮食诱导的肥胖和糖尿病小鼠模型中, 与TZDs的作用相似, JNK抑制剂能够降低血糖及血浆INS水平, 改善糖耐量异常[40-41]; 而对敲除了JNK基因的ob/ob JNK-/-小鼠原代脂肪细胞的研究发现, 罗格列酮并不能改善糖的摄取, 证实TZDs的降糖作用主要通过JNK通路发挥作用, 这与我们的实验结果相一致, 即本研究使用PIO干预后, PPARγ的表达上调, 并通过拮抗JNK1的蛋白表达, 改善了IR, 病理学证实延缓了NAFLD的发生. 但在我们的实验中, 高脂喂养大鼠8 wk并未对血糖产生明显影响, 其原因有待进一步研究阐明.
近年来国内外对PIO抗肝组织脂肪变性和炎症细胞浸润作用的研究进一步深入, 其作用机制主要包括: 特异性地作用于PPARγ, 调节糖脂代谢, 进而改善IR[19]; 改善脂肪组织的INS敏感性, 减轻肝细胞的脂肪沉积; 减少肝脏氧自由基的产生, 抑制脂质过氧化, 减轻肝组织炎症细胞浸润及肝细胞坏死, 延缓肝纤维化[19-20]. 本实验不但进一步证实了高脂饮食能减低肝组织PPARγ的表达, 使用PIO干预, 能激活肝组织PPARγ, 且探讨了PIO预防NAFLD形成的可能机制为: PIO的干预能激活肝组织PPARγ的表达, 降低TNF-α和FFAs水平, 改善脂代谢异常, 并通过JNK信号通路, 拮抗JNK1蛋白表达, 调控INS信号通路, 从而达到延缓或防止IR的产生及肝组织脂肪变性, 进而延缓NAFLD的发生. 总之, PIO对NAFLD的作用是多方面的, 而通过进一步研究PIO对NAFLD发生和发展中INS信号通路的影响的研究, 必定能为IR及相关疾病的防治开辟新的思路.
在全球, 非酒精性脂肪肝病(NAFLD)的发病率不断增高且起病渐趋低龄化, 已成为发达国家和我国富裕地区慢性肝病的首要病因.目前认为NAFLD是MS在肝脏的表现, 可导致肝硬化、肝癌、肝功能衰竭. NAFLD的高发病率及对人类的危害已成为全球医学关注和研究的热点.
高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科; 沈薇, 教授, 重庆医科大学附属第二医院消化内科
研究表明, NAFLD与IR密切相关, 而IR可能在NAFLD形成中起关键作用. 因此, 目前虽无肯定的NAFLD防治方法, 但改善IR可能成为防治NAFLD的一个主要方向. 吡格列酮可改善大鼠由高脂饮食喂养所产生的IR, 但具体机制尚不清楚.
本研究旨在使用PIO对由高脂饮食诱导的NAFLD进行干预, 观察其对JNK信号通路、IR和糖脂代谢的影响, 及其预防NAFLD形成的分子机制. 研究表明, 使用PIO预防NAFLD形成的可能机制为: 激活肝组织PPARγ的表达, 降低TNF-α和FFAs水平, 改善脂代谢异常, 并通过JNK信号通路, 拮抗JNK1蛋白表达, 调控INS信号通路, 从而延缓或防止IR的产生, 进而延缓NAFLD的发生.
本实验通过多角度探讨PIO对于由高脂饮食诱导的NAFLD的形成的预防作用, 为进一步研究PIO对NAFLD发生和发展中INS信号通路的影响, 及IR和相关疾病的防治开辟了新的思路.
本文选题较新颖, 从体内外实验探讨吡格列酮对SD大鼠非酒精性脂肪肝病形成的预防作及机制, 值得临床医生阅读.
编辑: 李军亮 电编:何基才
| 1. | Socha P, Wierzbicka A, Neuhoff-Murawska J, Włodarek D, Podleśny J, Socha J. Nonalcoholic fatty liver disease as a feature of the metabolic syndrome. Rocz Panstw Zakl Hig. 2007;58:129-137. [PubMed] |
| 2. | Preiss D, Sattar N. Non-alcoholic fatty liver disease: an overview of prevalence, diagnosis, pathogenesis and treatment considerations. Clin Sci (Lond). 2008;115:141-150. [PubMed] [DOI] |
| 3. | Boppidi H, Daram SR. Nonalcoholic fatty liver disease: hepatic manifestation of obesity and the metabolic syndrome. Postgrad Med. 2008;120:E01-E07. [PubMed] [DOI] |
| 4. | Khashab MA, Liangpunsakul S, Chalasani N. Nonalcoholic fatty liver disease as a component of the metabolic syndrome. Curr Gastroenterol Rep. 2008;10:73-80. [PubMed] [DOI] |
| 5. | Hjelkrem MC, Torres DM, Harrison SA. Nonalcoholic fatty liver disease. Minerva Med. 2008;99:583-593. [PubMed] |
| 6. | Abel T, Fehér J. [Non-alcoholic fatty liver disease and cardiovascular risk]. Orv Hetil. 2008;149:1299-1305. [PubMed] [DOI] |
| 7. | Sass DA, Chang P, Chopra KB. Nonalcoholic fatty liver disease: a clinical review. Dig Dis Sci. 2005;50:171-180. [PubMed] [DOI] |
| 8. | Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, Romanelli AJ, Shulman GI. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004;279:32345-32353. [PubMed] [DOI] |
| 9. | Neuschwander-Tetri BA, Caldwell SH. Nonalcoholic steatohepatitis: summary of an AASLD Single Topic Conference. Hepatology. 2003;37:1202-1219. [PubMed] [DOI] |
| 10. | Choudhury J, Sanyal AJ. Insulin resistance and the pathogenesis of nonalcoholic fatty liver disease. Clin Liver Dis. 2004;8:575-594, ix. [PubMed] [DOI] |
| 11. | Bugianesi E, Zannoni C, Vanni E, Marzocchi R, Marchesini G. Non-alcoholic fatty liver and insulin resistance: a cause-effect relationship? Dig Liver Dis. 2004;36:165-173. [PubMed] [DOI] |
| 12. | Seo YS, Kim JH, Jo NY, Choi KM, Baik SH, Park JJ, Kim JS, Byun KS, Bak YT, Lee CH. PPAR agonists treatment is effective in a nonalcoholic fatty liver disease animal model by modulating fatty-acid metabolic enzymes. J Gastroenterol Hepatol. 2008;23:102-109. [PubMed] |
| 13. | Savage DB, Petersen KF, Shulman GI. Mechanisms of insulin resistance in humans and possible links with inflammation. Hypertension. 2005;45:828-833. [PubMed] [DOI] |
| 14. | Chang L, Karin M. Mammalian MAP kinase signalling cascades. Nature. 2001;410:37-40. [PubMed] [DOI] |
| 15. | Arner P. Insulin resistance in type 2 diabetes -- role of the adipokines. Curr Mol Med. 2005;5:333-339. [PubMed] [DOI] |
| 16. | Ruan H, Lodish HF. Insulin resistance in adipose tissue: direct and indirect effects of tumor necrosis factor-alpha. Cytokine Growth Factor Rev. 2003;14:447-455. [PubMed] [DOI] |
| 17. | Kawaguchi K, Sakaida I, Tsuchiya M, Omori K, Takami T, Okita K. Pioglitazone prevents hepatic steatosis, fibrosis, and enzyme-altered lesions in rat liver cirrhosis induced by a choline-deficient L-amino acid-defined diet. Biochem Biophys Res Commun. 2004;315:187-195. [PubMed] [DOI] |
| 18. | Inoue M, Ohtake T, Motomura W, Takahashi N, Hosoki Y, Miyoshi S, Suzuki Y, Saito H, Kohgo Y, Okumura T. Increased expression of PPARgamma in high fat diet-induced liver steatosis in mice. Biochem Biophys Res Commun. 2005;336:215-222. [PubMed] [DOI] |
| 19. | Diehl AM. Nonalcoholic steatosis and steatohepatitis IV. Nonalcoholic fatty liver disease abnormalities in macrophage function and cytokines. Am J Physiol Gastrointest Liver Physiol. 2002;282:G1-G5. [PubMed] [DOI] |
| 20. | Froh M, Thurman RG, Wheeler MD. Molecular evidence for a glycine-gated chloride channel in macrophages and leukocytes. Am J Physiol Gastrointest Liver Physiol. 2002;283:G856-G863. [PubMed] [DOI] |
| 21. | Diehl AM. Tumor necrosis factor and its potential role in insulin resistance and nonalcoholic fatty liver disease. Clin Liver Dis. 2004;8:619-638, x. [PubMed] [DOI] |
| 22. | Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [PubMed] [DOI] |
| 23. | Kraegen EW, James DE, Bennett SP, Chisholm DJ. In vivo insulin sensitivity in the rat determined by euglycemic clamp. Am J Physiol. 1983;245:E1-E7. [PubMed] |
| 24. | Lin HZ, Yang SQ, Chuckaree C, Kuhajda F, Ronnet G, Diehl AM. Metformin reverses fatty liver disease in obese, leptin-deficient mice. Nat Med. 2000;6:998-1003. [PubMed] [DOI] |
| 25. | Yin HQ, Kim M, Kim JH, Kong G, Lee MO, Kang KS, Yoon BI, Kim HL, Lee BH. Hepatic gene expression profiling and lipid homeostasis in mice exposed to steatogenic drug, tetracycline. Toxicol Sci. 2006;94:206-216. [PubMed] [DOI] |
| 26. | Chung H, Hong DP, Kim HJ, Jang KS, Shin DM, Ahn JI, Lee YS, Kong G. Differential gene expression profiles in the steatosis/fibrosis model of rat liver by chronic administration of carbon tetrachloride. Toxicol Appl Pharmacol. 2005;208:242-254. [PubMed] [DOI] |
| 27. | Teramoto K, Bowers JL, Khettry U, Palombo JD, Clouse ME. A rat fatty liver transplant model. Transplantation. 1993;55:737-741. [PubMed] [DOI] |
| 28. | Blanc MC, Moinard C, Béziel A, Darquy S, Cynober L, De Bandt JP. Arginine and glutamine availability and macrophage functions in the obese insulin-resistant Zucker rat. J Cell Physiol. 2005;202:153-159. [PubMed] [DOI] |
| 29. | Cha MC, Chou CJ, Boozer CN. High-fat diet feeding reduces the diurnal variation of plasma leptin concentration in rats. Metabolism. 2000;49:503-507. [PubMed] [DOI] |
| 30. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 31. | Blechacz B, Stremmel W. [NASH -- nonalcoholic steatohepatitis]. Z Gastroenterol. 2003;41:77-90. [PubMed] [DOI] |
| 32. | Chitturi S, Farrell GC. Etiopathogenesis of nonalcoholic steatohepatitis. Semin Liver Dis. 2001;21:27-41. [PubMed] [DOI] |
| 33. | Burén J, Liu HX, Lauritz J, Eriksson JW. High glucose and insulin in combination cause insulin receptor substrate-1 and -2 depletion and protein kinase B desensitisation in primary cultured rat adipocytes: possible implications for insulin resistance in type 2 diabetes. Eur J Endocrinol. 2003;148:157-167. [PubMed] [DOI] |
| 34. | Burén J, Liu HX, Jensen J, Eriksson JW. Dexamethasone impairs insulin signalling and glucose transport by depletion of insulin receptor substrate-1, phosphatidylinositol 3-kinase and protein kinase B in primary cultured rat adipocytes. Eur J Endocrinol. 2002;146:419-429. [PubMed] [DOI] |
| 35. | Greene MW, Garofalo RS. Positive and negative regulatory role of insulin receptor substrate 1 and 2 (IRS-1 and IRS-2) serine/threonine phosphorylation. Biochemistry. 2002;41:7082-7091. [PubMed] [DOI] |
| 36. | Taniguchi CM, Emanuelli B, Kahn CR. Critical nodes in signalling pathways: insights into insulin action. Nat Rev Mol Cell Biol. 2006;7:85-96. [PubMed] [DOI] |
| 37. | Aguirre V, Uchida T, Yenush L, Davis R, White MF. The c-Jun NH(2)-terminal kinase promotes insulin resistance during association with insulin receptor substrate-1 and phosphorylation of Ser(307). J Biol Chem. 2000;275:9047-9054. [PubMed] [DOI] |
| 38. | Hui JM, Hodge A, Farrell GC, Kench JG, Kriketos A, George J. Beyond insulin resistance in NASH: TNF-alpha or adiponectin? Hepatology. 2004;40:46-54. [PubMed] [DOI] |
| 39. | Díaz-Delfín J, Morales M, Caelles C. Hypoglycemic action of thiazolidinediones/peroxisome proliferator-activated receptor gamma by inhibition of the c-Jun NH2-terminal kinase pathway. Diabetes. 2007;56:1865-1871. [PubMed] [DOI] |
| 40. | Bennett BL, Satoh Y, Lewis AJ. JNK: a new therapeutic target for diabetes. Curr Opin Pharmacol. 2003;3:420-425. [PubMed] [DOI] |