修回日期: 2009-01-24
接受日期: 2009-02-09
在线出版日期: 2009-02-28
目的: 建立肠道病毒71型(EV71)的空班形成方法, 并比较BGM、VeroE6、MRC-5、HEp-2及A549五种细胞对EV71病毒的敏感性.
方法: 将不同稀释浓度的EV71病毒接种到五种细胞, 分别覆盖三种不同的培养物, 孵育一定时间后固定染色, 比较出斑效果; 以新建空斑形成法测定五种细胞感染EV71 24-96 h后培养液滴度, 计算空班形成单位(pfu).
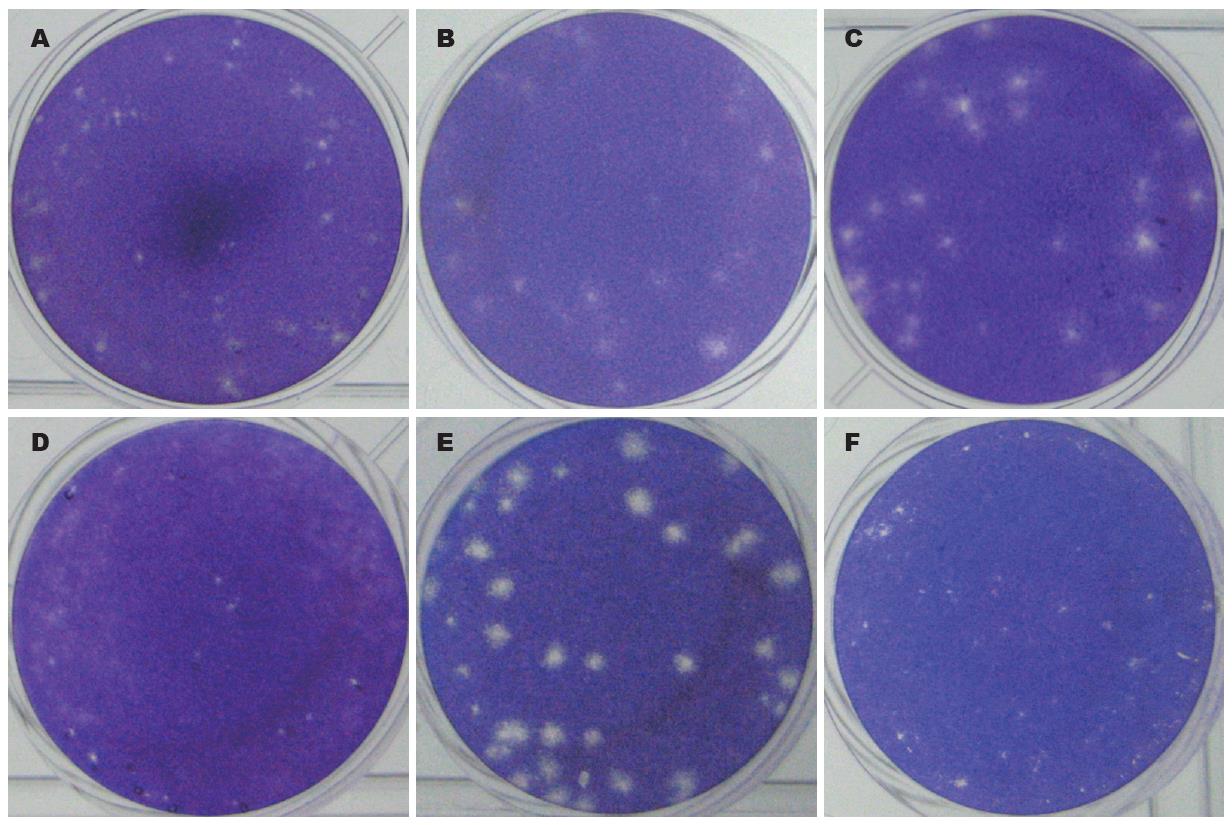
结果: 在五种细胞中, BGM和VeroE6覆盖琼脂糖凝胶的EV71可形成针尖样空班; 覆盖1%甲基纤维素的EV71可形成直径大约1 mm圆形或类圆形空班, 形成空斑单位最多, 病毒滴度分别达2.87×109 pfu/L和1.65×109 pfu/L; 覆盖1.2%艾维素的EV71在BGM细胞中可形成直径大约0.5 mm类圆形空斑, 在VeroE6细胞中形成针尖样空斑; 其他细胞均形成针尖样空斑.
结论: 空斑形成方法可对肠道病毒进行定量检测, BGM及VeroE6细胞为EV71的敏感细胞.
引文著录: 杨子峰, 秦笙, 莫自耀, 关文达, 王玉涛. 应用空斑形成法检测五种不同细胞对肠道病毒71型的敏感性. 世界华人消化杂志 2009; 17(6): 573-577
Revised: January 24, 2009
Accepted: February 9, 2009
Published online: February 28, 2009
AIM: To establish the plaque assay for the quantitative detection of enterovirus 71 (EV71) and to compare sensitivity of buffalo green monkey (BGM) cells, vero E6 cells, MRC-5 cells, A549 and HEp-2 cells to it.
METHODS: BGM cells and vero cells were transinfected with EV-71. Then the plates were covered with three kinds of overlay medium (i: 0.6% Agarose, ii: 1% methycellulose, iii: 1.2% Avicellulose) and incubated for 3 to 4 days. The plaques were stained, and the number of plaques was counted. The supernatants were harvested at 24-96 hours after infection for plaque assay, and this technique was used to measure the five cell lines simultaneously.
RESULTS: The plaques appeared as clear cycles (range 0.5 to 1 mm) in BGM and vero E6 cells covered with 1% methycellulose and 1.2% avicellulose, whereas EV71 produced the pinpoint plaques covered with 0.6% agarose. The titer of virus ranged from 1.65 × 109 pfu/L to 2.87 × 109 pfu/L.
CONCLUSION: The techniques may benefit the quantitative detection of EV71. Furthermore, it indicates that BGM cells and vero E6 cells constitute a valuable and sensitive cell line system for enterovirus 71.
- Citation: Yang ZF, Qin S, Mo ZY, Guan WD, Wang YT. Detection of five different cells' sensitivities to enterovirus 71 using plaque forming assay. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 573-577
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/573.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.573
肠道病毒71型(enterovirus71, EV71)是小RNA病毒科肠道病毒属(enteovirus)成员, 其感染主要引起患者的手足口病(hand-foot-and mouth disease, HFMD)[1]. 近年来, EV71病毒的流行在亚太地区呈上升趋势[2], 尤其是2008年我国安徽阜阳EV71疫情的爆发及蔓延[3], 再度引起医学界的高度重视. 关于肠道病毒定量检测, 传统的病毒滴定方法主要是通过观察被病毒感染细胞产生的细胞病变或血凝滴度进行定量检测, 但这类方法易因实验者的技术水平和经验的差异造成判断的主观性. 检测病毒核酸的实时定量PCR方法有快速、敏感的优点, 但不能提示病毒感染力[2].
空斑形成试验是对病毒感染力精确定量的有效方法, 本研究针对EV71病毒建立空班形成试验方法, 用于比较不同细胞对EV71的敏感性, 为临床实验室选择合适诊断细胞系组合提供依据.
琼脂糖(Oxoid)、二乙基氨基乙基(DEAE, GE公司), 小牛血清(TBD公司), 甲基纤维素(carboxymethylcellulose sodium salt, Sigma公司), 艾维素(Avicel, FMC公司), 结晶紫(Crystal violet, 天津市大茂化学试剂厂), 24孔细胞培养板(Cornnig公司). 细胞株: BGM、VeroE6、MRC-5、A549、HEp-2为本室保存细胞株, 细胞为本室保存. 病毒株: 肠道病毒71型广州株(EVGZ06), 自临床患者样品分离, 以MRC-5细胞传代扩增.
1.2.1 空斑试验: 用常规制备的BGM、VeroE6、MRC-5、HEp-2和A549五种细胞接种10倍系列稀释的病毒, 吸附1-2 h后, 五种细胞分别覆盖三种不同的培养物1.5 mL/孔, 置34℃、50 mL/L CO2条件下培养3 d. 以福尔马林缓冲结晶紫溶液(0.1%)固定和染色, 计算空班形成单位(PFU). 培养物配方: (1)6 g/L琼脂糖覆盖物: 总量22.6 mL, MEM(2×)10 mL, 无菌纯水3.4 mL, 小牛血清0.4 mL, 1% DEAE 0.2 mL, 20 g/L琼脂糖6 mL. (2)10 g/L甲基纤维素覆盖物: 总量20 mL, 称取1 g甲基纤维素粉高压灭菌后, 加入MEM(1×)19.6 mL和小牛血清0.4 mL, 混匀备用. (3)1.2% Avicel: 2.4% Avicel与MEM(2×)等体积混合. (4)MEM(2×): 总量500 mL, 称取9.4 g MEM粉末溶解于无菌纯水462 mL过滤除菌, 另补加终浓度0.6 g/L谷胺酰氨, 100 U/L青霉素, 100 μg/L链霉素, 7% NaHCO3, 0.02 mol/L HEPES, 0.4% BSA. 按下列公式计算空斑形成单位: 空斑形成单位(pfu/L) = [每孔平均空斑数/每孔病毒接种量(mL)]×病毒稀释度.
1.2.2 用空斑试验检测EV71在BGM、VeroE6、MRC-5、HEp-2和A549细胞上不同增殖时间的滴度: 常规接种五种细胞于24孔培养板, 待细胞形成单层后, 分别接种MOI = 0.01的病毒各3孔, 取感染后24、48、72、96 h四个时间点的上清液做空斑形成试验, 计算空斑形成单位.
在BGM和Vero E6两种细胞, 覆盖琼脂糖凝胶的EV71形成针尖样空班; 覆盖10 g/L甲基纤维素的EV71形成直径大约1 mm圆形或类圆形空班; 覆盖Avicel的EV71在BGM细胞中可形成直径大约0.5 mm类圆形空斑, 在Vero E6细胞中形成针尖样空斑, 其他细胞均形成针尖样空斑(图1).
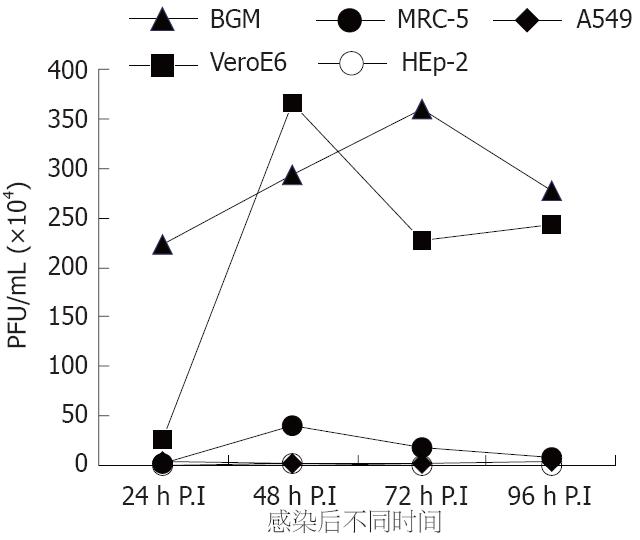
EV71病毒在不同细胞不同增殖时间所产生的滴度: BGM>VeroE6>MRC-5>HEp-2>A549, 其中病毒在BGM和VeroE6细胞上产量均高于其他3种细胞.
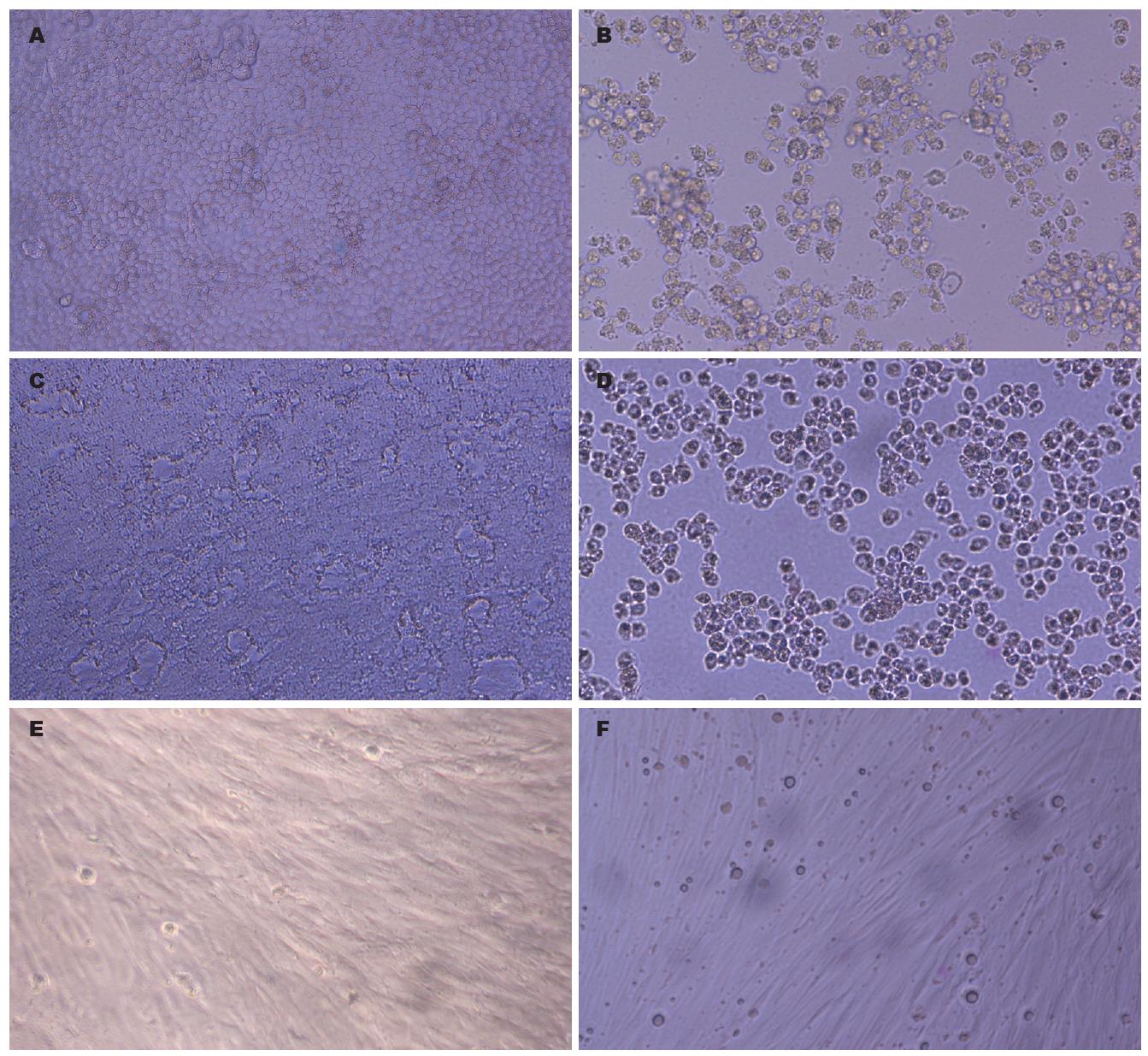
EV71在BGM、VeroE6细胞, 感染后第2天即迅速出现典型的肠道病毒CPE: 细胞变圆、坏死、脱落, 最终整个单层细胞被破坏(图2-3); MRC-5、A549和HEp-2细胞接种后4-5 d出现细胞变圆、坏死、脱落等CPE, 出现CPE的时间落后于上述两种细胞, 且不易与老化细胞辨别.
EV71是1969年首次从加利福尼亚患者的中枢神经系统疾病的婴儿粪便中分离出来的[4]. EV71已在世界范围内引起十多次爆发和流行, 我国台湾地区也曾发生EV71感染大爆发[5], 特别是2008-05我国安徽爆发的EV71[3], 严重危害人民群众的生命安全, 因此EV71感染和流行是值得长期密切关注的问题. 加强和完善其诊断方法, 特别是准确定量的方法, 将有助于开展EV71病毒的诊治、药物以及疫苗等研究.
病毒空斑(又叫蚀斑)如同噬菌体的蚀斑[7], 在细胞培养中是一种较精确地测定病毒感染力的方法. 每个空班由单个具有感染性病毒颗粒复制形成, 所以病毒空斑实验既检测了病毒的感染性也测定了病毒的滴度, 这一特点是分子生物学手段不能比拟的. 本研究将琼脂糖、甲基纤维素以及艾维素三种材料用于覆盖不同细胞, 为建立EV71病毒空斑试验选择最佳覆盖材料. 结果发现, 病毒在不同细胞不同材料下形成空斑效果差异较大, 最佳的是Vero E6细胞覆盖含10 g/L甲基纤维素营养物, 形成十分清晰的类圆形空斑. 本研究建立的EV71空斑形成法体系, 操作简单, 结果易于观察, 试验周期较短, 十分适用于EV71病毒的定量检测.
肠道病毒在自然界广泛存在且型别众多, 一病多原、一原多症是肠道病毒感染的重要特征. 在EV71流行期间, 虽然可通过血清中和试验和核酸扩增测序等手段进行鉴定分型, 但对于常规条件一般的临床实验室, 病毒分离培养仍然是十分实用和重要的诊断办法. 分离肠道病毒所选用的细胞系一般都为人源或猴源细胞[6], 他们都具有肠道病毒受体, 可不同程度地支持肠道病毒的体外复制. 如, 脊髓灰质炎病毒在猴肾细胞和HEp-2细胞产生CPE[8], 而埃可病毒只对A549、MRC-5和猴肾细胞敏感[9], 柯萨其病毒B组病毒和A组中的少数型别(7、9、16等)能在猴肾细胞中生长, 人胚肺成纤维细胞株对柯萨其A组和B组病毒敏感性也存在差异[10]. 明确EV71病毒敏感的宿主细胞, 不仅可以为临床实验室挑选合适细胞系提供可靠信息, 也对抗病毒药物和预防性疫苗的筛选有重要意义.
本研究根据以往实验经验、细胞的普遍性和获得的难易程度三个原则选择了BGM、VeroE6、HEp-2、MRC-5和A549 5种细胞, 比较其对EV71的敏感性, 结果显示BGM和VeroE6细胞的敏感性最好, 出现细胞病变最快, 病毒产量也最高. EV71感染BGM、VeroE6细胞后第2天即迅速出现典型的肠道病毒CPE, 因此感染后48-72 h病毒产量最高, 之后上清液中细胞碎片、脱落细胞过早出现, 有可能影响病毒高峰的持续时间. 而MRC-5敏感性虽然也不低, 但由于在体外传代数有限, 在临床实验室应用受到一定限制, A549和HEp-2虽然也有病毒增殖, 但由于滴度低且不易出现典型CPE, 仅可用于抗原检测.
总之, 我们建立了用于测定肠道病毒EV71型病毒的空斑形成技术, 成功应用于五种细胞对EV71型病毒敏感性比较的研究, 筛选出BGM、VeroE6细胞为EV71的敏感细胞, 为临床实验室挑选合适细胞系提供了可靠信息. 肠道病毒空班形成技术的应用能迅速准确计数出不同标本中的病毒空斑数, 将有利于疫苗效价滴定、抗病毒药物筛选等研究.
感谢陈敬贤教授为本研究提供的帮助.
肠道病毒71型是1969年首次从加利福尼亚患者的中枢神经系统疾病的婴儿粪便中分离出来的. EV71已在世界范围内引起十多次爆发和流行. 因此EV71感染和流行是值得长期密切关注的问题. 加强和完善其诊断方法, 特别是准确定量的方法, 将有助于开展EV71病毒的诊治、药物以及疫苗等研究.
赵平, 副教授, 中国人民解放军第二军医大学微生物学教研室
肠道病毒在自然界广泛存在且型别众多, 一病多原、一原多症是肠道病毒感染的重要特征. 在EV71流行期间, 虽然可通过血清中和试验和核酸扩增测序等手段进行鉴定分型, 但对于常规条件一般的临床实验室, 病毒分离培养仍然是十分实用和重要的诊断办法.
本研究根据以往实验经验、细胞的普遍性和获得的难易程度三个原则选择了BGM、VeroE6、HEp-2、MRC-5和A549 5种细胞, 比较其对EV71的敏感性, 结果显示BGM和VeroE6细胞的敏感性最好, 出现细胞病变最快, 病毒产量也最高.
本研究结果发现, 病毒在不同细胞不同材料下形成空斑效果差异较大, 最佳的是Vero E6细胞覆盖含10 g/L甲基纤维素营养物, 形成十分清晰的类圆形空斑. 本研究建立的EV71空斑形成法体系,操作简单, 结果易于观察, 试验周期较短, 十分适用于EV71病毒的定量检测.
本文建立了肠道病毒71型(EV71)的空班形成方法, 并比较了五种细胞对EV71病毒的敏感性, 探讨了三种覆盖材料对病毒感染以及空斑形成的影响, 为临床实验室进行EV71的定量检测提供了有用的方法, 有重要的应用推广价值.
编辑: 李军亮 电编:何基才
| 1. | Hsiung GD, Wang JR. Enterovirus infections with special reference to enterovirus 71. J Microbiol Immunol Infect. 2000;33:1-8. [PubMed] |
| 3. | 中华人民共和国卫生部新闻办公室. 卫生部公布2008年5月全国突发公共卫生事件信息. 中华人民共和国卫生部官方网站, 2008-06-12; cited 2008-12-26; 1(1): 24 screens. Available from: http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohbgt/s3582/200806/36296.htm. |
| 4. | Schmidt NJ, Lennette EH, Ho HH. An apparently new enterovirus isolated from patients with disease of the central nervous system. J Infect Dis. 1974;129:304-309. [PubMed] |
| 5. | Komatsu H, Shimizu Y, Takeuchi Y, Ishiko H, Takada H. Outbreak of severe neurologic involvement associated with Enterovirus 71 infection. Pediatr Neurol. 1999;20:17-23. [PubMed] [DOI] |
| 6. | David MK, Peter MH. Fields Virology. Philadelphia: Lippincott Williams and Wilkins 2007; 845. |
| 7. | 黄 文林. 分子病毒学. 第2版. 北京: 人民卫生出版社 2006; 742. |
| 8. | Albrecht P, Enterline JC, Boone EJ, Klutch MJ. Poliovirus and polio antibody assay in HEp-2 and Vero cell cultures. J Biol Stand. 1983;11:91-97. [PubMed] [DOI] |
| 9. | Smith CD, Craft DW, Shiromoto RS, Yan PO. Alternative cell line for virus isolation. J Clin Microbiol. 1986;24:265-268. [PubMed] |
| 10. | Shinohara M, Uchida K, Shimada S, Segawa Y, Hirose Y. [The usefulness of human lung embryonal fibroblast cells (MRC-5) for isolation of enteroviruses and adenoviruses]. Kansenshogaku Zasshi. 2002;76:432-438. [PubMed] |