修回日期: 2009-01-05
接受日期: 2009-01-12
在线出版日期: 2009-02-28
目的: 探讨黏蛋白5AC特异性siRNA对人肝内胆管癌细胞珠HCCC-9810体外增殖及凋亡能力的影响.
方法: 设计合成三对特异性siRNA, 构建了三个可在哺乳动物细胞中表达siRNA的表达质粒, pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3, 应用脂质体转染技术分别将三个稳定表达的质粒和对照质粒(空质粒对照)转染HCCC-9810, 应用有荧光标记的非特异性小分子的siRNA检测转染效率, RT-PCR检测黏蛋白5AC基因mRNA水平; SABC免疫组化染色技术检测黏蛋白5AC的表达; MTT检测细胞生长增殖情况; 流式细胞仪分析细胞凋亡.
结果: 基因测序表明成功构建质粒; 转染后荧光蛋白表达率28.57%; RT-PCR结果表明在mRNA水平, 三个质粒都可抑制黏蛋白5AC基因的表达, 并可使黏蛋白5AC的表达下降, MTT结果对细胞的生长有一定的抑制作用, 流式细胞仪分析结果使肿瘤细胞凋亡增加.
结论: 构建pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3质粒明显抑制了黏蛋白5AC基因在mRNA水平及蛋白的表达, 并可抑制肿瘤细胞的生长增殖和诱导其凋亡.
引文著录: 黄强, 任雪峰, 刘臣海, 齐伟. MUC5AC特异性siRNA对胆管癌细胞株HCCC-9810增殖及凋亡的影响. 世界华人消化杂志 2009; 17(6): 566-572
Revised: January 5, 2009
Accepted: January 12, 2009
Published online: February 28, 2009
AIM: To observe specific siRNA silencing effect on Mucin-5 subtype AC gene in human intrahepatic cholangiocarcinoma cell line HCCC-9810 as well as to investigate the influence on proliferation and apoptosis after silencing the Mucin-5 subtype AC gene.
METHODS: Three pairs of specific MUC5AC-siRNA were designed and synthesized through transcription in vitro. Three different siRNA expression plasmids (pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3) were constructed by gene recombination. Then three stable expression plasmids and the comparison plasmid (empty plasmid-transfected control) were transfected into HCCC-9810 by liposome-mediated transfection. Transfection efficiency was evaluated by nonspecific small molecular siRNA (fluorescent conjugate). MUC5AC-mRNA level was detected by RT-PCR. Expression of Mucin-5 subtype AC was investigated by immunohistochemical SABC method. Cell apoptosis and proliferation were analyzed by flow cytometry and MTT, respectively.
RESULTS: The results of gene sequencing indicated that the pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3 was successfully constructed. After the transfection, the efficiency of fluorescent protein expression reached 28.57%; the results of RT-PCR and immunocytochemistry showed that constructed plasmids down-regulated mRNA and protein of Mucin-5 subtype AC at 48 h after transfection. The results of MTT indicated that the growth of HCCC-9810 was obviously inhibited after silencing the Mucin-5 subtype AC gene. Apoptosis was induced in the tumor cells after suppressing the expression of Mucin-5 subtype AC gene by flow cytometry.
CONCLUSION: Three different stable expression plasmids of siRNA specific for Mucin-5 subtype AC gene obviously inhibit the expression at MUC5AC-mRNA and protein level. The blockage of Mucin-5 subtype AC gene expression in HCCC-9810 cells shows significant effect on cell apoptosis and proliferation.
- Citation: Huang Q, Ren XF, Liu CH, Qi W. Construction of the specific MUC5AC-siRNA expression plasmid and effect of siRNA on proliferation and apoptosis in human bile duct cancer line HCCC-9810. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 566-572
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/566.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.566
我国胆管癌在消化系肿瘤中居第5位, 居胆道肿瘤首位, 其发病机制目前尚不清楚. 因其生长缓慢, 往往发病时已到中晚期, 手术时大多已侵犯周围组织, 故手术根治率低, 预后差. 黏蛋白5AC(mucin-5 subtype AC, MUC5AC)是黏蛋白分子家族中的一员, 属于一种分泌型黏蛋白, 正常表达于人呼吸道、胃及生殖道中, 而不表达于胆管上皮细胞[1], 在胆管癌的发生过程中, 肿瘤细胞获得了这种表型, 使得MUC5AC的表达增加. 最近研究[2-6]表明MUC5AC在胃癌、结直肠癌、肺癌、卵巢肿瘤及胆管癌等肿瘤中均过度表达. 说明其在肿瘤的发生发展和转移过程中起重要的作用. 本实验采用腺病毒作为载体构建稳定表达MUC5AC-siRNA的质粒后, 通过脂质体转染胆管癌细胞干扰MUC5AC基因, 观察干扰后基因沉默的效果及对胆管癌细胞生长增殖与凋亡的影响.
胆管癌细胞株HCCC-9810购自中国科学院上海生命科学研究院细胞库; 胰蛋白酶、噻唑蓝(MTT), 碘化丙啶(PI)和二甲基亚砜(DMSO)购自Sigma公司; Annexin V-FITC购自南京凯基生物科技发展有限公司, 大肠杆菌感受态细胞DH5α购自上海闪晶分子生物科技有限公司; Lipofectamine 2000及Opti-MEM I购自Invitrogen公司; 小牛血清及RPMI 1640购自Gibco公司; 腺病毒载体PRNAT-U6.1/Neo购自南京金思特科技有限公司; 限制性内切酶BamHⅠ和HindⅢ, T4连接酶, TRIzol以及RT-PCR其他的相关试剂均购自TaKaRa公司; 质粒小量提取试剂盒QIAprep Spin Miniprep购自Qiagen公司; 鼠对人MUC5AC mAb购自Thermo Fisher Scientific公司; 即用型SABC免疫组化试剂盒和DAB染色试剂盒购自北京中杉金桥生物技术有限公司; 所设计的寡核苷酸链均委托上海闪晶分子生物科技有限公司合成.
1.2.1 特异性MUC5AC基因siRNA的设计与合成: 参照文献[7-8]介绍的方法设计合成三个选择性靶向MUC5AC基因mRNA的siRNA序列: (1): TCTGTGGCGGTATATGGTGGA; (2): TAATAGCAATGGCCAGCGAGG; (3): TGGTCGCGTACATCTTGACGC. 针对MUC5AC基因的RNA干扰(RNA interference, RNAi)位点, 设计三条双链DNA(double-strand DNA, dsDNA): S1: 正义链5'-GGATCCCGTCTGTGGCGGTATATGGTGGATTGATATCCGTCCACCATATACCGCCACAGATTTTTTCCAAAAGCTT-3'及反义链5'-AAGCTTTTGGAAAAAATCTGTGGCGGTATATGGTGGACGGATATCAATCCACCATATACCGCCACAGACGGGATCC-3'; S2: 正义链5'-GGATCCCGTAATAGCAATGGCCAGCGAGGTTGATATCCGCCCGCTGGCCATTGCTATTATTTTTTCCAAAAGCTT-3'及反义链5'-AAGCTTTTGGAAAAAATAATAGCAATGGCCAGCGAGGCGGATATCAACCTCGCTGGCCATTGCTATTACGGGATCC-3'; S3: 正义链5'-GGATCCCGTGGTCGCGTACATCTTGACGCTTGATATCCGGCGTCAAGATGTACGCGACCATTTTTTCCAAAAGCTT-3'及反义链5'-AAGCTTTTGGAAAAAATGGTCGCGTACATCTTGACGCCGGATATCAAGCGTCAAGATGTACGCGACCACGGGATCC-3'. 其中"GGATCCC"为BamHⅠ的酶切位点, "AAGCTT"为HindⅢ的酶切位点, TTGATATCCG为中间的发卡结构. 所设计的寡核苷酸链均委托上海闪晶分子生物科技有限公司合成.
1.2.2 pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3质粒的构建与鉴定: 用TE缓冲液(10 mmol/L Tris-HCI, 1 mmol/L EDTA, pH8.0)重悬MUC5AC的寡核苷酸干粉至浓度为100 μmol/L, 上下游序列以1∶1混合, 5'和3'黏端分别与BamHⅠ和HindⅢ酶切后黏端一致, 95℃ 30 s, 72℃ 2 min, 37℃ 2 min, 25℃ 2 min完成退火. 取其中1 μL退火后的双链寡核苷酸用TE缓冲液稀释成100 μL, 与PRNAT-U6.1/Neo, 用T4 DNA连接酶连接, 同时连接试剂盒中提供的阴性对照和空白对照(超纯水代替寡核苷酸). 室温放置3 h以进行连接. 把连接产物分别转化大肠杆菌感受态细胞DH5α, 挑选阳性克隆送上海闪晶分子生物科技有限公司测序鉴定, 确认获得重组质粒pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3, 取出测序结果正确的菌种, 划线接种在含氨苄的LB平板上, 挑单个菌落接种在4 mL含氨苄的LB液体培养基中, 取约3 mL菌液按QIAprep Spin Miniprep Kit说明书提取质粒, 取1 μL质粒DNA经酶切后进行电泳, 检测插入序列的DNA.
1.2.3 细胞培养与转染: 人HCCC-9810胆管癌细胞株常规培养于含100 mL/L小牛血清的RPMI 1640培养液, 37℃, 50 mL/L CO2, 稳定传代后至指数增长期用于本实验. 转染前24 h, 将肿瘤细胞接种在6孔培养板上, 每孔约5×105个细胞, 使每孔细胞饱和度在转染前达到90%以上, 铺板时不使用含抗生素的培养液. 按Lipofectamine 2000转染试剂说明书方法进行瞬时转染. 对于6孔板中的每一孔, 将质粒DNA(包括实验质粒、对照质粒)和Lipofectamine 2000以4 μg∶10 μL的比例分别用250 μL转染专用液Opti-MEM I稀释, 孵育5 min后, 将稀释的质粒DNA与稀释的Lipofectamine 2000混匀, 室温孵育20 min, 然后将500 μL混合物加入到细胞培养基中, 轻轻混匀, 于37℃培养6 h后, 将其中的培养基吸出, 加入新鲜的培养基, 继续孵育. 并在转染后8-12 h于荧光显微镜下直接观察具有荧光蛋白的非特异性小分子的siRNA的表达, 估算转染效率.
1.2.4 MTT检测肿瘤细胞的生长增殖: 将HCCC-9810细胞接种于96孔培养板中, 细胞终密度约为2×107/L, 体积100 μL, 接种后24 h进行转染. 分别培养0, 24, 48, 72 h后每孔加入100 μL MTT液(5 g/L), 继续培养4 h后, 小心弃去上清液, 加入100 μL DMSO液, 震荡, 待蓝紫色溶解后, 在全自动酶标仪上测定各孔A490. 抑制率(%) = (1-实验组A值平均值/对照组A值平均值)×100%. 每个时间点测定6孔求平均值, 以时间为横轴, 以抑制率为纵轴绘制曲线.
1.2.5 免疫组化检测MUC5AC的表达: 先将HCCC-9810以约5×108个/L的细胞密度接种在已铺有无菌盖玻片的6孔板内, 37℃, 50 mL/L CO2下生长24 h后进行转染, 转染后48 h取出盖玻片严格按照即用型SABC免疫组化试剂盒及DAB显色试剂盒使用说明进行免疫组化检测, 其中一抗为鼠对人MUC5AC mAb, 二抗为SABC免疫组化试剂盒内提供的生物素化山羊抗小鼠IgG, 实验结果在普通光学显微镜下观察. 免疫组化结果: 细胞不着色为阴性. 呈棕黄色为阳性, 每张爬片于高倍视野下随机观察5个视野, 计算阳性细胞平均数, 即为MUC5AC的表达强度. 按下列公式计算MUC5AC基因表达的抑制率: MUC5AC表达的抑制率(%) = (1-观察组MUC5AC表达强度/对照组MUC5AC表达强度)×100%.
1.2.6 半定量RT-PCR检测MUC5AC基因在mRNA水平的表达: 转染胆管癌细胞HCCC-9810 48 h后, 按照TRzol Reagan RNA提取试剂盒试剂操作说明从HCCC-9810细胞中提取总RNA, 而后按RT-PCR试剂盒说明书采用20 µL/L逆转录反应体系操作进行逆转录. PCR扩增MUC5AC基因和内参照β-actin基因. MUC5AC正义引物: 5'-ATCACCGAAGGCTGCTTCTGTC-3', 反义引物: 5'-GTTGATGCTGCACACTGTCCAA-3', 扩增片断长度为417 bp; β-actin正义引物: 5'-CTCCATCCTGGCCTCGCTGT-3', 反义引物: 5'-GCTGTCACCTTCACCGTTCC-3', 扩增片断长度为268 bp. 反应条件: 94℃预变性5 min, 94℃变性30 s, 56℃退火30 s, 72℃延伸30 s, 共30个循环, 72℃延伸10 min; 最后将RT-PCR产物在1%琼脂糖凝胶上进行电泳(5 V/cm×30 min), 用UVP凝胶成像系统进行条带灰度测定.
1.2.7 流式细胞仪检测细胞凋亡率: 转染48 h后, 先用胰酶消化下待测细胞, 用4℃预冷的PBS洗细胞2次, 用250 μL结合缓冲液重新悬浮细胞, 调节其浓度为1×109/L; 取100 μL的细胞悬液加入一个5 mL流式管中, 加入5 μL Annexin V-FITC和10 μL(20 mg/L)的PI溶液; 混匀后于室温避光孵育15 min; 在反应管中加400 μL PBS, 上流式细胞仪(FACSCalibur)分析.
通过测序验证了插入序列与我们合成的寡核苷酸序列完全符合, 说明我们成功构建了pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3.
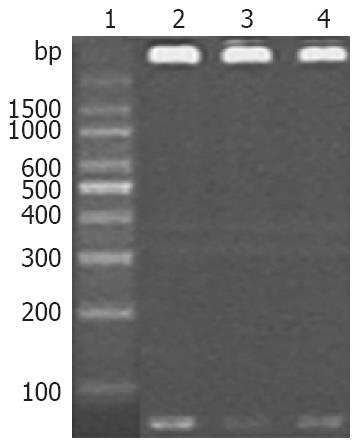
如图1所示, 与Marker的条带比较可见所提质粒经过酶切后DNA三条光带均位于76 bp处, 与构建的目的DNA片段相符.
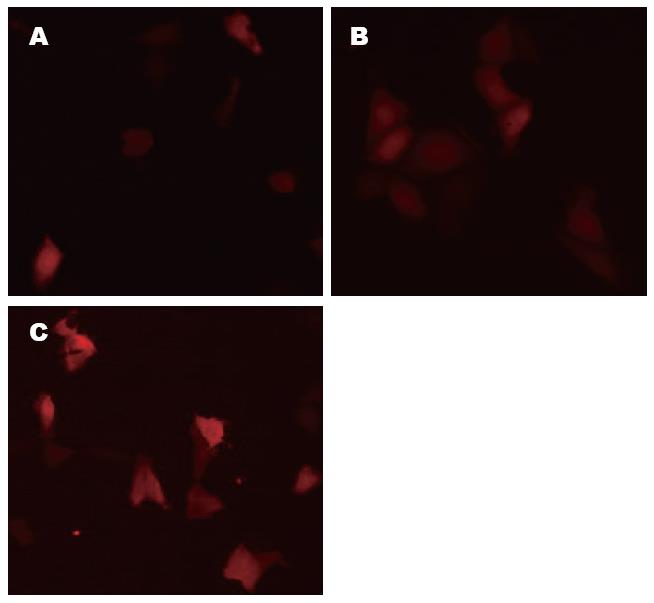
转染后11-12 h左右在荧光显微镜下观察荧光蛋白的表达, 取三个视野分别在光镜下计细胞总数, 在荧光镜下计表达特异红色荧光的细胞数以计算质粒的转染率[转染率(%) = 同一视野下发荧光的细胞/同一视野下所有细胞×100%]. 为了优化转染效率, 用不同比例的质粒载体和脂质体进行转染, 以4 μg∶10 μL下转染效率较高, 达到28.57%, 且脂质体对细胞的毒性较小, 为质粒和转染剂的合适比例, 以2 μg∶5 μL转染时转染率为9.37%, 8 μg∶20 μL比例转染时转染率为30.80%; 但当脂质体体积更大时(8 μg∶20 μL), 对细胞的毒性较大, 细胞形态不佳. 正常对照组无红色荧光(图2).
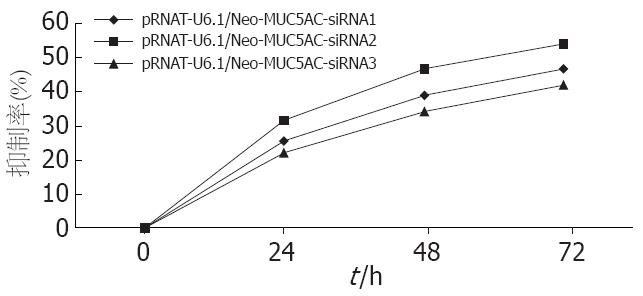
转染后分别在0、24、48、72 h测定各孔A490, 每个时间点测定6孔求平均值, 计算抑制率, 抑制率(%) = (1-实验组A值平均值/对照组A值平均值)×100%. 以时间为横轴, 以抑制率为纵轴绘制曲线如图3, 可见图中代表紫色线条的pRNAT-U6.1/Neo-MUC5AC-siRNA2的抑制作用最明显, 而代表蓝色线条的pRNAT-U6.1/Neo-MUC5AC-siRNA1和代表黄色线条的pRNAT-U6.1/Neo-MUC5AC-siRNA3的抑制率比pRNAT-U6.1/Neo-MUC5AC-siRNA2稍低.
转染后48 h, RT-PCR反应产物琼脂糖凝胶电泳结果如图4所示, 内参β-actin主带在268 bp处, 说明各组RNA提取正确. 各组均可见MUC5AC基因的特异性条带(417 bp), 与空白对照的条带比较可发现的MUC5AC条带亮度较弱, 而pRNAT-U6.1/Neo-MUC5AC-siRNA1和pRNAT-U6.1/Neo-MUC5AC-siRNA3的亮度变化比pRNAT-U6.1/Neo-MUC5AC-siRNA2亮度稍强, 但比空白对照的条带弱, 说明此三个质粒对MUC5AC均有抑制, 而以pRNAT-U6.1/Neo-MUC5AC-siRNA2的效率较高.
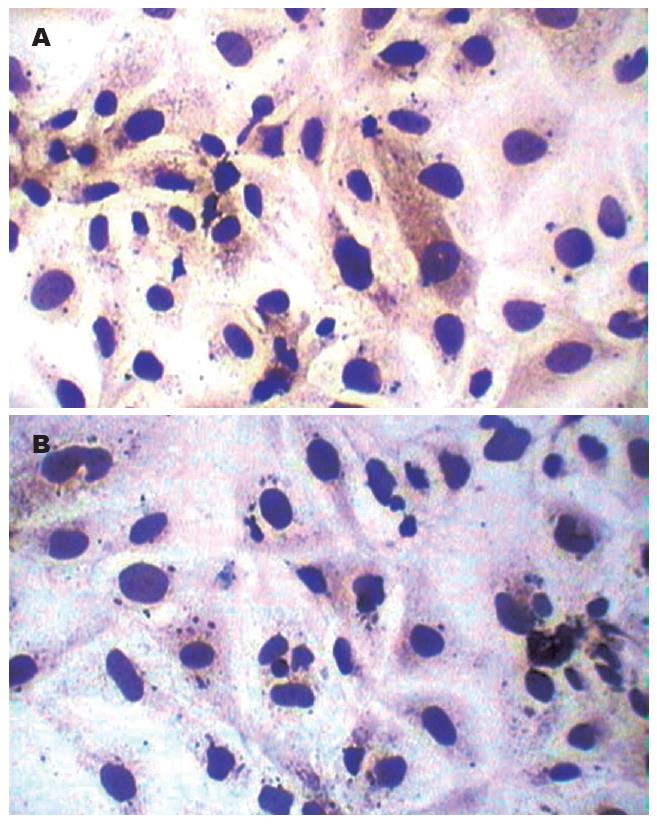
转染后48 h, 免疫细胞化学检测MUC5AC的表达情况, 棕黄色颗粒沉着代表黏蛋白分子MUC5AC表达阳性. 如图5所示转染后48 h, 空白对照组HCCC-9810细胞中的MUC5AC表达较多, 多数细胞均有棕黄色颗粒沉着, 而实验组HCCC-9810细胞中仅个别细胞有棕黄色颗粒沉着.
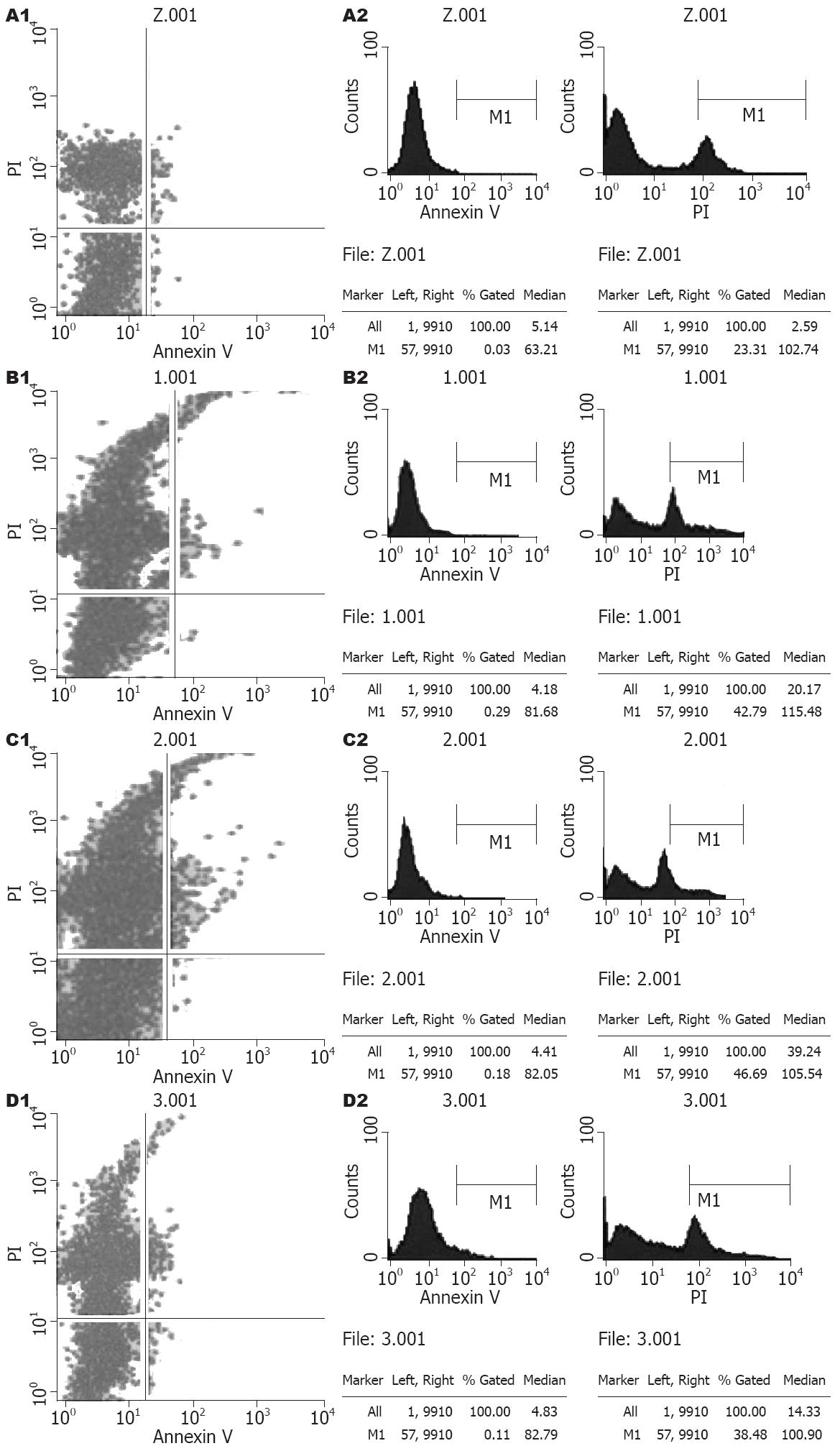
转染后48 h, Annexin V/PI双染色法检测HCCC-9810凋亡结果如图6实验组与空白对照组比较可见, Annexin V-FITC表达率很低, 即在转染后48 h未发现明显早期凋亡细胞; 但PI的表达率有升高, pRNAT-U6.1/Neo-MUC5AC-siRNA1/2/3的Gated分别为42.79%、46.69%、38.48%, 而空白对照为23.31%, 说明排除坏死细胞外, 有相当一部分为晚期凋亡细胞, 且pRNAT-U6.1/Neo-MUC5AC-siRNA2作用后诱导的晚期凋亡细胞最多.
RNAi是一种具有序列特异性的RNA依赖性转录后基因沉默现象. 自从1998年Fire et al[9]在向秀丽线虫注射双链RNA时发现RNAi现象以来, 已被广泛应用于基因功能的探索、治疗传染性疾病、恶性肿瘤和疤痕疙瘩等领域. 应用RNAi技术对肿瘤侵袭与转移的发生机制及有关基因的改变进行研究, 有助于加深理解恶性肿瘤的生物学本质, 为从不同水平阻断肿瘤的侵袭与转移提供理论依据和方法. 黏蛋白(mucin, MUC)是一组由不同基因编码产生的糖蛋白, 包括分泌型黏蛋白MUC2、MUC5AC、MUC6和跨膜型黏蛋白MUC1、MUC3、MUC4等, 他们的表达具有组织、器官、细胞特异性, 这种特点可能与不同种类的黏蛋白特定的功能有关. 在正常机体内, 多种组织的黏膜上皮细胞均可合成和分泌不同种类的黏蛋白, 保护黏膜免受各种物理、化学、微生物和机械等有害因素的损伤, 并参与细胞间的黏附及细胞间信号的传导, 对细胞生长、胚胎的发育、上皮细胞的更新和分化, 上皮完整性的维持及肿瘤的发生和转移等过程起重要作用[10]. 在上皮细胞恶变的过程中黏蛋白的质和量会发生相关改变. 这种变化主要表现为: 出现新的黏蛋白的表达, 原先存在于正常组织中的黏蛋白的表达增强或减弱, 原有黏蛋白的结构被修饰或改变, 如其糖链的结构发生变化(糖基化不全或去糖基化)[11]. 最近文献报道[12], MUC5AC可作为诊断胆管癌的一种肿瘤标记物, 其灵敏性达71%、特异性达90%. 一方面因失去极性和过度表达, 干扰来自机体免疫系统的识别, 逃避机体免疫反应; 另一方面肿瘤细胞表面的糖基侧链可在肿瘤细胞转移的过程中起到配体的作用, 从而促进肿瘤的生长与转移[13]. 因此, MUC5AC基因产物的异常表达与肿瘤细胞的表型变化、细胞黏附、免疫识别以及转移和预后密切相关.
为探讨MUC5AC基因在胆管癌发生发展中的作用, 本文采用RNAi技术体外靶向封闭人胆管癌细胞株(HCCC-9810)MUC5AC基因, 观察基因沉默效应及对胆管癌细胞凋亡及增值的影响. 本研究通过转染荧光蛋白标记的非特异性小分子siRNA了解转染效果, 排除了转染效率低对实验结果造成的影响. 结果显示: MUC5AC-siRNA成功诱导胆管癌细胞MUC5AC基因沉默, 转染组MUC5AC mRNA水平较空白对照组明显下降, 免疫组化检测显示转染组MUC5AC表达被靶向抑制. MTT法检测细胞增殖, 结果显示转染组与空白对照组及阴性对照组相比, 明显抑制了细胞的增殖. 流式细胞仪检测凋亡结果显示转染组与空白对照组相比, 可诱导细胞的凋亡.
以上结果表明, 靶向抑制MUC5AC基因对HCCC-9810细胞凋亡及增殖有一定的影响, 采用RNAi技术在基因水平封闭MUC5AC的表达就可能影响肿瘤细胞的生长和增殖, 从而为胆管癌和其他相关肿瘤的基因治疗开辟一条新的途径.
黏蛋白参与了细胞间的黏附及细胞间信号的传导, 在肿瘤的发生和转移等过程中起重要作用. 黏蛋白5AC是黏蛋白分子家族中的一员, 在多种恶性肿瘤中均过表达, 可能与肿瘤的发生发展有相关性, 但具体对肿瘤细胞的生长增值及凋亡的影响不清楚.
梁力建, 教授, 中山大学附属第一医院肝胆外科; 邰升, 副教授, 哈尔滨医科大学附属二院肝胆外科
黏蛋白5AC对胆管癌患者可作为癌标, 但在其他过表达黏蛋白5AC的肿瘤中是否可以作为一种癌标, 值得进一步研究.
2003年Boonla et al报道黏蛋白5AC在胆管癌患者的血清中过表达, 可能作为一种诊断胆管癌的指标, 2007年Bamrungphon et al报道黏蛋白5AC作为一种诊断胆管癌的肿瘤标记物, 其灵敏性达71%, 特异性达90%.
本文利用RNA干扰技术沉默黏蛋白5AC基因抑制黏蛋白5AC的表达, 探讨了黏蛋白5AC对胆管癌细胞生长增值和凋亡的影响.
本研究表明应用RNA干扰技术下调HCCC-9810细胞中黏蛋白5AC的表达, 抑制了肿瘤细胞的生长增值, 促进了肿瘤细胞的凋亡, 为将来在基因水平治疗肿瘤提供了可能的靶点.
本研究立题新颖, 结果可靠, 结论可信, 但实验方法过于繁琐.
编辑: 史景红 电编:何基才
| 1. | Boonla C, Wongkham S, Sheehan JK, Wongkham C, Bhudhisawasdi V, Tepsiri N, Pairojkul C. Prognostic value of serum MUC5AC mucin in patients with cholangiocarcinoma. Cancer. 2003;98:1438-1443. [PubMed] [DOI] |
| 2. | Wakatsuki K, Yamada Y, Narikiyo M, Ueno M, Takayama T, Tamaki H, Miki K, Matsumoto S, Enomoto K, Yokotani T. Clinicopathological and prognostic significance of mucin phenotype in gastric cancer. J Surg Oncol. 2008;98:124-129. [PubMed] [DOI] |
| 4. | Yu CJ, Shih JY, Lee YC, Shun CT, Yuan A, Yang PC. Sialyl Lewis antigens: association with MUC5AC protein and correlation with post-operative recurrence of non-small cell lung cancer. Lung Cancer. 2005;47:59-67. [PubMed] [DOI] |
| 6. | Aishima S, Kuroda Y, Nishihara Y, Taguchi K, Iguchi T, Taketomi A, Maehara Y, Tsuneyoshi M. Down-regulation of aquaporin-1 in intrahepatic cholangiocarcinoma is related to tumor progression and mucin expression. Hum Pathol. 2007;38:1819-1825. [PubMed] [DOI] |
| 7. | Tuschl T, Zamore PD, Lehmann R, Bartel DP, Sharp PA. Targeted mRNA degradation by double-stranded RNA in vitro. Genes Dev. 1999;13:3191-3197. [PubMed] [DOI] |
| 8. | Elbashir SM, Martinez J, Patkaniowska A, Lendeckel W, Tuschl T. Functional anatomy of siRNAs for mediating efficient RNAi in Drosophila melanogaster embryo lysate. EMBO J. 2001;20:6877-6888. [PubMed] [DOI] |
| 9. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 10. | Corfield AP, Myerscough N, Longman R, Sylvester P, Arul S, Pignatelli M. Mucins and mucosal protection in the gastrointestinal tract: new prospects for mucins in the pathology of gastrointestinal disease. Gut. 2000;47:589-594. [PubMed] [DOI] |
| 11. | Wittel UA, Goel A, Varshney GC, Batra SK. Mucin antibodies - new tools in diagnosis and therapy of cancer. Front Biosci. 2001;6:D1296-D1310. [PubMed] [DOI] |
| 12. | Bamrungphon W, Prempracha N, Bunchu N, Rangdaeng S, Sandhu T, Srisukho S, Boonla C, Wongkham S. A new mucin antibody/enzyme-linked lectin-sandwich assay of serum MUC5AC mucin for the diagnosis of cholangiocarcinoma. Cancer Lett. 2007;247:301-308. [PubMed] [DOI] |
| 13. | 13 Jass JR, Walsh MD. Altered mucin expression in the gastrointestinal tract: a review. J Cell Mol Med. 2001;5:327-351. [PubMed] [DOI] |