修回日期: 2009-01-20
接受日期: 2009-02-09
在线出版日期: 2009-02-28
目的: 逆向观察肝纤维化大鼠血红素氧合酶-1(heme oxygenase 1, HO-1)的表达与肝纤维化形成的关系, 探讨HO-1对免疫性肝纤维化大鼠肝脏的保护作用.
方法: 应用人体血清白蛋白建立免疫性肝纤维化模型, Zn组在攻击阶段同时腹腔注射Znpp, HE染色、VG染色、Foot氏网状纤维染色等三种染色方法观察肝纤维组织增生程度, Western blot和免疫组化法观察肝组织中HO-1的表达.
结果: F组和Zn组免疫组化阳性计分较N组明显升高(4.00±1.31, 2.33±0.78 vs 0.80±0.79, P<0.01); 且F组免疫组化阳性计分比Zn组高(4.00±1.31 vs 2.33±0.78, P<0.05). F组成纤维细胞、Ⅰ型胶原及Ⅲ型胶原增生较N组明显(P<0.01); Zn组成纤维细胞、Ⅰ型胶原及Ⅲ型胶原增生较F组更明显(P<0.01).
结论: 免疫性肝纤维化模型中, 肝脏能够高水平表达HO-1, 对肝脏起保护作用.
引文著录: 孙英杰, 段志军, 王飞. 抑制血红素氧合酶-1对大鼠免疫性肝纤维化的影响. 世界华人消化杂志 2009; 17(6): 560-565
Revised: January 20, 2009
Accepted: February 9, 2009
Published online: February 28, 2009
AIM: To observe effects of hemeoxygenase-1 (HO-1) on immune hepatic-fibrosis in rats.
METHODS: The hepatic fibrosis model was induced by human serum albumin (HSA). Znpp group was administrated ZnPP intraperitoneally at attacking stage. The fibrous hyperplasia degree were observed by HE staining, VG staining and Foot's reticular fiber staining. The expressions of HO-1 protein in liver were measured by immunohistochemistry and Western blot.
RESULTS: The positive scores of immunohistochemistry in F group and Zn group were significantly higher than that of N group (4.00 ± 1.31, 2.33 ± 0.78 vs 0.80 ± 0.79, both P < 0.01). And the positive scores in F group was higher than Zn group (4.00 ± 1.31 vs 2.33 ± 0.78, P < 0.05). The proliferation of fibroblast, typeⅠand typeⅢ collagen was more apparent in F group than in N group (P < 0.01). However, proliferation of fibroblast, typeⅠand type Ⅲ collagen were even more apparent in Zn group than in F group (P < 0.01).
CONCLUSION: The expression of HO-1 protein increases significantly in immune hepatic fibrosis rat models, which may have a protective effect on liver.
- Citation: Sun YJ, Duan ZJ, Wang F. Effect of hemeoxygenase-1 inhibition on immune hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(6): 560-565
- URL: https://www.wjgnet.com/1009-3079/full/v17/i6/560.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i6.560
肝纤维化是肝硬化的前期病理阶段, 是可逆性的病理变化, 因此阻断和逆转肝纤维化的发生和发展, 对防治肝硬化具有十分重要的意义. 血红素氧合酶(heme oxygenase, HO)是人类和哺乳动物组织中广泛存在的一种加氧酶, 是催化血红素的起始酶和限速酶, 有着重要的生物学作用. 研究发现, HO-1及其酶解产物参与了机体多种组织器官的病理生理反应, 协同发挥着抗炎、抗氧化、抑制细胞凋亡等作用, 是机体最重要的内源性保护体系之一[1-3]. 近年来的研究已证实, HO-1在肝移植、急性肝损伤和缺血再灌注损伤等多种肝脏损害中, 对肝细胞均具有保护作用. 但目前国内外对于HO-1在肝纤维化方面的研究, 特别是在免疫性肝纤维化模型的研究还很少. 本课题组已经用钴原卟啉诱导HO-1表达增多探讨HO-1对大鼠免疫性肝纤维化的影响(后另文报道). 本文是通过锌原卟啉(zinc protoporphyrin, Znpp)抑制HO-1的表达, 逆向观察肝纤维化大鼠HO-1的表达与肝纤维化形成的关系, 进一步探讨HO-1对免疫性肝纤维化大鼠肝脏的作用, 为今后干预肝纤维化的药物研究提供实验依据.
SD成年♂大鼠52只, 体质量220-270 g, 随机分为3组: 正常对照组(N组)12只, 肝纤维化组(F组)20只, 锌原卟啉组(Zn组)20只.
1.2.1 实验步骤: F组和Zn组用20 g/L人体血清白蛋白, 按Blackwell方法[4]的方法稍加改进制作肝纤维化模型. 末次致敏后第10天, 尾静脉攻击注射人体血清白蛋白, 共6 wk. Zn组在每次尾静脉攻击同时给予Znpp(5 mg/kg)ip. N组除同期皮下或尾静脉注射生理盐水外, 不注射其他药物, 其他与造模组相同. 6 wk后将所有大鼠处死. Western blot和免疫组化染色(SP法)观察肝组织中HO-1的表达. 通过HE染色、VG染色、Foot氏网状纤维染色等三种染色方法观察肝纤维组织增生程度.
1.2.2 实验判定标准: (1)免疫组化染色判定标准: 细胞质出现黄色颗粒判为阳性表达. 按照染色强度计分: 0分为无色, 1分为淡黄色, 2分为棕黄色, 3分为棕揭色; 按阳性细胞所占百分比计分: 0分为阴性, 1分为阳性细胞占10%, 2分为阳性细胞占11%-50%, 3分为阳性细胞占51%-75%, 4分为阳性细胞>75%[5]. 每张切片取四周及中央区域计数5个高倍视野, 计算每个视野的染色强度与阳性细胞所占百分比计分的乘积, 以5个视野的平均分作为此标本的阳性计分. (2)HE染色判定标准: 每张切片取四周及中央区域, 选取胶原纤维含量最多的视野, 每个视野含一个汇管区, 光学显微镜下观察纤维组织增生与分布情况. 成纤维细胞增生程度判断如下: "-": 无成纤维细胞增生; "+": 仅汇管区少量成纤维细胞增生; "++": 汇管区成纤维细胞增生并向肝小叶内延伸, 呈较窄较短的纤维条索; "+++": 汇管区成纤维细胞大量增生并向肝小叶内延伸, 形成假小叶[6]. (3)VG染色判定标准如下, 根据汇管区血管周围红染区厚度, 判断Ⅰ型胶原增生程度: "-": <5 μm; "+": 5-10 μm; "++": 10-15 μm; "+++": >15 μm[6]. (4)Foot氏网状纤维染色判断标准如下, 以判定Ⅲ型胶原增生程度: "-": 无网状纤维增生; "+": 少数小叶的汇管区网状纤维呈细纤维状向肝小叶内延伸; "++": 较多小叶的汇管区网状纤维呈细网状向肝小叶内延伸; "+++": 多数小叶的汇管区网状纤维呈细网状向肝小叶内延伸形成假小叶[6].
统计学处理 使用SPSS10.0统计软件包分析, 计量数据以mean±SD表示, 各组间比较采用方差分析、秩和检验, P<0.05认为差异有统计学意义.
肝纤维化动物模型建立成功. 大鼠共死亡14只, 其中N组死亡1只, F组死亡5只, Zn组死亡8只.
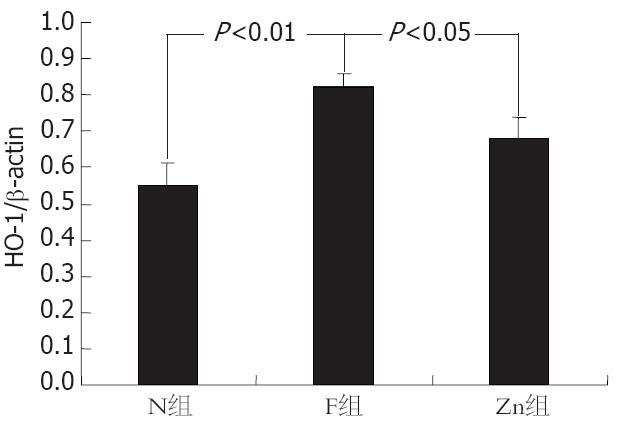
计算机吸光度分析显示: 与N组比较, F组肝组织HO-1蛋白的表达明显增加(P<0.01). 应用Znpp处理降低了肝纤维化时HO-1的表达, F组HO-1蛋白的表达高于Zn组(P<0.05), 但Zn组仍比N组高(P<0.01, 图1-2).
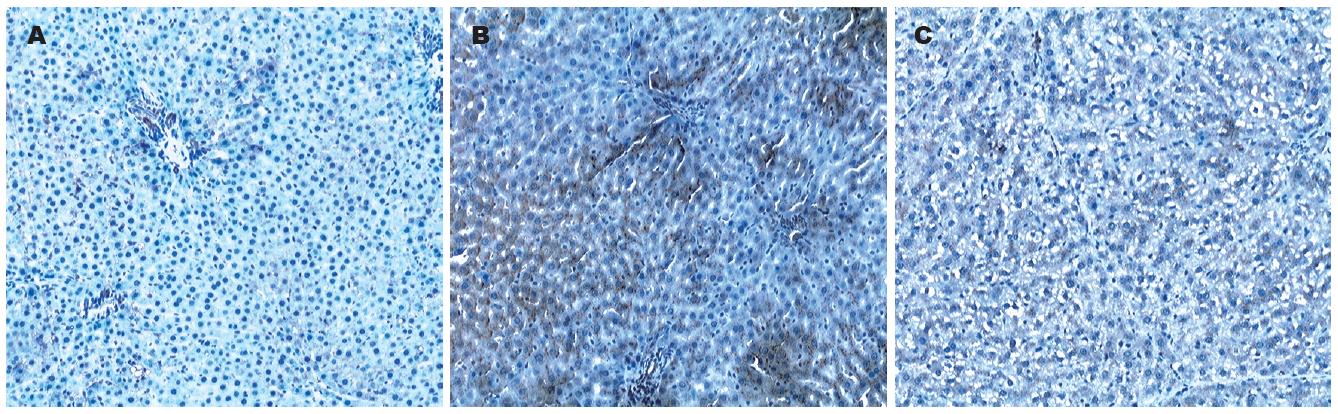
N组不显色或仅于汇管区和小叶中央静脉周围肝细胞轻微显色; F组: 肝细胞和间质细胞呈弥漫性显色, 显色区域强弱不均匀, 部分区域显色较强; Zn组: 显色范围较广, 显色区域较均匀, 但显色较轻微, 汇管区显色稍重(图3). N组计分: 0.80±0.79; F组计分: 4.00±1.31; Zn组计分: 2.33±0.78. 与N组比较, F组免疫组化阳性计分明显升高(P<0.01); 与N组比较, Zn组免疫组化阳性计分也明显升高, 有显著性差异(P<0.01); 与F组比较, Zn组免疫组化阳性计分降低, 有显著性差异(P<0.05).
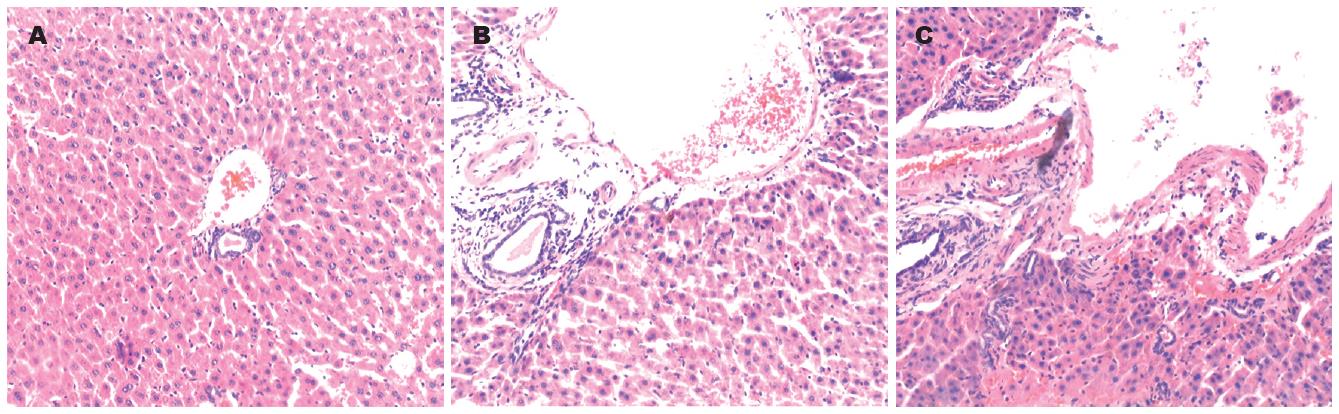
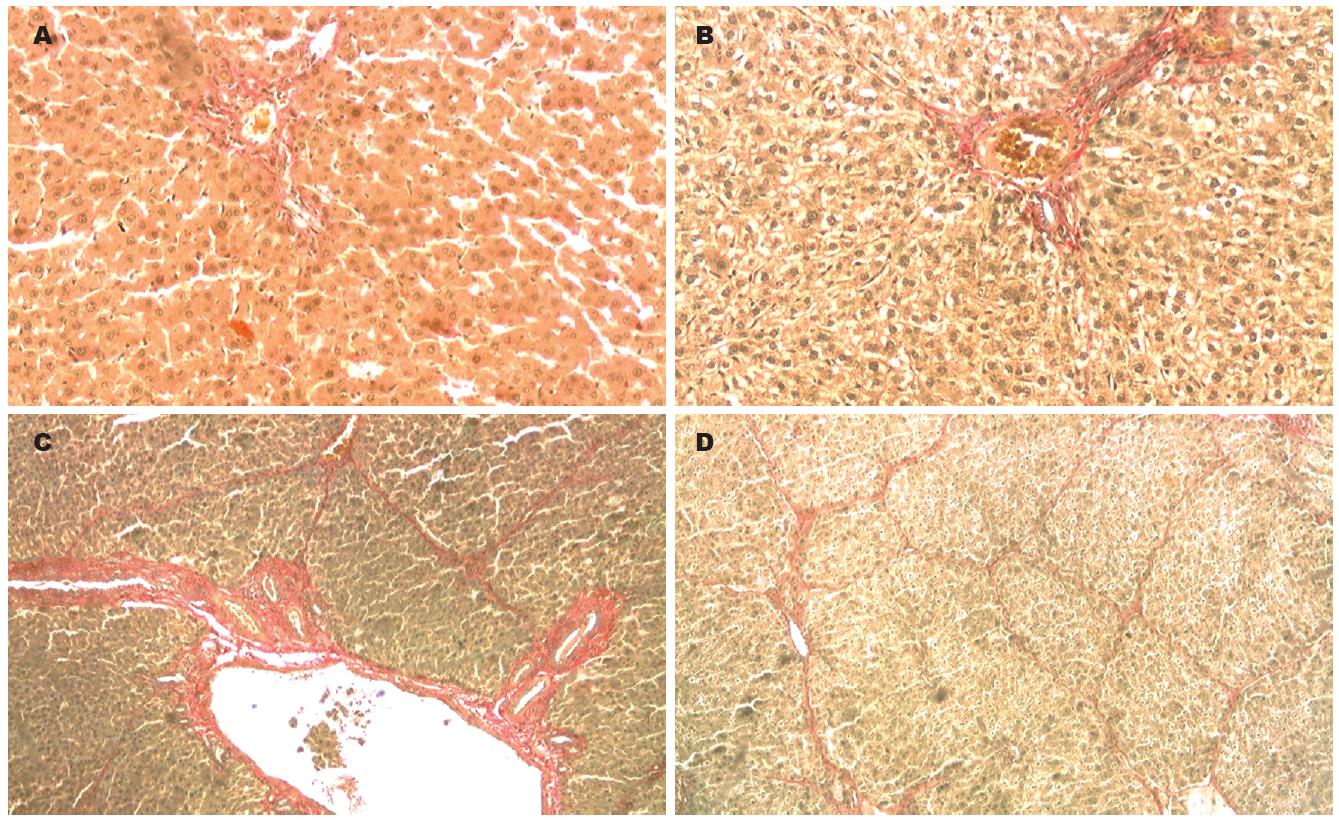
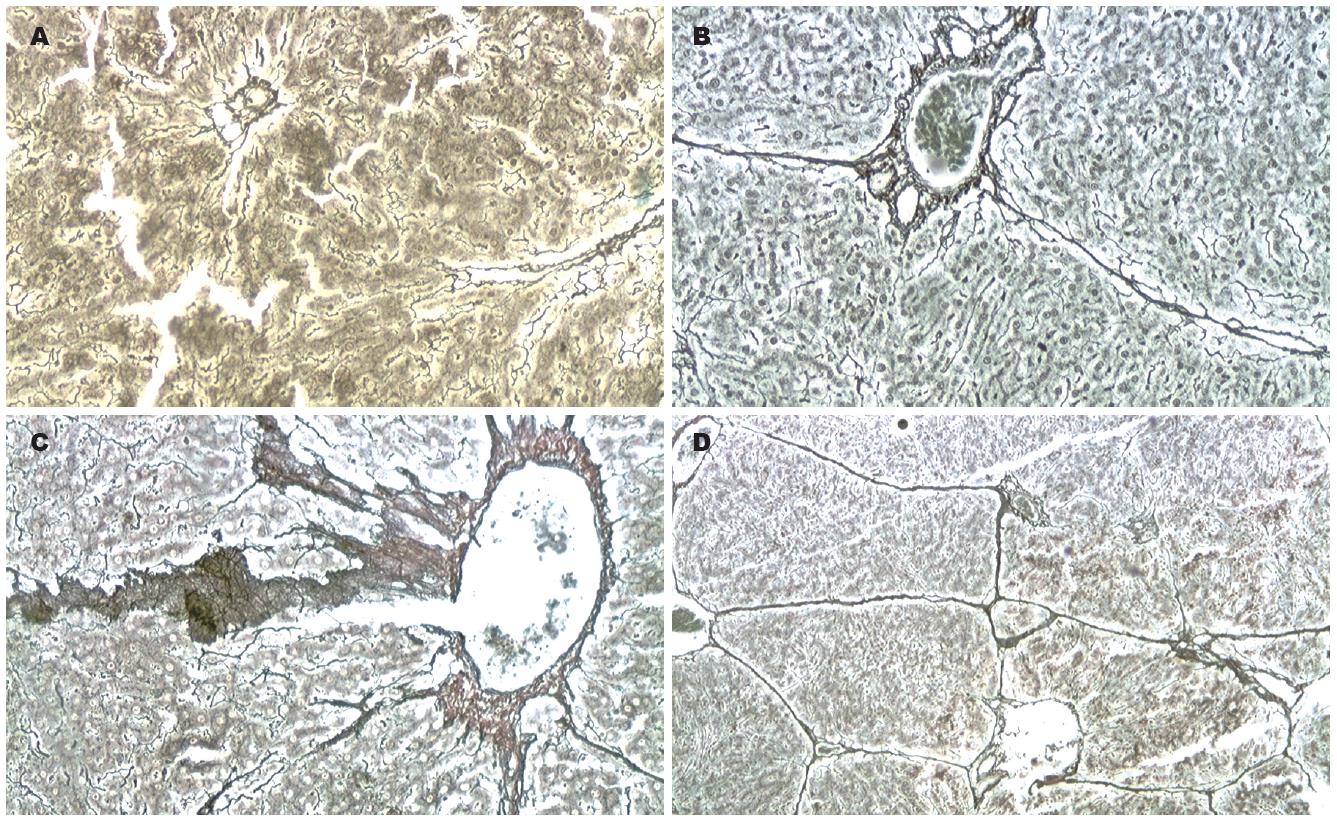
2.4.1 光镜下病理检查结果: N组: 肝小叶结构完整, 肝细胞索结构清晰, 排列规整, 肝细胞以中央静脉为中心呈放射状排列. 肝细胞形态大小正常, 无炎性细胞浸润及纤维组织增生, 汇管区可见少许胶原纤维(图4A, 图5A, 图6A). F组: 汇管区纤维化较明显, 纤维化扩大, 可见程度不等的纤维组织增生且向肝小叶延伸现象, 成纤维细胞大量增生, 小叶间隔明显增宽, 有较多纤维沉积, 有纤维间隔形成, 小叶内纤维化不明显, 单个细胞周围可见纤维化(图4B, 图5B, 图6B). Zn组: 汇管区扩张显著, 纤维化明显, 胶原纤维增生明显, 并可见厚薄不一的纤维束伸入肝小叶, 形成粗大的纤维间隔, 小叶内可见纤维化, 有灶性假小叶形成(图4C, 图5C-D, 图6C-D).
2.4.2 肝纤维化病理分级结果: 与N组相比, F组成纤维细胞增生明显(P<0.01); 与F组相比, Zn组成纤维细胞增生更明显, 有显著性差异(P<0.01, 表1). 与N组相比, F组Ⅰ型胶原增生明显(P<0.01); 与F组相比, Zn组Ⅰ型胶原增生更明显, 有显著性差异(P<0.01, 表1). 与N组相比, F组Ⅲ型胶原增生明显(P<0.01); 与F组相比, Zn组Ⅲ型胶原增生更明显, 有显著性差异(P<0.01, 表1).
| n | HE染色 | VG染色 | Foot氏网染 | ||||||||||
| - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | ||
| N组 | 11 | 11 | 0 | 0 | 0 | 11 | 0 | 0 | 0 | 11 | 0 | 0 | 0 |
| F组 | 15 | 0 | 8 | 7 | 0 | 0 | 7 | 6 | 2 | 0 | 4 | 8 | 3 |
| Zn组 | 12 | 0 | 1 | 9 | 2 | 0 | 1 | 6 | 5 | 0 | 0 | 4 | 8 |
目前, 由于我国乙型肝炎病毒感染人群庞大和酗酒人员逐年增多, 肝硬化、肝癌患者越来越多, 而肝病发展到肝硬化甚至肝癌阶段时, 药物、手术等各种治疗均难以奏效, 因此肝硬化已成为一个危害人类生命健康的世界性问题. 现代医学发现, 肝纤维化是肝脏损伤后的代偿修复机制, 是包括肝炎、酒精与药物损伤等各种慢性肝病的共同病理基础, 是肝硬化的必经病理阶段, 同时又是可逆转性的病变, 所以研究如何预防与治疗肝纤维化成为当今医学界治疗肝硬化的热点和难点[7-8].
在正常的肝脏, HO-1主要存在于Kupffer氏细胞中. 在应激状态或各种原因诱导的肝纤维化和肝硬化过程中, 肝脏能够高水平表达HO-1, 而且HO-1在肝实质细胞和间质细胞[肝星状细胞(hepatic stellate cell, HSC)、Kupffer氏细胞、肝窦内皮细胞等]都有表达, 为其广泛参与肝脏疾病的病理生理过程提供可能[9]. 在应激状态下HO-1适量表达可以减轻细胞损伤、蛋白质氧化及脂质过氧化. HO-1还防御体内由细胞因子介导的凋亡, 从而达到有效的细胞保护作用[1-2]. 在各种免疫性肝损伤中, HO-1表达可以抑制半胱天冬酶-3的活性, 从而阻止肝细胞凋亡[10]. 本研究的目的就是通过Znpp抑制HO-1的表达, 观察大鼠肝纤维化程度的变化, 从而证实HO-1能对肝脏起到有效保护作用.
据文献报道, 各种原因诱导的肝纤维化和肝硬化, 肝脏均能高水平表达HO-1, 而且HO-1在肝实质细胞和间质细胞中都有表达[9-10]. 在本实验中Western blot检测肝组织HO-1蛋白的表达, F组明显高于N组; 免疫组化染色, F组肝细胞和间质细胞呈弥漫性显色, 显色较N组明显增强. 实验结果证实, 在免疫性肝纤维化模型中, HO-1在肝实质细胞和间质细胞均有高水平表达, 提示慢性免疫性损伤可以诱导HO-1的表达.
Maines[11]给新生鼠皮下注射Znpp, 可使肝脏HO活性抑制40%-60%; 腹腔内注射同等剂量Znpp可使肝脏HO活性抑制27%-51%. Wei et al[12]在胆道结扎致肝硬化大鼠模型中发现, HO抑制剂Znpp可阻断HO-1的表达. 本实验Western blot和免疫组化结果证实, 应用Znpp处理后, 免疫性肝纤维化大鼠的肝脏组织中HO-1的表达均较F组下降.
近年来的一些研究表明, HO-1在肝纤维化模型中被诱导表达, 可有效减缓肝纤维化的进程. Li et al[13]采用15-脱氧-D-12, 14-前列腺素(15-dexoy-delta-12, 14-prostaglandin, 15-d-PGJ2)和高铁血红素诱导体外培养的肝成纤维细胞HO-1的表达, 结果说明诱导HO-1表达可以有效抑制因15-d-PGJ2和高铁血红素所引起的肝成纤维细胞增殖及Ⅰ型前胶原蛋白的表达. Wei et al[12]研究发现胆道结扎致肝硬化大鼠模型肝组织中HO-1 mRNA和HO-1蛋白较假手术组表达增加, HO特异性抑制剂Znpp可阻断HO-1的表达, 增加诱生型一氧化氮合酶的活性. 提示HO-1在肝硬化大鼠肝细胞中被诱导表达, 可调节诱生型一氧化氮合酶的活性, 在肝硬化中起保护作用. Tsui et al[14]从CCl4诱导的纤维化肝脏中分离不同类型的细胞, 研究发现, 重组腺相关病毒转导的HO-1主要在HSC中表达, HO-1转染的HSC能减少Ⅰ型胶原的分泌, 并削弱HSC的增殖能力, 从而有效阻止肝纤维化的进展. 本实验中, 通过HE染色、VG染色和Foot氏网染三种染色方法观察成纤维细胞、Ⅰ型胶原、Ⅲ型胶原增生情况, 三种染色、分级方法均提示Zn组纤维增生程度较F组明显加重. 实验说明, 应用Znpp可能通过抑制HO-1的活性, 抑制了HO-1的保护作用, 使免疫性肝纤维化模型的纤维化程度明显加重.
HO-1作为一种广泛存在的抗氧化防御酶, 主要通过其酶解产物发挥抗炎、抗氧化、抑制细胞凋亡等作用. HO-1能降解血红素产生一氧化碳(carbon monoxide, CO)、胆绿素和铁离子等一系列产物. 胆绿素进一步转化为胆红素, 胆红素在一定浓度范围内具备抗氧化、抗脂质过氧化、抑制炎性细胞浸润以及增强维生素C和维生素E的抗氧化能力等作用, 是有效的自由基清除剂; 铁离子诱导产生的铁蛋白与游离铁结合, 能减少氧化应激产生的自由铁, 从而中和其氧化毒性; 而CO适量表达可以保证肝脏血供, 减轻细胞损伤, 减少蛋白质氧化和脂质过氧化而发挥细胞保护作用[15-18]. 实验发现, 在肝纤维化形成过程中, 诱导HO-1表达可以抑制HSC增殖, 减少HSC活化, 并降低Ⅰ型胶原mRNA的表达, 减少Ⅰ型胶原转录, 提示诱导HO-1的表达能有效阻止肝纤维化的进展[13-14]. 而HO-1抑制剂Znpp则能通过与HO-1结合, 使血红素转化为胆绿素的通道被阻断, 而抑制这种保护作用. 并且, Znpp作为血红蛋白代谢过程中的一种正常代谢产物, 已被用于临床缺铁性贫血、铅中毒的辅助诊断用药, 新生儿黄疸的治疗药物, 无明显的肝脏毒副作用[19], 所以在本实验中, Zn组肝纤维化程度明显加重, 可以认为是Znpp通过抑制HO-1表达, 抑制了HO-1对肝脏的保护作用, 从而导致肝纤维化程度的加重.
总之, 本实验说明了在免疫性肝纤维化模型中, HO-1在肝实质细胞和间质细胞均有高水平表达; Zn组肝纤维化程度比F组严重. Znpp是一种HO的抑制剂, 可能通过抑制HO-1活性, 抑制了HO-1对肝脏的保护作用, 从而导致肝纤维化程度加重. 应用诱导HO-1表达的药物有可能起到保护肝细胞, 逆转肝纤维化的作用. 另外, 也有报告称, 在肝硬化阶段, HO-1的过度表达可加重肝损害. 如门脉高压时, 诱导HO-1表达虽可通过CO保证肝脏血供, 但也能使内脏循环处于高动力状态, 门脉压力增高, 促进门脉侧枝循环的形成[20]. 因此, HO-1对肝脏保护作用的详细机制及肝脏病变不同时期HO-1所产生的不同作用等值得进一步研究.
肝纤维化是一种临床常见的可逆性病理变化过程, 是肝硬化的前期病理阶段. 积极探索肝纤维化发病机制, 寻找有效的治疗方法以阻断和逆转肝纤维化的发生和发展, 对防治肝硬化具有十分重要的意义.
姚希贤, 教授, 河北医科大学附属第二医院消化内科; 刘绍能, 主任医师, 中国中医科学院广安门医院消化科
HO-1及其酶解产物已被发现在生物体内协同发挥着抗炎、抗氧化、抑制细胞凋亡等作用, 广泛参与心、脑、肺、肝、肾等组织细胞的抗氧化应激损伤, 是机体最重要的内源性保护体系之一.
据报道, 在各种原因诱导的肝纤维化和肝硬化过程中, 肝脏HO-1的表达明显增强, 而HO-1表达可以削弱肝星状细胞的增殖能力、减少Ⅰ型胶原的分泌, 有效阻止肝纤维化的进展, 还可以抑制半胱天冬酶-3的活性, 阻止肝细胞凋亡. HO-1抑制剂锌原卟啉则能废除这种保护作用, 因此诱导HO-1表达有可能成为治疗免疫性肝病的有效措施.
本研究显示, 免疫性肝纤维化大鼠肝脏HO-1表达明显增加, 给予抑制剂锌原卟啉预处理后, 肝脏HO-1的表达降低, 肝纤维化呈加重表现, 提示HO-1可能参与了肝纤维化的病理生理过程, 并对肝脏起保护作用.
本研究设计合理, 结果可靠, 有一定的科学性、创新性和可读性.
编辑: 史景红 电编:何基才
| 1. | Shiraishi F, Curtis LM, Truong L, Poss K, Visner GA, Madsen K, Nick HS, Agarwal A. Heme oxygenase-1 gene ablation or expression modulates cisplatin-induced renal tubular apoptosis. Am J Physiol Renal Physiol. 2000;278:F726-F736. [PubMed] |
| 3. | Petrache I, Otterbein LE, Alam J, Wiegand GW, Choi AM. Heme oxygenase-1 inhibits TNF-alpha-induced apoptosis in cultured fibroblasts. Am J Physiol Lung Cell Mol Physiol. 2000;278:L312-L319. [PubMed] |
| 4. | Blackwell JB. Cirrhosis resulting from repeated injections of antigen. J Pathol Bacteriol. 1965;90:245-257. [PubMed] [DOI] |
| 10. | Sass G, Soares MC, Yamashita K, Seyfried S, Zimmermann WH, Eschenhagen T, Kaczmarek E, Ritter T, Volk HD, Tiegs G. Heme oxygenase-1 and its reaction product, carbon monoxide, prevent inflammation-related apoptotic liver damage in mice. Hepatology. 2003;38:909-918. [PubMed] |
| 11. | Maines MD. The heme oxygenase system: a regulator of second messenger gases. Annu Rev Pharmacol Toxicol. 1997;37:517-554. [PubMed] [DOI] |
| 12. | Wei CL, Lee KH, Khoo HE, Hon WM. Expression of haem oxygenase in cirrhotic rat liver. J Pathol. 2003;199:324-334. [PubMed] [DOI] |
| 13. | Li L, Grenard P, Nhieu JT, Julien B, Mallat A, Habib A, Lotersztajn S. Heme oxygenase-1 is an antifibrogenic protein in human hepatic myofibroblasts. Gastroenterology. 2003;125:460-469. [PubMed] [DOI] |
| 14. | Tsui TY, Lau CK, Ma J, Wu X, Wang YQ, Farkas S, Xu R, Schlitt HJ, Fan ST. rAAV-mediated stable expression of heme oxygenase-1 in stellate cells: a new approach to attenuate liver fibrosis in rats. Hepatology. 2005;42:335-342. [PubMed] [DOI] |
| 15. | Chiu H, Brittingham JA, Laskin DL. Differential induction of heme oxygenase-1 in macrophages and hepatocytes during acetaminophen-induced hepatotoxicity in the rat: effects of hemin and biliverdin. Toxicol Appl Pharmacol. 2002;181:106-115. [PubMed] [DOI] |
| 16. | Brouard S, Otterbein LE, Anrather J, Tobiasch E, Bach FH, Choi AM, Soares MP. Carbon monoxide generated by heme oxygenase 1 suppresses endothelial cell apoptosis. J Exp Med. 2000;192:1015-1026. [PubMed] [DOI] |
| 17. | Otterbein LE, Bach FH, Alam J, Soares M, Tao Lu H, Wysk M, Davis RJ, Flavell RA, Choi AM. Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway. Nat Med. 2000;6:422-428. [PubMed] [DOI] |
| 18. | Otterbein LE, Mantell LL, Choi AM. Carbon monoxide provides protection against hyperoxic lung injury. Am J Physiol. 1999;276:L688-L694. [PubMed] |
| 19. | 叶 涛. 锌原卟啉的研究进展. 国外医学·儿科学分册. 2002;29:143-145. |
| 20. | Fernandez M, Bonkovsky HL. Increased heme oxygenase-1 gene expression in liver cells and splanchnic organs from portal hypertensive rats. Hepatology. 1999;29:1672-1679. [PubMed] [DOI] |