修回日期: 2008-12-23
接受日期: 2009-01-05
在线出版日期: 2009-02-08
目的: 探讨细胞核和线粒体DNA微卫星不稳在大肠癌发生中的作用及两者的关系.
方法: 直接测序法检测大肠癌线粒体控制区DNA微卫星不稳定位点(mitochondrial microsatellite instability, mtMSI); 微卫星扫描方法检测细胞核BAT25、BAT26微卫星位点不稳定性(nucle-ar microsatellite instability, nMSI). 分析大肠癌mtMSI发生率在性别、年龄、部位、分级各组间以及与nMSI的相关性.
结果: 40份大肠癌组织检出mtMSI 11例(27.5%), 其中仅1个微卫星位点mtMSI阳性者11份(17.5%), 有2个微卫星位点mtMSI阳性者2例(5%). 有9份于BAT25或BAT26位点检出nMSI, 阳性率为22.5%. 大肠癌mtMSI发生率在性别、年龄、部位、分级各组间无显著性差异(P>0.05), 但与nMSI有显著相关性(P<0.05).
结论: mtMSI在部分大肠癌的发生中起重要作用, 大肠癌mtMSI与nMSI有相关性.
引文著录: 崔海宏, 韩英, 王继恒, 曹建彪, 李恕军, 杨欣艳, 范如英. 细胞核和线粒体微卫星不稳在大肠癌发生中的作用及两者的关系. 世界华人消化杂志 2009; 17(4): 433-436
Revised: December 23, 2008
Accepted: January 5, 2009
Published online: February 8, 2009
AIM: To explore the roles of nuclear microsatellite instability (nMSI) and mitochondrial microsatellite instability (mtMSI) in the pathogenesis of colorectal cancer and their relationship.
METHODS: mtMSI was detected by using direct sequencing analysis, and nMSI by microsatellite scan method. Relationship between the positive incidence of mtMSI and nMSI was analyzed.
RESULTS: Forty cases with colorectal cancers were studied for mtMSI and nMSI. The mtMSI in at least one locus was detected in 11 out of 40 (27.5%) cases. Out of the 11 cases with mtMSI, 9 showed mtMSI at one locus (17.5%) and 2 at 11 loci (5%), but none at more than three loci. The nMSI at BAT25, BAT26 were detected in 9 out of 40 (22.5%) cases. mtMSI was found not to be associated with sex, age, subsite or TNM stage (P > 0.05). mtMSI was significantly correlated with nMSI (P < 0.05).
CONCLUSION: mtMSI may be involved in the carcinogenesis of some colorectal cancer, and mtMSI is associated with nMSI.
- Citation: Cui HH, Han Y, Wang JH, Cao JB, Li SJ, Yang XY, Fan RY. Nuclear and mitochondrial microsatellite instability in colorectal cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(4): 433-436
- URL: https://www.wjgnet.com/1009-3079/full/v17/i4/433.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i4.433
线粒体是细胞独特而重要的细胞器, 过去认为他只是人体的"能量供应站". 线粒体DNA(mitochondrial DNA, mtDNA)独立于细胞核DNA之外, 能独立进行复制、转录和翻译. 由于真核细胞线粒体DNA几乎均是小于20 kb的闭环分子, 与核基因组相比, 其分子质量小, 缺乏组蛋白保护, 易受致癌物攻击, 且其缺乏损伤修复系统, 因此是致癌物的重要靶点. 此外, 人体内90%以上的氧直接与线粒体的电子传递体系-呼吸链相联系. 大量的自由基在有氧代谢过程中不断地产生, 由于线粒体内氧浓度很高, 易产生自由基及过氧化氢等物质, 他本身又不能合成谷胱甘肽而将这些过氧化物有效地清除, 因此线粒体及mtDNA易受氧化性损伤. 线粒体受损以后可通过改变细胞能量产生, 提高线粒体氧化压力, 引起线粒体表达异常和/或调控凋亡失控等途径, 影响细胞的生物学行为[1]. 关于线粒体DNA微卫星不稳定(mitochondrial microsatellite instability, mtMSI)在大肠癌(colorectal cancer, CRC)发生中的作用, 以及他与核DNA微卫星不稳定(nuclear microsatellite instability, nMSI)的关系, 尚缺乏深入研究. 本研究采用直接测序及微卫星扫描的方法, 检测了大肠癌组织mtMSI和nMSI, 以期阐明其在CRC发生中的作用, 从另一角度揭示大肠癌的发病机制.
收集我院2008-01/2008-06手术切除的大肠癌组织40例, 其中男26例, 女14例, 年龄27-84(平均56)岁. 取材后部分标本用40 g/L甲醛固定, 其余立即放置于-80℃超低温冰箱保存备用. 将固定的大肠癌及距肿瘤1 cm以上正常黏膜连续冰冻切片20张(5 μm), HE染色, 显微镜下观察, 证实大肠癌组织中肿瘤细胞占70%以上. 全部患者术前均未接受放射治疗和化学治疗. 大肠癌及正常基因组DNA的提取采取酚/氯仿异戊醇提取法.
1.2.1 mtMSI的检测: 采用PCR为基础的方法扩增mtDNA微卫星序列, D-环区的PCR扩增上游引物(nt 15791-15810): 5'-ATCATTGGACAAGTAGCATC-3', 下游引物(nt 725-706): 5'-GGTGAA- CTCACTGGAACGGG-3'. 由上海英俊公司合成. PCR的反应体积是20 μL. 包括各1 μL的两种引物(20 pmol/μL), 5 μL的10×PCR缓冲液, 4 μL的dNTPs(2.5 mmol/L), Mg2+ 3 μL(25 mmol/L), 0.5 μL的LATaq DNA聚合酶(5 U/μL)和100 ng的组织, 其余用水补足. 用PCR仪(Thermal cycle 2720, applied bio-systems美国)进行反应. 起始变性温度94℃, 5 min, 以下过程进行35个循环, 变性温度94℃, 时间45 s; 复性温度56℃, 时间45 s; 延伸温度72℃, 时间90 s; 结束延伸温度72℃, 时间7 min. 取2 μL的反应产物, 在10 g/L的琼脂糖凝胶上电泳, 确定D-环区成功扩增并拍照. 设计3条测序引物: 5'-AAA ATA CTC AAA TGG GCC TGT C-3'; 5'-AGT CAA ATC CCT TCT CGT CC-3'; 5'-TTT GAT TCC TGC CTC ATT CT-3'. 测序结果行序列拼接, 并采用ClustralW 1.83和BioEdit软件与人线粒体DNA文库中的序列进行比对.
1.2.2 nMSI的检测: 选择微卫星位点Bat-25 (FAM)Forward: 5'-TCG CCT CCA AGA ATG TAA GT-3', Reverse: 5'-TCT GCA TTT TAA CTA TGG CTC-3', 片段大小120 bp, 位点4q12/C-kit; Bat-26(FAM)Forward: 5'-TGA CTA CTT TTG ACT TCA GCC-3', Reverse: 5'-AAC CAT TCA ACA TTT TTA ACC C-3'片段大小116 bp, 位点: 2P16.3/hMSH2. 引物序列参照[2], 由上海英俊公司合成. 荧光PCR反应体积20 μL, 包括10×缓冲液, 1.5 mmol/L MgCl2, 200 μmol/L dNTP, 上下游引物各0.5 μmol/L, 0.75 U Taq DNA多聚酶(大连宝生物公司)和100 ng基因组DNA. PCR反应条件为起始变性温度94℃, 5 min, 以下过程94℃ 1 min, 57℃ 1 min, 72℃ 1 min, 35个循环, 最后72℃延伸10 min. 变性后产物经ABIPRISM 3730(Applied Biosystems)毛细管电泳45 min. Datacollection软件自动进行数据收集和处理, 并生成原始的样品数据文件. GeneMarker分析软件对配对产物数据自动分析检测nMSI阳性率.
统计学处理 采用软件SPSS16.0进行χ2检验.
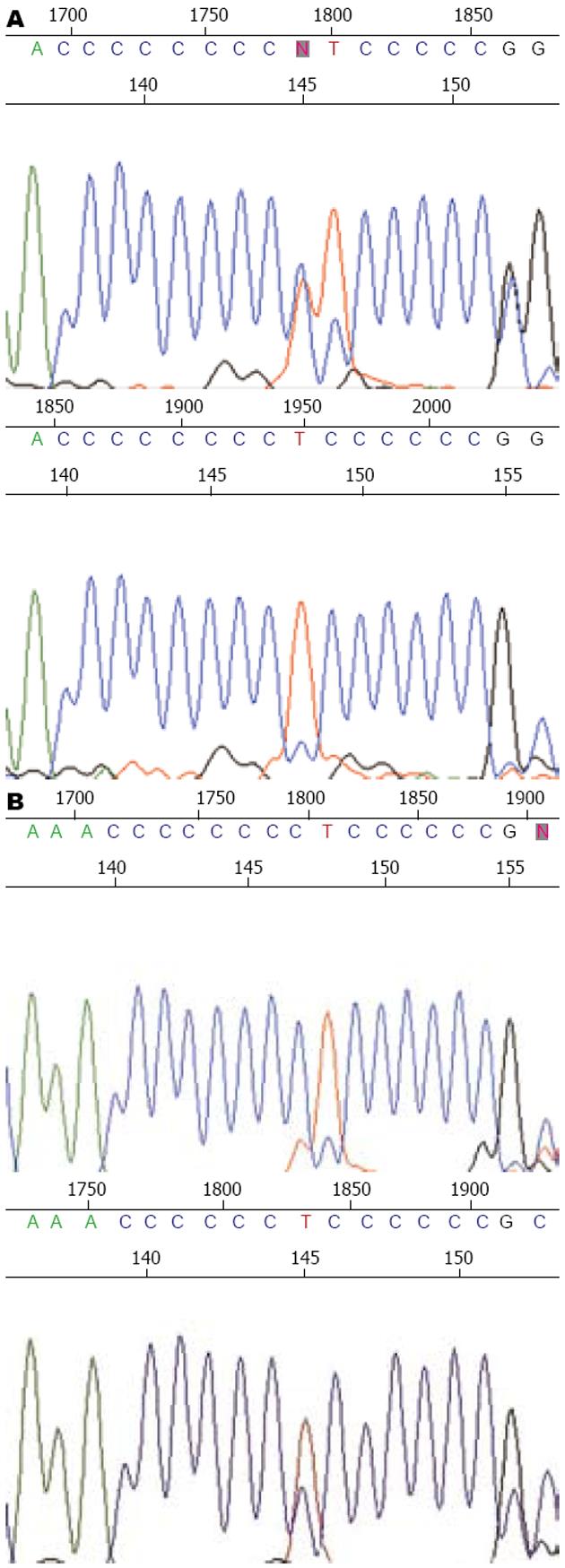
将310、514、16 184三个微卫星位点综合分析, 40例样本中有11例(27.5%)表现为mtMSI. 其中仅D310位点mtMSI阳性者11例, 有D310, D514位点mtMSI阳性者2例, D16184位点未检出阳性. 310位点突变明显高于514及16 184位点. 同质性突变3个, 异质性突变8个(图1).
根据患者性别、年龄、统计结果显示, 大肠癌mtMSI发生率在性别、年龄、部位、分级各组间无显著性差异(P>0.05), 但与nMSI有显著相关性(χ2 = 8.935, P = 0.003, 表1).
| n | mtMSI阳性 | mtMSI阴性 | P | |
| 性别 | 0.500 | |||
| 男 | 26 | 8 | 18 | |
| 女 | 14 | 3 | 11 | |
| 年龄 | 0.890 | |||
| ≤30 | 2 | 1 | 1 | |
| 30-60 | 17 | 4 | 13 | |
| ≥60 | 21 | 6 | 15 | |
| 肿瘤部位 | 0.680 | |||
| 直肠 | 22 | 5 | 17 | |
| 右半结肠 7 | 3 | 4 | ||
| 左半结肠 11 | 3 | 8 | ||
| TNM分期 | 0.140 | |||
| Ⅰ | 2 | 2 | 0 | |
| Ⅱ | 9 | 2 | 7 | |
| Ⅲ | 13 | 4 | 9 | |
| Ⅳ | 16 | 3 | 13 | |
| 微卫星 | 0.003 | |||
| MSI | 9 | 6 | 3 | |
| MSS | 31 | 5 | 26 |
通过PCR扩增BAT25、BAT26位点, 40例大肠癌中有9例MSI, 阳性率为22.5%, 其中BAT25和BAT26同时阳性1例, 其余均为BAT26阳性.
在我国大肠癌发病率逐年上升, 随着对线粒体与肿瘤关系的研究越来越深入, 近年来人们开始注意mtMSI与肿瘤的发生发展的相互关系[3-4]. 很多疾病的发生均与线粒体结构和功能缺陷有关, 因此有人将这些疾病统称为线粒体疾病[5-6]. 基因不稳在肿瘤的发生中起重要作用, 包括核基因组不稳和线粒体微卫星不稳定性. 滑行错配(slipped-strand misparing, SSM)、氧化物损伤和有限的自我修复能力是导致线粒体基因组不稳定性(mitochondrial genome instability, mtGI)发生的原因. 线粒体MSI(mitochondrial microsatellite instability, mtMSI)被定义为线粒体基因组内短的碱基重复序列长度的变化. 目前认为, mtMSI产生是由于复制时mtDNA链发生滑动错误导致重复修复所致, 表现为微卫星简单重复序列的增加或丢失, 广泛的MSI, 导致整个基因组不稳定, 基因组随机突变率增高, 有可能增加某些靶基因编码区中重复序列的突变率. 目前已发现, 编码区微卫星改变能使基因发生移码突变产生截短蛋白, 导致靶基因的失活; 而非编码区微卫星现象致癌的机制尚不清楚. D-loop区是mtDNA重链、轻链的复制起点, 为人类mtDNA的主要非编码区, 对mtDNA的转录和复制起调控作用. 肿瘤细胞mtDNA结构改变主要发生在D-loop区. 用来检测mtGI的最常用的位点为: D310, D514和D16184位点[7]. D310区由12-18个胞嘧啶残基组成, 在310位有一个胸腺嘧啶(T). 不同的个体长度不同, 又由于其位于保守序列区Ⅱ(conserved sequence block H, CSBZ), 与复制和转录相关, 因此mtDNA的D-loop区尤其是D310区成为肿瘤体细胞突变研究的热点. 肿瘤细胞的mtDNA不仅在结构上发生改变, 在数量上也会发生改变. D514为(CA)n微卫星, 多为4-10个(CA)重复. D16184为(PolyC)n微卫星, 重复多为8-14个. 有研究表明, 对食管癌、胃癌、肝癌等研究表明mtMSI是一种常见的现象, 可能在这些肿瘤的发生过程中起重要作用[8-10]. 一些研究证明: 核MSI与肿瘤细胞的生存优势有显著的相关性, 而与肿瘤的转移能力呈负相关. 部分研究发现, 线粒体微卫星不稳定与线粒体基因突变有相关性. 但也有人得出相反的研究结果[9]. 本研究检测了40例大肠癌3个最常见的mtDNA微卫星位点的mtMSI, 11例检出mtMSI, 阳性率为27.5%. 其中仅1个位点mtMSI阳性者11例, 2个位点mtMSI阳性者2例, 未检测到3个或更多位点mtMSI阳性者. 以上结果提示, mtMSI在大肠癌也比较常见, 可能在部分大肠癌的发生中起重要作用.
错配修复基因突变在遗传性非息肉性大肠癌和部分散发性肿瘤的发生中起重要作用[11-13]. Dietmaier et al[14]研究了58个结肠癌患者的31个微卫星标志后发现, 单碱基的重复序列发生率最高, 其次为双碱基重复序列, 3碱基以上的重复序列变异率较低. 而且Poly"A"的重复序列发生变异率最高, 在58例大肠癌标本中, c-kit癌基因内含子Poly"A"(BAT-25)与hMSH2基因第5内含子的Poly"A"检测到的变异分别为10/58和13/58. 本研究在40例大肠癌中检测出nMSI 9例, 其中6例同时合并mtMSI. 证实大肠癌mtMSI与nMSI有相关关系. 分析原因, 错配修复基因的突变可能不仅影响核基因也同时影响线粒体基因的微卫星不稳定. 另外由于310区域与D-环的复制密切相关, 故此区域MSI的发生可能会影响mtDNA的复制, 导致大量的重复序列小片段产生, 在线粒体膜及核膜受损时进入核内整合到核DNA中, 从而诱发细胞的癌变. 由上述结果我们推测, mtDNA非编码D-环区的MSI与细胞癌变的过程密切关系, 但其机制尚需深入研究证实. 实验中我们还做了统计学分析, 研究未发现线粒体微卫星不稳定与患者性别、年龄、肿瘤部位, 肿瘤分期之间的关系.
下一步如能从线粒体基因不稳、突变方面进行深入研究, 可能不仅有助于揭示大肠癌的发病机制, 而且可能为其临床诊断、治疗和预防提供新的思路.
线粒体微卫星不稳定的产生可能导致整个基因组不稳定, 基因组随机突变率增高, 有可能增加某些靶基因编码区中重复序列的突变率, 导致肿瘤的发生.
杜雅菊, 主任医师, 哈尔滨医科大学附属第二医院消化内科; 关玉盘, 教授, 首都医科大学附属北京朝阳医院消化科
研究发现, 核基因不稳定是导致遗传性大肠癌的重要原因, 核基因不稳定是由于错配修复基因的突变引起的, 他可能也是导致线粒体基因微卫星不稳定的原因.
随着对线粒体与肿瘤关系的研究越来越深入, 近年来人们开始注意mtMSI与肿瘤的发生发展的相互关系. 本研究利用直接测序及微卫星扫描的方法检测大肠癌患者细胞核与线粒体微卫星不稳定之间的关系, 从而探讨线粒体突变与大肠癌的关系.
本研究为从线粒体基因不稳、突变方面进行深入研究, 为揭示大肠癌的发病机制奠定基础.
本论文所涉的研究具有一定的创新性, 设计合理, 结论可靠, 分析条理清晰.
编辑: 李军亮 电编:何基才
| 1. | Conley KE, Marcinek DJ, Villarin J. Mitochondrial dysfunction and age. Curr Opin Clin Nutr Metab Care. 2007;10:688-692. [PubMed] |
| 2. | Boland CR, Thibodeau SN, Hamilton SR, Sidransky D, Eshleman JR, Burt RW, Meltzer SJ, Rodriguez-Bigas MA, Fodde R, Ranzani GN. A National Cancer Institute Workshop on Microsatellite Instability for cancer detection and familial predisposition: development of international criteria for the determination of microsatellite instability in colorectal cancer. Cancer Res. 1998;58:5248-5257. [PubMed] |
| 3. | Schwartz S Jr, Alazzouzi H, Perucho M. Mutational dynamics in human tumors confirm the neutral intrinsic instability of the mitochondrial D-loop poly-cytidine repeat. Genes Chromosomes Cancer. 2006;45:770-780. [PubMed] [DOI] |
| 4. | Kose K, Hiyama T, Tanaka S, Yoshihara M, Yasui W, Chayama K. Nuclear and mitochondrial DNA microsatellite instability in gastrointestinal stromal tumors. Pathobiology. 2006;73:93-97. [PubMed] [DOI] |
| 5. | Miceli MV, Jazwinski SM. Common and cell type-specific responses of human cells to mitochondrial dysfunction. Exp Cell Res. 2005;302:270-280. [PubMed] [DOI] |
| 6. | Yamashita S, Nishino I, Nonaka I, Goto Y. Genotype and phenotype analyses in 136 patients with single large-scale mitochondrial DNA deletions. J Hum Genet. 2008;53:598-606. [PubMed] [DOI] |
| 7. | Wang Y, Liu VW, Ngan HY, Nagley P. Frequent occurrence of mitochondrial microsatellite instability in the D-loop region of human cancers. Ann N Y Acad Sci. 2005;1042:123-129. [PubMed] [DOI] |
| 8. | Kumimoto H, Yamane Y, Nishimoto Y, Fukami H, Shinoda M, Hatooka S, Ishizaki K. Frequent somatic mutations of mitochondrial DNA in esophageal squamous cell carcinoma. Int J Cancer. 2004;108:228-231. [PubMed] [DOI] |
| 9. | Fang DC, Fang L, Wang RQ, Yang SM. Nuclear and mitochondrial DNA microsatellite instability in hepatocellular carcinoma in Chinese. World J Gastroenterol. 2004;10:371-375. [PubMed] |
| 10. | Habano W, Sugai T, Nakamura SI, Uesugi N, Yoshida T, Sasou S. Microsatellite instability and mutation of mitochondrial and nuclear DNA in gastric carcinoma. Gastroenterology. 2000;118:835-841. [PubMed] [DOI] |
| 11. | Hampel H, Frankel WL, Martin E, Arnold M, Khanduja K, Kuebler P, Clendenning M, Sotamaa K, Prior T, Westman JA. Feasibility of screening for Lynch syndrome among patients with colorectal cancer. J Clin Oncol. 2008;26:5783-5788. [PubMed] [DOI] |
| 12. | Pal T, Permuth-Wey J, Sellers TA. A review of the clinical relevance of mismatch-repair deficiency in ovarian cancer. Cancer. 2008;113:733-742. [PubMed] [DOI] |
| 13. | Jensen KC, Mariappan MR, Putcha GV, Husain A, Chun N, Ford JM, Schrijver I, Longacre TA. Microsatellite instability and mismatch repair protein defects in ovarian epithelial neoplasms in patients 50 years of age and younger. Am J Surg Pathol. 2008;32:1029-1037. [PubMed] |
| 14. | Dietmaier W, Wallinger S, Bocker T, Kullmann F, Fishel R, Rüschoff J. Diagnostic microsatellite instability: definition and correlation with mismatch repair protein expression. Cancer Res. 1997;57:4749-4756. [PubMed] |