修回日期: 2009-11-10
接受日期: 2009-11-16
在线出版日期: 2009-12-08
目的: 观察猕猴桃果仁油对小鼠非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的保护作用, 并初步探讨其作用机制.
方法: 健康, ♂小鼠50只, 随机分为: 对照组、模型组和果仁油低、中、高剂量组[90、180、270 mg/(kg•d)]5组. 除对照组用普通饲料喂养外, 其余各组均给予高脂饲料喂养. 实验6 wk后处死全部小鼠, 比较各组之间血清和肝脏生化以及肝脏组织病理学特征.
结果: 与对照组相比, 模型组小鼠血清TG、TC、ALT、AST和肝组织MDA显著升高(均P<0.01), 肝组织SOD和GSH-Px显著降低(均P<0.01); 果仁油中、高剂量组小鼠血清TC、TG、ALT、AST及肝组织MDA显著低于模型组(TC: 3.05±0.32 mmol/L, 2.55±0.43 mmol/L vs 4.55±0.23 mmol/L; TG: 1.62±0.68 mmol/L, 1.56±0.57 mmol/L vs 1.90±0.55 mmol/L; ALT: 76.91±16.32 U/L, 64.54±11.32 U/L vs 170.34±9.32 U/L; AST: 128.26±20.15 U/L, 112.74±21.37 U/L vs 158.86±18.45 U/L; MDA: 5.16±0.97 U/mg, 5.01±1.14 U/mg vs 5.88±1.07 U/mg, P<0.05或0.01), 肝组织SOD和GSH-Px的显著高于对照组(均P<0.05); 模型组小鼠肝脏脂肪变性严重, 并伴有炎细胞浸润及坏死, 而果仁油中、高剂量组小鼠肝脏脂肪变性程度轻, 无明显炎细胞浸润及坏死.
结论: 猕猴桃果仁油对高脂饲料诱导的小鼠非酒精性脂肪性肝病有明显的保护作用.
引文著录: 向志钢, 李先辉, 刘锋, 周卫华, 张永康. 猕猴桃果仁油对小鼠非酒精性脂肪性肝病的作用. 世界华人消化杂志 2009; 17(34): 3491-3496
Revised: November 10, 2009
Accepted: November 16, 2009
Published online: December 8, 2009
AIM: To investigate whether Kiwifruit seed oil has a protective effect against nonalcoholic fatty liver disease in mice.
METHODS: Fifty adult male mice were randomly divided into five groups: normal control group, model control group, and three Kiwifruit seed oil treatment groups (low-, medium- and high-dose). Mice in the normal control group were fed a normal diet, while those in other groups were fed a high-fat diet. Mice in the three Kiwifruit seed oil treatment groups were also given low-, medium- and high-dose Kiwifruit seed oil, respectively. Six weeks later, the body weight, liver index, serum TG, TC, ALT and AST levels, and hepatic TG, TC, MDA, SOD and GSH-Px levels were measured. The histological changes in the liver were evaluated by hematoxylin and eosin (HE) staining and oil red staining.
RESULTS: Compared with the normal control group, the liver index, serum TG, TC, ALT and AST levels, and hepatic MDA level markedly increased (all P < 0.01); and hepatic SOD and GSH-Px significantly decreased (both P < 0.01) in the model control group. Compared with the model control group, the liver index, serum TG, TC, ALT and AST, and hepatic MDA markedly decreased (TC: 3.05 ± 0.32 mmol/L, 2.55 ± 0.43 mmol/L vs 4.55 ± 0.23 mmol/L; TG: 1.62 ± 0.68 mmol/L, 1.56 ± 0.57 mmol/L vs 1.90 ± 0.55 mmol/L; ALT: 76.91 ± 16.32 U/L, 64.54 ± 11.32 U/L vs 170.34 ± 9.32 U/L; AST: 128.26 ± 20.15 U/L, 112.74 ± 21.37 U/L vs 158.86 ± 18.45 U/L; MDA: 5.16 ± 0.97 U/mg, 5.01 ± 1.14 U/mg vs 5.88 ± 1.07 U/mg; all P < 0.05 or 0.01); and hepatic SOD and GSH-Px significantly increased (both P < 0.01) in the medium- and high-dose Kiwifruit seed oil treatment groups. Mice in the model control group showed serious fatty degeneration, inflammatory cell infiltration and necrosis in the liver. However, these pathological changes were milder in the medium- and high-dose Kiwifruit seed oil treatment groups than in the model control group.
CONCLUSION: Kiwifruit seed oil has a protective effect against nonalcoholic fatty liver disease in mice.
- Citation: Xiang ZG, Li XH, Liu F, Zhou WH, Zhang YK. Kiwifruit seed oil has a protective effect against nonalcoholic fatty liver disease in mice. Shijie Huaren Xiaohua Zazhi 2009; 17(34): 3491-3496
- URL: https://www.wjgnet.com/1009-3079/full/v17/i34/3491.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i34.3491
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是指除外酒精和其他明确的损肝因素所致的, 以弥漫性肝细胞脂肪变为主要特征的临床病理综合征, 包括单纯性脂肪肝(nonalcoholic fatty liver, NAFL)以及由其演变的非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)和肝硬化, 是许多国家的第一大慢性肝病, 也是我国常见的慢性肝病之一[1-2]. 猕猴桃果仁油是以猕猴桃果籽为原料, 通过CO2超临界萃取而得到的天然植物油, 富含α-亚麻酸、亚油酸等不饱和脂肪酸, 研究证实其能有效降低血清中的总胆固醇(TC)、甘油三酯(TG)及低密度脂蛋白(LDL-C), 还具有清除氧自由基, 抑制氧化应激等作用[3-5]. 但猕猴桃果仁油对血脂的调节作用能否减少肝脏的脂质沉积和降低肝脏脂质过氧化水平, 以及猕猴桃果仁油对NAFLD的保护作用及机制研究尚未见文献报道. 本研究以高脂饲料诱导建立小鼠的脂肪肝模型, 观察猕猴桃果仁油对小鼠NAFLD的保护作用并探讨其机制, 旨在利用猕猴桃果仁油具有的调节血脂和抗氧化应激能力为NAFLD探寻新的防治途径, 也为猕猴桃的进一步开发利用提供理论指导和实验基础.
健康昆明小鼠50只, ♂, 周龄4-5 wk, 20±1.6 g, 清洁级, 湖南省长沙市开福区东创实验动物服务部提供, 批准号: 001847. 猕猴桃果仁油由吉首大学食品科学研究所提供, 为黄色油性液体, 浓度60%. 胆固醇(天津光复精细化工研究所生产, 批号: 20051010), 甲基硫氧嘧啶(常州康普药业有限公司, 批号: 0707029), 胆酸钠(武汉凯通精细化工有限公司), TG、TC试剂盒(温州东瓯津玛生物科技有限公司生产, 批号: 20080022); SOD、MDA、GSH-Px、AST、ALT试剂盒(南京建成生物工程研究所生产, 批号: 20090311), BCA蛋白定量试剂盒(北京康为世纪生物科技有限公司生产, 批号: 02/2010), 猪油自制. UV-3系列紫外可见分光光度计(上海美谱达仪器有限公司), 医学图像分析系统[BX51奥林巴斯(Olympus)销售服务有限公司].
1.2.1 高脂饲料的配制: 高脂饲料由猪油(15%自制)、胆固醇(2.8%)、甲基硫氧嘧啶(0.2%)、胆酸钠(0.7%)、普通饲料(81.3%)组成, 将以上各成分人工充分混匀搅拌, 压成圆条状, 经紫外光辐照消毒、烘干, 包装备用.
1.2.2 分组及造模: 50只小鼠给予普通饲料喂养5 d后, 随机分为5组, 即对照组、模型组和果仁油低、中、高剂量组, 每组各10只. 对照组继续普通饲料喂养, 模型组和果仁油低、中、高剂量组均给予高脂饲料喂养. 另外, 果仁油低、中、高剂量组小鼠分别给予猕猴桃果仁油90, 180, 270 mg/(kg•d)灌胃, 对照组及模型组均给予等量生理盐水灌胃, 均饮自来水, 实验期间小鼠自由进食和饮水. 6 wk后, 隔夜禁食, 不禁水, 眼眶取血, 颈椎脱臼处死, 取相同部位肝脏0.4 g加生理盐水制成10%匀浆液备用; 剖取相同部位肝脏, 分别浸泡于100 g/L甲醛溶液中固定, 石蜡包埋切片, 常规HE染色, 光镜下观察肝脏病理变化.
1.2.3 小鼠体质量和肝指数的测定: 实验开始前, 称小鼠体质量, 处死前再称小鼠体质量. 剖取肝脏后, 称量肝湿质量, 计算肝指数(肝指数 = 肝湿质量/体质量×100%).
1.2.4 血清及肝脏生化指标检测: 检测血清TG, TC, ALT, AST; 将制备的10%肝组织匀浆液, 3500 r/min 4 ℃离心10 min, 取上清液再离心10 min, 检测TC, TG, SOD, MDA, GSH-Px. 所有操作均严格按照试剂盒说明书进行.
1.2.5 肝脏病理组织检测: 常规HE染色, 光学显微镜下观察肝组织的脂肪变程度, 每张切片随机拍摄2个视野的低倍镜(10×10)和高倍镜(10×400)图像, 观察肝细胞变性情况; 根据非酒精性脂肪性肝病诊疗指南[1]的肝细胞脂肪变性程度F0-F4分级标准判断脂肪变性程度.
统计学处理 所有资料采用SPSS11.5软件进行统计分析, 计量资料采用mean±SD表达, 2组间采用两独立样本的t检验; 等级资料采用秩和检验. P<0.05差异具有统计学意义.
对照组小鼠状态保持良好, 模型组基础状态变差, 食欲减低, 体质量下降, 果仁油各剂量组小鼠体质量也有所下降, 但与模型组比较, 差异有显著性意义(P<0.05). 模型组小鼠肝指数显著升高, 果仁油中、高剂量组小鼠则较模型组显著降低(P<0.05, 表1). 实验过程中, 模型组小鼠在第3周死亡2只, 果仁油中剂量组小鼠在给药第1周死亡1只, 低剂量组小鼠在第1周和第3周分别意外死亡1只, 高剂量组小鼠在第5周死亡1只.
模型组小鼠血清TG, TC, ALT, AST显著高于对照组(均P<0.01), 果仁油中、高剂量组小鼠血清TG, TC, ALT, AST显著低于模型组(均P<0.01, 表2).
模型组小鼠肝组织中TG, TC的含量显著高于对照组(均P<0.05), 果仁油中、高剂量组小鼠肝组织中TG, TC的含量显著低于模型组(均P<0.05); 模型组小鼠肝组织中SOD, GSH-Px活性显著低于对照组(均P<0.01), MDA活性则显著高于对照组(均P<0.01); 果仁油中、高剂量组小鼠肝组织中SOD, GSH-Px活性显著高于模型组(均P<0.05), MDA活性则显著低于模型组(均P<0.05, 表3).
| 分组 | n | TG(mmol/L) | TC(mmol/L) | SOD(U/mg) | MDA(U/mg) | GSH-Px(U/mg) |
| 对照组 | 10 | 1.38±0.45 | 1.66±0.28 | 86.96±8.87 | 4.78±0.69 | 61.35±12.52 |
| 模型组 | 8 | 1.88±0.35a | 2.15±0.23a | 68.87±7.89b | 5.88±1.07b | 45.41±9.87b |
| 果仁油低剂量组 | 8 | 1.81±0.72 | 2.03±0.71 | 62.76±11.16 | 5.43±1.11 | 47.33±12.21 |
| 果仁油中剂量组 | 9 | 1.52±0.78c | 1.85±0.62c | 75.53±9.42c | 5.16±0.97c | 55.61±11.87c |
| 果仁油高剂量组 | 9 | 1.46±0.57c | 1.72±0.59c | 80.97±10.29c | 5.01±1.14c | 59.89±13.24c |
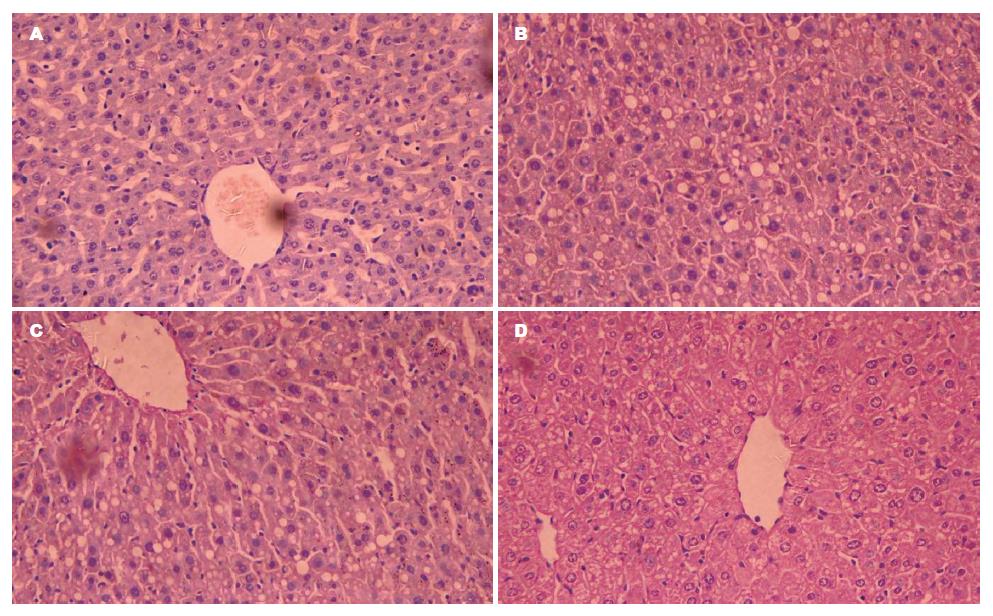
对照组小鼠肝脏组织结构正常, 肝小叶轮廓清晰, 肝索排列规则且以中心静脉放射排列, 汇管区未见炎细胞浸润, 脂肪变性程度显著低于模型组小鼠(P<0.01); 模型组小鼠肝索排列紊乱, 出现不同程度的弥漫性肝细胞脂肪变性, 大量炎性细胞浸润, 提示已经进入NASH阶段; 果仁油中、高剂量组小鼠肝板排列完好, 肝组织内可见散在大小不等的圆形脂肪空泡, 汇管区血管扩张充血, 无明显炎细胞浸润及坏死, 肝组织脂肪变性程度较模型组明显减轻(P<0.05, 0.01, 图1). 各组小鼠肝组织脂肪变性程度见表4.
| 分组 | n | 脂肪变性程度分级 | ||||
| F0 | F1 | F2 | F3 | F4 | ||
| 对照组 | 10 | 9 | 1 | 0 | 0 | 0 |
| 模型组 | 8 | 0 | 1 | 2 | 4 | 1 |
| 果仁油低剂量组 | 8 | 0 | 1 | 3 | 3 | 1 |
| 果仁油中剂量组 | 9 | 0 | 2 | 4 | 3 | 0 |
| 果仁油高剂量组 | 9 | 0 | 3 | 5 | 1 | 0 |
NAFLD除可导致终末期肝病外, 还会引起患者心血管疾病发生率和病死率增加, 对健康危害严重, 其相关病因很多, 如药物、肥胖、胰岛素抵抗和高脂血症等[6-7], 发病具体机制尚未完全明确, 一般认为与脂肪代谢异常、遗传因素、氧化应激及脂质过氧化损伤等有关[8]. 随着"二次打击"学说的提出, 氧化应激与脂质过氧化在NAFLD发病机制中的作用日益受到重视[9]. 氧化应激可增加脂质过氧化产物的释放, 介导NAFLD的发生发展[10]; 由氧化应激产生的氧自由基(reactive oxygen species, ROS)可启动细胞内脂质过氧化反应, 加重TG在肝脏内的积聚; 脂质过氧化反应可诱导中性粒细胞的趋化作用, 导致脂质产生炎性浸润, 使肝脏发生炎症、坏死, 还可激活Kupffer细胞和星状细胞, 促进肝纤维化[11-13]. MDA是强毒力的脂质过氧化产物, 有研究[14-15]证实NAFLD患者MDA水平增高, 而且与肝组织炎症、坏死及纤维化呈显著正相关. 因此, 氧化应激、脂质过氧化在NAFLD发病机制中的作用不容忽视.
为建立与人类NAFLD发病相近的动物模型, 本研究模拟人类摄食方式, 通过对常规高脂饲料配方进行改良, 在饲料中加入胆酸钠和甲基硫氧嘧啶两种物质, 成功建立了小鼠NAFLD动物模型. 高胆固醇和高脂饮食可增加胆固醇的吸收, 在饲料中加入少量胆酸盐后可增加外源性胆固醇的吸收, 加入少量甲状腺功能抑制药甲基硫氧嘧啶可抑制胆固醇在肝内转变为胆汁酸, 加速胆固醇在肝内的堆积, 加快脂肪肝形成过程[16-17].
本研究显示, 果仁油中、高剂量组小鼠血清和肝组织中TG、TC含量均显著低于模型组, 低剂量组无显著性变化, 提示猕猴桃果仁油可调节脂肪代谢, 减少脂质在肝内沉积, 阻止由高脂饲料诱导的小鼠NAFLD形成. 同时, 肝组织病理变化结果显示果仁油中、高剂量组小鼠肝组织脂肪变性程度较模型组明显减轻, 表明猕猴桃果仁油对高脂饲料诱导的小鼠NAFLD具有显著的保护作用. 此外, 果仁油中、高剂量组小鼠血清ALT、AST活性显著降低, 也表现出了猕猴桃果仁油较强的抗肝损伤效应. 尽管果仁油3个剂量组在减轻小鼠肝脏脂质沉积上的量效梯度关系不是很明显, 但从高剂量组小鼠血清ALT活性下降幅度强于中、低剂量组看, 猕猴桃果仁油抗肝损伤方面还是体现了一定的量效关系.
猕猴桃果仁油含有多种营养成分, 其不饱和脂肪酸的含量高达85.2%, 其中α-亚麻酸占不饱和脂肪酸的64%以上, 并含有一定量的维生素E和微量元素硒等物质[3,5]. α-亚麻酸是体内各种组织生物膜的结构材料, 也是人体合成前列腺素(prostaglandins, PGs)等重要生理活性物质的前体[18], 研究发现其具有显著的调节血脂和降低血压作用[19-21], 可以减少TG在大鼠肝脏中的沉积和降低血清及肝脏的脂质水平[22-23]. GSH-Px的活性中心是硒半胱氨酸, 硒是GSH-Px的必需部分, 而猕猴桃果仁油则可以作为GSH-Px的合成原料而促进GSH-Px合成, 增加其活力[5]; 维生素E具有抗脂质过氧化作用, 可以抑制单核细胞及Kupffer细胞表达炎性因子, 抑制肝胶原蛋白α1基因的表达, 有利于减轻氧化应激和肝损伤[24-25]. 本研究发现模型组小鼠肝组织中SOD、GSH-Px活性明显低于对照组, MDA活性显著高于对照组, 表明肝组织中产生了大量的ROS, 消耗了SOD、GSH-Px等抗氧化酶, 导致其在组织中含量减少, 活力减低, 这又会导致ROS在肝组织中大量蓄积, 形成恶性循环, 从而导致肝脏损伤. 本研究发现, 与模型组比较, 果仁油低剂量组小鼠肝组织中SOD、GSH-Px和MDA活性无显著变化, 说明此剂量猕猴桃果仁油保护作用不明显, 而果仁油中、高剂量组小鼠肝组织中以上指标均有显著性差异, 因此我们推测通过调节SOD等抗氧化酶的活性是猕猴桃果仁油发挥保护作用的机制之一.
总之, 猕猴桃果仁油具有显著的调脂作用和很强的抗过氧化作用及抑制氧化应激等能力, 可减轻肝脏脂质代谢障碍引起的肝损伤, 从而保护肝脏, 其保护作用呈剂量依赖性. 目前已知ROS参与了多种肝损伤的病理过程, 因此, 我们推论猕猴桃果仁油不但能减轻NAFLD导致的肝损伤, 对其他原因导致的肝损伤可能也有一定的保护作用, 有待进一步研究.
非酒精性脂肪性肝病(NAFLD)是慢性肝病最常见的原因之一, 发病率逐年上升, 除可导致终末期肝病外, NAFLD还会引起患者心血管疾病发生率和病死率增加, 对健康威胁极大, 如何有效防治NAFLD已成为全球普遍关注的医学问题和社会问题.
张占卿, 主任医师, 上海市公共卫生中心
氧化应激与脂质过氧化在NAFLD发病机制中的作用正日益受到重视, 积极寻找和筛选有效途径和方法阻止脂质在肝脏的沉积, 阻断氧化应激和脂质过氧化对NAFLD的进一步损伤是当前面临的严峻挑战, 已是当今NAFLD防治研究的焦点和热点.
谭小进 et al报道猕猴桃果王素有较强的抗氧化作用, 可提高心肌内抗氧化酶的表达与活性, 增加抗氧化酶清除氧自由基和抑制氧化应激等作用, 能有效减轻阿霉素引起的心肌自由基损伤.
猕猴桃果仁油富含α-亚麻酸、亚油酸等多种营养成分, 主要用于调节血脂和延缓衰老. 本实验通过研究发现其能有效减少肝脏的脂质沉积和降低肝脏脂质过氧化水平, 对由高脂饲料诱导的小鼠NAFLD有明显的保护作用.
本研究提示, 猕猴桃果仁油对高脂饲料诱导的小鼠非酒精性脂肪性肝病有明显的保护作用. 对于临床研发安全有效的防治NAFLD的药物有着重要的参考意义, 同时也将拓展猕猴桃的综合开发利用价值.
本文对猕猴桃果仁油对小鼠NAFLD的作用进行了研究, 结果有一定的参考意义.
编辑: 李军亮 电编: 何基才
| 2. | Portincasa P, Grattagliano I, Palmieri VO, Palasciano G. Current pharmacological treatment of nonalcoholic fatty liver. Curr Med Chem. 2006;13:2889-2900. [PubMed] [DOI] |
| 3. | 欧阳 辉, 张 永康. 猕猴桃果仁油主要成分及其药理生理作用. 吉首大学学报(自然科学版). 2004;25:80-82. |
| 6. | Misra VL, Khashab M, Chalasani N. Nonalcoholic fatty liver disease and cardiovascular risk. Curr Gastroenterol Rep. 2009;11:50-55. [PubMed] [DOI] |
| 7. | Assy N, Nassar F, Nasser G, Grosovski M. Olive oil consumption and non-alcoholic fatty liver disease. World J Gastroenterol. 2009;15:1809-1815. [PubMed] [DOI] |
| 10. | Pessayre D. Role of mitochondria in non-alcoholic fatty liver disease. J Gastroenterol Hepatol. 2007;22 Suppl 1:S20-S27. [PubMed] [DOI] |
| 11. | Lieber CS. Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis. Alcohol. 2004;34:9-19. [PubMed] [DOI] |
| 12. | Haufroid V, Ligocka D, Buysschaert M, Horsmans Y, Lison D. Cytochrome P4502E1 (CYP2E1) expression in peripheral blood lymphocytes: evaluation in hepatitis C and diabetes. Eur J Clin Pharmacol. 2003;59:29-33. [PubMed] |
| 13. | Begriche K, Igoudjil A, Pessayre D, Fromenty B. Mitochondrial dysfunction in NASH: causes, consequences and possible means to prevent it. Mitochondrion. 2006;6:1-28. [PubMed] [DOI] |
| 14. | Niemelä O, Parkkila S, Juvonen RO, Viitala K, Gelboin HV, Pasanen M. Cytochromes P450 2A6, 2E1, and 3A and production of protein-aldehyde adducts in the liver of patients with alcoholic and non-alcoholic liver diseases. J Hepatol. 2000;33:893-901. [PubMed] [DOI] |
| 15. | Yesilova Z, Yaman H, Oktenli C, Ozcan A, Uygun A, Cakir E, Sanisoglu SY, Erdil A, Ates Y, Aslan M. Systemic markers of lipid peroxidation and antioxidants in patients with nonalcoholic Fatty liver disease. Am J Gastroenterol. 2005;100:850-855. [PubMed] [DOI] |
| 16. | 张 智, 闪 增郁, 向 丽华, 陈 燕萍, 李 爽姿, 张 雪亮. 大鼠实验性高脂血症两种造模方法的比较. 中国中医基础医学杂志. 2004;10:33-34. |
| 17. | 秦 红波, 曹 浩强, 华 志元, 李 相成, 倪 全法. 高脂饮食致大鼠非酒精性脂肪肝模型的建立. 南京医科大学学报(自然科学版). 2008;28:973-976. |
| 18. | Simopoulos AP. n-3 fatty acids and human health: defining strategies for public policy. Lipids. 2001;36 Suppl:S83-S89. [PubMed] [DOI] |
| 19. | Nordøy A, Marchioli R, Arnesen H, Videbaek J. n-3 polyunsaturated fatty acids and cardiovascular diseases. Lipids. 2001;36 Suppl:S127-S129. [PubMed] [DOI] |
| 20. | Buang Y, Cha JY, Nagao K, Wang YM, Inoue N, Yanagita T. Alleviation of fatty liver by alpha-linolenic acid. J Nutr Sci Vitaminol (Tokyo). 2004;50:272-276. [PubMed] |
| 22. | Vijaimohan K, Jainu M, Sabitha KE, Subramaniyam S, Anandhan C, Shyamala Devi CS. Beneficial effects of alpha linolenic acid rich flaxseed oil on growth performance and hepatic cholesterol metabolism in high fat diet fed rats. Life Sci. 2006;79:448-454. [PubMed] [DOI] |
| 24. | Younossi ZM. Review article: current management of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2008;28:2-12. [PubMed] |
| 25. | Bayard M, Holt J, Boroughs E. Nonalcoholic fatty liver disease. Am Fam Physician. 2006;73:1961-1968. [PubMed] |