修回日期: 2009-11-02
接受日期: 2009-11-09
在线出版日期: 2009-11-28
目的: 观察饮食调整对SD大鼠非酒精性脂肪肝病(NAFLD)的治疗作用, 并探讨其作用机制.
方法: SD大鼠, ♂, 80只, 随机分为8 wk对照组(NG 8 wk组)、12 wk对照组(NG 12 wk组)、8 wk高脂组(HG 8 wk组)、12 wk高脂组(HG 12 wk组)及饮食调整组(DG组)各16只. NG组喂饲普通饲料, HG组喂饲高脂饲料, DG组喂饲高脂饲料, 8 wk后改普通饲料继续喂饲4 wk. 正糖高胰岛素钳夹实验检测葡萄糖输注率(GIR), 放射免疫法和生化法检测血清及肝匀浆生化指标; Western blot检测肝组织c-jun氨基末端激酶(JNK)1、胰岛素受体底物-1(IRS-1)、胰岛素受体底物-1丝氨酸307磷酸化(phospho-IRS-1Ser307, p-IRS-1Ser307)的表达.
结果: HG组与同期NG组大鼠比较, 体质量、肝指数、血清ALT、AST、TG、TC、FFAs、FIns、TNF-α及肝匀浆TG、TC、FFAs、MDA均明显升高(P<0.05或0.01), 肝匀浆SOD降低(t = 4.88, 7.92); GIR降低(均P<0.05); 肝组织JNK1蛋白表达、p-IRS1Ser307水平增高(t = 4.39, 5.81; 4.60, 6.48), JNK1蛋白表达强度与胰岛素抵抗呈正相关; HG 12 wk组和HG 8 wk组大鼠上述各项指标比较, 差异均具有统计学意义(P<0.05或0.01); 随着喂养时间的延长, HG组大鼠肝细胞脂肪变性明显加重; 而DG组大鼠的上述各项指标均得到明显改善, 但仍未达到同期NG组大鼠水平(均P<0.05).
结论: 高脂饮食喂养8 wk及12 wk分别能够构建SD大鼠NAFLD及NASH模型, 仅恢复正常饮食对于高脂饮食诱导的NAFLD有一定的治疗作用.
引文著录: 谭莺, 陈金虎, 张佳妮, 王利娟, 刘慧霞. 饮食调整对非酒精性脂肪肝病的治疗作用及机制. 世界华人消化杂志 2009; 17(33): 3394-3401
Revised: November 2, 2009
Accepted: November 9, 2009
Published online: November 28, 2009
AIM: To investigate the therapeutic effects of diet change on nonalcoholic fatty liver disease (NAFLD) and explore potential mechanisms involved.
METHODS: Eighty Sprague-Dawley male rats were randomly and equally divided into five groups: two normal control groups (NG8 and NG12 groups; fed a normal diet for 8 and 12 weeks, respectively), two high-fat diet groups (HG8 and HG12 groups; fed a high-fat diet for 8 and 12 weeks, respectively), and one diet change group (DG group; fed a high-fat diet for 8 weeks and a normal diet for another 4 weeks). The glucose infusion rate (GIR) was detected by the euglycemic hyperinsulinemic clamp test. The levels of ALT, AST, TG, TC, FFAs, FBS, FIns, TNF-α, SOD and MDA in the serum or liver were tested using a biochemistry automatic analyzer or by radioimmunoassay (RIA). The expression of c-Jun N-terminal protein kinase 1 (JNK1), insulin receptor substrate-1 (IRS-1) and phospho-IRS-1 Ser307 (p-IRS-1Ser307) was detected by Western blot.
RESULTS: Compared with the two matched NG groups, the body weight, liver index, the levels of ALT, AST, TG, TC, FFAs, FIns and TNF-α in the serum and TG, TC, FFAs and MDA in the liver increased (all P < 0.05 or 0.01), the level of SOD in the liver and GIR decreased (t = 4.88 and 7.92, respectively; both P < 0.05), and the expression of JNK1 protein and p-IRS-1Ser307 in the liver was upregulated in the two HG groups (t = 4.39, 5.81; 4.60, and 6.48, respectively). Significant differences were also noted in the above parameters between the HG8 and HG12 groups (all P < 0.05 or 0.01). A positive correlation was found between the expression intensity of JNK1 and insulin resistance (IR). The fatty degeneration of hepatocytes was aggravated in the HG groups with the prolongation of feeding time. In the DG group, all the above parameters were improved but did not return to normal levels as those in the NG groups (all P < 0.05).
CONCLUSION: A rat model of NAFLD and a rat model of NASH are established by feeding rats a high-fat diet for 8 weeks and 12 weeks, respectively. Diet change can improve NAFLD induced by a high fat diet.
- Citation: Tan Y, Chen JH, Zhang JN, Wang LJ, Liu HX. Therapeutic effects of diet change on nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2009; 17(33): 3394-3401
- URL: https://www.wjgnet.com/1009-3079/full/v17/i33/3394.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i33.3394
非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD)目前已经成为全球最常见的慢性肝病之一[1-2]. NAFLD的流行与肥胖症患病率的上升密切相关, 肥胖可引起胰岛素抵抗(insulin resistance, IR), 而IR是NAFLD发病机制的中心环节, 因而肥胖、IR和NAFLD之间关系密切[3-4]. 近年来研究发现, c-jun氨基末端激酶(c-Jun N-terminal kinase, JNK)信号通路在肥胖引起的IR中起重要作用, 但JNK信号通路如何导致IR及NAFLD的发生发展确切机制不明[5-6]. 高脂饮食等摄入热量过多的不良饮食方式容易导致肥胖、IR及NAFLD[7-8], 而通过饮食疗法来减轻肥胖及IR能有效地改善NAFLD, 但具体机制尚未完全阐明[9-11]. 尽管限制热量摄入的饮食疗法是有效的, 但目前尚无明确的饮食疗法方案确立, 研究表明, 过度限制热量摄入的饥饿疗法虽然减质量的疗效明显, 但却会加重NAFLD甚至进展为肝纤维化[12]; 而节食对于大多数患者来说难以坚持, 因而目前需要一种缓和、安全有效的饮食方案来改善NAFLD. 本研究通过喂饲SD大鼠高脂饮食构建NAFLD模型后, 改高脂饮食为正常饮食的方法, 观察饮食调整对NAFLD的治疗作用并探讨其作用机制.
清洁级♂SD大鼠80只, 体质量150-180 g, 由中南大学实验动物学部提供. 凯基全蛋白提取试剂盒(南京凯基生物科技有限公司)、BCA蛋白浓度测定试剂盒(美国Sigma公司)、JNK1小鼠IgG mAb、胰岛素受体底物1(insulin receptor substrate-1, IRS-1)小鼠mAb、胰岛素受体底物1丝氨酸307磷酸化(phospho-IRS-1Ser307, p-IRS-1Ser307)兔多克隆抗体及驴抗鼠二抗、驴抗兔二抗(美国Santa Cruz公司).
1.2.1 动物模型的建立: 实验动物普通饲料适应性喂养1 wk后将SD大鼠随机分为正常饮食组(NG组)32只和高脂饮食组(HG组)48只, NG组喂饲普通饲料, 其成分如下(按100 g计): 玉米粉32 g、小麦麸15 g、大豆粉15 g、芝麻饼10 g、面粉15 g、鸡蛋5 g、骨粉2 g、酵母粉2 g、食盐1 g、植物油1 g、奶粉2 g、复合维生素0.03 g; HG组喂饲高脂饲料, 为普通饲料加2%胆固醇和14%猪油, 2种饲料均为中南大学实验动物中心配制[13]. 8 wk末随机从2组中各抽取8只行正糖高胰岛素钳夹实验技术[14](简称钳夹技术)、另各抽取8只留取标本做相关指标检测, 称为8 wk对照组(NG 8 wk组)和8 wk高脂组(HG 8 wk组); 余下的NG组继续普通饲料喂养4 wk称为12 wk对照组(NG 12 wk组), 其余HG组再随机分为12 wk高脂组(HG 12 wk组) 和饮食调整组(DG组)各16只, HG 12 wk组继续高脂喂养, DG组改以普通饲料喂养, 均持续4 wk. 于第12周末将各组大鼠取8只行钳夹技术, 另各抽取8只留取标本做相关指标检测.
1.2.2 血清及肝匀浆生化指标检测: 空腹血糖(fasting blood sugar, FBS)、谷丙转氨酶(aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)均使用全自动生化分析仪检测. 空腹胰岛素(fast insulin, FIns)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)检测采用放射免疫法由全自动放射免疫γ测量仪测定. 超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)、游离脂肪酸(free fatty acids, FFAs)采用全波长分光光度计测定.
1.2.3 病理学检查: 部分新鲜肝组织以甲醛溶液固定, 制备冰冻切片及石蜡切片, 采用苏丹IV染色及HE染色. 判断肝脏脂肪变性程度分(-)-(++++)4个等级和慢性肝炎组织学活动指数(HAI)进行评价[15-16].
1.2.4 钳夹技术: 采用评价IR的金标准钳夹技术评价胰岛素敏感性: 大鼠均禁食过夜12 h, 用戊巴比妥钠1 mg/kg体质量腹腔注射麻醉后, 进行颈动脉和颈静脉插管并留置. 胰岛素、葡萄糖分别用2个微电脑数字式微量泵由颈静脉泵入, 血液标本由颈动脉导管获取. 胰岛素输注率为10.0 mU/(kg•min), 从颈动脉取血, 用微型血糖仪检测血糖值, 维持稳态血糖在(基础血糖值±0.5)mmol/L的范围内, 持续上述过程达2 h完成. 钳夹实验结束后, 计算灌流2 h的葡萄糖输注率(GIR), 判断大鼠的胰岛素敏感性.
1.2.5 Western blot分析: 肝右叶组织100 mg, 4 ℃匀浆后提取胞质蛋白, BCA法测定蛋白浓度. 蛋白变性后, 行聚丙烯酰胺凝胶电泳, 转移至PVDF膜, 50 g/L脱脂奶粉室温封闭2 h, 分别加入JNK1抗体(1:500)、IRS-1抗体(1:100)、p-IRS -1Ser307抗体(1:100)室温作用2 h, 洗涤后加入辣根过氧化酶结合的抗鼠IgG(1:4000)或抗兔IgG(1:5000), 作用1 h再洗膜. 然后化学发光试剂检测, X光片显影. 定量分析采用分子生物学图像分析系统测定各目的带灰度积分值, 所测结果为扣除背景的积分吸光度.
统计学处理 计量资料均以mean±SD表示, 两组间比较, 如数据符合正态分布采用t检验, 如符合偏态分布则采用秩和检验, 相关分析用秩相关, P<0.05认为有统计学意义. 采用SPSS14.0统计软件进行数据处理分析.
实验过程中各组大鼠均无死亡发生. 与同期NG组比较, HG组大鼠性情温顺, 不喜动, 毛发蓬乱无光泽, 大便稀软次数少; 体质量(t值: 5.90、7.92), 肝指数(t值: 5.75、7.42)均明显升高; HG 12 wk组大鼠体质量、肝指数均明显高于HG 8 wk组(t值: 5.05、5.03); DG组体质量、肝指数较HG 12 wk组明显降低(t值: 3.49、5.51), 但仍高于NG 12 wk组(t值: 3.79、3.53), 差异均具有统计学意义(P<0.05或0.01, 表1).
与同期NG组比较, HG组大鼠的ALT(T = 97、t = 5.49)、AST(t值: 4.99、5.31)、TG(T = 96、t = 7.37)、TC(t值: 2.30、5.86)、FIns(t值: 2.64、3.85)、FFAs(t值: 3.86、6.61)、TNF-α(t = 10.53、T = 100)水平及肝匀浆TG(t值: 7.07、6.18)、TC(T = 89.5、T = 100)、FFAs(t值: 5.20、6.18)、MDA(t值: 11.90、17.83)水平均增高, 肝匀浆SOD(t值: 4.88、7.92)水平降低, 差异均具有统计学意义(均P<0.05); HG 12 wk组与HG 8 wk组比较以上各项指标, 除肝匀浆SOD水平降低外其余指标均增高(血清: ALT: t = 2.39; AST: t = 2.26; TG: T = 95; TC: t = 2.19; FIns: t= 2.61; FFAs: t = 2.22; TNF-α: T = 92. 肝匀浆: TG: t = 3.14; TC: T = 93; SOD: t = 2.21; MDA: t = 8.59; FFAs: t = 2.61); DG组与HG 12 wk组比较: 除肝匀浆SOD水平升高外其余指标均降低(血清: ALT: t = 4.54; AST: t = 2.73; TG: t = 4.67; TC: t = 4.20; FIns: t = 2.41; FFAs: t = 2.79; TNF-α: T = 90.5. 肝匀浆: TG: t = 3.77; TC: t = 4.15; SOD: t = 6.01; MDA: t = 9.01; FFAs: t = 2.56); 而DG组与NG 12 wk组比较: 除肝匀浆SOD水平降低外其余指标均升高(血清: ALT: t = 5.35; AST: t = 3.73; TG: t = 4.40; TC: t = 2.48; FIns: t = 3.26; FFAs: t = 4.78; TNF-α: t = 10.38. 肝匀浆: TG: t = 6.39; TC: T = 96; SOD: t = 4.28; MDA: t = 3.78; FFAs: t = 3.59), 差异均具有统计学意义(均P<0.05); NG 12 wk组与NG 8 wk组比较以上各项指标, 差异均无统计学意义, 各组间的FBS比较, 差异均无统计学意义(P>0.05, 表2-3).
| 分组 | ALT(U/L) | AST(U/L) | TG(mmol/L) | TC(mmol/L) | FIns(μIU/mL) | FFAs(μmol/L) | FBS(mmol/L) | TNF-α(μg/L) |
| NG组 | ||||||||
| 8wk | 53.23±10.18 | 120.69±13.62 | 0.70±0.26 | 1.73±0.42 | 9.50±2.45 | 366.13±70.73 | 5.68±0.83 | 0.35±0.09 |
| 12wk | 52.00±8.75 | 123.29±11.47 | 0.74±0.25 | 1.88±0.38 | 10.17±3.38 | 381.00±55.42 | 5.11±0.50 | 0.36±0.13 |
| HG组 | ||||||||
| 8wk | 84.88±14.5a | 149.33±8.85a | 1.35±0.35a | 2.58±0.95a | 13.94±4.09a | 510.63±78.77a | 5.55±0.73 | 1.06±0.17a |
| 12wk | 99.31±8.99ac | 167.01±20.28ac | 2.03±0.43ac | 3.48±0.68ac | 22.64±8.50ac | 601.38±84.37ac | 5.40±0.60 | 1.34±0.30ac |
| DG组 | 77.44±10.22ae | 144.56±11.34ae | 1.24±0.21ae | 2.34±0.37ae | 15.08±2.59ae | 505.38±48.73ae | 5.45±0.65 | 1.11±0.37ae |
| 分组 | TG(mmol/L) | TC(mmol/L) | SOD(U/mgpro) | MDA(nmol/mgpro) | FFAs(μmol/gpro) |
| NG | |||||
| 8 wk组 | 1.61±0.23 | 0.76±0.44 | 21.64±3.99 | 0.72±0.14 | 408.32±70.73 |
| 12 wk组 | 1.69±0.15 | 0.90±0.35 | 22.03±3.56 | 0.76±0.27 | 425.61±61.76 |
| HG | |||||
| 8 wk组 | 3.79±0.84a | 1.78±0.89a | 13.00±3.03a | 3.91±0.75a | 598.70±75.75a |
| 12 wk组 | 5.48±1.26ac | 3.20±0.39ac | 10.06±2.23ac | 7.98±1.11ac | 705.56±87.65ac |
| DG组 | 3.50±0.79ae | 2.01±0.71ae | 16.04±1.72ae | 2.53±1.30ae | 580.95±105.87dae |
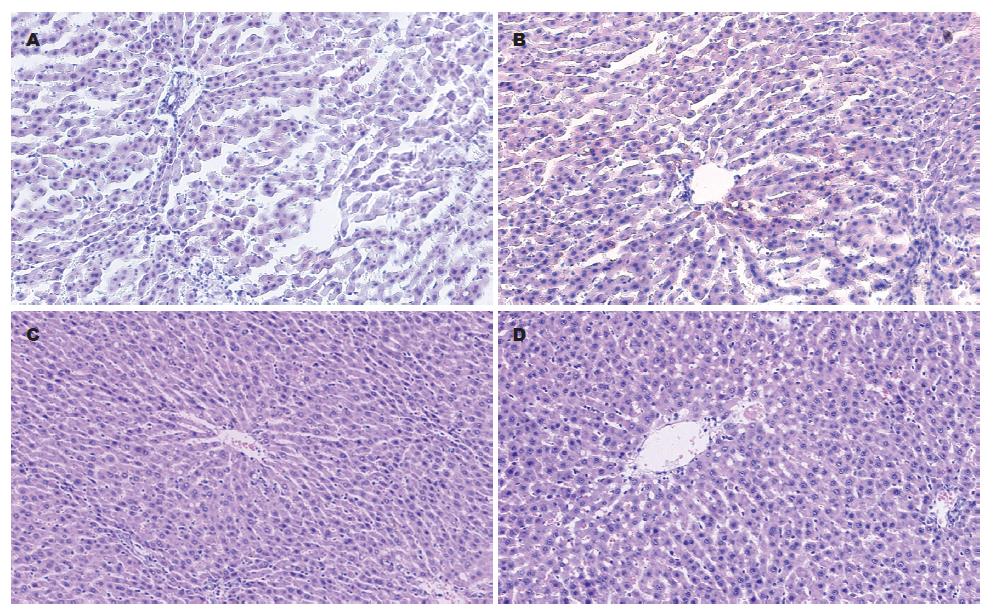
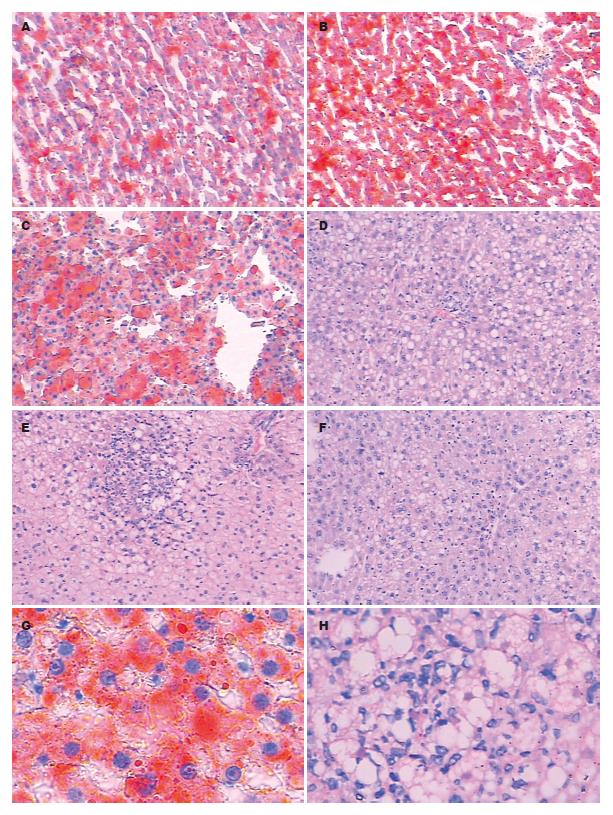
肝标本经苏丹Ⅳ及HE染色, 光镜下显示NG组大鼠肝组织形态学表现正常, 而HG 8 wk组、HG 12 wk组所有动物肝组织均出现不同程度的肝细胞脂肪变性, 肝细胞体积增大, 细胞质内可见大小不等的脂滴空泡, 肝组织脂肪变性程度与高脂饮食时间相关; HG 8 wk组为中度脂肪变性; HG 12 wk组为中-重度脂肪变性并小叶内及汇管区有以单核、淋巴细胞为主的炎症细胞浸润, 该组中所有大鼠都已进展为非酒精性脂肪肝炎(nonalcoholic steatohepatitis, NASH)阶段. 饮食治疗4 wk后DG组肝脂肪变性程度较HG 12 wk组减少, 为轻-中度脂肪变性, HAI积分: DG组 vs HG 12 wk组: 2.88±0.35 vs 4.00±0.76, t = 3.81, P<0.01(图1-2, 表4).
| 分组 | 肝脂变程度 | ||||
| - | + | ++ | +++ | ++++ | |
| NG | |||||
| 8 wk组 | 8 | ||||
| 12 wk组 | 8 | ||||
| HG | |||||
| 8 wk组 | 0 | 0 | 7 | 1 | 0 |
| 12 wk组 | 0 | 0 | 0 | 6 | 2 |
| DG组 | 0 | 3 | 5 | 0 | 0 |
与同期NG组比较, HG组大鼠GIR[mg/(kg•min)]水平明显降低 (HG 8 wk组 vs NG 8 wk组: 8.11±1.09 vs 10.77±1.26, t = 4.52, HG 12 wk组 vs NG 12 wk组: 6.31±1.46 vs 10.66±1.24, t = 6.41), HG 12 wk组GIR水平明显低于HG 8 wk组(t = 2.79), DG组的GIR水平(7.83±1.06)较HG 12 wk组升高, 但仍低于NG 12 wk组(t值分别为2.38、4.91), 差异均具有统计学意义(均P<0.05); NG 12 wk组与NG 8 wk组GIR水平比较差异无统计学意义(P>0.05).
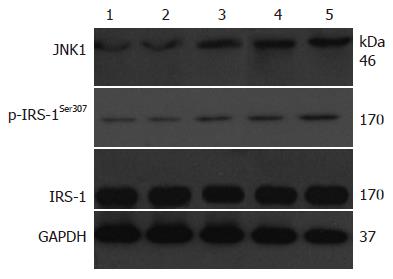
与同期NG组比较, HG组大鼠肝组织JNK1蛋白表达(t = 4.39、5.81)、p-IRS-1Ser307(t值: 4.06、6.48)水平增高; 与HG8 wk组比较, HG 12 wk组的JNK1蛋白表达、p-IRS-1Ser307水平升高(t = 2.92、2.47); DG组较HG 12 wk组JNK1蛋白表达、p-IRS-1Ser307水平降低(t值: 2.41、2.45), 但仍高于NG 12 wk组(t值: 4.45、6.99), 差异均具有统计学意义(均P<0.05); 各组间的IRS-1蛋白表达比较, 差异均无统计学意义(均P>0.05); NG 12 wk组与NG8 wk组比较以上各项指标, 差异均无统计学意义(均P>0.05, 图3).
将HG 8 wk组、HG 12 wk组、DG组的GIR与肝组织JNK1蛋白进行相关性分析后发现: GIR与JNK1蛋白表达呈明显负相关(Pearson: -0.671, P<0.01); 即JNK1蛋白表达与IR水平呈正相关.
研究表明, 高脂饮食是NAFLD发病的危险因素, 可导致肥胖及IR, 而IR是NAFLD发病的关键环节[17-20]. 本研究通过喂饲SD大鼠脂肪占总热量45%的高脂饲料8 wk成功的构建了NAFLD模型, 12 wk形成了NASH. 同时观察到NAFLD SD大鼠体质量、肝指数增高, 并伴有IR、高INS血症、高脂血症、血清转氨酶升高等代谢特征, 且随着高脂饲料喂养时间的延长, 以上异常逐渐加重; 病理切片显示肝脏脂肪变性程度增加, 呈明显时间依赖性, 以上研究证实高脂饮食可促进NAFLD的发生发展.
许多研究表明高脂饮食造成营养过剩, 将引起体内糖脂代谢产物及自由基的大量堆积, 这些产物可直接反馈抑制INS所介导的糖脂代谢. 同时, 机体往往处于炎症或氧化应激状态, 伴有炎症因子水平升高, 从而激活相应的应激信号通路包括JNK信号通路等, 干扰INS的信号转导而导致IR[21-22]. 目前认为, JNK信号通路在肥胖引起的IR中起关键作用, 在高脂饮食诱导的肥胖小鼠中INS敏感组织包括肝脏、脂肪等JNK活性明显升高, 而敲除JNK1基因的高脂饮食肥胖小鼠IR及肥胖明显减轻, 说明JNK1在肥胖及IR的发生发展中起着重要作用[5,23-24]. IRS-1是INS信号通路上的关键蛋白, JNK1与IRS-1结合后, 导致p-IRS-1Ser307水平增高, 抑制IRS-1的酪氨酸磷酸化, 从而下调INS信号传导, 导致IR[25-26]. 本研究结果证实, 正常大鼠的肝组织JNK1蛋白表达及p-IRS-1Ser307水平较弱, 而以上指标在高脂饮食诱导的NAFLD大鼠明显增高, 且JNK1蛋白表达与IR水平呈正相关, 而各组间肝组织的IRS-1蛋白表达无明显改变, 表明高脂饮食诱导的NAFLD是通过促进肝组织JNK1增高, 其与IRS-1结合后通过影响IRS-1的磷酸化功能, 下调INS信号传导从而导致IR.
研究表明TNF-α、FFAs、氧化应激反应均可以诱导IR, 他们可以特异性的激活JNK信号通路, 增加IRS-1的丝氨酸磷酸化, 抑制酪氨酸磷酸化来减弱IRS-1的活性, 从而导致IR[27,28]. 本研究结果显示NAFLD大鼠的TNF-α、FFAs、MDA水平升高, 而SOD水平降低, 并呈明显时间依赖性, 说明脂肪因子、脂质代谢异常及氧化应激反应通过导致IR而参与了NAFLD的发生发展过程.
目前NAFLD尚无有效的治疗方法, 去脂药物治疗周期长, 不良反应大且费用高. 大量研究表明, 饮食治疗和运动结合能有效改善NAFLD[29-31], 但对于现代人来说, 节食和长期运动都难以坚持, 而且节食过度的饥饿疗法又缺乏一定的安全性, 故本研究采取改高脂饮食为正常饮食的方法治疗NAFLD大鼠4 wk来观察其治疗效果. 结果表明: 高脂饮食形成的NAFLD经饮食调整后能明显减轻体质量, 改善血脂异常、肝功能损伤、脂肪因子异常、氧化应激反应及IR水平, 延缓肝脂肪变性的发展, 其机制可能为正常饮食治疗通过抑制JNK1的活性, 减少p-IRS-1Ser307水平, 增强IRS-1的功能, 促进INS信号通路的传导, 进而减弱IR, 同时降低TNF-α、FFAs水平, 减弱氧化应激反应, 从而改善NAFLD. 通过饮食调整可以明显的改善NAFLD, 但仍无法恢复到正常水平, 要达到完全逆转肝损害, 可能需视情况合用药物治疗.
本研究证实了喂饲SD大鼠高脂饮食8 wk可成功构建NAFLD大鼠模型, 12 wk可形成NASH, IR贯穿其发病始终, JNK信号通路与IR密切相关; 而恢复正常饮食对于改善NAFLD, 延缓其发展有明显的效果, 治疗有效安全, 为治疗NAFLD提供了理论依据及新途径, 说明科学合理的饮食方式等健康的生活习惯在NAFLD的防治中起着重要作用.
研究表明, 高脂饮食是NAFLD发病的危险因素, 可导致肥胖及IR, 而IR是NAFLD发病的关键环节. 因而肥胖、IR和NAFLD之间关系密切. 通过饮食疗法来减轻肥胖及IR能有效地改善NAFLD, 但具体机制尚未完全阐明.
宣世英, 教授, 山东省青岛市市立医院肝病内科
目前NAFLD尚无有效的治疗方法, 去脂药物治疗周期长, 不良反应大且费用高. 饮食治疗和运动结合能有效改善NAFLD, 但对于现代人来说, 节食和长期运动都难以坚持, 而且节食过度的饥饿疗法又缺乏一定的安全性. 故如何开展NAFLD的治疗成为亟待解决的问题.
Houstis et al研究表明TNF-α、FFAs、氧化应激反应均可以诱导IR, 他们可以特异性的激活JNK信号通路, 增加IRS-1的丝氨酸磷酸化, 抑制酪氨酸磷酸化来减弱IRS-1的活性, 从而导致IR. 目前认为, JNK1在肥胖及IR的发生发展中起着重要作用.
本研究通过喂饲SD大鼠高脂饮食构建NAFLD模型后, 改高脂饮食为正常饮食的方法, 观察饮食调整对NAFLD的治疗作用, 并探讨其作用机制, 试图为NAFLD的治疗提供理论依据.
本研究证实了喂饲SD大鼠高脂饮食8 wk可成功构建NAFLD大鼠模型, 12 wk可形成NASH, IR贯穿其发病始终, 而恢复正常饮食对于改善NAFLD, 延缓其发展有明显的效果, 治疗有效安全, 为治疗NAFLD提供了理论依据及新途径, 说明科学合理的饮食方式等健康的生活习惯在NAFLD的防治中起着重要作用.
本研究对于阐明"饮食调节可改善脂肪肝"的理论有一定帮助, 工作量可观, 然而重点不够突出.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Preiss D, Sattar N. Non-alcoholic fatty liver disease: an overview of prevalence, diagnosis, pathogenesis and treatment considerations. Clin Sci (Lond). 2008;115:141-150. [PubMed] [DOI] |
| 2. | Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol. 2009;50:204-210. [PubMed] [DOI] |
| 3. | Machado M, Marques-Vidal P, Cortez-Pinto H. Hepatic histology in obese patients undergoing bariatric surgery. J Hepatol. 2006;45:600-606. [PubMed] [DOI] |
| 4. | Patel AA, Torres DM, Harrison SA. Effect of weight loss on nonalcoholic fatty liver disease. J Clin Gastroenterol. 2009;43:970-974. [PubMed] [DOI] |
| 5. | Hirosumi J, Tuncman G, Chang L, Görgün CZ, Uysal KT, Maeda K, Karin M, Hotamisligil GS. A central role for JNK in obesity and insulin resistance. Nature. 2002;420:333-336. [PubMed] [DOI] |
| 6. | Yang R, Wilcox DM, Haasch DL, Jung PM, Nguyen PT, Voorbach MJ, Doktor S, Brodjian S, Bush EN, Lin E. Liver-specific knockdown of JNK1 up-regulates proliferator-activated receptor gamma coactivator 1 beta and increases plasma triglyceride despite reduced glucose and insulin levels in diet-induced obese mice. J Biol Chem. 2007;282:22765-22774. [PubMed] [DOI] |
| 7. | Ahmed U, Redgrave TG, Oates PS. Effect of dietary fat to produce non-alcoholic fatty liver in the rat. J Gastroenterol Hepatol. 2009;24:1463-1471. [PubMed] [DOI] |
| 8. | Safwat GM, Pisano S, D'Amore E, Borioni G, Napolitano M, Kamal AA, Ballanti P, Botham KM, Bravo E. Induction of non-alcoholic fatty liver disease and insulin resistance by feeding a high-fat diet in rats: does coenzyme Q monomethyl ether have a modulatory effect? Nutrition. 2009;25:1157-1168. [PubMed] [DOI] |
| 9. | Fan JG, Zhong L, Xu ZJ, Tia LY, Ding XD, Li MS, Wang GL. Effects of low-calorie diet on steatohepatitis in rats with obesity and hyperlipidemia. World J Gastroenterol. 2003;9:2045-2049. [PubMed] |
| 10. | Huang MA, Greenson JK, Chao C, Anderson L, Peterman D, Jacobson J, Emick D, Lok AS, Conjeevaram HS. One-year intense nutritional counseling results in histological improvement in patients with non-alcoholic steatohepatitis: a pilot study. Am J Gastroenterol. 2005;100:1072-1081. [PubMed] [DOI] |
| 12. | Andersen T, Gluud C, Franzmann MB, Christoffersen P. Hepatic effects of dietary weight loss in morbidly obese subjects. J Hepatol. 1991;12:224-229. [PubMed] [DOI] |
| 14. | Kraegen EW, James DE, Bennett SP, Chisholm DJ. In vivo insulin sensitivity in the rat determined by euglycemic clamp. Am J Physiol. 1983;245:E1-E7. [PubMed] |
| 17. | Toshimitsu K, Matsuura B, Ohkubo I, Niiya T, Furukawa S, Hiasa Y, Kawamura M, Ebihara K, Onji M. Dietary habits and nutrient intake in non-alcoholic steatohepatitis. Nutrition. 2007;23:46-52. [PubMed] [DOI] |
| 18. | Bugianesi E, McCullough AJ, Marchesini G. Insulin resistance: a metabolic pathway to chronic liver disease. Hepatology. 2005;42:987-1000. [PubMed] [DOI] |
| 21. | Saltiel AR, Kahn CR. Insulin signalling and the regulation of glucose and lipid metabolism. Nature. 2001;414:799-806. [PubMed] [DOI] |
| 22. | Svegliati-Baroni G, Candelaresi C, Saccomanno S, Ferretti G, Bachetti T, Marzioni M, De Minicis S, Nobili L, Salzano R, Omenetti A. A model of insulin resistance and nonalcoholic steatohepatitis in rats: role of peroxisome proliferator-activated receptor-alpha and n-3 polyunsaturated fatty acid treatment on liver injury. Am J Pathol. 2006;169:846-860. [PubMed] [DOI] |
| 23. | 陈 金虎, 刘 慧霞, 张 佳妮, 全 养雅, 郭 敏, 谭 莺. c-jun氨基末端激酶在非酒精性脂肪肝病胰岛素抵抗大鼠中的表达及意义. 中国现代医学杂志. 2009;19:1782-1785, 1789. |
| 24. | Sabio G, Das M, Mora A, Zhang Z, Jun JY, Ko HJ, Barrett T, Kim JK, Davis RJ. A stress signaling pathway in adipose tissue regulates hepatic insulin resistance. Science. 2008;322:1539-1543. [PubMed] [DOI] |
| 25. | Nakatani Y, Kaneto H, Kawamori D, Hatazaki M, Miyatsuka T, Matsuoka TA, Kajimoto Y, Matsuhisa M, Yamasaki Y, Hori M. Modulation of the JNK pathway in liver affects insulin resistance status. J Biol Chem. 2004;279:45803-45809. [PubMed] [DOI] |
| 26. | Tilg H, Moschen AR. Insulin resistance, inflammation, and non-alcoholic fatty liver disease. Trends Endocrinol Metab. 2008;19:371-379. [PubMed] [DOI] |
| 27. | Houstis N, Rosen ED, Lander ES. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature. 2006;440:944-948. [PubMed] [DOI] |
| 28. | Gual P, Le Marchand-Brustel Y, Tanti JF. Positive and negative regulation of insulin signaling through IRS-1 phosphorylation. Biochimie. 2005;87:99-109. [PubMed] [DOI] |
| 29. | Vieira VJ, Valentine RJ, Wilund KR, Antao N, Baynard T, Woods JA. Effects of exercise and low-fat diet on adipose tissue inflammation and metabolic complications in obese mice. Am J Physiol Endocrinol Metab. 2009;296:E1164-E1171. [PubMed] [DOI] |
| 30. | Mensink RP, Plat J, Schrauwen P. Diet and nonalcoholic fatty liver disease. Curr Opin Lipidol. 2008;19:25-29. [PubMed] [DOI] |
| 31. | Bellentani S, Dalle Grave R, Suppini A, Marchesini G. Behavior therapy for nonalcoholic fatty liver disease: The need for a multidisciplinary approach. Hepatology. 2008;47:746-754. [PubMed] [DOI] |