修回日期: 2009-11-09
接受日期: 2009-11-16
在线出版日期: 2009-11-28
目的: 观察p55γ N末端24个氨基酸的过表达对胃癌MGC803细胞迁移的影响.
方法: 通过脂质体介导用pEGFPN24和空载体pEGFPC1质粒进行基因转染, 建立稳定表达融合蛋白GFP-N24和GFP的细胞系; 通过细胞划痕实验和迁移实验观察GFP-N24的过表达对细胞运动迁移的影响; 明胶酶谱实验观察其对肿瘤转移相关基因MMP9表达和分泌的影响; 免疫印迹实验检测GFP-N24的过表达对PI3K-Akt信号通路活性的影响.
结果: 建立了稳定表达融合蛋白GFP-N24的MGC803/GFP-N24细胞系和表达GFP的MGC803/GFP细胞系. 细胞划痕实验和细胞迁移实验发现表达GFP-N24的MGC803细胞运动迁移能力下降(t = 0.003, P<0.01). GFP-N24通过减少磷酸化Akt的表达而抑制PI3K-Akt信号的活性, 但其对MMP9的表达和分泌没有影响.
结论: PI3K p55γ N末端24个氨基酸通过抑制PI3K-Akt信号通路的活性而抑制胃癌MGC803细胞的迁移, 其在胃癌的治疗上可能具有潜在的应用前景.
引文著录: 李珅, 郭红艳, 吴琦, 张梅, 高涵, 孙晓杰. PI3K p55γ N末端氨基酸过表达对胃癌MGC803细胞迁移的影响. 世界华人消化杂志 2009; 17(33): 3381-3386
Revised: November 9, 2009
Accepted: November 16, 2009
Published online: November 28, 2009
AIM: To investigate the effects of overexpression of the N-terminal 24-amino acid domain of p55γ regulatory subunit (N24p55γ) of phosphoinositide 3-kinase (PI3K) on the migration of human gastric carcinoma MGC803 cells.
METHODS: MGC803/GFP-N24 and MGC803/GFP cell lines stably expressing N24p55γ-GFP fusion protein (GFP-N24) and GFP protein alone were generated by transfection of MGC803 cells with pEGFPN24 plasmid and control plasmid pEGFPC1, respectively. The impact of GFP-N24 overexpression on cell motility and migration was detected by wound healing assay and Transwell migration assay. The expression and secretion of tumor metastasis-related protein matrix metalloproteinase-9 (MMP9) were determined by gelatin zymography. The effect of GFP-N24 overexpression on the activity of the PI3K-Akt signaling pathway was analyzed by Western blot.
RESULTS: The MGC803/GFP-N24 cell line steadily expressing the GFP-N24 fusion protein and the MCG803/GFP cell line steadily expressing GFP were successfully established. The results of wound healing assay and Transwell migration assay showed that the in vitro migration of MGC803/GFP-N24 cells was restricted (t = 0.003, P < 0.01). GFP-N24 overexpression inhibited the activity of PI3K-Akt signaling pathway by decreasing the expression of phospho-Akt in MGC803 cells. However, GFP-N24 overexpression did not alter the expression and secretion of MMP9 protein.
CONCLUSION: Ectopic expression of N24p55γ inhibits cell migration in vitro by suppressing the activity of the PI3K-Akt signaling pathway in MGC803 cells. The N24p55γ peptide can potentially be used to treat gastric carcinoma.
- Citation: Li S, Guo HY, Wu Q, Zhang M, Gao H, Sun XJ. Overexpression of the N-terminal 24-amino acid domain of p55γ regulatory subunit of PI3K inhibits the migration of human gastric carcinoma MGC803 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(33): 3381-3386
- URL: https://www.wjgnet.com/1009-3079/full/v17/i33/3381.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i33.3381
胃癌在全球常见恶性肿瘤中居第4位, 而42%的病例发生在中国. 据WHO最新统计, 至2005年胃癌仍是居中国癌症死亡率首位的恶性肿瘤[1]. 磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)参与细胞内多种信号转导机制, 调节细胞的增殖、分化、迁移、凋亡以及胰岛素刺激的葡萄糖转运等. PI3K活性的异常与多种人类肿瘤的发生相关, 近年来大量文献报道PI3K和其下游分子Akt所组成的信号通路(PI3K-Akt信号通路)与肿瘤侵袭转移的主要事件如肿瘤细胞的迁移黏附、肿瘤血管生成以及细胞外基质的降解等相关. 作为PI3K的调节亚基, p55γ以其独特的N末端与视网膜母细胞瘤(retinoblastoma, Rb)蛋白相互作用, 调节细胞周期的进程[2-3]. 前期研究发现, p55γ参与生长因子介导的细胞迁移过程, 其N末端24个氨基酸(N-terminal 24 amino acid, N24)的过表达在体内和体外均能抑制胃癌细胞的生长, 表现为细胞生长速度减慢、细胞周期阻滞、克隆形成能力以及在裸鼠中的成瘤能力降低等[4-5]. 在此基础上, 我们进一步研究N24的过表达对胃癌MGC803细胞迁移的影响, 并初步探讨其作用的分子机制, 为开发以PI3K信号通路为靶点的抗肿瘤药物奠定基础.
本研究所用细胞MGC803为胃低分化黏液腺癌细胞系, 由中国医学科学院肿瘤研究所提供. 细胞用含100 g/L小牛血清的RPMI 1640培养液在50 mL/L CO2、37 ℃条件下培养. 本实验所使用的空载体质粒pEGFPC1和重组质粒pEGFPN24由美国霍普金斯大学医学院夏献民博士惠赠, 该质粒转染真核细胞后分别表达绿色荧光蛋白GFP和融合蛋白GFP-N24. RPMI 1640和Pestained protein marker为Gibco BRL公司产品, GFP多克隆抗体购自BD公司, pAkt(473Ser)多克隆抗体为Cell signaling公司产品, β-actin mAb、Fibronectin和Collagen为Sigma公司产品, 细胞培养瓶、Transwell培养板为Costar公司产品, Wortmannin购自生物晶美公司, 为Upstate公司产品, 结晶紫和Gelatin为鼎国生物技术公司产品.
1.2.1 基因转染: 采用Lipofectamine进行基因转染, 具体操作按说明书进行. 生长良好的细胞于转染前1 d接种到培养板中, 经16-18 h后, 细胞总面积达到60%-70%时用pEGFPN24重组质粒和空载体质粒pEGFPC1各3 μg进行基因转染. 用含G418的选择性培养基筛选抗性克隆(浓度前3 d为600 mg/L, 以后为400 mg/L), 建立稳定表达融合蛋白GFP-N24的803/GFP-N24多克隆pooled细胞系和表达GFP的803/GFP空载体多克隆pooled细胞系, 通过Western blot方法鉴定融合蛋白GFP-N24的表达. 稳定转染的细胞系用含200 mg/L G418的培养液扩大培养用于实验.
1.2.2 免疫印迹: 收集生长状态良好的细胞, 用含PMSF的PBS洗2遍. 加入蛋白裂解液RIPA (50 mmol/L Tris pH 7.5, 1.0 mmol/L EDTA, 150 mmol/L NaCl, 1 g/L SDS, 10 g/L TritonX-100, 10 g/L去氧胆酸钠), 冰浴30 min. 4 ℃12000 r/min离心10 min, 取上清, 采用Bradford法进行蛋白定量后进行SDS-PAGE及转膜. 50 g/L脱脂奶粉室温封闭2 h; 加一抗4 ℃过夜(GFP和pAkt为1:1000, β-actin为1:5000); TTBS漂洗3次后加二抗, 室温孵育45 min; TTBS漂洗3次后进行ECL显色, 显影于X光片上, 用Umax2100XL扫描及Quantity One图像分析系统测定吸光度值(A值).
1.2.3 细胞划痕实验: 将生长状态良好的细胞按每孔1×105种植于6孔培养板上, 细胞长至60%-70%汇合, 形成单细胞层. 对照组细胞先用200 nmol/L的Wortmannin处理30 min再种植于6孔培养板上. 分别观察MGC803、MGC803+WT、MGC803/GFP、MGC803/GFP-N24 4组细胞0、24和48 h的增殖速度. 同时用塑料加样器在另外4组单层细胞上划过, 形成一个创伤口. 继续培养48 h, 在0、24和48 h分别观察伤口愈合情况[6].
1.2.4 细胞迁移实验: 细胞培养至良好状态, 常规胰酶消化. 计数1×105细胞, 加入Transwell迁移小杯, 对照组细胞先用200 nmol/L的Wortmannin处理30 min后再加入迁移小杯. 将迁移小杯放入含RPMI 1640的24孔板中, 于37 ℃、50 mL/L CO2条件下培养8 h. 取出迁移小杯, 以PBS轻轻冲洗后, 用棉花棒轻轻擦去杯底膜上层的细胞. 950 mL/L乙醇固定细胞10 min, 2 g/L结晶紫染色20 min, PBS冲洗, 10 g/L SDS 200 μL于37 ℃溶解1 h后, 酶标仪测A620值, 结果进行统计学分析[7].
1.2.5 明胶酶谱实验: 在6孔板中接种相同数量的各组转染细胞, 进行无血清培养, 48 h后收集上清. 按Fridman et al[8]方法, 在分离胶的配制中, 加10 g/L明胶使之终浓度为1 g/L, 100 g/L非还原性SDS-PAGE电泳, 进行基质金属蛋白酶(matrix metalloproteinase, MMP)酶谱实验. 样品不经加热变性, 与非还原性上样缓冲液混合上样. 电泳结束后, 取下胶, 蒸馏水漂洗后, 于25 g/L TritonX-100中室温轻摇2 h. 蒸馏水漂洗后, 将胶放入明胶酶缓冲液中, 置于37 ℃摇床缓慢摇动5-12 h. 2.5 g/L考马斯亮蓝R250染色4 h, 脱色液中脱色, 直至出现负染带.
统计学处理 实验数据均以mean±SD表示, 使用SPSS13.0 for Windows软件包进行t检验, P<0.05为差异有统计学意义.
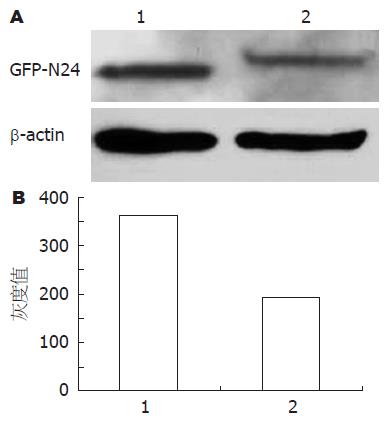
由于pEGFPC1载体表达绿色荧光蛋白GFP, 用抗GFP的抗体通过Western blot方法对稳定转染的多克隆pooled细胞中外源基因的表达进行了检测. 结果发现N24p55γ能够在MGC803细胞中得到表达, 但融合蛋白GFP-N24的表达量低于空载体中GFP的表达量(图1).
在无血清培养的条件下观察细胞的运动迁移, 结果各组细胞的生长速度都很缓慢, 细胞不发生迁移, 伤口在0、24和48 h没有明显变化, 各组细胞之间没有明显差异. 而给细胞添加血清后细胞发生迁移(图2), 但MGC803/GFP-N24组细胞迁移速度缓慢, 在划痕24 h后创伤口变化与0 h差异不大, 但此时对照MGC803/GFP细胞和亲本细胞伤口则已有部分愈合, 其迁移速度明显大于MGC803/GFP-N24组. 在划痕后48 h, 亲本细胞和对照组细胞伤口已经基本愈合, 但MGC803/GFP-N24组细胞伤口尚未愈合. 可见GFP-N24的表达抑制了MGC803细胞的运动迁移, 但其抑制作用低于PI3K抑制剂Wortmannin.
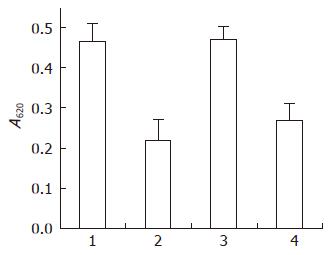
Transwell细胞迁移实验显示, 亲本细胞和对照空载体组细胞有大量细胞穿过, 而MGC803/GFP-N24组穿过膜的细胞明显减少, 经PI3K抑制剂Wortmannin处理后的亲本细胞于镜下仅见少量的细胞穿过, 经检测MGC803、MGC803+WT、MGC803/GFP以及MGC803/GFP-N24细胞的A620值分别为0.466±0.041、0.217±0.053、0.471±0.033、0.270±0.046, MGC803/GFP-N24组与空载体相比, 差异有统计学意义(P<0.01, t = 0.003, 图3).
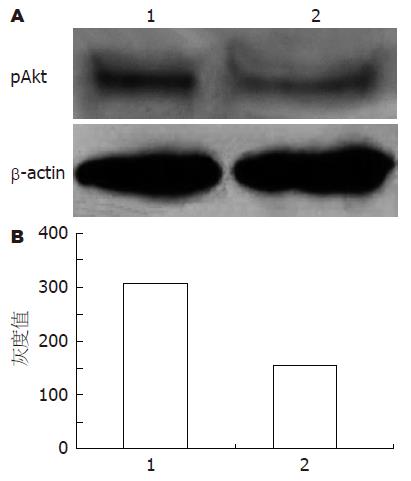
由于p55γ与催化亚基p110结合后能表现PI3K的活性, 进而通过磷酸化作用激活其下游靶蛋白PKB(Akt), 导致PI3K-Akt信号通路的活化, 进而调节细胞的增殖、分化和迁移. 因此在没有其他因素的影响下, 可以用细胞中磷酸化Akt(pAkt)的表达水平代表PI3K-Akt信号通路的活性[9]. 实验中收集对数生长期的各组转染细胞, 分别提取细胞总蛋白, 通过免疫印迹方法检测细胞中总pAkt的表达. 结果与对照空载体细胞相比, MGC803/GFP-N24细胞中, pAkt的表达量明显减少(图4), 表明融合蛋白GFP-N24的过表达对PI3K信号通路下游蛋白激酶PKB(Akt)的活化具有抑制作用.
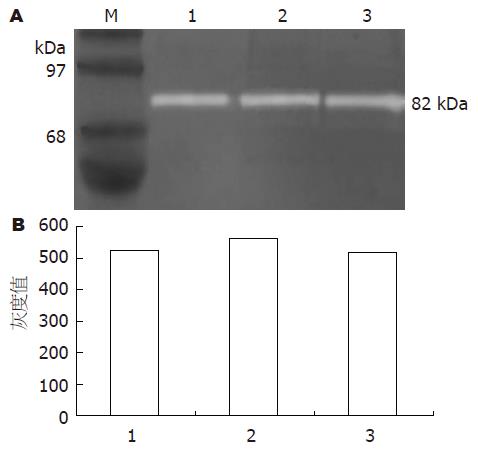
肿瘤侵袭转移的潜能与肿瘤组织产生MMP的能力存在密切的正相关性. 明胶酶谱实验结果显示: 在各组细胞上清中均检测到相对分子质量为82 kDa的活化型MMP9, 3组细胞在表达量上没有明显差异, 但未检测到92kDa的酶原型MMP9(图5). 表明融合蛋白GFP-N24的表达没有影响细胞中MMP9的表达和分泌.
p55γ是Pons et al[10]于1995年通过筛选鼠cDNA表达文库分离得到的新的PI3K调节亚基. 在结构上p55γ与调节亚基P85α和P85β在C末端70%同源, 能与催化亚基P110结合表现PI3K的活性, 不同之处是其N末端缺乏SH3、BCR以及富脯氨酸基序等蛋白结合结构域, 但却含有具有潜在磷酸化位点Tyr-22的YXXM基序. 关于p55γ在细胞中的功能目前尚不完全清楚.
本研究建立了稳定表达N24p55γ的MGC803细胞系, 此24个氨基酸序列为MDRDDADWREVMMPYSTELIFYIE. 我们发现N24的过表达能抑制MGC803细胞的运动迁移能力. 大量文献报道在肿瘤侵袭转移过程中常伴随着PI3K-Akt信号通路的组成性活化[11]. 作为PI3K的下游靶分子, Akt通过PDK1的磷酸化作用而被激活, 活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白如Bad、caspase9、NF-κB、GSK-3、FKHR、P21Cip1和P27 Kip1等, 调节细胞的存活、生长、分化、血管形成和迁移等功能. 本研究发现转染N24p55γ的细胞中pAkt的表达量明显减少, 推测GFP-N24通过下调细胞中pAkt的表达而抑制PI3K-Akt信号通路的活性, 这不仅使由Akt活化所导致的细胞增殖受阻, 而且在某种程度上也可能对PI3K-Akt信号通路所参与的肿瘤的侵袭和转移行为有所抑制. MMP是肿瘤侵袭转移过程中细胞外基质重建或降解、去除细胞迁移屏障的关键酶, 肿瘤侵袭转移的潜能与肿瘤组织产生MMP的能力呈正相关性, 而MMP9与多种人类肿瘤的侵袭和转移都相关[12-13], 但本研究中GFP-N24的过表达并没有影响细胞中MMP9的表达. 上述结果表明, 抑制PI3K-Akt信号通路关键分子pAkt的表达可能是N24p55γ抑制MGC803细胞运动迁移的主要机制.
据报道[14], 正常情况下细胞中内源性p55γ的蛋白表达量却极低, 几乎检测不到, 而本实验中在MGC803细胞中亦未检测出内源性p55γ的蛋白表达, 所以本实验可以忽略胃癌MGC803细胞野生型PI3K p55γ调节亚基的微量mRNA对实验结果的影响. 另外, 本实验融合蛋白GFP-N24的表达量虽然不高, 但细胞划痕实验和迁移实验结果良好, 我们经过数次努力未将表达量提高, 这将是我们将来努力的方向, 相信高表达量的载体将会带来更好的抑制细胞迁移能力.
目前PI3K-Akt信号通路已成为抗肿瘤药物研究领域的热点[15-16], 在肝癌[17]、乳腺癌[18]、肾脏肿瘤[19]的靶向治疗中都有较深入的研究. 胃癌分子靶向治疗已经成为优于手术、放疗、化疗三大传统治疗方案的新趋势, 具有高分子特异性、高选择性、高效性、低副作用的优点[20]. 而且现阶段应用于临床的20多类靶向药物具有耐药时间不够长、种类少、造价高等缺点, 临床上急需更多高效的靶向治疗药. 用于抑制该信号通路的策略包括发展和应用小分子抑制剂、反义核酸、RNA干扰以及显性负效应蛋白的表达等. Xia et al[2]发现N24p55γ抑制内源性p55γ的表达, 因此认为其具有显性负效应的作用. 本研究发现N24p55γ通过抑制PI3K-Akt信号通路的活性抑制胃癌细胞的迁移, Wortmannin作为PI3K的抑制剂虽然能有效抑制PI3K的活性, 但因其细胞毒作用较大因此一直用于实验研究未能进入临床, 本研究中GFP-N24对细胞迁移的抑制作用虽然低于Wortmannin, 但因其来源于细胞对人体没有毒性, 而且提高质粒表达量应该会增加疗效, 提示其在胃癌的治疗上具有潜在的应用前景.
PI3K参与细胞增殖、分化、凋亡和迁移等功能的调节. p55γ是近年来新发现的PI3K调节亚基, 其N末端序列能与Rb蛋白结合调节细胞周期的进程. p55γ N末端的过表达能抑制胃癌细胞的生长增殖, 本文进一步研究其对胃癌细胞运动迁移能力的影响.
周士胜, 教授, 大连大学医学院医学研究中心
PI3K-Akt信号通路与肿瘤的发生发展均相关, 他已经成为当前抗肿瘤药物研发领域的热点. 在中国, 胃癌死亡率仍居恶性肿瘤死亡率第1位, 但现阶段应用于临床的胃癌分子靶向治疗药物仍有许多局限性, 因此亟待研发更多高效的靶向治疗药物.
本文通过基因转染方法研究了N24p55γ的过表达对胃癌MGC803细胞运动迁移的影响, 初步探讨了其作用的分子机制, 为开发以PI3K信号通路为靶点的抗肿瘤药物奠定基础.
本研究发现N24p55γ的过表达通过抑制PI3K-Akt信号通路的活性, 从而抑制胃癌MGC803细胞的迁移, 在胃癌的靶向治疗方面具有潜在的应用前景.
显性负效应(DN): 抑癌基因突变的拷贝在另一野生型拷贝存在并表达的情况下, 仍可使细胞出现恶性表型和癌变, 并使野生型拷贝功能失活, 这种作用称为显性负效应.
本研究通过观察PI3K调节亚基N24p55γ对胃癌MGC803细胞迁移的影响, 以探讨其作用机制, 有一定的科学性和参考价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | WHO. The Impact of Cancer. Emerg Infect Dis serial online, 2007-11-11, cited 2009-10-11; 1(1): 24 screens. Available from: http://www.who.int/ncd_surveillance/infobase/web /InfoBasPolicyMaker/ reports/ReporterFullView.aspx?id=5. |
| 2. | Xia X, Cheng A, Akinmade D, Hamburger AW. The N-terminal 24 amino acids of the p55 gamma regulatory subunit of phosphoinositide 3-kinase binds Rb and induces cell cycle arrest. Mol Cell Biol. 2003;23:1717-1725. [PubMed] [DOI] |
| 3. | Hu J, Liu S, Wang J, Luo X, Gao X, Xia X, Feng Y, Tao D, Wang G, Li X. Overexpression of the N-terminal end of the p55gamma regulatory subunit of phosphatidylinositol 3-kinase blocks cell cycle progression in gastric carcinoma cells. Int J Oncol. 2005;26:1321-1327. [PubMed] |
| 4. | 孙 晓杰, 赵 玫, 袁 兴华, 余 权, 郑 利民, 方 明镜, 黄 常志. PI3Kp55PIK调节亚单位N末端抑制胃癌细胞株MGC803生长及其机制. 癌症. 2006;25:264-268. |
| 6. | Trifonova R, Small D, Kacer D, Kovalenko D, Kolev V, Mandinova A, Soldi R, Liaw L, Prudovsky I, Maciag T. The non-transmembrane form of Delta1, but not of Jagged1, induces normal migratory behavior accompanied by fibroblast growth factor receptor 1-dependent transformation. J Biol Chem. 2004;279:13285-13288. [PubMed] [DOI] |
| 7. | Diehl D, Hoeflich A, Wolf E, Lahm H. Insulin-like growth factor (IGF)-binding protein-4 inhibits colony formation of colorectal cancer cells by IGF-independent mechanisms. Cancer Res. 2004;64:1600-1603. [PubMed] [DOI] |
| 8. | Fridman R, Fuerst TR, Bird RE, Hoyhtya M, Oelkuct M, Kraus S, Komarek D, Liotta LA, Berman ML, Stetler-Stevenson WG. Domain structure of human 72-kDa gelatinase/type IV collagenase. Characterization of proteolytic activity and identification of the tissue inhibitor of metalloproteinase-2 (TIMP-2) binding regions. J Biol Chem. 1992;267:15398-15405. [PubMed] |
| 9. | Choi YA, Lim HK, Kim JR, Lee CH, Kim YJ, Kang SS, Baek SH. Group IB secretory phospholipase A2 promotes matrix metalloproteinase-2-mediated cell migration via the phosphatidylinositol 3-kinase and Akt pathway. J Biol Chem. 2004;279:36579-36585. [PubMed] [DOI] |
| 10. | Pons S, Asano T, Glasheen E, Miralpeix M, Zhang Y, Fisher TL, Myers MG Jr, Sun XJ, White MF. The structure and function of p55PIK reveal a new regulatory subunit for phosphatidylinositol 3-kinase. Mol Cell Biol. 1995;15:4453-4465. [PubMed] |
| 11. | Mukherji A, Janbandhu VC, Kumar V. HBx protein modulates PI3K/Akt pathway to overcome genotoxic stress-induced destabilization of cyclin D1 and arrest of cell cycle. Indian J Biochem Biophys. 2009;46:37-44. [PubMed] |
| 12. | Qin L, Liao L, Redmond A, Young L, Yuan Y, Chen H, O'Malley BW, Xu J. The AIB1 oncogene promotes breast cancer metastasis by activation of PEA3-mediated matrix metalloproteinase 2 (MMP2) and MMP9 expression. Mol Cell Biol. 2008;28:5937-5950. [PubMed] [DOI] |
| 13. | Martin MD, Carter KJ, Jean-Philippe SR, Chang M, Mobashery S, Thiolloy S, Lynch CC, Matrisian LM, Fingleton B. Effect of ablation or inhibition of stromal matrix metalloproteinase-9 on lung metastasis in a breast cancer model is dependent on genetic background. Cancer Res. 2008;68:6251-6259. [PubMed] [DOI] |
| 14. | Xia X, Serrero G. Multiple forms of p55PIK, a regulatory subunit of phosphoinositide 3-kinase, are generated by alternative initiation of translation. Biochem J. 1999;341:831-837. [PubMed] [DOI] |
| 15. | Garcia-Echeverria C, Sellers WR. Drug discovery approaches targeting the PI3K/Akt pathway in cancer. Oncogene. 2008;27:5511-5526. [PubMed] [DOI] |
| 16. | Nagl F, Schönhofer K, Seidler B, Mages J, Allescher HD, Schmid RM, Schneider G, Saur D. Retinoic acid-induced nNOS expression depends on a novel PI3K/Akt/DAX1 pathway in human TGW-nu-I neuroblastoma cells. Am J Physiol Cell Physiol. 2009;297:C1146-C1156. [PubMed] [DOI] |
| 17. | Park SJ, Sohn HY, Yoon J, Park SI. Down-regulation of FoxO-dependent c-FLIP expression mediates TRAIL-induced apoptosis in activated hepatic stellate cells. Cell Signal. 2009;21:1495-1503. [PubMed] [DOI] |
| 18. | Chen Y, Guggisberg N, Jorda M, Gonzalez-Angulo A, Hennessy B, Mills GB, Tan CK, Slingerland JM. Combined Src and aromatase inhibition impairs human breast cancer growth in vivo and bypass pathways are activated in AZD0530-resistant tumors. Clin Cancer Res. 2009;15:3396-3405. [PubMed] [DOI] |
| 19. | Lee DH, Szczepanski MJ, Lee YJ. Magnolol induces apoptosis via inhibiting the EGFR/PI3K/Akt signaling pathway in human prostate cancer cells. J Cell Biochem. 2009;106:1113-1122. [PubMed] [DOI] |
| 20. | Mahalingam D, Mita A, Sankhala K, Swords R, Kelly K, Giles F, Mita MM. Targeting sarcomas: novel biological agents and future perspectives. Curr Drug Targets. 2009;10:937-949. [PubMed] [DOI] |