修回日期: 2009-09-29
接受日期: 2009-10-12
在线出版日期: 2009-11-18
目的: 构建新肿瘤睾丸抗原Ropporin原核表达载体, 表达和纯化人Ropporin重组蛋白, 并制备其兔抗血清.
方法: 人Ropporin全长cDNA克隆入pQE30载体, 在大肠杆菌中利用IPTG诱导表达并纯化人Ropporin重组蛋白. 利用人Ropporin重组蛋白免疫兔, 制备人Ropporin多克隆抗体.
结果: 以构建的pQE30-Ropporin质粒转化大肠杆菌后, 在IPTG诱导下表达和纯化得到相对分子质量与鼠Ropporin蛋白一致的蛋白质, 利用其免疫动物后, Western blot检测显示该蛋白具有良好的免疫原性, 制备的兔抗血清效价>1:512000, 对该蛋白具有高度特异性.
结论: 利用大肠杆菌原核表达系统表达和纯化了人Ropporin重组蛋白, 并成功制备了人Ropporin多克隆抗体.
引文著录: 尹燕华, 李占飞, 邹声泉. 新肿瘤睾丸抗原Ropporin重组蛋白的原核表达及其多克隆抗体的制备. 世界华人消化杂志 2009; 17(32): 3342-3345
Revised: September 29, 2009
Accepted: October 12, 2009
Published online: November 18, 2009
AIM: To prepare human ropporin (a novel cancer/testis antigen) recombinant protein using a prokaryotic expression system and generate its rabbit polyclonal antisera.
METHODS: The full-length cDNA of the human ropporin gene was subcloned into the pQE30 vector and transformed into competent Escherichia coli (E.coli) JM109 cells. After transformed E.coli was induced using IPTG (isopropyl β-D-1-thiogalactopyranoside), human recombinant ropporin protein was extracted, purified by Nickel sepharose affinity chromatography, and verified by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE). Rabbits were immunized with the purified protein to prepare antisera. The specificity of antisera was determined by Western blot.
RESULTS: SDS-PAGE analysis showed that a protein with similar molecular weight to mouse popporin protein was purified from transformed E.coli. Western blot using anti-His tag monoclonal antibody showed that the prepared protein contained a His-tag. Polyclonal antisera were successfully generated by immunization of rabbits with human recombinant ropporin protein. The titers of antisera were more than 1:512000. Western blot analysis confirmed the specificity of the antisera obtained.
CONCLUSION: Human recombinant ropporin protein was successfully prepared using a prokaryotic expression system, and its rabbit polyclonal antisera were also successfully generated. The antisera obtained can be used to detect the expression of ropporin protein in various types of tumors and investigate its role in malignant processes.
- Citation: Yin YH, Li ZF, Zou SQ. Prokaryotic expression of ropporin and generation of its rabbit polyclonal antisera. Shijie Huaren Xiaohua Zazhi 2009; 17(32): 3342-3345
- URL: https://www.wjgnet.com/1009-3079/full/v17/i32/3342.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i32.3342
肿瘤免疫治疗是一种极有潜力的治疗方法, 近年来在肿瘤研究领域受到广泛关注. 肿瘤-睾丸抗原(cancer-testis antigen, CTA)是一类仅表达于生殖细胞和肿瘤组织而不表达于其他正常组织的蛋白. 由于他们具有高度免疫原性和特异性, 被认为是肿瘤免疫治疗的理想靶点[1-2]. Ropporin是一种特异性表达于精子鞭毛鞘的蛋白, 不表达于其他正常成人组织中[3-4]. 我们前期研究发现Ropporin在血液系统恶性肿瘤中是一种新CTA[5]. 但他是否表达于其他类型恶性肿瘤, 以及他与肿瘤恶性生物学特征之间的关系, 目前国内外尚未见报道. 本研究利用大肠杆菌系统原核表达Ropporin重组蛋白, 并用其免疫兔制备抗血清, 以利于进一步研究Ropporin在各种肿瘤中蛋白质水平表达和他在肿瘤细胞恶性生物学行为中的作用.
pGADT7-Ropporin质粒、pQE30载体、JM109为本室保存. 凝胶回收和DNA连接试剂盒均购自美国Qiagen公司, 工具酶BamHⅠ和HindⅢ购自美国Promega公司. PCR引物由美国Sigma公司合成. 鼠Ropporin重组蛋白为日本Kyoto大学药理学系Shuh Narumiya惠赠.
1.2.1 pQE30-Ropporin重组质粒的构建: 以PCR自pGADT7-Ropporin质粒中扩增Ropporin全长cDNA片段, 两端分别加上BamHⅠ和HindⅢ酶切位点. Ropporin 5'引物: 5'-GCGAATTCATGGCTCAGACAGATAAGC-3'; 3'引物: 5'-ATGGATCCGTTACTCCAGCCAAACCCTG-3'. 10 g/L琼脂糖凝胶电泳, 回收Ropporin目的片段和酶切的pQE30线性载体. 回收产物在T4 DNA连接酶的作用下连接, 产物转化感受态E.coli JM109菌株(CaCl2法制备), 涂布于含氨苄青霉素100 mg/L的LB培养平皿中, 于37 ℃培养过夜. 挑取单菌落抽提质粒, 用BamHⅠ和HindⅢ双酶切鉴定. 鉴定阳性质粒送测序证实.
1.2.2 人Ropporin重组蛋白的诱导表达: 将经鉴定正确含pQE30-Ropporin原核表达载体的JM109菌接种于含氨苄霉素的LB液体培养基内, 转化pQE30的细菌为对照. 培养至A600 = 0.6. 分别加IPTG使其终浓度达到0、0.5、1 mmol/L, 在37 ℃诱导培养. 将诱导菌液置于冰上5 min, 10000 g离心30 s, 收集沉淀, 以0.1 mol/L Tris-CL(pH 6.8)悬浮, 再加入等体积2×SDS上样缓冲液, 煮沸3 min后离心取上清. 样品以12% SDS-PAGE电泳, 考马斯亮蓝染色观察. 同样处理另一块胶电泳完毕转移至PVDF膜, 3% BSA封闭, 以兔抗鼠His单克隆抗体为一抗, 鼠抗兔IgG为二抗, Western blot检测人Ropporin重组蛋白.
1.2.3 人Ropporin重组蛋白的大量制备: 用2 L的LB培养基于37 ℃培养, 在菌液浓度A600值约0.5时, 加入IPTG至终浓度为1 mmol/L, 37 ℃继续培养4 h收获菌体. 将菌体反复冻融3次后, 以0.1 mol/L的Tris-CL缓冲(pH 7.6)重悬菌体, 超声破碎菌体, 离心. 分别收集沉淀和上清, SDS-PAGE胶分析, 发现融合蛋白在沉淀中. 沉淀重悬于含6 mol/L尿素的Tris-HCL缓冲液中, 镍柱亲和层析纯化重组蛋白, 蛋白分析试剂盒测定纯化蛋白浓度, SDS-PAGE分析蛋白纯度.
1.2.4 抗人Ropporin兔血清的制备和纯化: 取体质量4 kg的♂新西兰兔2只, 免疫前3 d耳缘静脉取血分离血清作为阴性对照. 初次免疫时, 每只新西兰兔背部皮下多点注射2 mL经完全弗氏佐剂乳化的纯化融和蛋白(0.5 g/L). 2 wk后以1 mL不完全弗氏佐剂乳化的融合蛋白纯品进行第2次免疫, 方法同前. 以后每隔2 wk重复免疫1次, 剂量、方法均与第2次免疫相同. 免疫3次后, 耳缘静脉采血做多克隆抗体ELISA法效价分析. 效价符合要求(要求至少大于1:128000)后, 再加强免疫1次. 加强免疫后3 d, 颈总动脉插管法取血, 离心收集血清并纯化, 常规ELISA方法检测兔抗血清效价. -80 ℃保存备用.
1.2.5 多克隆抗体特异性鉴定: 人和鼠Ropporin蛋白行SDS-PAGE电泳后转移至PVDF膜, 3% BSA封闭, 以兔抗血清为一抗(1:5000稀释于封闭液), 鼠抗兔IgG为二抗, Western blot检测兔抗血清的特异性.
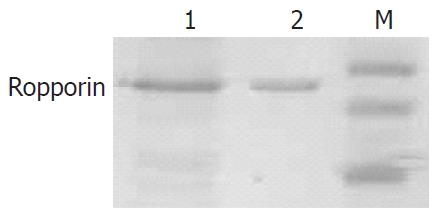
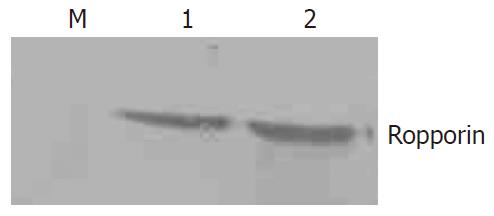
SDS-PAGE电泳显示制备得到与鼠Ropporin重组蛋白相对分子质量一致的蛋白(图1). 以His抗体进行Western blot检测显示, 制备的蛋白与鼠Ropporin重组蛋白均携带His标签(图2). 以上结果提示成功制备得到人Ropporin重组蛋白.
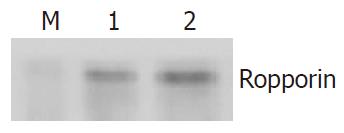
利用人Ropporin重组蛋白免疫兔, 我们成功地制备了人Ropporin多克隆抗体. ELISA检测显示抗体效价>1:512000. Western blot显示制备的抗体对人Ropporin重组蛋白具有特异性, 与鼠Ropporin重组蛋白也具有交叉反应(图3).
由于CTA具有很强的免疫原性, 其表达又具有高度特异性(仅表达于肿瘤和生殖细胞, 由于生殖系统的免疫豁免, 不会引起针对其他正常组织的免疫反应), 他被认为是肿瘤免疫治疗的理想靶点. 目前已在多种肿瘤中发现40余种CTA, 包括MAGE1、NY-ESO-1和SP17等[1-2,6-9]. 在美国, 已有多项利用肿瘤-睾丸抗原进行肿瘤免疫治疗的研究得到FDA批准进入临床研究阶段, 但这些研究均未能取得令人满意的效果. 究其原因, 在于肿瘤细胞可通过各种机制逃逸机体的免疫监控, 其中重要机制之一是肿瘤抗原表达具有极强的异质性: 不仅不同患者的肿瘤抗原表达谱各不相同, 同一患者肿瘤细胞的抗原表达也存在差异, 多数肿瘤抗原仅表达于一个肿瘤内的部分肿瘤细胞. 这就导致大部分肿瘤疫苗仅能激发机体仅针对部分肿瘤细胞的免疫反应, 难以有效抑制整个肿瘤. 因此, 寻找更多的肿瘤抗原, 并深入研究肿瘤抗原与恶性肿瘤生物学特征之间的关系, 有助于根据肿瘤抗原表达情况, 选择既高表达又与肿瘤恶性生物学行为密切相关的抗原, 制备特异性肿瘤疫苗或多价疫苗进行免疫治疗[2], 以进一步提高免疫治疗效果.
人Ropporin是一个由212个氨基酸组成的蛋白, 属于Rho家族, 与Rophilin结合而参与G蛋白信号传导[3-4]. 在人类, 其编码基因定位于3q21.1. 人与鼠Ropporin蛋白具有高度同源性(94%), 两者相对分子量基本一致. 最初的研究发现他主要存在于精子鞭毛的纤维鞘中, 在精子运动中起重要作用. 他主要表达于生殖系统和胚胎组织中而不表达于成人正常组织.
我们前期研究发现, Ropporin表达于多种血液系统肿瘤细胞, 并且在血液系统肿瘤患者的血清中可检测到Ropporin特异性IgG抗体, 说明Ropporin能诱发机体特异性免疫反应. 他特异性表达于睾丸组织和肿瘤组织而不表达于其他正常组织, 因此被认为是一种新的肿瘤-睾丸抗原[5]. 进一步研究发现, 他在人原发性肝细胞癌组织中也存在mRNA水平的表达(前期研究, 结果未发表), 提示他在肝癌中可能是一种新的CTA.
目前, 关于Ropporin生物学功能的研究主要集中于他在精子运动和精子发生中的作用[10-11], 尚未见他在肿瘤细胞恶性生物学行为中的作用的报道. 肿瘤细胞在其发生、分化等方面与生殖细胞具有高度相似性, 肿瘤细胞中常出现精子发生和胚胎发育中特异表达基因(不表达于正常成人组织)的异常表达, 这些基因可能在肿瘤细胞的恶性生物学行为中起重要作用[1,12].
Ropporin氨基端40个氨基酸序列与cAMP依赖性蛋白激酶(cAMP-dependent protein kinase, PKA)Ⅱ型调节亚单位(RⅡ)有高度同源性. 在精子中, Ropporin与AKAP110结合, 在精子运动中起重要作用. 用合成肽竞争性拮抗其结合后可导致实验动物不育[3-4]. Ropporin的羧基端可以与Rhophilin羧基末端的PDZ域结合而与RhoA相互作用, 提示Ropporin可能与RhoA结合而参与Rho介导的信号通路[4].
Rho是癌基因Ras同源体(ras homogenous, Rho), 属于Ras超家族成员. Rho家族成员绝大部分是具有GTP酶活性的小分子蛋白, 在细胞迁移、细胞骨架重组、细胞黏附、基因表达调控等多种重要的生物学活动中发挥重要作用. 已有研究提示Rho在多种肿瘤(包括肝癌、乳腺癌和结肠癌等)的侵袭和转移中发挥重要作用[13-15].
目前关于Ropporin的研究刚刚起步, 国际上已有一些实验室制备了针对鼠Ropporin蛋白的多克隆抗体, Western blot显示其与人Ropporin蛋白存在交叉反应. 但尚无商品化Ropporin抗体问世, 限制了对他的表达谱和在肿瘤恶性生物学行为中的作用的进一步研究. 本研究利用PQE30大肠杆菌原核表达系统成功制备和纯化了Ropporin重组蛋白, 并免疫兔成功制备多抗血清. Western blot检测显示, 目的蛋白准确, 制备的抗体具有很强的特异性. 这将有助于深入研究Ropporin在各种肿瘤组织中蛋白质水平的表达和生物学功能, 为研究其应用于恶性肿瘤的免疫治疗奠定实验基础.
肿瘤细胞可通过各种机制逃逸机体的免疫监控, 其中重要机制之一是肿瘤抗原表达具有极强的异质性: 多数肿瘤抗原仅表达于一个肿瘤内的部分肿瘤细胞, 导致大部分肿瘤疫苗仅能激发机体仅针对部分肿瘤细胞的免疫反应, 难以有效抑制整个肿瘤. 因此, 寻找更多的肿瘤抗原有助于根据肿瘤抗原表达情况制备特异性肿瘤疫苗或多价疫苗进行免疫治疗, 以进一步提高免疫治疗效果.
刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科; 李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
Ropporin是近年新发现的一种肿瘤睾丸抗原. 本研究制备其多克隆抗体, 以便于进一步研究其在肿瘤生物学行为中的作用.
本研究制备的Ropporin抗体有助于进一步研究Ropporin在各种肿瘤中的表达情况, 以及他在肿瘤恶性生物学行为中的作用.
肿瘤-睾丸抗原(cancer-testis antigen, CTA): 是一类仅表达于生殖细胞和肿瘤组织而不表达于其他正常组织的蛋白. 由于他们具有高度免疫原性和特异性, 被认为是肿瘤免疫治疗的理想靶点.
本文构建Ropporin重组蛋白的原核表达载体, 纯化人Ropporin重组蛋白, 及其制备兔抗血清, 有重要临床指导意义.
编辑: 李军亮 电编: 何基才
| 1. | Simpson AJ, Caballero OL, Jungbluth A, Chen YT, Old LJ. Cancer/testis antigens, gametogenesis and cancer. Nat Rev Cancer. 2005;5:615-625. [PubMed] [DOI] |
| 2. | Scanlan MJ, Gure AO, Jungbluth AA, Old LJ, Chen YT. Cancer/testis antigens: an expanding family of targets for cancer immunotherapy. Immunol Rev. 2002;188:22-32. [PubMed] [DOI] |
| 3. | Fujita A, Nakamura K, Kato T, Watanabe N, Ishizaki T, Kimura K, Mizoguchi A, Narumiya S. Ropporin, a sperm-specific binding protein of rhophilin, that is localized in the fibrous sheath of sperm flagella. J Cell Sci. 2000;113:103-112. [PubMed] |
| 4. | Carr DW, Fujita A, Stentz CL, Liberty GA, Olson GE, Narumiya S. Identification of sperm-specific proteins that interact with A-kinase anchoring proteins in a manner similar to the type II regulatory subunit of PKA. J Biol Chem. 2001;276:17332-17338. [PubMed] [DOI] |
| 5. | Li Z, Li W, Meklat F, Wang Z, Zhang J, Zhang Y, Lim SH. A yeast two-hybrid system using Sp17 identified Ropporin as a novel cancer-testis antigen in hematologic malignancies. Int J Cancer. 2007;121:1507-1511. [PubMed] [DOI] |
| 7. | Zhang Y, Wang Z, Robinson WR, Lim SH. Combined real time PCR and immunohistochemical evaluation of sperm protein 17 as a cancer-testis antigen. Eur J Haematol. 2004;73:280-284. [PubMed] [DOI] |
| 9. | 吴 力群, 王 新建, 卢 云, 张 斌, 杨 金镛. 肝细胞肝癌患者肿瘤/睾丸抗原SSX-1及NY-ESO-1 mRNA的表达意义. 世界华人消化杂志. 2005;13:1673-1678. [DOI] |
| 10. | Newell AE, Fiedler SE, Ruan JM, Pan J, Wang PJ, Deininger J, Corless CL, Carr DW. Protein kinase A RII-like (R2D2) proteins exhibit differential localization and AKAP interaction. Cell Motil Cytoskeleton. 2008;65:539-552. [PubMed] [DOI] |
| 11. | Fiedler SE, Bajpai M, Carr DW. Identification and characterization of RHOA-interacting proteins in bovine spermatozoa. Biol Reprod. 2008;78:184-192. [PubMed] [DOI] |
| 12. | Xiao J, Chen HS. Biological functions of melanoma-associated antigens. World J Gastroenterol. 2004;10:1849-1853. [PubMed] |
| 13. | Croft DR, Olson MF. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 2008;14:349-351. [PubMed] [DOI] |
| 14. | Joshi B, Strugnell SS, Goetz JG, Kojic LD, Cox ME, Griffith OL, Chan SK, Jones SJ, Leung SP, Masoudi H. Phosphorylated caveolin-1 regulates Rho/ROCK-dependent focal adhesion dynamics and tumor cell migration and invasion. Cancer Res. 2008;68:8210-8220. [PubMed] [DOI] |
| 15. | Ordóñez-Morán P, Larriba MJ, Pálmer HG, Valero RA, Barbáchano A, Duñach M, de Herreros AG, Villalobos C, Berciano MT, Lafarga M. RhoA-ROCK and p38MAPK-MSK1 mediate vitamin D effects on gene expression, phenotype, and Wnt pathway in colon cancer cells. J Cell Biol. 2008;183:697-710. [PubMed] [DOI] |