修回日期: 2009-11-02
接受日期: 2009-11-02
在线出版日期: 2009-11-08
目的: 探讨α-2a干扰素(IFNα-2a)对大鼠肝组织bcl-2基因表达的影响和对肝纤维化的作用及其机制.
方法: 将SD大鼠随机分成纤维化模型组(A组, CCl4诱导形成大鼠肝纤维化模型), 对照组(B组)及IFNα-2a干预组(C组). 用RT-PCR法检测各组大鼠肝脏bcl-2的表达, 常规HE和网状纤维染色检测肝组织标本.
结果: C组纤维化程度及肝细胞脂肪变性较A组显著减轻, 但肝组织炎症改变无显著差异性. C组bcl-2基因蛋白表达显著低于A组(P<0.01), 但显著高于B组bcl-2基因蛋白表达的量(P<0.01).
结论: IFNα-2a能够阻断CCl4诱导的肝纤维化和减少肝脂肪变性. 其机制与bcl-2基因表达有关, 可能通过调节bcl-2基因表达与HSC凋亡, 从而阻断肝纤维化和减少肝脂肪变性.
引文著录: 席文娜, 孙水林, 李方春, 罗杰, 肖影群, 章萍, 张伟. α-2a干扰素对大鼠肝组织bcl-2基因表达的影响及意义. 世界华人消化杂志 2009; 17(31): 3237-3240
Revised: November 2, 2009
Accepted: November 2, 2009
Published online: November 8, 2009
AIM: To investigate the effects of interferon α-2a (IFNα-2a) on bcl-2 gene expression in the fibrotic liver of rats and explore potential mechanisms involved.
METHODS: Hepatic fibrosis was induced in rats by subcutaneous injection of carbon tetrachloride (CCl4). Sprague-Dawley rats were randomly divided into normal control group, fibrosis model group and IFNα-2a intervention group. The expression of bcl-2 gene in the liver was detected by reverse transcription-polymerase chain reaction (RT-PCR). Liver tissue samples were taken for conventional hematoxylin and eosin (HE) staining and reticular fiber staining to observe histological changes.
RESULTS: A rat model of liver fibrosis was successfully established. IFNα-2a treatment significantly ameliorated liver fibrosis and fatty degeneration, but showed no impact on hepatic inflammation in fibrotic rats. The expression level of bcl-2 mRNA in the IFNα-2a intervention group was significantly lower than that in the fibrosis model group (P < 0.01), but higher than that in the normal control group (P < 0.01).
CONCLUSION: IFNα-2a can effectively ameliorate CCl4-induced hepatic fibrosis and liver fatty degeneration possibly via a mechanism associated with downregulating bcl-2 gene expression and controlling apoptosis of HSC.
- Citation: Xi WN, Sun SL, Li FC, Luo J, Xiao YQ, Zhang P, Zhang W. Effects of IFNα-2a on bcl-2 expression in the fibrotic liver of rats. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3237-3240
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3237.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3237
肝纤维化是一切慢性肝病的共同病理基础, 其实质是组织发生修复反应时细胞外基质(extracellular matrix, ECM)合成、降解与沉积不平衡而引起的病理过程[1]. 肝星状细胞(hepatic stellate cell, HSC)是参与肝纤维化过程的重要细胞, 他的活化增殖是肝纤维化发生机制的中心环节, 抑制HSC增殖, 诱导其凋亡是抗纤维化的重要策略[2-3].
α-干扰素(interferon α, IFNα)能直接抑制ECM形成, 对已经形成的肝纤维化, 使ECM降解是抗肝纤维化的重要策略[4-6]. IFNα可提高基质金属蛋白酶(matrix metalloproteinase, MMP)活性, 促进ECM降解[7]. IFNα可以直接影响MMP及组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase, TIMP)的比率, 从而促进胶原的降解, 使肝纤维化改善[8]. 但IFNα是否能通过细胞凋亡通路阻断肝纤维化, 目前报道少见.
本研究旨在观察IFNα-2a对大鼠肝组织bcl-2基因表达的影响, 以探讨IFNα-2a对肝纤维化的作用及其机制.
SD大鼠, ♂, 体质量250±20 g, 由南昌大学医学院动物科学部提供. 总RNA提取试剂盒(北京天根公司), 逆转录酶, PCR试剂(上海Promega公司), 引物设计参考文献[9], 借助Pubmed Nucleotide获取目的基因全序列, 验证参考文献引物. PCR引物由上海捷瑞生物工程有限公司合成. IFNα-2a由长春长生基因药业股份有限公司生产.
1.2.1 分组及造模: 实验大鼠随机分为3组. 纤维化模型组(A组, n = 15): 按0.3 mL/100 g皮下注射50% CCl4(用花生油稀释), 每周2次, 共8 wk; 对照组(B组, n = 10): 以等量生理盐水皮下注射, 每周2次, 共8 wk; IFNα-2a组(C组, n = 15): 在用CCl4建立肝纤维化模型的同时隔日肌肉注射IFNα-2a 6×104 U/(kg•d), 共8 wk. 在实验结束时, 总共8只大鼠死亡, 其中A组5只, C组3只. 其余大鼠处死前12 h禁食禁水, 用10%戊巴比妥麻醉大鼠.
1.2.2 取材及染色: 在无菌条件下迅速剪切50-100 g肝脏尾状叶组织, 放入无菌弯盘, 剪成碎块, 用无菌PBS液冲洗2-3次, 再放入RNAstore液, -20 ℃冷藏提取RNA用. 剩余肝脏组织用100 g/L甲醛固定, 石蜡切片用于检测项目. HE染色: 经100 g/L甲醛固定, 石蜡包埋切片处理后制成4 μm厚连续切片6张, 切片面积约1 cm×1 cm, 常规HE染色. 特殊染色: 网状纤维染色.
1.2.3 bcl-2 mRNA检测: 采用RT-PCR技术, 设置β-actin为内对照, 引物序列: β-actin: 上游: 5'-TCAGGTCATCACTATCGGCAAT-3',下游: 5'-AAAGAAAGGGTGTAAAACGCA-3'(扩增产物为462 bp); bcl-2: 上游 5'-CGGGAGAACAGGGTATGA-3';下游5'-CAGGCTGGAAGGAGAAGAT-3'(扩增产物为149 bp). PCR反应参数: 94 ℃预变性5 min, 94 ℃变性35 s, 52 ℃退火35 s, 72 ℃延伸35 s, 30循环; 72 ℃延伸7 min.
1.2.4 结果判定: 将RT-PCR产物在15 g/L琼脂糖凝胶上进行电泳, 用BANDLEAD系统测量扩增条带辉度值, 以bcl-2/β-actin的比值分别表示bcl-2的相对水平, 并进行统计学处理.
统计学处理 所有指标均用mean±SD表示, 采用SPSS16.0统计软件进行方差分析, P<0.05为差异有统计学意义.
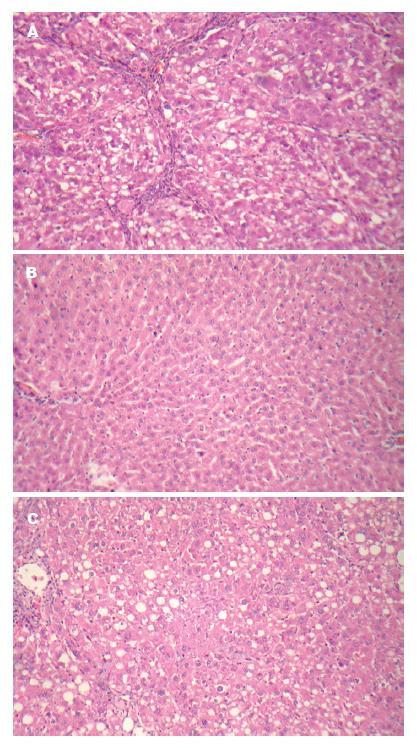
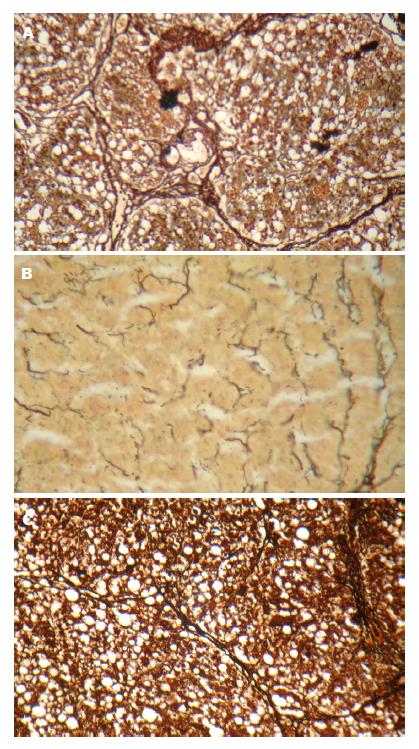
纤维化模型组肝组织纤维化程度明显, 表现为肝细胞结构紊乱, 广泛肝细胞脂肪变性, 坏死及弥漫的纤维间隔形成, 但肝组织炎症轻度(图1A, 图2A); IFNα-2a干预组肝细胞脂肪变性及肝纤维化程度较模型对照组显著减轻, 肝组织炎症也为轻度, 较纤维化模型组无显著差异性(图1B, 图2B); 对照组可见炎症不明显, 极少数芒状纤维形成(图1C, 图2C).
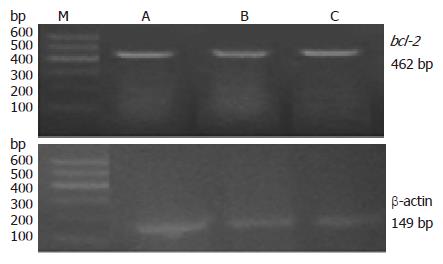
纤维化模型组、对照组、IFNα-2a干预组bcl-2/β-actin相对吸光度比值分别为0.98±0.03、0.86±0.03、0.96±0.02. IFNα-2a干预组bcl-2基因蛋白表达显著低于纤维化模型组(P<0.01); 对照组bcl-2基因蛋白表达显著低于纤维化模型组和IFNα-2a干预组(均P<0.01, 图3).
目前国内外研究表明肝纤维化的发病机制和HSC凋亡密切相关, 研究HSC与肝纤维化的内在联系, 对预防肝纤维化有着重要的临床意义. 近年发现, bcl-2为一种细胞凋亡抑制基因. HSC是否发生凋亡主要受bcl-2家族的调控. 其中bcl-2是最重要的抗凋亡因子. 在慢性肝病的研究中发现bcl-2过表达[10]; 在肝纤维化时, HSC凋亡障碍与bcl-2表达上调导致细胞对CD95等凋亡信号敏感性降低有关[11]; bcl-2在人肝纤维化过程中呈过表达, 导致HSC持续活化, 这也是慢性肝病迁延难愈的原因之一[10-11].
IFNα抗病毒、抗肿瘤和免疫调节作用已人所共知, 国内外学者也逐渐公认IFNα有预防肝纤维化形成的作用[5]. IFNα抗纤维化的机制是通过抗病毒、抗炎作用减少对肝纤维化形成细胞的刺激[12], 还是通过促进肝内ECM降解[7], 或者是通过细胞凋亡途径具有抗肝纤维化作用. 目前具体机制尚不十分透彻. 该研究旨在观察IFNα-2a对大鼠肝组织bcl-2基因表达的影响,以探讨IFNα-2a对肝纤维化的作用及其机制.
本实验结果表明对照组仅见极少数芒状纤维形成, IFNα-2a干预组和纤维化模型组纤维化明显, 但IFNα-2a干预组纤维化程度较纤维化模型组显著减轻, 提示IFNα-2a能够阻断CCl4诱导的肝纤维化. 对照组肝组织炎症不明显, IFNα-2a干预组和纤维化模型组炎症均为轻度, 并无显著差异性. 提示IFNα-2a阻断由CCl4引起的肝纤维化并不是直接通过抗炎作用实现, 可能存在其他途径. 细胞凋亡途径也许起了至关重要的作用, 因为实验中发现, 纤维化模型组肝组织中bcl-2基因表达最强, 对照组bcl-2基因表达最弱, 而IFNα-2a干预组肝组织中bcl-2基因的表达介于两者之间, 有显著差异性(P<0.01). IFNα-2a干预组显著抑制了肝纤维化肝组织中bcl-2基因的表达. 由此可见, 随着肝纤维化程度加重, bcl-2基因的表达也增强. 有研究认为bax/bcl-2基因表达比值与肝纤维化程度正相关[13]. Novo et al[11]认为激活的人HSC对大多数预凋亡刺激抵抗都归咎于bcl-2的过度表达. 这种特征在肝脏疾病纤维化进程中也许起着至关重要的作用. 可见, bcl-2基因的表达在肝纤维化发生发展中起了重要的作用. 因此, 我们认为IFNα-2a可能通过调节bcl-2基因表达, 从而阻断CCl4诱导的肝纤维化, 但IFNα-2a又是如何通过调节bcl-2基因表达阻断肝纤维化的呢? 有报道IFNα通过抑制HSC和胶原的激活来阻断由猪血清诱导的大鼠肝纤维化[14]; IFNα能够抑制转化生长因子β(transforming growth factor-β, TGF-β)的表达, 减少HSC的激活和刺激他的凋亡[15]. 这些资料均提示IFNα抗纤维化的作用与HSC凋亡密切有关. 因此, 我们认为IFNα-2a可能通过调节bcl-2基因表达, 调控HSC凋亡, 阻断CCl4诱导的肝纤维化. 研究中还发现, IFNα-2a干预组肝细胞脂肪变性减少, 提示IFNα-2a能够减少由CCl4的肝脂肪变性, 其机制尚未见报道, 可能也与bcl-2基因密切相关, 具体机制还有待于进一步研究.
总之, IFNα-2a能够阻断CCl4诱导的肝纤维化和减少肝脂肪变性. 其机制与bcl-2基因表达有关, 可能通过调节bcl-2基因表达, 调控HSC凋亡, 从而阻断肝纤维化和减少肝脂肪变性.
肝纤维化是一切慢性肝病的共同病理基础, HSC是参与肝纤维化过程的重要细胞, 其活化增殖是肝纤维化发生机制的中心环节, 抑制HSC增殖, 诱导其凋亡是抗纤维化的重要策略.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
Wetanabe et al报道IFNα可提高MMP活性, 促进ECM降解. Ninomiya et al认为IFNα可以直接影响MMP及TIMP的比率, 从而促进胶原的降解, 使肝纤维化改善.
IFNα是否能通过细胞凋亡通路阻断肝纤维化, 目前报道少见. 本研究旨在观察IFNα-2a对大鼠肝组织bcl-2基因表达的影响, 以探讨IFNα-2a对肝纤维化的作用及其机制.
本研究设计合理, 可为干扰素α-2a抗肝纤维化作用机制提供参考, 具有一定可读性.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 3. | 王 丽辉, 童 坦君. 神经生长因子. 生物化学与生物物理进展. 1992;19:29. |
| 4. | Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004;1:98-105. [PubMed] [DOI] |
| 5. | Okazaki I, Watanabe T, Inagaki Y. [Recent advance in understanding mechanisms of fibrogenesis and fibrolysis in hepatic fibrosis]. Nippon Shokakibyo Gakkai Zasshi. 2002;99:353-364. [PubMed] |
| 6. | Brenard R. Practical management of patients treated with alpha interferon. Acta Gastroenterol Belg. 1997;60:211-213. [PubMed] |
| 7. | Watanabe T, Niioka M, Ishikawa A, Hozawa S, Arai M, Maruyama K, Okada A, Okazaki I. Dynamic change of cells expressing MMP-2 mRNA and MT1-MMP mRNA in the recovery from liver fibrosis in the rat. J Hepatol. 2001;35:465-473. [PubMed] [DOI] |
| 8. | Ninomiya T, Yoon S, Nagano H, Kumon Y, Seo Y, Kasuga M, Yano Y, Nakaji M, Hayashi Y. Significance of serum matrix metalloproteinases and their inhibitors on the antifibrogenetic effect of interferon-alfa in chronic hepatitis C patients. Intervirology. 2001;44:227-231. [PubMed] [DOI] |
| 9. | Cheng Y, Ping J, Xu LM. Effects of curcumin on peroxisome proliferator-activated receptor gamma expression and nuclear translocation/redistribution in culture-activated rat hepatic stellate cells. Chin Med J (Engl). 2007;120:794-801. [PubMed] |
| 10. | Mutluay R, Ozenirler S, Poyraz A. The expression of bcl-2 in chronic liver diseases. Saudi Med J. 2005;26:1245-1249. [PubMed] |
| 11. | Novo E, Marra F, Zamara E, Valfra di Bonzo L, Monitillo L, Cannito S, Petrai I, Mazzocca A, Bonacchi A, De Franco RS. Overexpression of Bcl-2 by activated human hepatic stellate cells: resistance to apoptosis as a mechanism of progressive hepatic fibrogenesis in humans. Gut. 2006;55:1174-1182. [PubMed] [DOI] |
| 12. | Maria Elzbieta SL, Marek LD. Histological outcome of chronic hepatitis B in children treated with interferon alpha. World J Gastroenterol. 2005;11:7179-7182. [PubMed] |
| 14. | Wu CS, Piao XX, Piao DM, Jin YR, Li CH. Treatment of pig serum-induced rat liver fibrosis with Boschniakia rossica, oxymatrine and interferon-alpha. World J Gastroenterol. 2005;11:122-126. [PubMed] |
| 15. | Chang XM, Chang Y, Jia A. Effects of interferon-alpha on expression of hepatic stellate cell and transforming growth factor-beta1 and alpha-smooth muscle actin in rats with hepatic fibrosis. World J Gastroenterol. 2005;11:2634-2636. [PubMed] |