修回日期: 2009-10-08
接受日期: 2009-10-19
在线出版日期: 2009-10-28
目的: 探讨肠源性内毒素血症在肝窦毛细血管化形成中的作用及其可能机制.
方法: ♂Wistar大鼠40只, 完全随机分为模型组(n = 32)与正常对照组(n = 8), 采用复合因素致肝硬化大鼠模型. 模型组分别在饲养第2, 4, 6, 8周末, 正常对照组在实验开始时, 经肠系膜上静脉末端穿刺测PVP, 肝脏HE、VG染色, 肝脏免疫组织化学染色观察α-SMA、LN、TGF-β1的动态表达, 测定外周血中的内毒素、TNF-α、ALT的动态变化, 采用扫描电镜观察肝窦内皮细胞失窗孔情况.
结果: 模型组ALT在第2周末达到高峰(57.84±7.57 IU/L), 随后逐渐下降; 内毒素在第2、4、6周末, 各点呈递增趋势, 到第8周末时略有下降; TNF-α在第2、4周末呈递增趋势, 到第6周末时略有下降, 第8周末时又逐渐升高, 但各点组均较对照组明显升高(均P<0.05); 模型组PVP在第2、4周末, 各点呈递增趋势, 到第6周末时略有下降, 第8周末时又逐渐升高; 肝窦内皮细胞扫描电镜结果示随着肝纤维化及硬化程度的加重, 窗孔逐渐变小、变少至消失; LN、TGF-β1免疫组织化学染色结果示随着病变的发展, 与对照组和同指标前一时间组相比阳性表达逐渐增强(均P<0.05). α-SMA免疫组织化学染色在第2、4、6周末, 阳性表达逐渐增强, 到第8周末时略有下降.
结论: 肝硬化大鼠发生了肠源性内毒素血症, 其可使TGF-β1、TNF-α、LN等合成增多, 促进肝窦内皮细胞去窗孔化, 间接参与肝窦毛细血管化的形成.
引文著录: 杨照新, 韩德五, 邢桦云, 刘慧荣, 燕子. 肝硬化时肝窦毛细血管化形成机制. 世界华人消化杂志 2009; 17(30): 3101-3108
Revised: October 8, 2009
Accepted: October 19, 2009
Published online: October 28, 2009
AIM: To investigate the role of intestinal endotoxemia in the pathogenesis of hepatic sinusoidal capillarization in hepatic cirrhosis and explore possible mechanisms involved.
METHODS: Forty male Wistar rats were randomly divided into two groups: control group (n = 8) and experimental group (n= 32). Hepatic cirrhosis was induced in rats using carbon tetrachloride (CCl4) and alcohol. Rats in the experimental group were killed at weeks 2, 4, 6 and 8, respectively, while those in the control group were executed at the beginning of the experiment. The portal venous pressure (PVP) was measured by cranial mesenteric vein cannulation. The degree of hepatic cirrhosis was evaluated by hematoxylin and eosin (HE) staining and Van Gieson's (VG) staining. The expression of alpha-smooth muscle actin (α-SMA), laminin (LN) and transforming growth factor-β1 (TGF-β1) in the liver was detected by immunohistochemistry. The dynamic changes in the levels of endotoxin, alanine transferase (ALT) and tumor necrosis factor-α (TNF-α) in plasma were monitored using various kits. The defenestration of liver sinusoidal endothelial cells (LSECs) was observed using a scanning electron microscope.
RESULTS: In the experimental group, plasma ALT level reached its peak at week 2 (57.84 ± 7.57 IU/L) and thereafter decreased. Plasma endotoxemia level gradually increased from week 2 to 6, but slightly decreased at week 8. Plasma TNF-α level increased from week 2 to 4, slightly decreased at week 6, and increased again at week 8. At all time points, the values of the above parameters were significant higher in the experimental group than in the control group (all P < 0.05). PVP showed the same tendency as TNF-α level, increasing from week 2 to 4, slightly decreasing at week 6, and increasing again at week 8. LSEC fenestration gradually shrank, lessened and disappeared from week 0 to 8. The expression levels of LN and TGF-β1 increased from week 0 to 8, significantly higher than those in the control group or at the previous time points in the same group (all P < 0.05). The expression level of α-SMA increased from week 0 to 6, but slightly decreased at week 8.
CONCLUSION: Intestinal endotoxemia occurs in hepatic cirrhosis rats, which can increase the synthesis of TNF-α, TGF-β1 and LN and promote LSEC defenestration. Intestinal endotoxemia may be indirectly involved in the development of hepatic sinusoidal capillarization.
- Citation: Yang ZX, Han DW, Xing HY, Liu HR, Yan Z. Pathogenesis of hepatic sinusoidal capillarization in hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3101-3108
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3101.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3101
肝窦毛细血管化(hepatic sinusoid capillarization)是肝纤维化(hepatic fibrosis)及肝硬化(hepatic cirrhosis)过程中的一个特征性病变, 他的主要特征包括: 肝窦内皮细胞(liver sinusoidal endothelial cell, LSEC)的去窗孔化、表型的改变和内皮下基底膜的形成, 他可以使肝脏微循环的功能发生改变并促进肝纤维化的形成, 并且与门静脉高压的形成有密切关系. 近年来, 肠源性内毒素血症(intestinal endotoxemia, IETM)与肝病的关系日益受到重视, 有大量的实验证实, 在实验性大鼠肝硬化形成过程中往往都伴有IETM, 后者又通过过度或持续激活枯否细胞(Kupffer cell, KC)所释放的细胞因子、炎性介质、自由基等, 又造成了肝脏"第二次打击", 进一步加重了肝纤维化及硬化的发生[1]. 本研究探讨IETM对肝窦毛细血管化形成的影响及其机制.
♂Wistar大鼠40只, 体质量200-250 g, 由山西医科大学实验动物中心提供. 兔抗大鼠层粘连蛋白(laminin, LN), 小鼠抗大鼠α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA), SABC法免疫组织化学试剂盒及DAB显色剂均购自武汉博士德生物工程有限公司. 兔抗大鼠转化生长因子(transforming growth factor-β1, TGF-β1), 购自北京中杉金桥生物技术有限公司. 肿瘤坏死因子(tumor necrosis factor-α, TNF-α)放免药盒购自上海海研医学生物技术中心. 内毒素(Endotoxin)鲎试剂定量检测试剂盒, 购自上海伊华临床医学科技公司. 胶原纤维(VG)染色液, 购自恒大百盛生物(北京)科技发展有限公司.
1.2.1 动物模型的复制及常规标本的制作: ♂Wistar大鼠40只, 完全随机分为2组: 正常对照组8只, 模型组32只. 采用复合因素致肝硬化模型的造模方法[2], 实验第1天, 皮下注射CCl4原液, 按0.5 mL/100 g体质量计算, 以后每隔3 d, 皮下注射40%的CCl4油溶液, 按0.3 mL/100 g体质量计算. 饲料喂养前2 wk为79.5%玉米面, 20%猪油, 0.5%胆固醇, 从第3周起为99.5%玉米面, 0.5%胆固醇, 10%-30%饮用乙醇为其唯一饮料. 正常对照组在实验开始时, 模型组分别于饲养第2、4、6、8周末, 各取6只, 空腹12 h后称质量, 按0.3-0.4 mL/100 g, 1%戊巴比妥钠腹腔注射麻醉, 在肠系膜上静脉末端穿刺, 并连接U型管, 管内注有无菌无热源生理盐水, 测定门静脉压力(PVP). 无菌无热源污染条件下经腹主动脉取血, 分离血清待检. 取部分肝左叶于固定液中固定, 石蜡包埋, 5 μm切片, 分别行HE、VG、免疫组织化学染色.
1.2.2 肝脏组织形态学观察: 肝组织切片常规HE和VG染色, 确定肝纤维化及硬化程度. 免疫组织化学染色观察LN、TGF-β1和α-SMA动态变化, 采用免疫组织化学SABC法, 以PBS缓冲液替代一抗做空白对照. 一抗浓度: LN, 1:50稀释; α-SMA, 1:100稀释; TGF-β1, 1:200稀释. 应用Image Pro Plus 5.0图像分析系统分析LN、TGF-β1和α-SMA免疫组织化学染色切片, 阳性染色为棕黄色, 每个标本各取1张, 在同一放大倍率下随机选择3个不同视野, 测量窗口区域内的积分吸光度值(IA值), 取平均值. LSEC窗孔扫描电镜标本制作方法: 正常组及模型组各时间点随机取2只, 采用门静脉插管灌流, 再经2%-3%戊二醛固定液和1%锇酸固定后, 梯度乙醇脱水, 真空干燥, 金属镀膜, 上镜观察.
1.2.3 主要血液生化指标的检测: 血清丙氨酸氨基转移酶(ALT)含量测定, 采用赖氏法; 血清内毒素(endotoxin)含量测定, 采用鲎试剂定量检测法; 血清TNF-α含量测定采用放射免疫法.
统计学处理 采用SPSS12.0统计软件, 进行单因素ANOVA方差分析, 两两比较采用SNK法, 相关分析采用Pearson相关分析, 实验数据均以mean±SD表示.
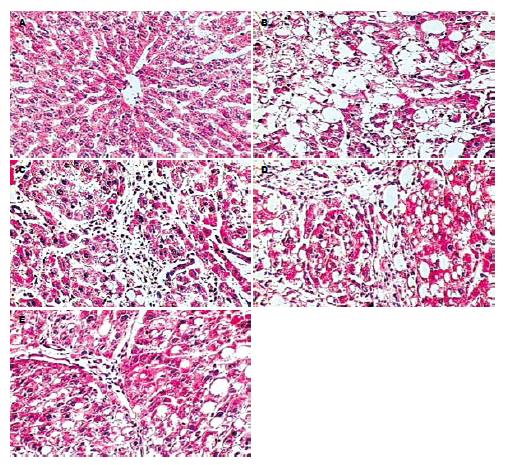
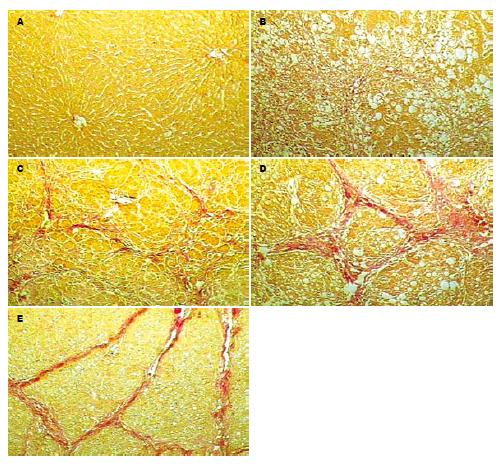
肝组织HE染色和VG染色示(图1-2): 第2周末为脂肪病变期, 第4周末为肝纤维化病变期, 第6周末, 为早期肝硬化, 第8周末, 为肝硬化期.
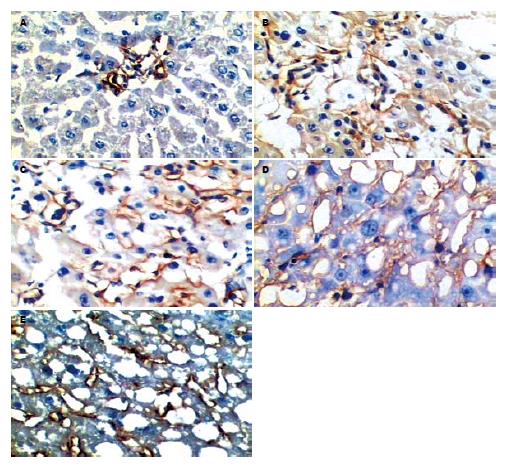
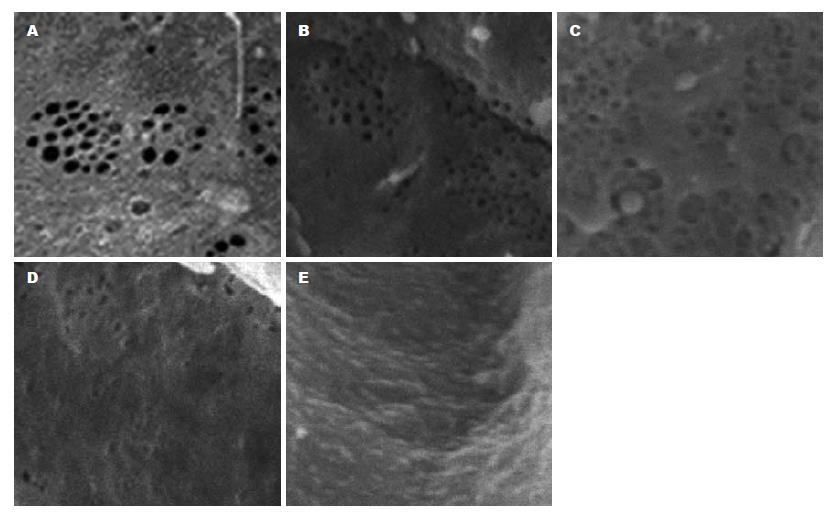
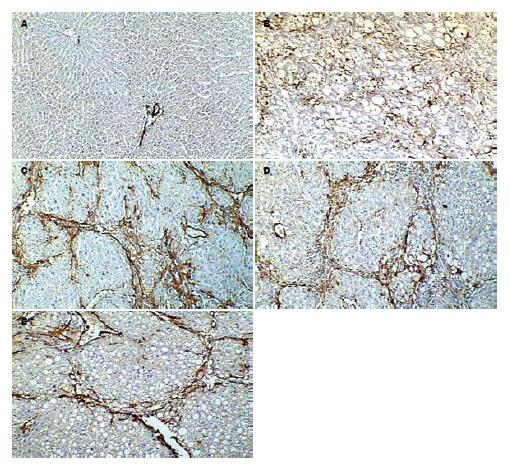
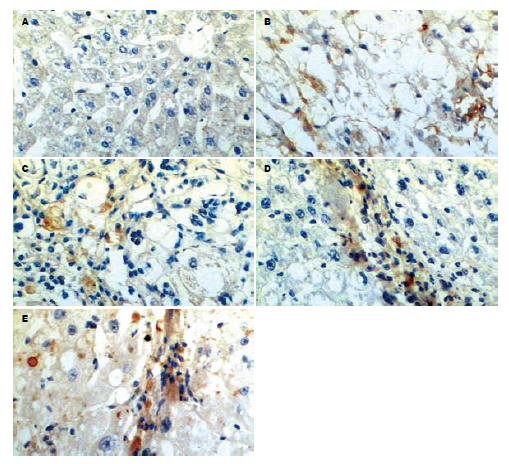
LN免疫组织化学染色(图3): 正常肝脏内仅在汇管区血管壁有少量LN阳性表达, 肝窦间隙内无LN分布. 随着病变的发展, 在纤维间隔及肝窦间隙逐渐出现阳性表达, 到第8周末, 在肝窦间隙内已呈连续的线状分布. 肝窦内皮细胞窗口扫描电镜观察的结果(图4): 正常LSEC上存在直径在100 nm左右, 大小不等的窗孔, 随着肝脏病变程度的加重, 窗孔逐渐变小, 变少直至消失, 到8 wk末时, 已完全消失, 类似于毛细血管内皮细胞, 形成肝窦毛细血管化.
血清ALT在第2周末达到高峰, 随后下降, 到第8周末仍然较正常对照组有统计学差异; 外周血清内毒素水平在第2、4、6周末, 各点呈递增趋势, 到第8周末时略有下降; 外周血清TNF-α水平在第2、4周末, 各时间点呈递增趋势, 而到第6周末时略有下降, 第8周末时又升高(表1).
PVP在第2、4周末, 各点呈递增趋势(从14.88±2.81到17.54±1.84), 到第6周末时略有下降(15.44±3.11), 第8周末时又逐渐升高(18.38±2.53), 考虑第6周末时PVP降低可能与侧支循环的建立有关.
α-SMA免疫组织化学染色(图5): 正常肝脏内除汇管区血管壁有阳性表达外, 小叶内未见阳性表达, 随着病变的发展, 在纤维间隔及肝窦间隙逐渐出现阳性表达, 到第8周末, 阳性表达主要分布在假小叶周围的纤维间隔区域内, 小叶内也有少量的阳性细胞表达. TGF-β1免疫组织化学染色(图6): 正常肝脏阳性表达仅见于少部分KC、肝形状细胞(hepatic stellate cell, HSC), 且着色较浅、范围较小. 随着病变的发展, 在脂肪病变区和纤维间隔区域内, 出现许多含棕黄色颗粒状的细胞, 范围广, 主要为活化的HSC和KC.
LN、TGF-β1免疫组织化学染色在第2、4、6、8周末, 阳性表达逐渐增强. α-SMA免疫组织化学染色在第2、4、6周末, 阳性表达逐渐增强, 到第8周末时略有下降, 下降原因与肝小叶再生有关(表2).
血清TNF-α与血清内毒素、PVP、α-SMA、TGF-β1及LN呈显著正相关(r = 0.8282, 0.8722, 0.7360, 0.7220, 0.8690, 均P<0.01), 肝脏TGF-β1与肝脏LN也呈显著正相关(r = 0.9080, P<0.01).
肝脏免疫组织化学及扫描电镜结果表明, 肝窦毛细血管化是肝纤维化及硬化过程中的一个特征性病变. 通过测定外周血内毒素及TNF-α的动态水平, 说明在肝硬化形成过程中同时伴随有IETM的形成[1]. 外周血TNF-α水平与肝脏免疫组织化学指标LN、TGF-β1、α-SMA的相关分析结果都呈高度正性相关, 说明IETM对肝窦毛细血管化的形成可能有重要影响.
在肝硬化形成过程中, 往往都伴有IETM, 从肠道吸收的内毒素, 可以激活KC, 使其产生一些重要的细胞因子, 如TNF-α、TGF-β1等, 这些细胞因子可以刺激HSC活化, 这与我们在早期的研究结果相一致[1]. 而活化的HSC又可以通过合成和分泌TGF-β1[3-4], 作用于自身及LSEC, 促进他们合成细胞外基质, 如LN和ColⅣ等, 从而促进肝窦毛细血管化的形成[5-6]. TGF-β1的作用尤为关键, 可以作用于HSC使其合成基底膜成分, 还可以作用于LSEC使之也可以分泌LN和ColⅣ[6]. 由内毒素引起的TGF-β1可通过以下两个途径: 首先内毒素可以直接刺激Kupffer产生TNF-α, 再通过TNF-α在作用于KC, 活化转录因子如NF-κB, 而引发TGF-β1大量合成的自分泌途径[7]; 其次, 由内毒素刺激Kupffer产生的TNF-α、PDGF、TGF-β1等细胞因子可以活化HSC, 活化HSC又可以合成和分泌大量TGF-β1[1]. 由此可见内毒素可以直接或间接的激活KC、HSC细胞产生TGF-β1. 因此IETM间接通过促进TGF-β1合成增多, 使HSC和LSEC合成和分泌LN、ColⅣ等基底膜成分, 形成基底膜, 促进肝窦毛细血管化的形成.
正常的肝窦壁是由一层LSEC构成, 他具有开放的窗孔及孔下缺乏完整的基底膜, 这使他不同于机体其他部位的血管内皮细胞. 实验中LSEC的扫描电镜结果表明, 随着肝脏病变程度的加重, LSEC窗孔逐渐变小, 变少直至消失, 到8 wk末时, 已完全消失, 已类似于毛细血管内皮. 正常的LSEC外基质对维持LSEC结构和功能的完整性具有重要作用[6], 他的改变对LSEC窗口的改变具有重要影响, 实验中的肝脏LN免疫组织化学结果表明, 随着LSEC下基底膜的逐渐形成, LSEC也逐渐失窗孔. 而内毒素可以通过间接刺激基底膜的形成, 引起LSEC失窗孔. 此外, 有实验表明LSEC窗孔在内毒素的直接作用下, 可以出现去窗孔化, 而且内毒素还可以通过激活Kupffer后产生的TNF-α、白细胞三烯等细胞因子, 对LSEC骨架的进行重新排列, 从而可以导致去窗孔化的发生[8-9], 而正常的LSEC对于维持正常HSC有重要作用, 转型后的LSEC不能逆转HSC活化[10].
由于肝窦毛细血管化可直接影响PVP[11-12], 这种窦内阻力的增加主要发生在Disse腔, 因为肝窦毛细血管化时Disse腔形态常因基底膜如LN、ColⅣ的形成, 以及LSEC去窗孔化而发生改变, 影响了PVP. 因此IETM可以通过间接促进肝窦毛细血管化的形成来影响PVP.
总之, IETM对肝纤维化及硬化时的特征性病变-肝窦毛细血管化的形成有重要影响作用.
肝窦毛细血管化是肝纤维化及硬化过程中的一个特征性病变, 而肝硬化又往往伴有内毒素血症, 这种肠源性内毒素血症对肝窦毛细血管化形成有何影响, 有待深入研究.
陈耀凯, 副教授, 中国人民解放军第三军医大学西南医院全军感染病研究所
肠源性内毒素血症是肝硬化进一步发生发展的重要促进因素, 如何有效地控制肠源性内毒素血症的发生是今后研究的重点.
韩德五证实, 在肝硬化形成过程中, 往往都伴有IETM, 从肠道吸收的内毒素, 可以激活KC, 使其产生一些重要的细胞因子, 如TNF-α、TGF-β1等, 这些细胞因子可以刺激HSC活化.
由于肠源性内毒素血症对肝脏会产生更直接的损害作用, 本文采用免疫组织化学法检测细胞因子、炎症介质、自由基等来研究肠源性内毒素血症对肝窦毛细血管化形成的影响.
本研究从一个侧面阐明了肝硬化的形成机制, 设计合理, 统计学方法应用恰当, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 3. | 王 连升, 陈 颖伟, 李 定国. TGFβ_1信号与肝纤维化. 国外医学·消化系疾病分册. 2004;24:142-144. |
| 5. | Wynn TA. Common and unique mechanisms regulate fibrosis in various fibroproliferative diseases. J Clin Invest. 2007;117:524-529. [PubMed] [DOI] |
| 6. | Neubauer K, Krüger M, Quondamatteo F, Knittel T, Saile B, Ramadori G. Transforming growth factor-beta1 stimulates the synthesis of basement membrane proteins laminin, collagen type IV and entactin in rat liver sinusoidal endothelial cells. J Hepatol. 1999;31:692-702. [PubMed] [DOI] |
| 7. | Tilg H, Diehl AM. Cytokines in alcoholic and nonalcoholic steatohepatitis. N Engl J Med. 2000;343:1467-1476. [PubMed] [DOI] |
| 8. | Braet F, Wisse E. Structural and functional aspects of liver sinusoidal endothelial cell fenestrae: a review. Comp Hepatol. 2002;1:1. [PubMed] [DOI] |
| 9. | Sarphie TG, D'Souza NB, Deaciuc IV. Kupffer cell inactivation prevents lipopolysaccharide-induced structural changes in the rat liver sinusoid: an electron-microscopic study. Hepatology. 1996;23:788-796. [PubMed] [DOI] |
| 10. | Deleve LD, Wang X, Guo Y. Sinusoidal endothelial cells prevent rat stellate cell activation and promote reversion to quiescence. Hepatology. 2008;48:920-930. [PubMed] [DOI] |
| 12. | DeLeve LD. Hepatic microvasculature in liver injury. Semin Liver Dis. 2007;27:390-400. [PubMed] [DOI] |