修回日期: 2008-12-26
接受日期: 2008-12-29
在线出版日期: 2009-01-28
目的: 探讨三硝基苯磺酸(TNBS)诱导结肠炎大肠道动力学异常的发病机制, 研究参青方消炎愈溃, 以及调节结肠神经递质P物质(SP)、血管活性肠肽(VIP)的作用机制.
方法: 用TNBS复制实验性大鼠结肠炎模型, 随机分为参青方高剂量组、参青方低剂量组、美沙拉嗪组、模型Ⅰ组、模型Ⅱ组及正常组, 每组各10只. 其中模型Ⅰ组于造模3 d时处死, 其余5组均在3 d开始给药, 每日1次, 连续给药7 d时处死. 取大鼠结肠病变部位标本, 检测结肠组织中超氧化物歧化酶(SOD)、髓过氧化物酶(MPO)及丙二醛(MDA)含量; 免疫组化染色法检测SP和VIP的表达.
结果: 模型Ⅰ组结肠黏膜MPO、MDA含量比正常组增加(2.78±0.26 vs 0.56±0.20, 15.14±2.02 vs 7.41±1.19, 均P<0.05), SOD含量减少(84.15±6.27 vs 176.33±12.06, P<0.05); 与模型Ⅱ组比较, 参青方高剂量组、参青方低剂量组和美沙拉嗪组MPO、MDA含量明显减少(1.03±0.23, 1.57±0.27, 1.59±0.12 vs 2.03±0.33; 8.30±1.27, 10.09±1.09, 10.46±1.37 vs14.38±1.84, 均P<0.05), SOD含量增加(190.17±7.71, 178.90±8.59, 176.13±9.50 vs 107.09±6.37, 均P<0.05). 正常组大鼠结肠组织可见VIP、SP阳性表达, 与正常组比较, 模型Ⅰ组大鼠结肠组织SP、VIP表达减少(42 608.00±4823.37 vs 461 570.00±18 227.7; 50 801.90±7698.09 vs 607 333.90±34 166.35, 均P<0.05), 经治疗后, 参青方高剂量组、参青方低剂量组和美沙拉嗪组SP、VIP表达上调(302 253.10±11 484.92, 171 014.7±21 993.34, 158 355.10±13 855.66 vs 77 260.26±9375.49; 419 171.36±23 267.98, 279 572.17±26 645.82, 282 438.50±13 236.13 vs 111 838.85±9698.09, 均P<0.05).
结论: 参青方能够上调结肠VIP和SP表达, 因而具有调节肠道动力学的作用.
引文著录: 戴彦成, 唐志鹏, 王臻楠, 张亚利, 李凯, 何新颖. 参青方对三硝基苯磺酸诱导结肠炎大鼠结肠SP和VIP表达的影响. 世界华人消化杂志 2009; 17(3): 253-258
Revised: December 26, 2008
Accepted: December 29, 2008
Published online: January 28, 2009
AIM: To study the change of intestinal motility in trinitrobenzene sulfonic acid (TNBS)-induced rat colitis and to investigate the mechanism underlying the anti-inflammatory action and regulating the expression of substance P(SP)and vasoactive intestinal Polypeptide (VIP) by Shenqing recipe (SQR).
METHODS: Rats were randomly divided into SQR high dose group, SQR low dose group,5-ASA group, model Ⅰ group, model Ⅱ group and normal group with 10 rats in each group. Rats in model Ⅰ group were killed on day 3, and rats in the other groups were given medicine on day 3, once a day for 7 days. Rats were killed after 7 days' treatment. Histopathological assessment of the colonic mucosa was performed. MPO, MDA and SOD levels in the colonic mucosa were determined by ultraviolet spectrometer. The expression of neurotransmitters including SP and VIP was detected by immunohistochemical staining.
RESULTS: Compared with the normal group, the colonic mucosal levels of MPO and MDA were increased (2.78 ± 0.26 vs 0.56 ± 0.20, 15.14 ± 2.02 vs 7.41 ± 1.19, P < 0.05), while the level of SOD was decreased in the model Ⅰ group (84.15 ± 6.27 vs176.33 ± 12.06, P < 0.05). Compared with model Ⅱ group, the colonic mucosa levels of MPO and MDA were markedly decreased (1.03 ± 0.23, 1.57 ± 0.27, 1.59 ± 0.12 vs 2.03 ± 0.33; 8.30 ± 1.27, 10.09 ± 1.09, 10.46 ± 1.37 vs 14.38 ± 1.84, P< 0.05), and the level of SOD was increased in the SQR high dose group, SQR low dose group and 5-ASA group (190.17 ± 7.71, 178.90 ± 8.59, 176.13 ± 9.50 vs 107.09 ± 6.37, P < 0.05). Compared with the normal group, the expression of VIP and SP of the colonic mucosal was decreased in model Ⅰ group (42 608.00 ± 4823.37 vs 461 570.00 ± 18 227.7; 50 801.90 ± 7698.09 vs 607 333.90 ± 34 166.35, P < 0.05). After treatment, compared with the model Ⅱ group ,the expressions of VIP and SP were up-regulated in SQR high dose group, SQR low dose group and 5-ASA group (302 253.10 ± 11 484.92, 171 014.7 ± 21 993.34, 158 355.10 ± 13 855.66 vs 77 260.26 ± 9375.49; 419 171.36 ± 23 267.98, 279 572.17 ± 26 645.82, 282 438.50 ± 13 236.13 vs 111 838.85 ± 9698.09, all P < 0.05).
CONCLUSION: Our data indicate Shenqing recipe regulates the intestinal motility of SQR possibly through up- regulating the expressions of VIP and SP.
- Citation: Dai YC, Tang ZP, Wang ZN, Zhang YL, Li K, He XY. Effect of Shenqing recipe on the expression of substance P and vasoactive intestine poiypeptide in TNBS-induced rat colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 253-258
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/253.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.253
溃疡性结肠炎(ulcerative colitis, UC), 是以腹痛、腹泻、黏液脓血便、里急后重等为主要症状, 以直、结肠黏膜及黏膜下层炎症和溃疡形成为病理特点的一种慢性非特异性消化系疾病. 大多研究侧重于异常免疫应答、炎症因子等免疫发病机制为主的层面. 近年来, 肠道动力学与溃疡性结肠炎的发病关系得到医学界的重视, 并逐渐成为UC发病机制研究的热点[1]. 本文对三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)诱导结肠炎大鼠结肠P物质(substance P, SP)、血管活性肠肽(vasoactive intestinal polypeptide, VIP)2种主要的肽能神经递质进行了研究, 探讨其调节肠道动力作用的机制.
♂清洁级健康SD大鼠60只, 体质量180-200 g, 购自上海斯莱克实验动物有限责任公司. 随机分为6组, 即正常组、模型Ⅰ组、模型Ⅱ组、美沙拉嗪组、参青方低剂量组、参青方高剂量组, 每组10只. 参青方由青黛、参三七、地榆等组成, 由上海家化医药科技有限公司提供. 美沙拉嗪肠溶片(mesalazine, -aminosalicylic acid, 5-ASA), 商品名惠迪, 由佳木斯鹿伶制药有限责任公司生产. 2, 4, 6-三硝基苯磺酸(TNBS)为美国Sigma公司产品. 兔抗大鼠VIP多克隆抗体, 购自美国Santa Cruz公司. 兔抗大鼠SP多克隆抗体, 购自英国ABCAM公司. 髓过氧化酶(myoleperoxidase, MPO)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malonaldehyde, MDA)测试盒均为南京建成生物工程研究所产品.
1.2.1 造模: 除正常组大鼠之外, 其余动物参考文献制备TNBS诱导结肠炎大鼠模型[2]. 造模前将大鼠禁食不禁水24 h后, ip氯胺酮2 mL/kg麻醉大鼠, 用大鼠直灌胃针从肛门插入肠道深约8 cm, 向每只大鼠结肠内注入100 mg/kg浓度TNBS原液0.4 mL+500 mL/L乙醇溶液0.25 mL, 然后注入约0.3 mL空气, 并用夹子夹住大鼠肛门约2 h. 造模后大鼠归笼, 自然清醒, 自由饮食.
1.2.2 给药: 于造模后3 d开始, 各组大鼠经肛门给药. 配置5 g/L的羧甲基纤维素钠(sodium carboxymethylcellulose, CMC-Na)溶液. 各组给药剂量及浓度(W/V)如下: 美沙拉嗪组: 美沙拉嗪肠溶片(5-ASA)临床成人用量为50 mg/(kg·d), 大鼠给药剂量则按600 mg/(kg·d), 配成溶液浓度为60 g/L, 用CMC-Na溶液溶解, 下同. 参青方原处方临床成人用量为45.2 g原料药每天, 按成人体质量60 kg计算, 即每天原料药0.753 g/kg. 参青方低剂量组: 剂量为1.2 g/(kg·d), 配成溶液浓度为120 g/L. 参青方高剂量组: 剂量为2.4 g/(kg·d), 配成溶液浓度为240 g/L. 给药体积为1 mL/100 g体质量, 经肛门给药每天1次, 连续7 d. 正常组和模型Ⅱ组经肛门给予等体积的5 g/L CMC-Na.
1.2.3 标本采集: 模型Ⅰ组于3 d, 其余各组大鼠于给药7 d(即造模处理10 d)后取材. 分离结肠, 沿肠系膜纵轴剪开肠腔, 剪取距肛门8 cm左右病变的结肠段, 纵向剖开冰生理盐水冲洗干净后平展于过滤纸上, 一部分结肠组织经40 g/L的中性甲醛溶液固定后, 常规脱水、浸蜡、透明、包埋, 4 μm厚度切片, 分别行常规HE染色和免疫组化染色. 其余部分结肠组织迅速置于液氮中, 然后转入-80℃冰箱保存, 留待行检测MPO、MDA、SOD的含量检测.
1.2.4 结肠组织病理形态学观察: 切片HE染色后以Olympus显微镜观察并拍照.
1.2.5 结肠组织MOP、SOD和MDA水平的测定: 测定方法按MPO、SOD和MDA试剂盒说明书操作.
1.2.6 免疫组化检测: 采用EnVision免疫组化染色法(两步法), 操作过程按照试剂盒说明书进行, 兔抗大鼠SP、VIP多克隆抗体稀释倍数为1:100. 每张切片分析3个视野, 采用IMS细胞图像分析系统(上海申腾信息技术有限公司)分析切片免疫组化图像中阳性区域面积和吸光度值(A), 并计算免疫组化指数(HIC-I). 免疫组化指数 = 阳性面积(Area+)×A, 从而描述或反应样本的阳性情况.
统计学处理 所有计量资料的数据均以mean±SD表示, 各组数据进行正态检验及方差齐性检验, 采用SPSS11.5统计软件进行单因素方差分析(analytic of variance, ANOVA)和LSD-t(least significant difference-t)检验进行组间比较, P<0.05为具有统计学意义.
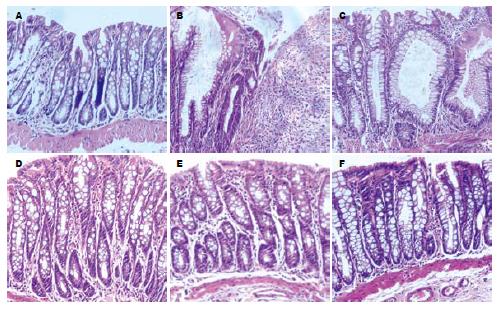
正常组大鼠结肠黏膜上皮完整、连续, 细胞与腺体排列规则, 黏膜、固有层内血管和纤维间质正常, 肌层无异常; 模型Ⅰ组大鼠结肠黏膜出现广泛坏死、糜烂、腺体结构紊乱, 可见溃疡及隐窝脓肿形成, 个别溃疡深达黏膜下层甚至肌层, 炎症细胞浸润全层, 并可见到淋巴滤泡及巨噬细胞. 模型Ⅱ组仍有黏膜层糜烂, 黏膜及黏膜下层炎细胞浸润较前有所好转, 溃疡底部已见肉芽组织增生, 部分糜烂黏膜表面已有上皮移行修复迹象. 参青方低剂量组和美沙拉嗪组可见程度不同的黏膜上皮移行修复, 肉芽组织增生, 固有层中腺体呈管状增粗, 可见散在淋巴细胞及巨噬细胞. 参青方高剂量组黏膜下层和肌层轻度水肿, 炎症细胞减少, 并见肉芽组织参与修补, 多数表面已出现上皮修复, 黏膜腺体恢复接近正常(图1).
与正常组比较, 模型Ⅰ组及模型Ⅱ组大鼠病变结肠组织MPO、MDA含量均明显升高, SOD含量均明显减少, 差异有显著性意义(P<0.05); 实验结束时, 与模型Ⅱ组比较, 参青方高剂量组、参青方低剂量组和美沙拉嗪组的MPO、MDA含量均显著减少, SOD含量均显著增加(P<0.05); 但参青方低剂量组与美沙拉嗪组比较, 两者差异无显著性意义(P>0.05, 表1).
免疫组化染色显示: SP、VIP阳性产物为棕黄色或棕褐色, 分布于正常组大鼠肠道黏膜层、黏膜下层、肌层; 而在结肠炎大鼠的再生黏膜腺体、溃疡边缘腺体及溃疡底部肉芽组织中表达明显减少. 通过分析免疫组化指数表明: 与正常组大鼠比较, 模型Ⅰ组大鼠结肠组织VIP、SP表达明显减少, 差异有显著性意义(P<0.05); 实验结束时, 与模型Ⅱ组比较, 参青方高剂量组、参青方低剂量组和美沙拉嗪组结肠组织VIP、SP表达均显著增加(P<0.05); 参青方高剂量组结肠组织VIP、SP表达高于参青方低剂量组和美沙拉嗪组(P<0.05); 但参青方低剂量组与美沙拉嗪组比较, 两者差异无显著性意义(P>0.05, 表2).
| 分组 | n | SP(HIC-I) | VIP(HIC-I) |
| 正常组 | 10 | 461 570.00±18 227.7 | 607 333.90±34 166.35 |
| 模型Ⅰ组 | 10 | 42 608.00±4823.37a | 50 801.90±7698.09a |
| 模型Ⅱ组 | 9 | 77 260.26±9375.49a | 111 838.85±9698.09a |
| 美沙拉嗪组 | 10 | 158 355.10±13 855.66e | 282 438.50±13 236.13e |
| 参青方低剂量组 | 9 | 171 014.7±21 993.34e | 279 572.17±26 645.82e |
| 参青方高剂量组 | 10 | 302 253.10±11 484.92ce | 419 171.36±23 267.98ce |
UC的发病率和患病率在我国有明显增加趋势[3], 其发病机制尚在研究中. 中性粒细胞、炎性介质是导致UC溃疡、糜烂的最直接因素. MPO是中性粒细胞中的一种酶, 在单核和巨噬细胞中也有少量存在, 故其含量的增高可以反映中性粒细胞在某一组织中的增高, 间接反映炎症在组织中的存在. 因此, 凡是存在中性粒细胞浸润的组织都可以通过MPO活性测定来决定细胞浸润程度. 对于他的检测能较好地反映本病急性炎症期(致炎后1 wk内)中性粒细胞浸润情况, 作为评价本病的急慢性病理改变和炎症程度具有重要意义[4]. 一些学者报道认为氧自由基(oxygen free radicals, OFR)在UC发病过程中起者重要作用[5]. 当OFR形成过量或抗氧化系统削弱, OFR可引起机体一系列损伤, 其中最重要的是触发细胞膜上的多不饱和脂肪酸发生脂质过氧化的链式反应, 产生MDA等脂质过氧化物, 使组织损害进一步加重[6]. 测定MDA含量不仅可间接反映OFR生成的多少, 同时也是OFR触发生物膜脂质过氧化反映的直接证据和膜结构受损程度的指标[7]. 而SOD是体内最重要的自由基-超氧阴离子自由基的天然清除剂, 可以保护细胞免受损伤. 检测SOD含量可以间接了解自由基在体内的状况和机体清除氧自由基的能力[8].
肠肽能神经递质包括VIP、SP等. 他们能有效调节肠道免疫活性, 与UC的发病机制有一定联系. VIP是一种含28个氨基酸残基的碱基多肽, 在整个消化系肌间丛分布着VIP免疫反应阳性胞体与纤维, 其主要作用是舒张胃肠平滑肌、舒张血管和刺激腺体分泌. ICC与VIP神经元连接紧密, 其细胞膜上发现有VIP-1和VIP-2受体. SP为含11个氨基酸残基的直链多肽, 分布人体全身, 以胃肠道和中枢神经系统浓度最高. SP为胃肠感觉和运动神经元的兴奋性递质, 其生理作用为强烈促进消化系平滑肌收缩, 刺激小肠、结肠黏膜分泌水和电解质等.
以前研究已证实在炎症性肠病累及的肠段中肠神经肽含量及其神经分布均有显著的变化, 而这些改变都与病变结肠腺体和血管的固有层的改变相关. Kimura et al[9]研究指出, 活动性UC患者的VIP神经元和SP神经元均减少. 特别是在脓肿周围, VIP神经原几乎是缺如的, 而在其未被累及的黏膜中分部则没有改变. Surrenti et al[10]测定了中度及重度UC患者结肠直肠黏膜中VIP的含量, 发现他明显减少, 而且VIP的减少与黏膜炎症程度显著相关. Surrenti et al推测, VIP的下降是一个继发现象, 即继发于黏膜的炎症损伤. Delgado et al[11]研究发现VIP能阻止诱导型一氧化氮合酶(iNOS)在巨噬细胞的转录, 而已有实验发现, 在活动性炎症性肠病, 结肠黏膜中NO产生过多可加重黏膜损伤, 结肠黏膜中iNOS活性增加与炎症程度相关, 由此推测VIP的下降也可能通过此途径参与了黏膜的炎症反应. Törnblom et al[12]研究发现: UC患者的ENS由胆碱能神经节变为SP神经节, 这一改变可能是UC肠道动力学改变的神经基础. Vento et al[13]在研究了UC患者中SP与生长相关蛋白243(GAP243)关系后发现, UC患者中GAP243没有变化, 因为GAP243是与神经再生相关的, 可以反映神经再生的发生, 由此推断UC患者SP的升高与肠神经元的再生没有明显关系, 亦即UC中没有明显的肠神经元再生发生, 而SP的升高可能与SP的合成增多有关, 过多的SP合成造成SP反应性神经纤维变得明显, 这也解释了很多研究发现的UC患者中SP反应性神经纤维明显增多的结论. 也有研究[14]得出在严重UC患者肠道SP含量是下降的, 其机制可能与血管活性肠肽下降机制类似, 由于疾病严重期造成的黏膜神经受到很大破坏有关.
本实验结果表明: 参青方治疗溃疡性结肠炎的机制之一可能是降低结肠组织MPO含量, 增加肠道组织黏膜SOD含量, 清除氧自由基从而改善肠道黏膜损害. 在TNBS诱导大鼠结肠炎模型中, 黏膜的神经元分布改变伴随着黏膜炎症损害. 由于神经肽是重要的免疫调节因子, 其改变可能引起结肠黏膜免疫功能的异常, 从而导致结肠黏膜损害及肠道动力学改变. 参青方可能通过消炎愈溃, 修复受损结肠黏膜, 改善病变部位神经递质VIP和SP表达, 从而调节肠动力.
参青方(青黛、参三七, 一见喜等)是口服结肠靶向制剂参青肠溶片的原料药, 是建立在龙华医院自制剂型清肠栓的良好疗效基础上, 继续以清热化湿、活血止血立法, 改进药物组成配方, 研制中药口服pH依赖性结肠靶向定位释放的新剂型. 他在回盲部崩解释放, 直接作用于靶器官, 既体现和提升了中医药治疗溃疡性结肠炎的简、便、廉、验特色, 又富有创新性, 具有良好的开发和产业化前景. 本实验对参青方调节UC肠道动力学的机制进行初步研究, 为中医药治疗UC提供了新的思路和方法.
肠道动力学异常与溃疡性结肠炎(UC)的发病关系得到医学界的重视, 并逐渐成为UC发病机制研究的热点, 而P物质(SP)、血管活性肠肽(VIP)这两种主要的肽能神经递质在胃肠道电生理和动力发生以及动力障碍上具有重要作用.
杜群, 副研究员, 广州中医药大学脾胃研究所药理室.
UC是临床常见难治性疾病, 目前西医治疗存在疗效欠佳、复发率高、副作用大及价格昂贵问题. 中医药治疗本病具有优势. 参青方(青黛、参三七, 一见喜等)是口服结肠靶向制剂参青肠溶片的原料药, 具有清热解毒化湿, 凉血化瘀止血, 祛腐生新愈疡之功, 持续应用能有效防止溃疡性结肠炎复发, 是中药治疗该病的有效方剂.
Kimura et al研究指出, 活动性UC患者的VIP神经元和SP神经元均减少. 特别是在脓肿周围, VIP神经原几乎是缺如的, 而在其未被累及的黏膜中分部则没有改变.
本文采用免疫组化染色法检测大鼠结肠病变部位SP、VIP的表达, 结果提示参青方能够上调结肠VIP和SP表达, 因而具有调节肠道动力学的作用.
本文对参青方调节UC肠道动力学的机制进行初步研究, 为中医药治疗UC提供了新的思路和方法.
本文设计合理, 结果可信, 有较好的科学意义.
编辑: 李军亮 电编:何基才
| 2. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 4. | Depoortere I, Van Assche G, Thijs T, Geboes K, Peeters TL. Differential changes in ACh-, motilin-, substance P-, and K (+)-induced contractility in rabbit colitis. Am J Physiol. 1999;277:G61-G68. [PubMed] |
| 5. | Simmonds NJ, Rampton DS. Inflammatory bowel disease--a radical view. Gut. 1993;34:865-868. [PubMed] [DOI] |
| 7. | Sedghi S, Keshavarzian A, Klamut M, Eiznhamer D, Zarling EJ. Elevated breath ethane levels in active ulcerative colitis: evidence for excessive lipid peroxidation. Am J Gastroenterol. 1994;89:2217-2221. [PubMed] |
| 9. | Kimura M, Masuda T, Hiwatashi N, Toyota T, Nagura H. Changes in neuropeptide-containing nerves in human colonic mucosa with inflammatory bowel disease. Pathol Int. 1994;44:624-634. [PubMed] [DOI] |
| 10. | Surrenti C, Renzi D, Garcea MR, Surrenti E, Salvadori G. Colonic vasoactive intestinal polypeptide in ulcerative colitis. J Physiol Paris. 1993;87:307-311. [PubMed] [DOI] |
| 11. | Delgado M, Munoz-Elias EJ, Gomariz RP, Ganea D. Vasoactive intestinal peptide and pituitary adenylate cyclase-activating polypeptide prevent inducible nitric oxide synthase transcription in macrophages by inhibiting NF-kappa B and IFN regulatory factor 1 activation. J Immunol. 1999;162:4685-4696. [PubMed] |
| 12. | Törnblom H, Lindberg G, Nyberg B, Veress B. Full-thickness biopsy of the jejunum reveals inflammation and enteric neuropathy in irritable bowel syndrome. Gastroenterology. 2002;123:1972-1979. [PubMed] [DOI] |
| 13. | Vento P, Kiviluoto T, Keränen U, Järvinen HJ, Kivilaakso E, Soinila S. Quantitative comparison of growth-associated protein-43 and substance P in ulcerative colitis. J Histochem Cytochem. 2001;49:749-758. [PubMed] |
| 14. | Renzi D, Mantellini P, Calabrò A, Panerai C, Amorosi A, Paladini I, Salvadori G, Garcea MR, Surrenti C. Substance P and vasoactive intestinal polypeptide but not calcitonin gene-related peptide concentrations are reduced in patients with moderate and severe ulcerative colitis. Ital J Gastroenterol Hepatol. 1998;30:62-70. [PubMed] |