修回日期: 2008-12-12
接受日期: 2008-12-15
在线出版日期: 2009-01-28
目的: 评价携带TRAIL基因的肿瘤特异性增殖型腺病毒CNHK500-hTRAIL在人肝癌细胞株中介导TRAIL基因表达及对肝癌细胞的凋亡诱导作用.
方法: CNHK500-hTRAIL感染人肝癌细胞株HepG2、Hep3B以及人正常肝细胞株WRL-68, 通过增殖实验观察病毒的选择性增殖能力, 并进行酶联免疫吸附试验(ELISA)检测TRAIL蛋白的表达量, 四甲基偶氮唑蓝(MTT)比色法检测其杀伤肝癌细胞的功效, 流式细胞术(FCM)检测其对细胞早期凋亡的影响.
结果: CNHK500-hTRAIL能选择性地在HepG2、Hep3B细胞内高效增殖; 感染72 h后HepG2、Hep3B细胞培养上清中TRAIL的表达量分别为167.4、173.22 ng/L; 在MOI = 0.1时, CNHK500-hTRAIL即可明显杀伤HepG2、Hep3B细胞, 并选择性地诱导细胞早期凋亡, 均显著高于空病毒CNHK500及非增殖型腺病毒Ad-hTRAIL; 而对人正常肝细胞株WRL-68则无明显杀伤作用.
结论: 携带TRAIL基因的肿瘤特异性增殖型腺病毒载体对肿瘤细胞的杀伤能力和目的基因的表达, 明显优于单纯的病毒载体及传统的非增殖型腺病毒载体, 应用前景广阔.
引文著录: 刘永靖, 陈飞虎, 苏长青, 王星华, 钱炎珍, 钱其军. 携带TRAIL基因的新型溶瘤病毒体外诱导肝癌细胞凋亡. 世界华人消化杂志 2009; 17(3): 241-246
Revised: December 12, 2008
Accepted: December 15, 2008
Published online: January 28, 2009
AIM: To evaluate the efficiency of transgene expression and inducing apoptosis on tumor-specific replication-competent adenovirus carrying human tumor necrosis factor-related apoptosis-inducing ligand gene, a novel gene-viral therapeutic system CNHK500-hTRAIL, in hepatocellular carcinoma (HCC) cell lines in vitro.
METHODS: HCC cell lines HepG2, Hep3B and normal hepatocyte lines WRL-68 were transfected with CNHK500-hTRAIL. Virus replication assay was performed to evaluate the selective replication ability of CNHK500-hTRAIL. ELISA assay was used to detect the transgene expression of TRAIL. The cytotoxicity in cultured HCC and normal cells was evaluated by Methyl thiazolyl tetrazolium (MTT). Flow cytometry (FCM) was used to detect the early apoptotic induced by CNHK500-hTRAIL.
RESULTS: CNHK500-hTRAIL was selectively proliferated in the telomerase-positive HCC cell lines HepG2 and Hep3B. 72 hours after infection with CNHK500-hTRAIL, the expression of TRAIL in the supernatant of cultured cell lines HepG2 and Hep3B were 167.4 and 173.22 ng/L, respectively; CNHK500-hTRAIL killed more HepG2 and Hep3B cells significantly with MOI = 0.1 and induced obvious apoptosis but not in WRL-68 even with MOI = 50. The ability of transgene expression and inducing apoptosis were significantly stronger than that of replication-competent adenovirus CNHK500 or replication-defective Ad-hTRAIL.
CONCLUSION: Replication-competent adenovirus carrying human TRAIL gene is more effective than simplex oncolytic adenovirus or replication-defective adenovirus carrying human TRAIL gene in both cytotoxicity and efficiency of gene transfer in HCC, and holds great promise in the area of HCC therapy.
- Citation: Liu YJ, Chen FH, Su CQ, Wang XH, Qian YZ, Qian QJ. A novel oncolytic adenovirus carrying human tumor necrosis factor-related apoptosis-inducing ligand gene induces hepatocellular carcinoma cell line apoptosis in vitro. Shijie Huaren Xiaohua Zazhi 2009; 17(3): 241-246
- URL: https://www.wjgnet.com/1009-3079/full/v17/i3/241.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i3.241
以往研究表明, 肿瘤坏死因子相关凋亡诱导配体(TRAIL)具有明显的抗肿瘤活性, 但由于系统给药可能存在的肝细胞毒性, 限制了其进一步应用[1]. 如果能使TRAIL仅在肿瘤局部形成高浓度, 则是提高疗效、降低毒性的关键所在. 为此, 我们利用增殖型腺病毒载体可特异性地靶向肿瘤细胞内增殖复制的特点, 以携带人TRAIL基因的肿瘤特异性增殖型腺病毒治疗肝癌, 并以携带人TRAIL基因的传统非增殖型腺病毒为对照, 观察并比较对肝癌细胞的杀伤能力.
携带人肿瘤坏死因子相关凋亡诱导配体可溶性胞外区基因的增殖型腺病毒CNHK500-hTRAIL、空病毒载体CNHK500以及增殖缺陷型腺病毒载体Ad-hTRAIL由第二军医大学东方肝胆外科医院病毒-基因治疗实验室构建并保存[2]. 胎牛血清(FBS)、DMEM、MEM培养液均购于Gibco BRL公司.
1.2.1 细胞株及培养: 人肝癌细胞株HepG2、Hep3B, 正常人肝细胞株WRL-68均购自ATCC(American Type Cuture Collection, USA). HepG2、Hep3B用含100 mL/L FBS的DMEM培养液, WRL-68用含100 mL/L FBS的MEM培养液. 所有细胞37℃、50 mL/L CO2条件下培养, 2.5 g/L胰酶消化、传代.
1.2.2 病毒增殖实验: 取对数生长期的HepG2、Hep3B、WRL-68细胞铺6孔板, 3×105/孔, 置于37℃ 50 mL/L CO2孵箱内24 h(正常人肝细胞株WRL-68则需培养48 h), 待细胞贴壁后, 换用无血清培养液1 mL, 按MOI = 5分别加入病毒CNHK500-hTRAIL和wtAd5, 2 h后弃去含病毒的培养液, 换用含50 mL/L血清的培养液3 mL, 分别在0、6、12、48、96 h用细胞刮子将细胞移至5 mL离心管中, 置于-80℃冰箱中, 反复冻融3次, 使病毒自细胞中释放, 用TCID50法测定病毒滴度. 以0 h病毒滴度为参照, 计算病毒的增殖倍数.
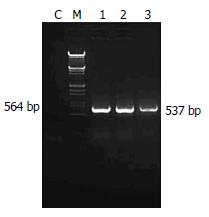
1.2.3 TRAIL基因表达的检测: 以上述相同方法配制成的单个HepG2、Hep3B、WRL-68细胞悬液加入6孔培养板, 3×105个细胞/孔, 常规培养24 h后按MOI = 5加入CNHK500-hTRAIL病毒液100 μL, 2 h后换20 mL/L血清培养液2 mL, 再孵育24h后收集细胞, 均计数为5×109个/L, 提取细胞总RNA, 以TRAIL可溶性胞外区(114-281AA)cDNA引物(上海基康公司合成), 序列见表1. 以相同体系进行RT-PCR(反应体积25 μL, 1 μL抽提的总RNA为模板), 反应条件为50℃ 30 min, 94℃ 2 min, [94℃ 30 s, 52℃ 30 s, 72℃ 90 s]×35个循环, 最后一个循环72℃延伸10 min, 产物全部进行琼脂糖凝胶电泳. 紫外灯下观察结果并照相.
| 引物 | 序列 | 片段(bp) |
| P1 | AGCCCTCTGGCCCAGGCAGTGAGAGAAAGAGGTCCTCA | 537 |
| P2 | TGCTCTAGACTATTAGCCAACTAAAAAGGCCCCGA |
1.2.4 MTT检测细胞活力: 按不同MOI值进行MTT实验. 以配制成的单个HepG2、Hep3B、WRL-68细胞悬液, 按100 μL/孔加入96孔培养板, 置于37℃ 50 mL/L CO2孵箱内24 h. 无血清培养液稀释病毒, 按MOI = 0、0.01、0.02、0.05、0.1、0.2、0.5、1、2、5、10, 加入CNHK500-hTRAIL或CNHK500病毒液100 μL, 按MOI = 0、0.1、0.2、0.5、1、2、5、10、20、50、100加入Ad-hTRAIL病毒液100 μL, 对应于每个MOI值设8个复孔, 37℃ 50 mL/L CO2孵箱培养7 d. 进行MTT检测, 测定波长570 nm, 校正波长655 nm(具体方法见Roche公司MTT检测试剂盒操作说明). 相同条件下重复实验3次, 结果取均数.
1.2.5 ELISA检测TRAIL蛋白表达量: 以配制成的单个细胞悬液加入6孔培养板, 常规孵育24 h后换无血清培养液1 mL, CNHK500-hTRAIL按MOI = 1、Ad-hTRAIL按MOI = 20加入用无血清培养液稀释的病毒液各100 μL, 空白对照组加Ad-Buffer液100 μL, 感染2 h后换2%血清培养液2 mL, 置于孵箱72 h后收集培养液上清, 行ELISA检测. 测定波长450 nm, 校正波长为540 nm.
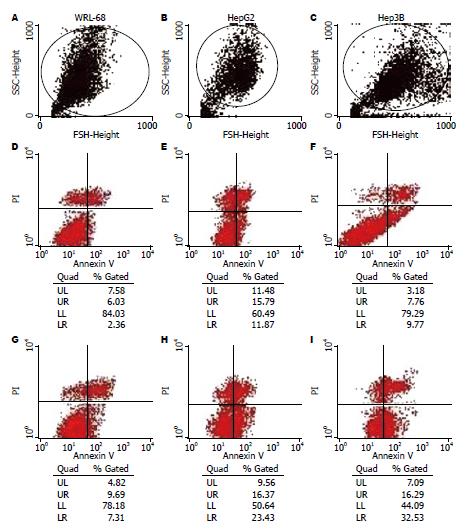
1.2.6 FCM检测细胞早期凋亡: 常规铺6孔板, 肿瘤细胞5×105/孔, 正常细胞1×106/孔, 3 mL/孔. 孵育24 h后换用无血清培养液1 mL/孔, CNHK500-hTRAIL及CNHK500按MOI = 1, Ad-hTRAIL按MOI = 10分别加入病毒100 μL/孔, 十字摇匀; 2 h后换用50 mL/L血清培养液3 mL/孔, 再培养24 h; 收集细胞, 冷PBS洗细胞2次, 1×AnnexinV结合缓冲液重悬细胞至1×109/L; 取100 μL重悬液(1×105)至5 mL培养管; 加10 μL(20 mg/L)Annexin V-FITC, 室温避光30 min, 轻轻混匀, 再加入PI(50 mg/L)5 μL, 室温避光孵育5 min; 每管加400 μL 1×Annexin V结合缓冲液, 1h内流式细胞仪检测. 同时以不加Annexin V-FITC及PI的一管作为阴性对照. 避光, 1 h内检测.
统计学处理 采用SPSS ver.11.5软件进行统计分析, 实验数据以mean±SD表示, 两样本均数差别采用t检验. P<0.01认为差异有统计学意义.
经CNHK500-hTRAIL处理的HepG2、Hep3B细胞株, 可以检测到TRAIL可溶性胞外区mRNA的表达, 并且明显多于WRL-68细胞中的表达量(图1).
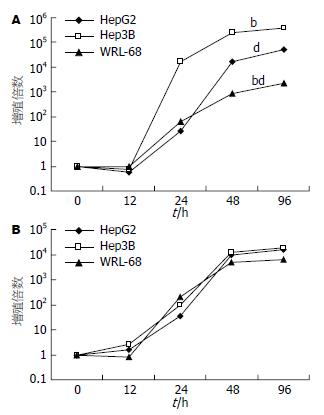
在HepG2、Hep3B人肝癌细胞株中进行病毒增殖实验, 结果显示, CNHK500-hTRAIL与wtAd5的增殖能力相近, 48-96 h达到较高水平, 48 h时CNHK500-hTRAIL在HepG2、Hep3B细胞中病毒滴度比0 h时高16 120及251 156.5倍, 在正常细胞株WRL-68中, CNHK500-hTRAIL病毒48 h增殖倍数仅为831.64倍, 而野生型腺病毒增殖可达5063.29倍(图2). 说明CNHK500-hTRAIL可以选择性地在肿瘤细胞内增殖, 而在正常细胞WRL-68中增殖能力较野生型腺病毒明显降低, 仅为前者的10%左右. CNHK500-hTRAIL在HepG2、Hep3B中比在WRL-68中的增殖能力高出300倍之多.
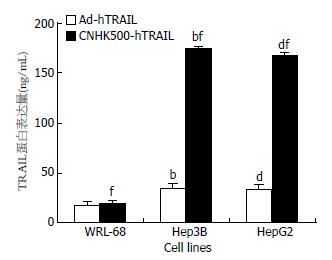
CNHK500-hTRAIL感染HepG2、Hep3B、WRL-68细胞, 72 h后收集细胞培养液上清, 间接法酶联免疫吸附试验(ELISA)检测, CNHK500-hTRAIL感染HepG2、Hep3B细胞培养液上清TRAIL的表达量分别为167.4±2.13、173.22±3.26 ng/L, 感染Ad-hTRAIL病毒HepG2、Hep3B细胞上清中TRAIL蛋白的表达量仅为32.89±2.73、34.02±2.42 ng/L; 而的CNHK500-hTRAIL及Ad-hTRAIL感染WRL-68细胞后TRAIL的表达量分别为18.43±3.24、17.08±4.41 ng/L(图3).
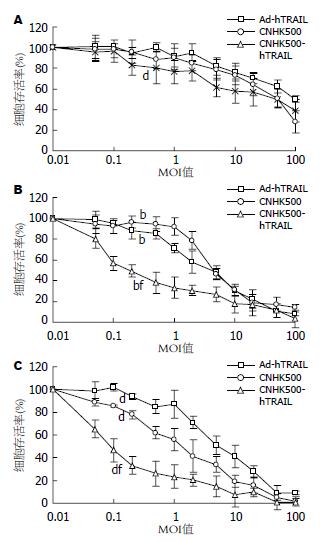
四甲基偶氮唑蓝比色实验(MTT)发现, 腺病毒CNHK500-hTRAIL可以在较低MOI值时杀伤HepG2、Hep3B细胞, 达到半数杀伤时约为MOI = 0.1, 对正常细胞WRL-68, 当MOI = 50时, 细胞仍有约50%存活, 说明CNHK500-hTRAIL对HepG2、Hep3B细胞的杀伤效应明显高于对正常细胞的杀伤效应(P<0.01), 而且对Hep3B相对更加敏感; 而在MOI = 5时, 感染CNHK500、Ad-hTRAIL的各细胞也都有50%存活, 说明CNHK500-hTRAIL对HepG2、Hep3B细胞的杀伤效应明显高于CNHK500、Ad-hTRAIL(P<0.01, 图4).
Annexin V-FITC法检测细胞的早期凋亡非常敏感, 在流式细胞散点图上凋亡细胞聚集在B4区. B4区细胞占总细胞的比例即是细胞发生凋亡的比例. CNHK500-hTRAIL感染各细胞后, 其表达的TRAIL蛋白均可诱导细胞凋亡, CNHK500-hTRAIL诱导HepG2、Hep3B细胞凋亡的细胞数百分比分别为23.43%±2.43%、32.53%±2.32%, 明显高于对照病毒Ad-hTRAIL(11.87%±2.51%、9.77%±2.61%)及对照细胞WRL-68(7.31%±1.17%)(图5).
肝细胞肝癌(hepatocelluar carcinoma, HCC)是我国常见的一种恶性肿瘤. 由于肝癌术后易复发、转移率高等特点, 导致手术疗效难以令人满意[3], 而现有的非手术治疗措施疗效也不确切, 因而寻求新的肝癌有效辅助治疗手段十分必要. 随着现代分子生物学的深入发展, 肿瘤的基因治疗成为极有发展前景的方法, 近年来受到了越来越多的关注[4].
TRAIL为一种Ⅱ型跨膜蛋白, 是TNF超家族的第10个成员, 可通过特异性结合死亡结构域激发和传导凋亡信号, 激活Caspase蛋白酶解级联反应, 诱导细胞凋亡[5]. TRAIL诱导细胞凋亡具有肿瘤或转化细胞特异性, 而且不依赖功能性P53的存在, 并能够通过旁观者效应杀伤肿瘤细胞, 在肿瘤的免疫监督和抑制转移中也起着重要作用[6], 肝、肺等多种肿瘤细胞株75%以上都对TRAIL敏感. TRAIL在肿瘤基因治疗领域受到了越来越多的重视[7-8].
传统肿瘤基因治疗面临的主要问题是缺乏肿瘤靶向性以及目的基因表达量低[9]. 而肿瘤特异性增殖病毒能选择性地只在肿瘤细胞内复制、增殖, 特异性地杀伤肿瘤细胞; 携带的抗肿瘤基因通过病毒特异性的增殖、复制, 从而在肿瘤细胞内高效表达, 通过两者协同作用, 双重杀伤肿瘤细胞, 进一步提高抗肿瘤疗效、降低潜在的对正常细胞的毒性[10].
肿瘤特异性增殖型腺病毒CNHK500-hTRAIL, 其E1A、E1B基因分别由端粒酶逆转录酶(telomerase reverse transcriptase, TERT)和缺氧反应元件(hypoxia response element, HRE)双重调控. 理论上其只能在端粒酶阳性的实体瘤的微缺氧环境下增殖[11]. 研究发现, CNHK500-hTRAIL选择性地在端粒酶阳性的肝癌细胞株HepG2、Hep3B中的增殖能力显著, 比在正常肝细胞WRL-68中的增殖能力高出300倍之多; 感染效率以及介导目的基因TRAIL表达的效率均十分理想, 在感染后72 h的HepG2、Hep3B培养上清中, 用ELISA法可以检测到TRAIL蛋白的表达量分别为167.4、173.22 ng/L, 明显高于对照组Ad-hTRAIL. MTT检测发现, CNHK500-hTRAIL在极低MOI值时即可造成对HepG2、Hep3B细胞株的大量杀伤, 明显强于CNHK500和Ad-hTRAIL, 而对人正常肝细胞WRL-68却无明显的杀伤作用. 其主要原因在于CNHK500造成的杀伤仅为单纯病毒溶瘤, 非增殖型腺病毒Ad-hTRAIL的TRAIL表达量相对较低, 而CNHK500-hTRAIL能且仅能在肿瘤细胞HepG2、Hep3B中大量增殖复制并介导跨膜蛋白TRAIL的高效表达, 通过病毒与TRAIL协同作用, 达到双重杀伤. 流式细胞术检测也发现, CNHK500-hTRAIL感染各细胞后, 其表达的TRAIL蛋白可显著诱导肝癌细胞凋亡, 但对正常细胞的凋亡诱导作用非常弱, 这也进一步提示了CNHK500-hTRAIL基因治疗更好的疗效及安全性.
总之, 携带TRAIL基因的肿瘤特异性增殖型腺病毒载体对肿瘤细胞的杀伤能力和目的基因的表达, 明显优于单纯的病毒载体及传统的非增殖型腺病毒载体, 却对正常细胞无明显毒性, 在肝细胞癌的治疗方面有着广阔的前景. 当然, 其在体内的效果还有待于动物实验进一步验证.
原发性肝癌已成为我国恶性肿瘤死亡率的第2位. 虽然在不断发展的综合治疗模式下诊治水平取得了很大进步, 但居高不下的发病率、复发率和死亡率仍然非常棘手. 因而寻求新的肝癌有效辅助治疗手段十分必要.
禄韶英, 副主任医师, 西安交通大学医学院第一附属医院普外科; 杨林, 副研究员, 中山大学附属第三医院感染病科.
肿瘤的基因治疗是近年来的研究热点之一. 这种新的生物治疗方法具有完全不同的作用机制, 与现有的肿瘤治疗方法无交叉耐受且有协同作用, 因而受到了越来越多的关注.
缺乏肿瘤特异性是肿瘤基因治疗面临的一个主要问题. 近年来的研究重点也在于寻求提高靶向性, 但将病毒与治疗基因二者联合的"病毒-基因治疗"鲜见报道.
本研究是建立在肿瘤特异增殖病毒及肿瘤基因治疗基础上的新方案. 该病毒能选择性地在肿瘤细胞内复制增殖, 特异地杀伤肿瘤细胞; 携带的TRAIL基因通过病毒的增殖复制, 在肿瘤细胞内特异且高效表达, 二者协同作用, 提高抗肿瘤疗效、降低潜在的毒性.
CCP的研究已经得到国家科技部"863"创新药物重大专项资助. 本文是有关药效学研究的部分内容. 经研究已明确, CCP在动物体外和体内均有杀伤肿瘤细胞的作用, 疗效高于卡铂, 副作用小, 有望进入正式的临床实验.
肿瘤特异性增殖型病毒: 又称溶瘤病毒, 是通过对病毒的基因进行有效修饰从而使病毒特异性地只在肿瘤细胞内选择性地复制增殖, 最终达到杀伤肿瘤细胞的目的, 为肿瘤的治疗提供了一条新的途径.
本文研究病毒载体介导转移TRAIL基因的表达及对肝癌细胞的凋亡的诱导作用, 有一定学术价值及潜在应用价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Kruyt FA. TRAIL and cancer therapy. Cancer Lett. 2008;263:14-25. [PubMed] [DOI] |
| 2. | Qian QJ, Zhang Q, Wu MC, Peng LH, LI YM. A novel replication-competent adenovirus CNHK500 in the treatment of heptocellular carcinoma in vitro. Chin Ger J Clin Oncol. 2004;4:70-73. |
| 3. | El-Serag HB, Marrero JA, Rudolph L, Reddy KR. Diagnosis and treatment of hepatocellular carcinoma. Gastroenterology. 2008;134:1752-1763. [PubMed] [DOI] |
| 4. | Avila MA, Berasain C, Sangro B, Prieto J. New therapies for hepatocellular carcinoma. Oncogene. 2006;25:3866-3884. [PubMed] [DOI] |
| 5. | Finnberg N, El-Deiry WS. TRAIL death receptors as tumor suppressors and drug targets. Cell Cycle. 2008;7:1525-1528. [PubMed] |
| 6. | Sedger LM, Glaccum MB, Schuh JC, Kanaly ST, Williamson E, Kayagaki N, Yun T, Smolak P, Le T, Goodwin R. Characterization of the in vivo function of TNF-alpha-related apoptosis-inducing ligand, TRAIL/Apo2L, using TRAIL/Apo2L gene-deficient mice. Eur J Immunol. 2002;32:2246-2254. [PubMed] [DOI] |
| 7. | Jacob D, Schumacher G, Bahra M, Davis J, Zhu HB, Zhang LD, Teraishi F, Neuhaus P, Fang BL. Fiber-modified adenoviral vector expressing the tumor necrosis factor-related apoptosis-inducing ligand gene from the human telomerase reverse transcriptase promoter induces apoptosis in human hepatocellular carcinoma cells. World J Gastroenterol. 2005;11:2552-2556. [PubMed] |
| 8. | Dong F, Wang L, Davis JJ, Hu W, Zhang L, Guo W, Teraishi F, Ji L, Fang B. Eliminating established tumor in nu/nu nude mice by a tumor necrosis factor-alpha-related apoptosis-inducing ligand-armed oncolytic adenovirus. Clin Cancer Res. 2006;12:5224-5230. [PubMed] [DOI] |
| 9. | Liu TC, Kirn D. Gene therapy progress and prospects cancer: oncolytic viruses. Gene Ther. 2008;15:877-884. [PubMed] [DOI] |
| 11. | Zhang Q, Chen G, Peng L, Wang X, Yang Y, Liu C, Shi W, Su C, Wu H, Liu X. Increased safety with preserved antitumoral efficacy on hepatocellular carcinoma with dual-regulated oncolytic adenovirus. Clin Cancer Res. 2006;12:6523-6531. [PubMed] [DOI] |