修回日期: 2009-08-10
接受日期: 2009-08-17
在线出版日期: 2009-09-28
目的: 探讨芦荟大黄素和吡喹酮的联合治疗对血吸虫肝纤维化小鼠TGF-β/Smad通路的影响.
方法: 80只小鼠随机分为4组. 前3组每只小鼠感染日本血吸虫尾蚴25条. 感染8 wk后, 第一组小鼠以吡喹酮500 mg/(kg·d)治疗2 d(吡喹酮组), 第2组小鼠以吡喹酮500 mg/(kg·d)治疗2 d后用芦荟大黄素0.3 mg/(kg·d)治疗8 wk(吡喹酮+芦荟大黄素组), 第3组不作任何治疗(实验对照组), 第4组小鼠作为正常对照. 第16周末处死小鼠留取肝脏组织, 应用HE染色法、RT-PCR法和免疫组织化学染色法观察、分析各组小鼠肝脏病理改变与Smad2 mRNA、Smad7 mRNA、TGF-β1、TIMP-1、Ⅰ型胶原及Ⅲ型胶原的表达变化.
结果: 芦荟大黄素治疗后血吸虫肝纤维化程度减轻, 肝组织中Smad2 mRNA、TGF-β1、TIMP-1、Ⅰ型胶原、Ⅲ型胶原的表达明显低于实验对照组和吡喹酮组(q = 6.20, 4.38; q = 6.22, 4.41; q = 6.30, 4.52; q = 6.25, 4.44; q = 6.29, 4.48, P<0.01或0.05); 肝组织中Smad7 mRNA的表达, 明显高于实验对照组和吡喹酮组(q = 6.32, 4.62, P<0.01或0.05).
结论: 芦荟大黄素可通过降低肝组织中TGF-β1、TIMP-1、Ⅰ型胶原、Ⅲ型胶原的表达, 抑制Smad2基因的表达, 促进Smad7的表达发挥抗肝纤维化作用.
引文著录: 吴艳艳, 何生松, 邓敏. 芦荟大黄素和吡喹酮联合治疗对血吸虫肝纤维化小鼠TGF-β/Smad通路的影响. 世界华人消化杂志 2009; 17(27): 2778-2783
Revised: August 10, 2009
Accepted: August 17, 2009
Published online: September 28, 2009
AIM: To investigate the effects of combined use of aloeemodin and praziquantel on the transforming growth factor-β (TGF-β)/Smad pathway in mice with schistosomiasis-induced liver fibrosis.
METHODS: Eighty mice were randomly divided into four groups: normal control group, infection group, praziquantel treatment group, and praziquantel and aloeemodin treatment group. Mice in the infection group and the two treatment groups were infected with 25 Schistosoma japonicum cercariae. Eight weeks after infection, mice in the praziquantel treatment group were treated with praziquantel at a dose of 500 mg/(kg•d) for two days, while those in the praziquantel and aloeemodin treatment group were treated with praziquantel at the same dose for the same duration followed by treatment with aloeemodin at a dose of 0.3 mg/(kg•d) for 8 weeks. At week 16, all mice were sacrificed to take liver tissue samples. Hematoxylin and eosin staining was performed to observe changes in hepatic histopathology. Reverse transcription-polymerase chain reaction (RT-PCR) was used to detect the expression of Smad2 and Smad7 mRNAs in the liver. Immunohistochemical staining was performed to detect the expression of TGF-β1, TIMP-1, and type I and III collagen in liver tissue.
RESULTS: Aloeemodin treatment relieved the degree of hepatic fibrosis. The expression levels of Smad2 mRNA and TGF-β1, tissue inhibitor of metalloproteinases-1 (TIMP1), and type I and III collagen proteins in liver tissue were significantly lower in the praziquantel and aloeemodin treatment group than in the infection group and the praziquantel treatment group (q = 6.20 and 4.38, 6.22 and 4.41, 6.30 and 4.52, 6.25 and 4.44. and 6.29 and 4.48, respectively; all P < 0.01 or 0.05). In contrast, the expression level of Smad7 mRNA was significantly higher in the praziquantel and aloeemodin treatment group than in the infection group and the praziquantel treatment group (q = 6.32 and 4.62, respectively; P < 0.01 and 0.05, respectively).
CONCLUSION: Aloeemodin exerts anti-fibrotic effects perhaps through downregulation of the expression of Smad2 mRNA and TGF-β1, TIMP1, and type I and III collagen proteins, and upregulation of the expression of Smad7 mRNA.
- Citation: Wu YY, He SS, Deng M. Effects of combined use of aloeemodin and praziquantel on the transforming growth factor-β/Smad pathway in mice with schistosomiasis-induced liver fibrosis. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2778-2783
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2778.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2778
芦荟作为传统的中药, 具有良好的抗菌、消炎、抗肿瘤、抗辐射损伤、降压降糖、抗衰老及预防艾滋病等药理作用. 而芦荟大黄素和芦荟素是芦荟主要药用成分, 临床研究表明其具有抗菌、消炎、杀虫、抗癌、泻下、抗衰老等功效. Arosio et al[1]发现, 芦荟大黄素对CCl4所致的小鼠急性肝损害有保护作用, 不仅能阻止肝细胞的死亡, 而且对脂质过氧化引起的炎症反应有保护作用. 罗霄山[2]发现芦荟大黄素能显著抑制CCl4造成的肝细胞及细胞膜脂质过氧化产物丙二醛(MDA)水平的升高. 但目前尚无芦荟大黄素对血吸虫肝纤维化治疗作用及机制的研究. 本实验以日本血吸虫尾蚴感染小鼠建立早期血吸虫肝纤维化模型, 经吡喹酮杀虫后再予芦荟大黄素治疗, 观察吡喹酮、芦荟大黄素干预前后肝组织病理改变及Smad2 mRNA、Smad7 mRNA、TGF-β1、TIMP1、Ⅰ、Ⅲ型胶原的表达变化, 以评估和探讨芦荟大黄素对杀虫治疗后肝纤维化进展的抑制作用及其机制.
芦荟大黄素(质量分数98%, 批号041006)购自南京替斯艾么中药研究所. TGF-β1、TIMP-1、Ⅰ型胶原和Ⅲ型胶原抗体均购自武汉博士德生物工程有限公司, 均为多克隆抗体. 乙醇、异丙醇、氯仿、溴乙锭(EB)均为分析纯. TRIzol试剂购于美国Gibco BRL公司. 一步法逆转录聚合酶链反应试剂盒购自大连TaKaRa公司. DEPC水购于晶美生物工程公司. DNA酶购自美国Promega公司. Smad2引物(购于大连TaKaRa公司, 产物194 bp): 上游: 5'-ATAGTGCAATCTTTGTGCAG-3'; 下游: 5'-CATTCTTATGGTGCACATTC-3'. Smad7引物(购于大连TaKaRa公司, 产物228 bp): 上游: 5'-GTGTTGCTGTGAATCTTACG-3'; 下游: 5'-AGAAGAAGTTGGGAATCTGA-3'. GAPDH引物(购于大连TaKaRa公司, 产物233 bp): 上游: 5'-GGTGAAGGTCGGTGTGAACG -3'; 下游: 5'-CTCGCTCCTGGAAGATGGTG-3'.
1.2.1 分组及处理: 清洁级昆明小鼠80只, 雌雄各半, 体质量20-25 g, 4-6周龄(购自同济医学院动物实验中心). 随机均分为4组, 每组20只. 吡喹酮组: 每只小鼠感染日本血吸虫尾蚴25条(下同), 感染尾蚴8 wk后用吡喹酮(由华中科技大学同济医学院寄生虫教研室提供)灌胃治疗2 d, 剂量为500 mg/(kg·d), 溶于生理盐水, 每只1 mL/d; 吡喹酮+芦荟大黄素组: 感染尾蚴8 wk后用吡喹酮灌胃治疗2 d后, 继以芦荟大黄素灌胃治疗8 wk, 剂量为0.3 mg/(kg·d), 溶于生理盐水, 每只1 mL/d; 实验对照组: 感染尾蚴8 wk后以生理盐水灌胃8 wk, 每只1 mL/d; 正常对照组: 未感染血吸虫尾蚴, 正常方法饲养16 wk. 第16周末以2%戊巴比妥钠40 mg/kg腹腔注射麻醉小鼠, 分别取各组小鼠肝组织.
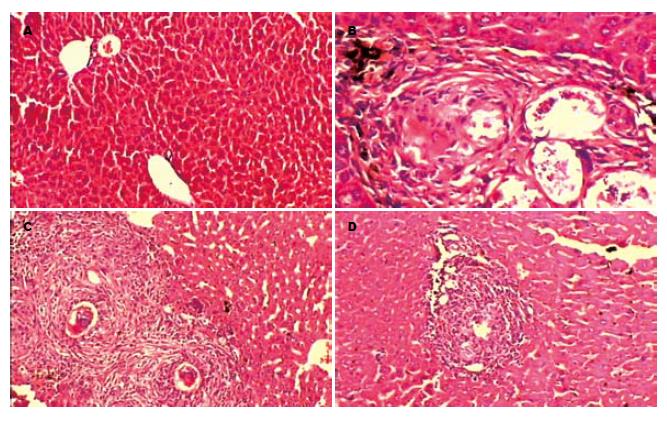
1.2.2 肝组织切片: HE染色检测取肝左叶组织, 用甲醛固定, 石蜡包埋, 切片, HE染色, 观察肝组织的病理学变化. 肝纤维化程度依病情轻重分4级[3]: 0级: 正常; Ⅰ级: 胶原纤维包绕肉芽肿周围并插入其中; Ⅱ级: 汇管区有大量纤维化, 小叶间仅有少量纤维; Ⅲ级: 纤维组织大量延伸至小叶间.
1.2.3 肝组织TGF-β1、TIMP-1、Ⅰ型胶原和Ⅲ型胶原的检测: 采用免疫组织化学法[链酶亲和素-生物素-过氧化物酶复合物法(SABC法)]检测. 肝组织切片3 μm, 脱蜡至水, 用PBS水化10 min. 用含5 mL/L H2O2的甲醇溶液室温孵育30 min后, PBS洗3次, 每次5 min. 滴加正常血清封闭液, 室温孵育30 min后, 甩去多余液体, 不洗. 分别滴加兔抗小鼠TGF-β1、TIMP-1、Ⅰ型胶原和Ⅲ型胶原抗体(均为1:50), 4℃孵育过夜. PBS洗3次, 每次5 min. 滴加生物素标记的羊抗兔IgG, 于37℃孵育30 min后, PBS洗3次, 每次5 min. 滴加链霉亲和素-生物素-辣根过氧化物酶(S-A/HRP)工作液, 于37℃孵育30 min后, PBS洗3次, 每次5 min. 在0.05% DAB溶液中加入H2O2至终浓度为0.03%, 以此作为显色液, 镜下控制显色. 显色满意后, 用梯度乙醇脱水, 二甲苯透明, 中性树胶封片. 同时设有阳性对照和阴性对照. TGF-β1、TIMP-1、Ⅰ型胶原和Ⅲ型胶原免疫组化染色切片于物镜20倍视野下, 每组随机选取20个视野, 用HMIAS-2000型全自动医学彩色图像分析系统(武汉千屏医学影像技术有限责任公司)测定细胞内棕黄色颗粒的平均吸光度(A)值.
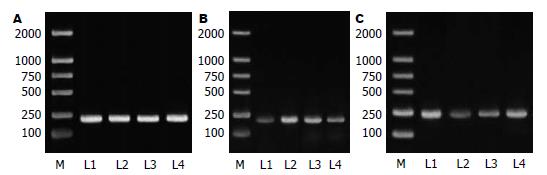
1.2.4 RT-PCR检测肝组织Smad2 mRNA和Smad7 mRNA表达: 使用TRIzol试剂提取RNA, 经反转录和PCR扩增程序得扩增产物. 扩增产物用15 g/L琼脂糖凝胶电泳, 加样量为10 μL, 电压120 V, 电泳完毕后在EB中染色, 在紫外灯下观察结果并照相. 用Multi-Analyst软件包进行半定量分析. 单位肝组织Smad2 mRNA和Smad7 mRNA的相对含量用Smad2和Smad7条带平均积分与GAPDH条带平均积分(A)值表示.
统计学处理 RT-PCR与免疫组织化学结果均以mean±SD表示. 使用SPSS12.0软件行方差分析, 两两比较采用SNK-q检验. 肝脏纤维化程度为等级资料, 用Ridit分析, P<0.05表示差异显著, 有统计学意义.
光镜下, 正常对照组小鼠肝组织未见任何病变. 实验对照组、吡喹酮组以及吡喹酮+芦荟大黄素联合治疗组与正常组相比, 发现众多慢性虫卵肉芽肿, 其虫卵周围包绕梭形细胞和胶原纤维, 亦可见少部分急性虫卵肉芽肿, 汇管区有大量炎性细胞浸润; 肉芽肿和小静脉周围的胶原纤维束向肝小叶周围延伸. 在病变程度和病变范围上, 吡喹酮组比实验对照组明显减轻(P<0.01); 吡喹酮+芦荟大黄素联合治疗组比吡喹酮组明显减轻(P<0.05, 图1). 根据肝纤维化程度级别标准, 统计每组小鼠各级别的鼠数(表1).
| 分组 | 0 | Ⅰ | Ⅱ | Ⅲ | 合计 |
| 正常对照组 | 20 | 0 | 0 | 0 | 20 |
| 实验对照组 | 0 | 0 | 4 | 7 | 11 |
| 吡喹酮组 | 0 | 4 | 4 | 5 | 13 |
| 吡喹酮+芦荟大黄素组 | 0 | 11 | 2 | 2 | 15 |
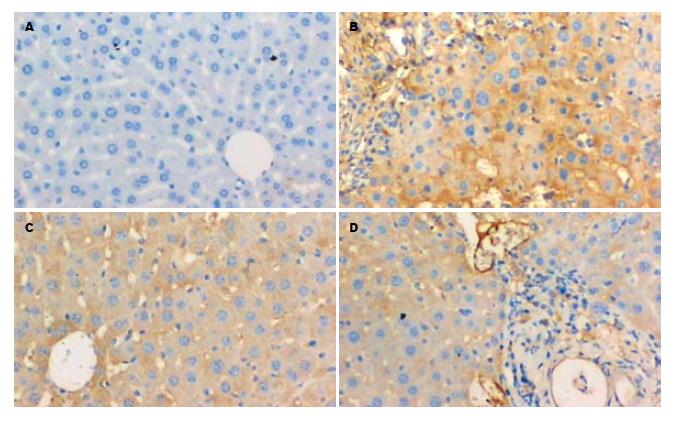
正常对照组肝内未见明显TGF-β1和TIMP-1阳性着色. 吡喹酮组、实验对照组肝内 TGF-β1和TIMP-1呈棕黄色, 呈片状分布于虫卵肉芽肿内及其周围汇管区、肝血窦. 吡喹酮+芦荟大黄素联合治疗组肝内TGF-β1和TIMP-1分布区域同上, 但着色少而浅. 吡喹酮+芦荟大黄素联合治疗组小鼠与实验对照组相比, TGF-β1和TIMP-1含量下降非常显著(P<0.01); 与吡喹酮组相比, TGF-β1和TIMP-1含量明显下降(P<0.05), 但其含量仍比正常组高(P<0.01). 吡喹酮组肝组织中TGFβ-1和TIMP-1含量比实验对照组有显著下降(P<0.01), 但其含量仍比正常组高(P<0.01, 表2, 图2-3).
各组小鼠RT-PCR光带吸光度强弱呈梯度变化(图4). 芦荟大黄素、吡喹酮联合治疗组与实验对照组相比, Smad2 mRNA表达下降非常显著(P<0.01), Smad7 mRNA表达上升非常显著(P<0.01); 与吡喹酮组相比, Smad2 mRNA 表达显著下降(P<0.05), Smad7 mRNA表达显著上升; 但Smad2 mRNA表达仍比正常组高(P<0.01), Smad7 mRNA表达仍比正常组低(P<0.01). 吡喹酮组肝组织中Smad2 mRNA表达比实验对照组显著下降(P<0.05), 但其含量仍比正常组高(P<0.01); 吡喹酮组肝组织中Smad7 mRNA表达比实验对照组显著升高(P<0.01), 但其含量仍比正常组低(P<0.01, 表3).
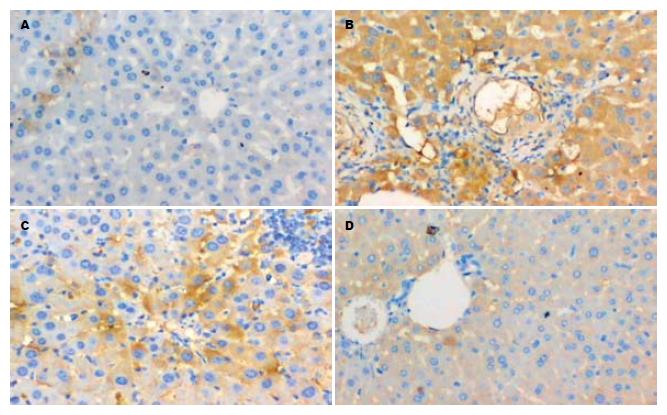
正常对照组肝内无明显胶原着色. 吡喹酮组、实验对照组肝内Ⅰ和Ⅲ型胶原呈棕黄色, 密集片状, 主要分布在虫卵肉芽肿内及汇管区. 吡喹酮、芦荟大黄素联合治疗组肝内虫卵肉芽肿普遍较小, 胶原分布较少, 与实验对照组相比, Ⅰ和Ⅲ型胶原含量下降非常显著(P<0.01); 与吡喹酮组相比, 其含量显著下降(P<0.05); 但其含量仍比正常组高(P<0.01). 吡喹酮组肝组织中Ⅰ和Ⅲ型胶原含量比实验对照组显著下降(P<0.01), 但其含量仍比正常组高(P<0.01, 表4).
目前认为, 在各种损伤性因素的始动作用下, 肝星状细胞(hepatic stellate cell, HSC)的激活是肝纤维化发生发展的中心环节, 激活的"持久化"是HSC激活状态的维持及产生纤维化的过程. HSC就是在各细胞因子, 如: TGF-β1、血小板衍生的生长因子(platelet derived growth factor, PDGF)、肝细胞生长因子(hepatocyte growth factor, HGF)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)等作用下被激活而发生细胞增殖, 其表面分子及膜受体表达发生改变, 最终转化为肌成纤维细胞, 其中TGF-β1是最关键的致纤维化因子, 他是通过对HSC、肝实质细胞、肝窦内皮细胞等细胞, 以及对与纤维化有关的其他生长因子和调节基质代谢的各种酶类施加广泛影响, 从而起到致纤维化的作用, 他在肝纤维化的启动、发展乃至肝硬化的形成中发挥了核心作用. TGF-β必须与靶细胞表面高亲和力的TGF-β受体(TβR)结合才能发挥生物学效应. TGF-β1与Ⅱ型TβR亲和力最高. TGF-β1二聚体与Ⅱ型TβR细胞外段结合后, Ⅱ型TβR胞内段丝氨酸自身磷酸化, 自身激活, 进而与Ⅰ型TβR结合形成异源四聚体, 磷酸化Ⅰ型TβR胞内近膜区的GS域的丝氨酸, 使其活化. 活化的Ⅰ型TβR作用于胞质Smad蛋白, 使Smad发生丝氨酸磷酸化, Smad形成同源或异源寡聚体后进入细胞核, 调节相应基因的转录[4]. 目前许多研究表明, 干扰TGF-β信号途径是治肝纤维化的有效方法[5]. 曾军 et al[6]研究显示, 动物血吸虫肝纤维化往往伴随肝脏组织TGF-β增加, HSC数量进行性增多, Smad3 mRNA表达显著增高, Smad7则初期升高、中晚期进行性下降, 提示肝纤维化发生发展与TGF-β/Smad信号通路密切相关. Dooley et al[7]研究显示体内基因转移Smad7可以抑制实验性肝纤维化的发生, 对体外培养HSC的研究发现, 其机制可能是抑制TGF-β信号转导通路和HSC的分化转移. Zhang et al[8]研究显示, 血吸虫肝纤维化时, 肝脏组织Smad2 mRNA水平在血吸虫尾蚴感染小鼠的第12周和第24周均降低. Uemura et al[9]研究显示, Smad3增加HSC纤维蛋白和Ⅰ型胶原的沉积, Smad2增加HSC的增生. 本实验发现, 血吸虫肝纤维化时, 小鼠肝脏TGF-β1含量增加, Smad2 mRNA表达增加, 这与Zhang et al的研究结果不符, 可能是实验所用的小鼠种系不同. 我们的研究显示, 血吸虫肝纤维化时, Smad7 mRNA表达降低, 这与曾军 et al研究结果一致. 吡喹酮和芦荟大黄素的联合治疗可降低小鼠肝脏TGF-β1含量, 使小鼠肝脏Smad2 mRNA表达降低, 并且增高小鼠肝脏Smad7 mRNA的表达. 在肝脏损害中, Smad7对TGF-β信号通路的负反馈调节对肝细胞起到保护作用[10]. 以上这些提示: 吡喹酮和芦荟大黄素的联合治疗可能通过影响TGF-β/Smad信号通路发挥抗肝纤维化作用.
芦荟大黄素和芦荟素是芦荟主要药用成分, 临床研究表明其具有抗菌、消炎、杀虫、抗癌、泻下、抗衰老等功效. 芦荟大黄素作为一种新的可能的药物, 其功效被广泛研究.
范建高, 教授, 上海交通大学医学院附属新华医院消化内科.
多年来, 国内外学者在血吸虫肝纤维化的发生机制、调节因素、诊断及治疗方面进行了大量卓有成效的研究, 尽管实验药物很多, 但仍缺乏能应用于临床的、高效、无明显不良反应的西药. 中医药治疗血吸虫肝纤维化在改善临床症状等方面体现了很大的潜力.
Arosio et al发现, 芦荟大黄素对CCl4所致的小鼠急性肝损害有保护作用, 不仅能阻止肝细胞的死亡, 而且对脂质过氧化引起的炎症反应有保护作用. 罗霄山发现芦荟大黄素能显著抑制CCl4造成的肝细胞及细胞膜脂质过氧化产物丙二醛(MDA)水平的升高.
本实验以日本血吸虫尾蚴感染小鼠建立早期血吸虫肝纤维化模型, 经吡喹酮杀虫后再予芦荟大黄素治疗, 观察吡喹酮、芦荟大黄素干预前后肝组织病理改变及Smad2 mRNA、Smad7 mRNA、TGF-β1、TIMP1、Ⅰ、Ⅲ型胶原的表达变化.
芦荟大黄素可通过降低肝组织中TGF-β1、TIMP-1、Ⅰ型胶原、Ⅲ型胶原的表达, 抑制Smad2基因的表达, 促进Smad7的表达发挥抗肝纤维化作用.
本文设计合理, 统计学方法应用恰当, 结论有价值, 对临床治疗会有一定的指导价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Arosio B, Gagliano N, Fusaro LM, Parmeggiani L, Tagliabue J, Galetti P, De Castri D, Moscheni C, Annoni G. Aloe-Emodin quinone pretreatment reduces acute liver injury induced by carbon tetrachloride. Pharmacol Toxicol. 2000;87:229-233. [PubMed] [DOI] |
| 3. | Nieto N, Friedman SL, Cederbaum AI. Stimulation and proliferation of primary rat hepatic stellate cells by cytochrome P450 2E1-derived reactive oxygen species. Hepatology. 2002;35:62-73. [PubMed] [DOI] |
| 4. | Kitamura Y, Ninomiya H. Smad expression of hepatic stellate cells in liver cirrhosis in vivo and hepatic stellate cell line in vitro. Pathol Int. 2003;53:18-26. [PubMed] [DOI] |
| 5. | García BL, Gálvez GJ, Armendáriz BJ. [Therapeutical targets for revert liver fibrosis]. Rev Med Chil. 2007;135:783-791. [PubMed] [DOI] |
| 6. | 曾 军, 杨 镇, 李 岽健, 邹 卫龙, 高 志强, 李 涛. 实验性血吸虫病肝纤维化中TGF-β1 Smad3 Smad7的表达变化及意义. 中国血吸虫病防治杂志. 2004;16:269-273. |
| 7. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] [DOI] |
| 8. | Zhang BB, Jiao YW, Cai WM, Tao J, Zheng M, Dong FQ, Liu RH. [Studies on Smads at transcription level in liver fibrosis of mice with Schistosomiasis japonica]. Zhongguo Jishengchongxue Yu Jishengchongbing Zazhi. 2004;22:154-156. [PubMed] [DOI] |
| 9. | Uemura M, Swenson ES, Gaça MD, Giordano FJ, Reiss M, Wells RG. Smad2 and Smad3 play different roles in rat hepatic stellate cell function and alpha-smooth muscle actin organization. Mol Biol Cell. 2005;16:4214-4224. [PubMed] [DOI] |
| 10. | Hamzavi J, Ehnert S, Godoy P, Ciuclan L, Weng H, Mertens PR, Heuchel R, Dooley S. Disruption of the Smad7 gene enhances CCI4-dependent liver damage and fibrogenesis in mice. J Cell Mol Med. 2008;12:2130-2144. [PubMed] |