修回日期: 2009-07-14
接受日期: 2009-07-20
在线出版日期: 2009-08-08
目的: 探讨CCR5Δ32等位基因在贵州世居少数民族(彝、瑶)与汉族人群的分布, 并分析CCR5位点突变与HBV的关系.
方法: 采用PCR技术分别扩增贵州92份黔西彝族、101份威宁彝族、138份荔波瑶族以及165份毕节汉族CCR5编码区片段, 通过琼脂糖凝胶电泳对CCR5Δ32多态性进行分析, 最后抽取样本并进行DNA测序验证.
结果: 经过PCR特异性扩增, 琼脂糖凝胶电泳后, 496份样本均未发现CCR5Δ32突变型和杂合子. DNA测序验证所有样本CCR5基因未发生32碱基缺失的突变.
结论: CCR5Δ32的分布有较明显的地域和种族差异, 该位点与HBV感染的相关性有待于进一步深入研究.
引文著录: 谭奎, 单可人, 何燕, 张婷, 李毅, 王婵娟, 齐晓岚, 赵艳, 肖雁, 谢渊, 吴昌学, 官志忠, 任锡麟. CCR5Δ32等位基因多态性与贵州特殊人群HBV感染的相关性. 世界华人消化杂志 2009; 17(22): 2317-2319
Revised: July 14, 2009
Accepted: July 20, 2009
Published online: August 8, 2009
AIM: To investigate the distribution of CCR5-Δ32 polymorphism in Han nationality, Yi and Yao minorities of Guizhou and analyze the association between CCR5-Δ32 polymorphism and HBV infection.
METHODS: Blood samples were taken from 92 Chinese Yi ethic individuals in Qianxi, 101 Chinese Yi ethic individuals in Weining, 138 Chinese Yao ethic individuals in Libo and 165 Chinese Han ethic individuals in Bijie. The coding region of the CCR5 gene was amplified by PCR and resolved by agarose gel electrophoresis to analyze the polymorphism of CCR5-Δ32. DNA sequencing was performed to verify the above results.
RESULTS: The 32-base pair deletion allele in the CCR5 gene was not found in all 496 samples. DNA sequencing verified that no CCR5-Δ32 allele was detected in all samples.
CONCLUSION: No CCR5-Δ32 allele is detected in this study in special population of Guizhou Province though the distribution of CCR5-Δ32 allele has geographical and ethnic differences.
- Citation: Tan K, Shan KR, He Y, Zhang T, Li Y, Wang CJ, Qi XL, Zhao Y, Xiao Y, Xie Y, Wu CX, Guan ZZ, Ren XL. Association of CCR5-Δ32 polymorphism with HBV infection in special population of Guizhou Province. Shijie Huaren Xiaohua Zazhi 2009; 17(22): 2317-2319
- URL: https://www.wjgnet.com/1009-3079/full/v17/i22/2317.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i22.2317
乙型肝炎病毒(hepatitis B virus, HBV)作为一种非侵袭性嗜肝病毒, 他并不直接损害肝脏, 而是由其表达的抗原系统及其抗体所介导的特异性免疫反应和非特异性的以细胞因子为主的炎症介质导致的肝细胞损伤[1]. 趋化因子是低相对分子质量的趋化性细胞因子, 他募集白细胞到炎症部位, 调节T细胞发育和细胞因子产生, 因此趋化因子在炎症和感染中起重要作用[2], 而这些生理功能通过与趋化因子受体结合产生跨膜信号而实现的. 趋化性细胞因子受体5(chemokine receptor, CCR5)就是趋化细胞因子受体的一种. 急性HBV感染的恢复需要强烈的T细胞反应, 近年来发现在HBV感染的老鼠模型体内发生CCR5的缺失, T细胞反应会加强, 而且也有研究发现CCR5Δ32等位基因多态性与HBV感染密切相关. 本研究对贵州彝族、瑶族以及汉族CCR5Δ32等位基因多态性的分布进行分析, 并对该人群该位点多态性与HBV的关联性进行初步探索.
选取贵州世居少数民族中较封闭的隔离自然人群-威宁彝族、黔西彝族、荔波瑶族和毕节汉族人群, 样本总量496份, 所选的研究对象3代无族外通婚, 彼此间无直接血缘关系, 年龄25-60岁, 并且由于当地偏远、医疗水平落后, 无乙型肝炎疫苗接种史. 根据知情同意原则, 采取受试对象静脉血, 离心, 采用ELISA检测乙型肝炎血清标志物, 即表面抗原(HBsAg)、表面抗体(抗-HBs)、e抗原(HBeAg)、e抗体(抗-HBe)以及核心抗体(抗-HBc). 试剂盒由上海实业科华生物技术有限公司生产, 按说明进行操作, 美国Bio-tecELX800酶标仪判断结果. 根据检测结果, 由于样本人群无乙肝疫苗接种史, 将HBsAg、抗-HBs以及抗-HBc中, 任一项阳性者判断为感染组, 否则视为非感染组. 具体如下: 黔西彝族92份, 其中感染组37份, 非感染组55份; 威宁彝族101份, 其中感染组53份, 非感染组48份; 荔波瑶族138份, 其中感染组80份, 非感染组58份; 毕节汉族165份, 其中感染组130份, 非感染组35份; 总共感染组300份, 非感染组196份.
1.2.1 DNA的制备: 每份样本各取静脉血200 μL, 用微量提取法提取DNA样本并储存于-80℃冰箱.
1.2.2 PCR引物的设计与合成: 根据GenBank报道的人类CCR5 DNA序列(NCBI序列号: U95626), 参照相关文献[3]选取扩增CCR5Δ32位点的引物序列, 引物由上海生工合成. PCR产物169 bp(野生型)和137 bp(突变型, CCR5Δ32)(表1).
| 引物序列 | 扩增产物长度(bp) | |
| CCR5Δ32 | 上游5'AGGTCTTCATTACACCTGCAGC3' | 169(野生型) |
| 下游5'CTTCTCATTTCGACACCGAAGC3' | 137(突变型) |
1.2.3 PCR反应体系: 反应体系含10×PCR Buffer 2.5 μL, 25 mmol/L MgCl2 2.0 μL, 2.5 mol/L dNTPs 2.0 μL, 10.0 μmol/L上游和下游引物各0.5 μL, Taq DNA聚合酶(天根)(5 U/μL)0.4 μL, 模板DNA(100 ng/μL)1 μL, 加水补足体积至25 μL. 混匀反应体系, 瞬时离心后上机, PCR循环条件如下: 预变性95℃ 5 min, 变性95℃ 30 s, 退火55.3℃ 30 s, 延伸72℃ 30 s, 循环30次, 终末延伸 72℃ 7 min, 置于4℃保存. PCR反应在美国ABI公司(原PE公司)9700型扩增仪上完成.
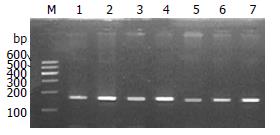
1.2.4 PCR扩增产物的分析: 经2.0%琼脂糖凝胶电泳, 在UVP凝胶成像仪上照相观察结果, 由于突变型比野生型少32 bp, 经PCR扩增后在2.0%的琼脂糖凝胶电泳上分辨出来, 野生型169 bp, 突变型137 bp.
经过PCR特异性扩增, 琼脂糖凝胶电泳后, 496份样本均未发现突变型和杂合子(图1).
随机选择样本测序, 验证样本基因型(每个基因型选取2-3个样本进行测序). 测序结果与rs333完全相同(图2).
蒲春文 et al[4]研究显示在慢性肝炎中肝内CCR5阳性细胞高度表达, 且其表达程度与炎症程度平行, 提示该受体在HBV的病理损伤进展过程中起重要作用. CCR5Δ32是指CCR5等位基因编码区第185位氨基酸密码子以后发生了32个碱基的缺失[5]. CCR5发生32碱基缺失产生无功能的CCR5. CCR5Δ32包括纯合子和杂合子2种, 纯合子是指构成CCR5的两条链均发生了32个碱基缺失; 杂合子则指其中一条链发生碱基缺失的现象[6]. CCR5Δ32在免疫系统疾病中是具有保护性的等位基因[7]. Thio et al[3]研究认为CCR5Δ32与HBV感染的康复有关, 他将发展成迁移性乙型肝炎的风险减低将近一半, 对HBV的持续性感染有强的抵抗作用, 而且两条链中至少有一条链发生CCR5Δ32缺失产生无功能的CCR5个体从乙肝中恢复的可能性比有功能的CCR5个体要大一些, 而且这种保护作用具有共显性. 在免疫反应中CCR5可能为T细胞的负调节蛋白, 即CCR5Δ32缺乏增强了T细胞免疫反应. Ajuebor et al[8]研究中发现CCR5缺失在伴刀豆凝集素α诱导的暴发性肝炎鼠类模型中阻止肝自然杀伤T细胞(natural killer T cell, NKT)的凋亡而且上调NKT细胞的功能, 有利于HBV感染的康复.
虽然有研究证明CCR5Δ32与HBV的感染恢复有关, 但在我们的研究中都没有发现CCR5发生32碱基缺失, 这与冯涛 et al[9]、洪卫国 et al[2]和徐维国 et al[10]的研究结果一致, 即我国CCR5Δ32等位基因突变率普遍很低. 与Ahn et al[11]的研究结果也一致. 尽管在我们的研究中未发现CCR5发生32碱基缺失, 并不代表他与HBV的感染无关, 我们样本量的局限性对其也可能有一定影响. CCR5Δ32的分布有较明显的地域和种族差异, 如以色列人群中的检出率为20.93%, 中东地区和印度次大陆为2%-5%[12], 在白种人群中检出率为10%-15%[13]. 我国是多民族国家, 各民族之间CCR5Δ32的检出率也有显著差异, 如汉族为0.12%且均为杂合子性突变, 维吾尔族则高达3.48%, 而仫佬族和壮族则为0%[14]. 在我国CCR5Δ32突变比较罕见, HBV流行却比较严重, 而在欧美白种人中CCR5Δ32频率高, HBV感染率低. 这就提示我们亚洲人和欧美人HBV易感性的差别是否与CCR5Δ32频率分布有关, 是一个值得深入探讨的问题.
乙型肝炎病毒感染是世界范围的严重公共卫生问题之一, 严重危害人类的健康和社会生产力. 宿主自身的遗传因素在HBV感染发病和疾病进展方面都发挥着重要作用.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
对CCR5多态性的研究最早是在HIV感染研究领域, 并取得一定成果. 其相关产品的研究已成为生物治疗的研究热点.
通过对CCR5基因多态性与HBV感染相关性的研究, 希望能够为HBV感染种族性差异和乙型肝炎的发病机制提供线索, 为乙型肝炎的治疗开辟新的基因治疗途径.
本研究选题尚可, 结果可信, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 3. | Thio CL, Astemborski J, Bashirova A, Mosbruger T, Greer S, Witt MD, Goedert JJ, Hilgartner M, Majeske A, O'Brien SJ. Genetic protection against hepatitis B virus conferred by CCR5Delta32: Evidence that CCR5 contributes to viral persistence. J Virol. 2007;81:441-445. [PubMed] [DOI] |
| 6. | Samson M, Libert F, Doranz BJ, Rucker J, Liesnard C, Farber CM, Saragosti S, Lapoumeroulie C, Cognaux J, Forceille C. Resistance to HIV-1 infection in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene. Nature. 1996;382:722-725. [PubMed] [DOI] |
| 7. | Shahbazi M, Ebadi H, Fathi D, Roshandel D, Mahamadhoseeni M, Rashidbaghan A, Mahammadi N, Mahammadi MR, Zamani M. CCR5-Delta32 Allele is Associated with the Risk of Developing Multiple Sclerosis in the Iranian Population. Cell Mol Neurobiol. 2009; May 29. [Epub ahead of print]. [PubMed] |
| 8. | Ajuebor MN, Aspinall AI, Zhou F, Le T, Yang Y, Urbanski SJ, Sidobre S, Kronenberg M, Hogaboam CM, Swain MG. Lack of chemokine receptor CCR5 promotes murine fulminant liver failure by preventing the apoptosis of activated CD1d-restricted NKT cells. J Immunol. 2005;174:8027-8037. [PubMed] |
| 11. | Ahn SH, Kim do Y, Chang HY, Hong SP, Shin JS, Kim YS, Kim H, Kim JK, Paik YH, Lee KS. Association of genetic variations in CCR5 and its ligand, RANTES with clearance of hepatitis B virus in Korea. J Med Virol. 2006;78:1564-1571. [PubMed] [DOI] |
| 12. | Ioannidis JP, Rosenberg PS, Goedert JJ, Ashton LJ, Benfield TL, Buchbinder SP, Coutinho RA, Eugen-Olsen J, Gallart T, Katzenstein TL. Effects of CCR5-Delta32, CCR2-64I, and SDF-1 3'A alleles on HIV-1 disease progression: An international meta-analysis of individual-patient data. Ann Intern Med. 2001;135:782-795. [PubMed] |