修回日期: 2009-05-15
接受日期: 2009-05-25
在线出版日期: 2009-06-18
目的: 建立稳定表达候选抑癌基因DMBT1的食管癌细胞系EC9706, 并分析转染前后其增殖特点、转移侵袭能力的变化.
方法: 脂质体介导法将DMBT1的全长表达质粒转染食管癌细胞系EC9706, G418筛选阳性克隆细胞, Western blot及RT-PCR检测DMBT1蛋白及mRNA水平变化, MTT法绘制细胞生存曲线及无血清条件下测细胞生存抑制率, Transwell实验检测细胞趋化迁移能力变化.
结果: 通过稳定转染后, DMBT1蛋白水平及mRNA水平均比对照组提高3.2倍以上, 与对照组比较, 差异有显著意义(P<0.01); 实验组细胞增殖速度、倍增时间、对数生长期等均比对照组细胞更为缓慢, 在无血清培基中增殖抑制率随时间延长不断增高, 实验组迁移细胞数为206±25, 对照组为367±42, 2组比较差异有显著意义(P<0.01).
结论: 在体外成功建立稳定表达DMBT1的细胞系, DMBT1过表达在体外显著抑制食管癌细胞系EC9706的生长增殖及趋化迁移.
引文著录: 张光斌, 贺涛, 张宁. DMBT1过表达对食管癌细胞系EC9706生物学行为的影响. 世界华人消化杂志 2009; 17(17): 1759-1763
Revised: May 15, 2009
Accepted: May 25, 2009
Published online: June 18, 2009
AIM: To establish the cell line EC9706 of esophagus carcinoma with stable expression of a new candidate tumor suppressor gene DMBT1 and to analyze cell invasiveness and cell proliferation compared to the control group so as to provide any insights into the function of the newly-discovered tumor suppressor gene.
METHODS: The full-length DMBT1 expression plasmid pTRexDest30_DMBT18kb.2 was transfected into esophagus carcinoma cell line EC9706 with Lipofectamine 2000 which was subsequently screened with G418. DMBT1 transcript and protein were determined by semi-quantitative RT-PCR and Western blot; then cell growth and proliferation was evaluated with MTT; finally transwell assay was applied to evaluate the ability of its migration before and after the transfection.
RESULTS: After transfection, the levels of DMBT1 protein and mRNA were 3.2 times higher than control group. There was significant difference between transfection group and the control group. The growth curves mapped with MTT indicated that the group transfected with pTRexDest30_DMBT1 showed slower speed of proliferation versus the vector control and the untreated group. In addition, cell survival in serum-free medium was markedly inhibited compared to the vector control. Transwell assay further confirmed conspicuous discrepancy in migration (206 ± 25 vs 367 ± 42, P < 0.01), the experimental group versus the control group.
CONCLUSION: The biological model that stably expresses DMBT1 was successfully established; DMBT1 over-expression significantly inhibits the proliferation and invasive process of esophagus carcinoma cell line in vitro.
- Citation: Zhang GB, He T, Zhang N. Effects of DMTB1 over-expression on the biological behavior of esophagus carcinoma cell line EC9706. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1759-1763
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1759.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1759
脑恶性肿瘤缺失基因1(deleted in malignant brain tumors 1, DMBT1)位于人类染色体10q26.13, 是新近发现的一种候选抑癌基因, 在脑、胃、结肠、食管、皮肤等多数组织发生恶性肿瘤中表达下调, 而在胰腺、腮腺等少数组织发生的肿瘤中表达上调, 因而被提议作为一个候选的抑癌基因[1-7]. 食管癌是一种常见的消化系肿瘤, 全世界每年约30万人死于食管癌. 我国是食管癌的高发地区, 每年因食管癌死亡者约15万人, 约占全部恶性肿瘤死亡的四分之一[8]. 本研究目的在于应用DMBT1全长表达表达质粒稳定转染食管癌细胞系EC9706, 研究转染前后细胞增殖以及侵袭转移能力的变化, 以进一步认识DMBT1的功能及食管癌侵袭浸润的机制.
食管癌细胞系EC9706, 购自上海生物细胞所. DMBT1全长表达质粒pTRexDest30_DMBT18kb.2为德国Jan Mollenhauer教授构建[9], 复旦大学糖蛋白重点实验室惠赠, 经上海生工测序后显示上下游酶切位点正确, 序列无突变. RT-PCR试剂盒、DL2000DNA Marker、λHind Ⅲ DNA Marker为TaKaRa UNIQ-10柱式质粒小剂量抽提试剂盒购自上海生工. LipofectamineTM 2000、TRIzol、DAPI、RPIM 1640培养液干粉和小牛血清购自上海英俊生物公司. DMBT1小鼠单抗购自晶美(Abcam公司). 引物设计参照相关文献[4], 递交上海生工合成, 内参为GADPH, 上游引物: 5' ACCACAGTCCATGCCATCAC 3', 下游引物: 5' CCACCACCCTGTTGCTGTAG 3', 产物为450 bp. 核酸电泳仪、 蛋白电泳仪、 蛋白转印仪为BIO-RAD公司生产. 台式冷冻离心机为Sigma公司产品. PE2400型PCR仪为美国PE公司产品. 凝胶图像分析系统为美国UVP公司. CO2培养箱为Nacpo公司生产.
1.2.1 稳定转染EC9706细胞的筛选: 按照LipofectamineTM 2000的说明, 用250 μL血清无抗培养基各稀释4.0 μg质粒及10 μL脂质体两者混合, 混匀, 静置20 min后转染六孔板的对数期生长细胞(细胞汇合率在80%以上), 6 h后更换为一般培养基. 24 h后, G418(350 mg/L)开始筛选转染细胞. 加压筛选5-6 wk. 设立pTRexDest30空载体做对照. 克隆形成后逐个计数, 随机挑取克隆, 大量扩增抗性细胞. 为便于下面论述, 将细胞分为3组: 实验组: 转染DMBT1质粒组; 对照组: 转染空载体组; 未处理组: 未转染的食管癌细胞系.
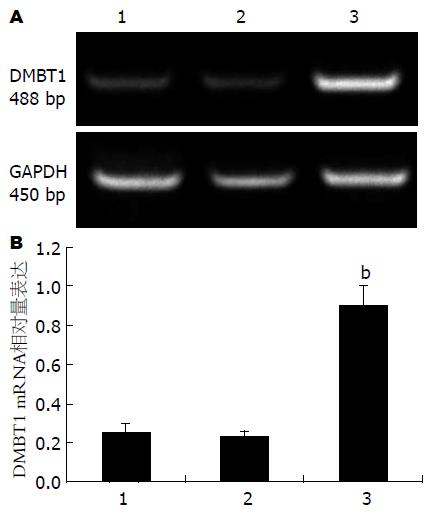
1.2.2 RT-PCR检测DMBT1 mRNA转染前后表达水平的变化: 收集状态良好细胞, 参照TRIzol试剂的说明抽提总量RNA, 紫外分光光度计测定抽提RNA浓度. 反转录为20 μL反应体系, 总RNA 2.0 μg, Oligo(dT) 181 μL, 再加入DEPC水, 上述混匀, 70 ℃, 5 min, 置于冰上. 再加入5×M-MLV缓冲液4 μL, 核酸酶抑制剂0.5 μL, 10 mol/L dNTP 1.25 μL, M-MLVRT(逆转录酶)1 μL, 37 ℃反应60 min. PCR反应体系为25 μL: cDNA, 1.5 μL; 2×Master Mix, 12.5 μL; primers, 各1 μL; 无菌三蒸水, 9 μL. 反应条件为94 ℃预变性5 min, 94 ℃, 30 s; 60 ℃, 30 s; 72 ℃, 2 min; 延伸72 ℃ 10 min. 30个循环. 内参为GAPDH. 为比较转染前后DMBT1 mRNA表达量变化, 由此计算了其相对表达量, 代表了上样量一致的情况下DMBT1的表达量. 独立实验重复3次.
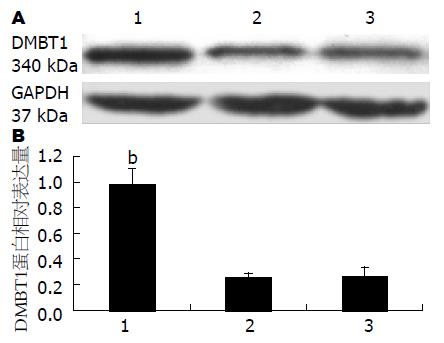
1.2.3 Western blot检测转染前后DMBT1蛋白水平的变化: 收集对数期生长细胞, 总蛋白抽提后改良Lorry法蛋白定量, 按照上样量为50 μg的量计算上样体积, 余下用SDS上样缓冲液补足20 μL, 样品经β-巯基乙醇、离心、加热变性处理后上样, 电泳, 5%浓缩胶, 50 V, 10%分离胶, 100 V; 2 h后再行电转移至PVDF膜上, 3 h后50 g/L脱脂奶粉室温封闭, 敷封闭液稀释的一抗(1:2000)4 ℃过夜, PBST洗膜3次, 每次10 min, 敷封闭液稀释HRP标记的二抗(1:4000). PBST洗膜3次, 暗室中ECL发光. 为比较转染前后DMBT1蛋白表达量变化, 由此计算了其相对表达量, 代表了上样量一致的情况下DMBT1的表达量. 独立实验重复3次.
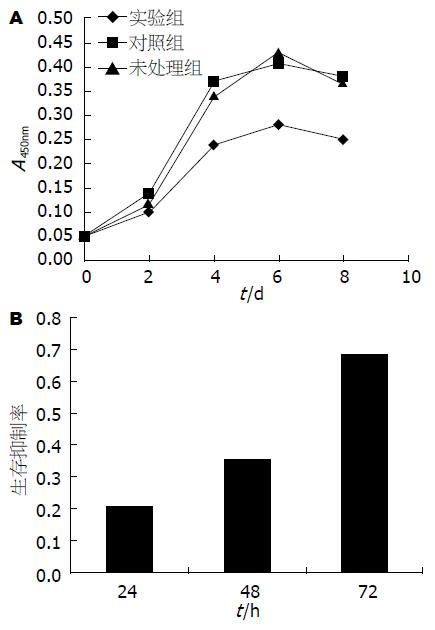
1.2.4 MTT法绘制细胞生长曲线及无血清情况下测定细胞生存抑制率: 用Trypsin-EDTA Solution消化细胞, RPMI 1640培液制备细胞悬液, 以每孔104个细胞接种于96孔培养板中, 测生存抑制率为每孔4×104个细胞, 且用无血清培液. 每组细胞4个复孔. 边缘孔加PBS. 每隔24 h, 每孔加入20 μL MTT溶液(5 g/L), 37 ℃继续孵育4 h, 终止培养, 弃孔内上清液, 每孔加入150 μL DMSO, 振荡10 min, 490 nm波长, 在酶标仪上测定各孔吸光度值(A值). 绘制细胞生长曲线. 生存抑制率为1-A490nm(实验组)/A490nm(对照组), 独立实验重复3次.
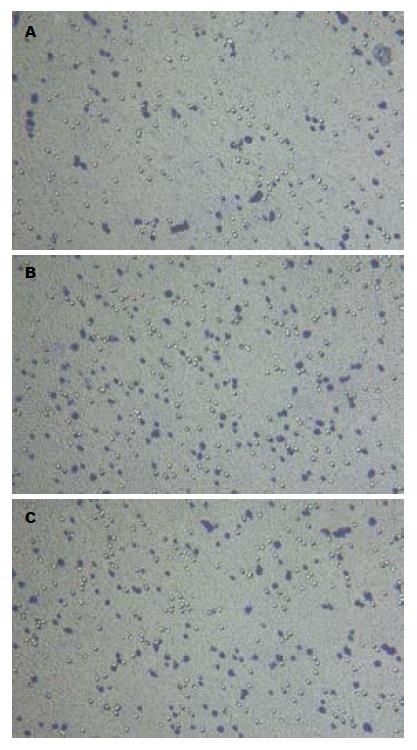
1.2.5 Transwell小室检测细胞趋化迁移能力: 将Transwell放入24孔培养板, 使其形成上下2个小室. 以2.5 g/L胰酶消化细胞, 加入含100 g/L小牛血清的DMEM的培养基中和, 离心, 以无血清DMEM培养基洗涤细胞2次, 重悬于无血清0.5% BSA-DMEM培养基中. 计数细胞, 调节细胞为1×109/L, 取100 L细胞悬液加入Transwell上层小室中, 下层小室中加入含50 g/L胎牛血清肌0.5% BSA的DMEM 0.8 mL培养基作为趋化因子. 置培养皿于细胞培养箱中24 h. 培养结束, Transwell膜以甲醇固定30 min, 结晶紫染色. 用棉签拭去上层小室内Transwell膜表面的细胞将膜取出并用中性树胶封闭于玻片中. 显微镜下观察穿过Transwell膜表面的细胞并拍照, 穿过的细胞数与细胞的迁移能力成正比. 随机选取5-8个视野计数并统计. 独立实验重复3次.
统计学处理 所有服从正态分布的数据均用mean±SD表示, 检验采用配对t检验或独立样本t检验, 所有数据均应用SPSS处理.
转染后细胞经G418加压筛选4-5 wk后, 首先应用半定量RT-PCR分析了转染前后DMBT1 mRNA变化. 如图1A所示, 在GAPDH一致的情况下, 可以看出转染DMBT1质粒的一组条带明显增亮. 如图1B所示的计算的相对表达量看出, 实验组DMBT1 mRNA相对表达量均比对照组高3.2倍以上, 差异有显著意义(P<0.01).
图2A为Western blot的结果, 在340 kDa处检测到DMBT1特异性蛋白条带, 由图2可以看出, 在上样量(GAPDH)一致的情况下转染后DMBT1表达量明显增加. 实验组DMBT1表达量比对照组高3.5倍以上, 2组细胞比较, 差异有显著意义(P<0.01). 实验组DMBT1表达量比对照组显著提高, 从而证实在体外成功建立了稳定表达DMBT1的食管癌细胞系EC9706.
图3A为检测细胞增殖的结果, 从绘制的细胞生长曲线可以看出, 实验组细胞生长速度明显要慢, 无明显的对数生长期, 很早就进入衰亡期. DMBT1过表达在无血清条件下更明显的抑制食管癌细胞的增殖(图3).
实验结束后经迁移细胞计数发现实验组迁移细胞数为206±25, 对照组为367±42, 两者比较, 差异有显著意义(P<0.01). 说明DMBT1过表达抑制食管癌细胞的趋化迁移(图4).
DMBT1位于人类染色体10q26.13, 因在髓母细胞瘤和胶质细胞瘤中广泛缺失而得名. 在感染、炎症及肿瘤中发挥着广泛的作用. 研究发现DMBT1在大多数肿瘤表达下调, 少数肿瘤中表达上调. 正常生理情况下, DMBT1不表达或低水平表达, 炎症及癌旁组织却发现DMBT1高表达. DMBT1的全长表达质粒pTRexDest30_DMBT18kb.2由End et al[9]构建并将其成功用于稳定转染中国仓鼠卵巢细胞系. 体外实验表明, DMBT1在细胞外基质的聚合能够引发细胞极性的逆转及肾脏上皮的终端分化, 包括微绒毛的出现. 早期研究观察到暴露于酸性环境时肾脏上皮可以通过跨膜离子运转载体如KAE1等从基底膜到顶膜的易位而逆转上皮的极性. 由此纯化了一种命名为Hensin的细胞外基质蛋白, 研究表明Hensin可以逆转细胞极性. Hensin基因克隆分析及同源性搜索确认这种蛋白为兔DMBT1的直系同源基因[10-12]. 这些提示促进细胞的分化可能是DMBT1抑制肿瘤的一种机制. 我们发现同转染空载体细胞比较, 转染DMBT1的细胞生长增殖明显比对照组缓慢, 无明显对数生长期, 较早进入衰亡期. 恶性肿瘤细胞对饥饿(无血清)耐受能力非常强. 我们实验中也发现转染后的细胞对低血清比较敏感. 这些都提示转染后细胞出现分化的倾向. DMBT1与凋亡的关系文献报道较少. 针对胃癌细胞系AGS研究时发现佛波脂通过PKC及ERK介导DMBT1下调及细胞分化抑制. 应用ERK抑制剂PD98059或高密度接种细胞会显著降低AGS的增值, 使细胞停滞于G0/G1期, 同时伴DMBT1表达细胞明显增多. 但DMBT1对已分化的细胞的周期却无明显的影响[13]. 与正常肝脏组织比较, DMBT1经常表达于伴有肝内胆管结石的胆道上皮. 并且, 在非侵入性肝内胆管癌中, DMBT1的表达也较高. 而在侵入性肝内胆管细胞癌中DMBT1的表达降低[14]. 这提示DMBT1与肿瘤的侵袭存在联系, 我们采用Transwell实验分析发现实验组细胞穿膜细胞数明显少于对照组, 由于Transwell实验时间跨度短, 较少受到细胞增殖的影响, 故可说明DMBT1在体外的过表达会抑制食管癌细胞的侵袭. 上面谈到DMBT1过表达在体外抑制食管癌细胞的增殖, 故不适用用实验周期较长的划痕损伤来检测细胞的迁移能力. 关于DMBT1在体外过表达抑制食管癌细胞侵袭的具体机制还需进一步研究.
总之, 我们在体外成功构建了稳定表达DMBT1的食管癌细胞系EC9706, 并初步研究了转染后细胞的增殖特性、转移侵袭能力, 发现DMBT1过表达在体外能够抑制食管癌细胞系EC9706的增殖及转移. DMBT1究竟是否具有经典抑癌基因的特性目前还存在争议, 我们期望能够进一步借助我们建立的生物学模型对DMBT1的功能及食管癌的发生发展机制做进一步的研究.
DMBT1究竟是否是经典的抑癌基因目前还存有争论, 对其功能的认识主要基于其在组织中的表达特点, 直接在体外研究其功能的报道很少.
王振宁, 教授, 中国医科大学附属第一医院肿瘤外科
由于DMBT1在感染、炎症及肿瘤中发挥着广泛的作用, 目前在体外对其进行功能研究成为热点, 有望揭示感染、炎症及肿瘤之间存在的关系及进一步认识肿瘤的发生发展机制.
体外实验表明, DMBT1在细胞外基质的聚合能够引发细胞极性的逆转及肾脏上皮的终端分化, 包括微绒毛的出现. 早期研究观察到暴露于酸性环境时肾脏上皮可以通过跨膜离子运转载体如KAE1等从基底膜到顶膜的易位而逆转上皮的极性.
鉴于DMBT1的长度, 质粒构建时碱基错配、二聚体形成等几率甚高, 故在体外研究DMBT1功能的报道较少, 本研究较好的利用了已构建的DMBT1质粒成功建立了稳转细胞系.
本实验在体外建立了稳定表达DMBT1的食管癌生物学模型, 将有助于进一步深入研究DMBT1的功能及食管癌的发生发展机制.
本研究探讨了DMBT1表达对食管癌细胞系EC9706增殖与转移的影响, 结果认为其表达增加会在体外显著抑制食管癌细胞系EC9706的生长增殖及侵袭, 具有一定的理论价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Mollenhauer J, Wiemann S, Scheurlen W, Korn B, Hayashi Y, Wilgenbus KK, von Deimling A, Poustka A. DMBT1, a new member of the SRCR superfamily, on chromosome 10q25.3-26.1 is deleted in malignant brain tumours. Nat Genet. 1997;17:32-39. [PubMed] [DOI] |
| 2. | De Lisle RC, Xu W, Roe BA, Ziemer D. Effects of Muclin (Dmbt1) deficiency on the gastrointestinal system. Am J Physiol Gastrointest Liver Physiol. 2008;294:G717-G727. [PubMed] [DOI] |
| 3. | Mollenhauer J, Helmke B, Muller H, Kollender G, Lyer S, Diedrichs L, Holmskov U, Ligtenberg T, Herbertz S, Krebs I. Sequential changes of the DMBT1 expression and location in normal lung tissue and lung carcinomas. Genes Chromosomes Cancer. 2002;35:164-169. [PubMed] [DOI] |
| 4. | Mollenhauer J, Herbertz S, Holmskov U, Tolnay M, Krebs I, Merlo A, Schrøder HD, Maier D, Breitling F, Wiemann S. DMBT1 encodes a protein involved in the immune defense and in epithelial differentiation and is highly unstable in cancer. Cancer Res. 2000;60:1704-1710. [PubMed] |
| 5. | Sasaki K, Sato K, Akiyama Y, Yanagihara K, Oka M, Yamaguchi K. Peptidomics-based approach reveals the secretion of the 29-residue COOH-terminal fragment of the putative tumor suppressor protein DMBT1 from pancreatic adenocarcinoma cell lines. Cancer Res. 2002;62:4894-4898. [PubMed] |
| 6. | Bikker FJ, van der Wal JE, Ligtenberg AJ, Mollenhauer J, de Blieck-Hogervorst JM, van der Waal I, Poustka A, Nieuw Amerongen AV. Salivary agglutinin/DMBT1SAG expression is up-regulated in the presence of salivary gland tumors. J Dent Res. 2004;83:567-571. [PubMed] [DOI] |
| 7. | Li Z, Szabolcs M, Terwilliger JD, Efstratiadis A. Prostatic intraepithelial neoplasia and adenocarcinoma in mice expressing a probasin-Neu oncogenic transgene. Carcinogenesis. 2006;27:1054-1067. [PubMed] [DOI] |
| 9. | End C, Lyer S, Renner M, Stahl C, Ditzer J, Holloschi A, Kuhn HM, Flammann HT, Poustka A, Hafner M. Generation of a vector system facilitating cloning of DMBT1 variants and recombinant expression of functional full-length DMBT1. Protein Expr Purif. 2005;41:275-286. [PubMed] [DOI] |
| 10. | Hikita C, Takito J, Vijayakumar S, Al-Awqati Q. Only multimeric hensin located in the extracellular matrix can induce apical endocytosis and reverse the polarity of intercalated cells. J Biol Chem. 1999;274:17671-17676. [PubMed] [DOI] |
| 11. | Schwartz GJ, Barasch J, Al-Awqati Q. Plasticity of functional epithelial polarity. Nature. 1985;318:368-371. [PubMed] [DOI] |
| 12. | Takito J, Hikita C, Al-Awqati Q. Hensin, a new collecting duct protein involved in the in vitro plasticity of intercalated cell polarity. J Clin Invest. 1996;98:2324-2331. [PubMed] [DOI] |
| 13. | Kang W, Nielsen O, Fenger C, Leslie G, Holmskov U, Reid KB. Induction of DMBT1 expression by reduced ERK activity during a gastric mucosa differentiation-like process and its association with human gastric cancer. Carcinogenesis. 2005;26:1129-1137. [PubMed] [DOI] |
| 14. | Sasaki M, Huang SF, Chen MF, Jan YY, Yeh TS, Ishikawa A, Mollenhauer J, Poustka A, Tsuneyama K, Nimura Y. Decrease of deleted in malignant brain tumour-1 (DMBT-1) expression is a crucial late event in intrahepatic cholangiocarcinoma. Histopathology. 2003;43:340-346. [PubMed] [DOI] |