修回日期: 2009-05-22
接受日期: 2009-05-25
在线出版日期: 2009-06-18
目的: 观察生长抑素(奥曲肽)对溃疡性结肠炎(ulcerative colitis, UC)大鼠模型的作用, 初步探讨其可能机制.
方法: ♂SD大鼠随机分为正常对照组、奥曲肽对照组、模型组、治疗组, 每组7只. 模型组、治疗组大鼠用三硝基苯磺酸(TNBS)/乙醇溶液灌肠复制UC模型. 观察各组实验大鼠体质量变化、大体及组织病理学改变. 采用酶联免疫吸附法检测细胞因子(IL-6、IL-10、TNF-α)的含量、蛋白质印迹杂交法检测结肠组织NF-κB p65蛋白的表达.
结果: 生长抑素可以缓解大鼠体质量的减轻, 减少腹泻及便血的发生, 并且能够显著改善结肠组织大体和组织学评分. 与正常组比较, 模型组大鼠结肠黏膜IL-6、TNF-α表达明显升高(188.27±11.65 ng/L vs 102.13±7.12 ng/L, 87.39±6.74 ng/L vs 121.51±8.56 ng/L, 均P<0.01); IL-10表达明显下降(71.40±8.28 ng/L vs 202.97±12.26 ng/L, P<0.01); 与模型组比较, 治疗组大鼠结肠黏膜IL-6、TNF-α表达均明显降低(142.03±12.68 ng/L, 90.87±9.26 ng/L, 均P<0.01), IL-10表达明显升高(124.07±10.05 ng/L, P<0.01). 模型组结肠组织中NF-κB的蛋白含量明显高于治疗组(1059.60±96.35 vs 471.23±11.61, P<0.01).
结论: 生长抑素对TNBS诱导的大鼠溃疡性结肠炎具有显著治疗作用, 其作用机制可能是通过影响炎症反应的信号通路NF-κB的活化, 进而下调促炎细胞因子及上调抗炎细胞因子的产生和表达.
引文著录: 刘元山, 陈剑群, 朱炳喜. 生长抑素对溃疡性结肠炎模型大鼠肠道炎性损伤的治疗作用. 世界华人消化杂志 2009; 17(17): 1726-1731
Revised: May 22, 2009
Accepted: May 25, 2009
Published online: June 18, 2009
AIM: To study the therapeutic effects of somatostatin (octreotide) on 2, 4, 6-trinitrobenzene sulfonic acid induced ulcerative colitis (UC) in rats and to explore its possible mechanism.
METHODS: Twenty-eight female SD rats were randomized into normal control group, octreotide control group, model group and treatment groups (7 rats for each group). UC in model group and treatment group was induced by intrarectal administration of TNBS (100 mg/kg in 50% ethanol). Octreotide 50 µg/kg per day (octreotide control group and treatment group) or saline 1 mL per day (normal control group and model group) was administered intraperitoneally each day for 14 days. All animals were killed on day 15. The body weight loss of each rat, macroscopical and histological changes of the colon were observed. IL-6, IL-10, tumor necrosis factor (TNF-α) in colon supernate were tested by ELISA and the expression of nuclear factor (NF)-κB p65 in the colonic tissues was detected using Western blot.
RESULTS: Compared with the model group, somatostatin inhibited the body weight loss and occurrence of diarrhea as well as rectal bleeding in the rats, and significantly improved the macroscopic damage score and histological score in the treatment group. Compared with the normal group, colonic mucosal IL-6, TNF-α expression of model group rats were significantly increased (188.27 ± 11.65 ng/L vs 102.13 ± 7.12 ng/L, 121.51 ± 8.56 ng/L vs 87.39 ± 6.74 ng/L, both P < 0.01); IL-10 expression was significantly decreased (71.40 ± 8.28 ng/L vs 202.97 ± 12.26 ng/L, P < 0.01); Compared with the model group, mucosal IL-6, TNF-α expression of the treatment group rats colon were significantly lower (142.03 ± 12.68 ng/L, 90.87 ± 9.26 ng/L, both P < 0.01), IL-10 expression was significantly elevated (124.07 ± 10.05 ng/L, P < 0.01). For the model group, the colon tissue of NF-κB protein content was significantly higher than the treatment group (1059.60 ± 96.35 vs 471.23 ± 11.61, P < 0.01).
CONCLUSION: Somatostatin has noticeable therapeutic effects on TNBS-induced ulcerative colitis in rats. Suppressing NF-κB activation, decreasing the expression of proinflammatory cytokines and increasing the expression of anti-inflammatory cytokines may be the possible mechanism.
- Citation: Liu YS, Chen JQ, Zhu BX. Therapeutic effects of somatostatin on the intestinal inflammatory injury in rat model of ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1726-1731
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1726.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1726
溃疡性结肠炎(ulcerative colitis, UC)是病因未明的结肠黏膜及黏膜下炎症, 近年来国内报道日渐增多, 成为常见消化系疾病和慢性腹泻的主要病因[1]. 传统药物对UC疗效不甚理想, 特别是对部分顽固性、复发性或重症患者, 至今还没有理想的治疗方法, 筛选高效低毒的抗炎药物一直是该领域的研究热点. 生长抑素(somatostatin, SST)是1973年首先从下丘脑分离出来的一个具有14个氨基酸的肽类激素, SST细胞在神经系统、消化系都有大量分布, 另外许多腺体也有SST分布[2]. 其功能主要是抑制胃肠分泌和胰腺的内外分泌; SST还可抑制胃肠道和胆道蠕动、消化系血流及炎症介质的产生, 同时对免疫系统也有多种调节作用. 国内曾有生长抑素治疗激素依赖型重度UC的成功报道[3]. SST类似物奥曲肽(善宁)是人工合成的生长抑素八肽, 他具有与天然生长抑素类似的药理作用, 其半衰期长, 价格便宜, 且使用方便. 本实验应用三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, TNBS)复制UC模型, 观察奥曲肽对UC模型大鼠肠道炎性损伤的抑制作用, 并初步探讨其可能机制, 从而为奥曲肽治疗UC患者提供一定的实验基础和理论依据.
健康SD大鼠28只, ♂, 体质量170-210 g, 清洁级, 由徐州医学院实验动物中心提供. TNBS购自Sigma公司; 奥曲肽(善宁)由瑞士诺华公司提供; NF-κB p65抗体(一抗)购自美国Santa Cruz公司; 大鼠IL-6、IL-10、TNF-α ELISA试剂盒均购自上海西唐生物科技有限公司.
1.2.1 造模及分组: SD大鼠28只, 随机分为正常对照组、奥曲肽对照组、模型组及治疗组, 每组7只. 正常对照组及奥曲肽对照组不造模, 模型组及治疗组均按Morris et al[4]采用的方法建立TNBS结肠炎动物模型. 各组大鼠实验前禁食(不禁水)24 h, 实验时, ip 10%的水合氯醛(0.35 mL/100 g体质量)使大鼠轻微麻醉, 而后将一直径2.0 mm、长约12 cm的硅胶管用石蜡油润滑, 由肛门轻缓插入大鼠体内深约8 cm, 缓慢注入含100 mg/kg TNBS的等体积无水乙醇溶液, 然后提起大鼠尾部, 持续倒置10 min, 使造模剂充分渗入大鼠肠腔内. 造模后, 使动物保持平躺, 自然清醒, 自由饮食.
1.2.2 给药: 奥曲肽对照组与治疗组大鼠每天给予50 µg/kg的奥曲肽, 用生理盐水稀释至1 mL, 由腹腔注入; 正常对照组及模型组大鼠每天ip生理盐水1 mL. 连续给药14 d后处死所有大鼠并取样.
1.2.3 症状观察: 每天对各组大鼠称质量并记录, 日观察各组大鼠精神状态、进食、活动、腹泻情况及粪便性状等.
1.2.4 标本采集: 水合氯醛麻醉后处死大鼠, 打开腹腔, 截取自肛门向上10 cm的结肠, 沿肠系膜纵轴剪开, 冰生理盐水反复冲洗干净, 在滤纸上将肠黏膜面向上展开, 参照文献[5]肉眼观察大体形态并评分. 然后以病灶为中心纵轴切开分成两部分: 一部分以40 g/L甲醛溶液固定, 常规石蜡包埋, HE染色, 参照文献[5]进行病理组织切片观察及组织学评分. 另切取部分病变结肠组织, 滤纸吸干, 称质量后置-70 ℃冰箱冻存, 为组织待测标本.
1.2.5 结肠组织IL-6、IL-10及TNF-α检测: 精确称取备用的结肠组织0.1 g, 用眼科小剪刀尽快剪碎, 置于匀浆器中用9倍生理盐水匀浆(匀浆器末端置于放冰块的冷水中), 而后以3500 r/min离心10 min, 取上清液. 采用双抗体夹心ELISA法, 严格按试剂盒说明书进行操作.
1.2.6 结肠组织NF-κB p65蛋白表达检测: 用Western blot法, 分别称取备用的结肠组织0.1 g经匀浆离心后取上清液, 酚试剂法(lowry法)测核蛋白浓度, 并调整核蛋白浓度为5 g/L, 置于-70 ℃冰箱保存备用. 每泳道取40 µL提取核蛋白, 用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离, 半干转印于固相支持体硝酸纤维素膜上, 封闭后与NF-κB p65一抗4 ℃孵育过夜, 再加入荧光标记二抗孵育, 采用Odyssey双色红外激光成像系统检测.
统计学处理 数据采用mean±SD表示. 运用SPSS16.0软件来进行统计学处理, 组间采用方差分析, 以P<0.05为差异有统计学意义.
正常组及奥曲肽组大鼠反应较灵敏, 毛发有光泽, 饮食正常, 无腹泻及便血; 模型组大鼠则表现为精神萎靡、少动, 毛发杂乱无光泽, 饮食量减少, 进而出现不同程度的腹泻和便血. 与模型组相比, 治疗组大鼠一直未出现肉眼血便.
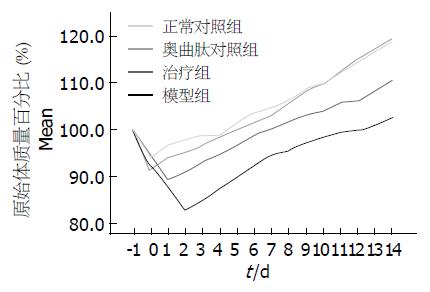
通过每天对各组大鼠体质量的检测发现, 正常组及奥曲肽组大鼠禁食24 h后, 体质量轻微减轻, 随后2 wk体质量逐渐恢复并增加至原体质量的120%, 2组大鼠间体质量变化无显著性差异(P<0.05). 模型组大鼠体质量在第2天降至最低, 只有原体质量的83%, 随后2 wk内逐渐增加至最初体质量的103%, 且在2 wk内体质量显著低于正常组及奥曲肽组大鼠的体质量(P<0.05). 而治疗组大鼠的体质量在第2天就开始恢复, 7-8 d即恢复至最初. 以上结果表明, 生长抑素能够有效缓解造模后大鼠体质量的下降, 促进大鼠体质量的尽快恢复(图1).
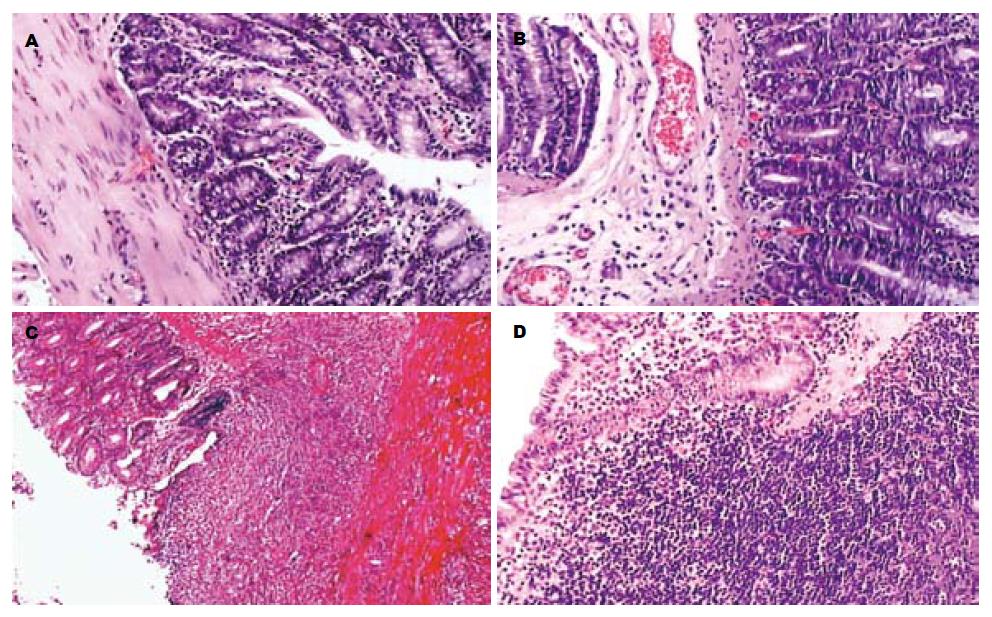
模型组大鼠结肠黏膜明显充血、水肿, 部分与周围组织粘连, 距肛门8 cm范围内可见较大溃疡病灶, 局部肠管扩张, 肠壁增厚、颜色灰暗, 病灶处有假膜样物覆盖. 光镜下可见黏膜上皮坏死脱落、溃疡形成, 固有层内有大量中性粒细胞、淋巴细胞浸润, 纤维组织增生. 治疗组肠黏膜上皮脱落缺损较轻, 溃疡区域减少, 黏膜周围上皮可见增生修复, 炎症细胞浸润减少, 表现出明显的治疗作用. 正常对照组及奥曲肽组结肠黏膜完整, 固有层内肠腺丰富, 排列紧密(图2), 各组别结肠大体形态和组织学损伤评分具体结果见表1.
与正常组比较, 模型组大鼠结肠黏膜IL-6、TNF-α表达明显升高(P<0.01); IL-10表达明显下降(P<0.01); 与模型组比较, 治疗组大鼠结肠黏膜IL-6、TNF-α表达均明显降低(P<0.01), IL-10表达明显升高(P<0.01), 差异有统计学意义(表2).
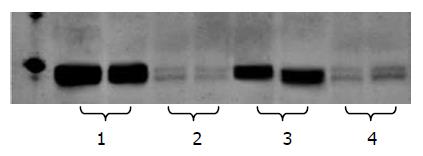
模型组结肠组织NF-κB蛋白区带加宽, 深于正常对照组和奥曲肽对照组(图3), 其NF-κB蛋白积分吸光度值为1059.60±96.35, 治疗组NF-κB蛋白积分吸光度值为471.23±11.61, 二者比较有统计学意义, 即模型组结肠组织中NF-κB的蛋白含量明显高于治疗组.
UC是临床上常见的一种反复发作、经久难愈的疾病, 且与结肠癌关系密切. 其确切病因和发病机制迄今未明, 多数学者认为, 可能是遗传、环境和免疫等多因素共同作用的结果[6]. 其中UC的免疫学发病机制特别是细胞因子发病机制越来越受到人们的重视[7]. UC的发病机制主要是结肠黏膜局部免疫紊乱, 同时伴有全身免疫功能失调[8]. 目前, 细胞因子失衡是UC产生肠道非特异性炎症的关键环节[9]. 与UC关系密切的促炎细胞因子主要有IL-1、IL-6、IL-8、TNF-α等, 抗炎细胞因子主要有IL-4、IL-10等, 他们可同时或相继、直接或间接作用于靶细胞, 形成细胞因子网络, 在UC的组织破坏及炎症反应中起着重要作用[10]. 正常机体肠黏膜内促炎细胞因子和抑炎细胞因子处于平衡状态, UC时肠黏膜促炎细胞因子(IL-1、IL-6、TNF-α等)表达升高, 而抗炎细胞因子(IL-4、IL-10等)分泌相对不足, 使肠黏膜产生过强的炎症反应, 从而引起肠道损伤, 这在很大程度上解释了UC的发病机制, 研究认为这与调节细胞因子基因转录的NF-κB的异常活化有关[11].
促炎细胞因子TNF-α、IL-6主要由激活的单核-巨噬细胞分泌, 他们的许多生物学作用是相同的, 但也各有其特点[12]. TNF-α在UC发病中被公认为是一种促炎细胞因子, 他可以促使肠上皮内淋巴细胞增殖、分化及移行, 这一过程会释放大量的特异性或非特异性炎症分子, 起到局部免疫破坏作用, 反映到UC则是肠局限性溃疡的出现和延续[13]. 已有研究表明[14], 活动期UC患者血清TNF-α水平明显增高. 在病理情况下, 肠道黏膜中多种炎性细胞均可大量分泌TNF-α[15]. 提示TNF-α参与了UC的病理过程. 本实验发现模型组大鼠结肠黏膜中TNF-α水平明显高于对照组, 经生长抑素治疗后其水平显著下降, 说明生长抑素可以通过抑制TNF-α的产生, 减少特异性或非特异性炎症分子的释放, 缓解肠道免疫破坏作用. 而IL-6异常则可以导致一些免疫炎性疾病的发生, 他的过度增高可导致机体内环境紊乱, 诱发或加重某些疾病[16]. 已有文献报道, IL-6在溃疡性结肠炎中浓度明显增高[9,17]. UC患者血清IL-6浓度升高的程度与病变范围和病变严重程度成正相关[18-19]. 本研究结果也显示, 模型组IL-6、TNF-α含量明显增加, 说明IL-6、TNF-α在实验性结肠炎的发生、发展过程中可能起重要作用.
IL-10又名细胞因子合成抑制因子, 他是1989年由Mdsmann et al[20]首先发现. 目前多认为IL-10是一种重要的负向调节细胞因子, 对免疫炎症发展过程中的多个环节均有阻断作用, 具有广泛的免疫抑制活性[21], 如抑制活化的单核-巨噬细胞转录分泌IL-1、IL-6和TNF-α等, 在维持正常肠道黏膜免疫调节与稳定肠道黏膜内环境中发挥重要作用. 大量研究表明, UC患者结肠黏膜内IL-10含量减少[22], 而应用IL-10灌肠治疗UC患者, 能明显改善肠道黏膜炎症[23]. 在一些动物实验中也发现, IL-10具有防治发生结肠炎的作用[24]. 目前, 各种针对IL-10的溃疡性结肠炎免疫治疗在模型动物和临床试验中均取得良好效果[25]. 本实验研究结果也显示, 奥曲肽能够显著降低大鼠UC模型结肠组织促炎细胞因子IL-6、TNF-α的含量, 同时明显升高结肠黏膜IL-10的含量(P<0.01). 因此, 从奥曲肽治疗后细胞因子发生的改变, 推测奥曲肽可能总体上能够调节细胞因子的网络平衡, 即抑制促炎细胞因子(IL-6、TNF-α等)的表达, 促进抗炎细胞因子(IL-10等)的分泌, 使免疫功能恢复正常, 控制持续扩大的炎症反应, 从而减轻大鼠实验性结肠炎的肠道损伤, 达到治疗结肠炎症的目的.
NF-κB作为调节细胞基因转录的关键因子, 在机体免疫应答、炎症反应等方面发挥着重要作用[26-27]. 研究发现, 已有100余种基因(包括细胞因子, 黏附分子, 免疫性受体, 促、抑凋亡蛋白等)均可被NF-κB调控[28-29]. 在正常情况下, NF-κB以二聚体形式与抑制蛋白(IκB)结合成复合物潜伏于细胞质中、无活性. 当炎性细胞受到如TNF-α等细胞外信号刺激时, 可导致NF-κB的活化, NF-κB激活后又可增强TNF-α、IL-6等细胞因子的基因转录, 使TNF-α、IL-6等细胞因子产生和释放增多以及炎性细胞的激活, 从而进一步激活NF-κB, 由此形成一个正反馈调节, 进而导致UC炎症和黏膜的损伤. 已有研究[30]显示, NF-κB与UC关系密切. 在UC中NF-κB被诱导剂激活, 调节炎症递质的产量, 进而导致UC炎症和黏膜的损伤[31]. 因此, NF-κB在UC的病理生理过程中可能起枢纽作用. 本研究发现, UC模型大鼠结肠组织NF-κB p65表达显著高于对照组, 表明TNBS所致大鼠UC的发生与NF-κB的高表达密切相关, 治疗组结肠组织中NF-κB p65表达显著低于模型对照组, 显示奥曲肽对UC大鼠模型过度激活的NF-κB有抑制作用. 因此, 我们可以推测在UC的发病过程中, NF-κB活化在复杂的细胞因子网络失调中可能是一中心环节.
本研究说明奥曲肽具有一定的止泻、抗炎和减轻肠黏膜损伤的作用, 从而能有效防止大鼠实验性结肠炎的发生及发展. 其作用机制可能与其通过影响炎症反应的信号通路NF-κB的活化, 进而下调促炎细胞因子及上调抗炎细胞因子的产生和表达有关. 但NF-κB在UC中的具体作用机制尚不十分清楚, NF-κB在UC中活化以及对细胞因子表达调控的具体过程等尚有待于进一步研究.
生长抑素抑制消化系血流及抑制炎症介质的产生, 同时对免疫系统也有多种调节作用. 本研究应用生长抑素类似物奥曲肽治疗溃疡性结肠炎大鼠模型, 初步探讨其对肠道炎性损伤的治疗作用.
程斌, 副教授, 华中科技大学同济医学院附属同济医院消化内科.
溃疡性结肠炎是病因未明, 传统药物疗效不甚理想, 至今还没有理想的治疗方法, 筛选高效低毒的抗炎药物一直是该领域的研究热点.
国内曾有生长抑素治疗激素依赖型重度溃疡性结肠炎的成功报道, 但其确切治疗机制不明确.
本研究为生长抑素治疗溃疡性结肠炎提供了理论依据. 特别是对激素耐药、顽固性复发性、重症UC患者, 通过生长抑素的使用可使激素逐渐减量甚至停用, 避免激素长期使用的不良反应, 为此类UC患者的治疗开辟新的途径.
奥曲肽具有一定的止泻、抗炎和减轻肠黏膜损伤的作用, 从而能有效防止大鼠实验性结肠炎的发生及发展.
本实验设计合理, 方法科学, 结论明确, 对溃疡性结肠炎临床治疗有一定指导意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] |
| 2. | Brazeau P, Vale W, Burgus R, Ling N, Butcher M, Rivier J, Guillemin R. Hypothalamic polypeptide that inhibits the secretion of immunoreactive pituitary growth hormone. Science. 1973;179:77-79. [PubMed] [DOI] |
| 4. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 6. | Lehmann FS. [Pathophysiology of inflammatory bowel disease]. Ther Umsch. 2003;60:127-132. [PubMed] [DOI] |
| 7. | Sartor RB. Cytokines in intestinal inflammation: pathophysiological and clinical considerations. Gastroenterology. 1994;106:533-539. [PubMed] |
| 9. | Indaram AV, Visvalingam V, Locke M, Bank S. Mucosal cytokine production in radiation-induced proctosigmoiditis compared with inflammatory bowel disease. Am J Gastroenterol. 2000;95:1221-1225. [PubMed] [DOI] |
| 10. | 胡 仁伟, 欧阳 钦. 细胞因子与炎症性肠病. 国外医学·消化系疾病分册. 1998;18:146-149. |
| 11. | Schmid RM, Adler G. NF-kappaB/rel/IkappaB: implications in gastrointestinal diseases. Gastroenterology. 2000;118:1208-1228. [PubMed] [DOI] |
| 16. | Podolsky DK. Inflammatory bowel disease (1). N Engl J Med. 1991;325:928-937. [PubMed] |
| 18. | Atreya R, Neurath MF. Involvement of IL-6 in the pathogenesis of inflammatory bowel disease and colon cancer. Clin Rev Allergy Immunol. 2005;28:187-196. [PubMed] [DOI] |
| 19. | Kitamura K, Nakamoto Y, Kaneko S, Mukaida N. Pivotal roles of interleukin-6 in transmural inflammation in murine T cell transfer colitis. J Leukoc Biol. 2004;76:1111-1117. [PubMed] [DOI] |
| 23. | Wichan P, Chojnacki J, Wojtuń S. [Immunotherapy of inflammatory bowel diseases]. Pol Merkur Lekarski. 2004;17 Suppl 1:40-43. [PubMed] |
| 24. | 张 延龄. 炎性肠道疾病的免疫治疗. 国外医学·外科学分册. 2002;29:356-358. |
| 25. | Li MC, He SH. IL-10 and its related cytokines for treatment of inflammatory bowel disease. World J Gastroenterol. 2004;10:620-625. [PubMed] |
| 26. | Baldwin AS Jr. Series introduction: the transcription factor NF-kappaB and human disease. J Clin Invest. 2001;107:3-6. [PubMed] [DOI] |
| 27. | Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001;107:7-11. [PubMed] [DOI] |
| 28. | Dikopoulos N, Schmid RM, Bachem M, Buttenschoen K, Adler G, Chiang JY, Weidenbach H. Bile synthesis in rat models of inflammatory bowel diseases. Eur J Clin Invest. 2007;37:222-230. [PubMed] [DOI] |
| 29. | Abreu MT, Vora P, Faure E, Thomas LS, Arnold ET, Arditi M. Decreased expression of Toll-like receptor-4 and MD-2 correlates with intestinal epithelial cell protection against dysregulated proinflammatory gene expression in response to bacterial lipopolysaccharide. J Immunol. 2001;167:1609-1616. [PubMed] |
| 30. | Nosti-Escanilla MP, Pena AS. [NF-kappa B and inflammatory intestinal diseases]. Rev Esp Enferm Dig. 1998;90:113-119. [PubMed] |