修回日期: 2009-05-28
接受日期: 2009-06-08
在线出版日期: 2009-06-18
目的: 探讨p38MAPK在Bip蛋白介导的体外轻度热应激大鼠巨噬细胞功能改变中的信号作用.
方法: p38MAPK抑制剂预处理大鼠脾脏巨噬细胞, 将细胞置于41 ℃恒温箱中, 使细胞轻度热应激, 1 h后恢复到37 ℃(抑制组), 以未应激(对照组)和41 ℃热应激1 h后60 min巨噬细胞(应激组)为对照, 分别检测3组巨噬细胞吞噬、杀伤、趋化功能, 同时检测p38MAPK蛋白和Bip蛋白的表达.
结果: p38MAPK抑制剂预处理大鼠脾脏巨噬细胞, 与应激组比较, 轻度热应激后巨噬细胞吞噬、趋化和杀伤活性明显降低(0.17±0.01 vs 0.74±0.03, 33.32±3.55 vs 82.07±5.17, 24.20%±2.39% vs 60.80%±4.02%, 均P<0.01); 应激组p38MAPK蛋白表达明显上调, p38MAPK抑制剂预处理后, 抑制组p38 MAPK蛋白表达受到抑制, 与应激组比较差异有显著性(p38/β-actin: 2.863±0.794 vs 4.752±1.386, P<0.01); Bip蛋白的表达(Bip/β-actin)也因p38MAPK抑制剂预处理而由应激组的1.270±0.535降至抑制组的1.028±1.061(P<0.05).
结论: p38MAPK抑制剂可显著抑制轻度热应激大鼠巨噬细胞吞噬、趋化和杀伤功能以及p38MAPK和Bip蛋白的表达.
引文著录: 黄长文, 蔡成行, 李光明, AqeelAhmed, 李惠珍, 傅华群. p38MAPK对轻度热应激大鼠脾脏巨噬细胞免疫功能的影响. 世界华人消化杂志 2009; 17(17): 1720-1725
Revised: May 28, 2009
Accepted: June 8, 2009
Published online: June 18, 2009
AIM: To investigate the role of p38MAPK in Bip protein-mediated functional changes of mild heat stressed rat splenic macrophages in vitro.
METHODS: Rat splenic macrophages were pretreated with p38MAPK inhibitor and placed into 41 ℃ incubator for mild heat stress. One hour later, temperature was restored to 37 ℃ in inhibition group. Non stressed rat spleen macrophages were assigned to the control group, and macrophages which was heat stressed at 41 ℃ for 1 h (stress group) were used as controls, too. Three groups were detected for macrophage phagocytosis, cytotoxicity and chemotaxis. At the same time p38MAPK protein and Bip protein expressions were detected.
RESULTS: p38MAPK inhibitor pretreated rat splenic macrophages, when compared with the stress group, their phagocytosis, cytotoxicity and chemotaxis were significantly lowered after mild heat stress (0.17 ± 0.01 vs 0.74 ± 0.03, 33.32 ± 3.55 vs 82.07 ± 5.17, 24.20% ± 2.39% vs 60.80% ± 4.02%, all P < 0.01). In stress group p38MAPK protein expressions were significantly increased; compared with the stress group, p38MAPK protein expressions were significantly inhibited after p38MAPK inhibitor pretreatment in inhibition group (p38/β-actin: 2.863 ± 0.794 vs 4.752 ± 1.386, P < 0.01). p38MAPK inhibitor pretreatment also caused changes in Bip protein expressions (Bip/β-actin) in the stress group from 1.2702 ± 0.5345 dropped to 1.0281 ± 1.0614 in inhibition group (P < 0.05).
CONCLUSION: p38 inhibitors can significantly inhibit mild heat stressed rat splenic macrophage phagocytosis, cytotoxicity and chemotaxis, which inhibit p38MAPK and Bip protein expressions.
- Citation: Huang CW, Cai CH, Li GM, Ahmed A, Li HZ, Fu HQ. Effect of p38MAPK on immunofunction of spleen macrophages from heat stressed rats. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1720-1725
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1720.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1720
丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)家族是介导细胞反应的重要信号系统, 普遍存在于多种生物中. 目前在哺乳动物中大约已鉴定出5类MAPKs, p38MAPK被认为是细胞众多信号转导通路的中转站. 细胞外多种应激原, 如放射线、紫外线、热休克、高渗液和促炎因子(如TNF-α, IL-1)等都可激活p38MAPK通路, 从而引起细胞内蛋白激酶的连锁反应, 影响细胞的转录、蛋白合成和细胞表面受体表达等生物效应[1]. 热休克反应是一个保守的细胞应激反应, 在保护细胞免受刺激损伤和自我防御等方面具有重要作用. 已有实验表明, 轻度热应激对某些细胞的功能起到促进作用, 我们的实验已经证实, 轻度热应激(41 ℃、1 h)可以使脾脏巨噬细胞的吞噬功能、杀伤活性和趋化作用明显增强, 并能促进脾脏巨噬细胞分泌细胞因子TNF-α和IL-12, 体现出轻度热应激对脾脏巨噬细胞功能有很强的促进作用; 而且, 我们的实验还发现Bip蛋白在此过程起到重要的调节作用[2]. p38MAPK参与应激细胞功能调节的研究很多, 但p38MAPK信号通路是否参与Bip介导的热应激脾脏巨噬细胞功能改变的调节, 尚不清楚. 本文通过研究p38MAPK信号通路对轻度热应激后巨噬细胞功能的调节, 为进一步探讨热应激对巨噬细胞的影响及其信号传导机制奠定基础.
健康SD大鼠, 雌雄不限, 体质量180-220 g购自南昌大学医学院实验动物部. PBS液, 用干粉剂(Gbico, 美国)自行配制, RPMI 1640, 用干粉剂(Sigma, 美国)自行配制, 其中加入链霉素、青霉素各1×105 U/L, Tris-NH4Cl(NH4Cl 3.735 g, Tris 1.03 g加水溶解至500 mL), 以上液体配好后, 均抽滤除菌(双层滤膜, 孔径为0.22 μm和0.45 μm)除菌, 胎牛血清(Hyclone公司, 美国)按照100 mL/L比例加入到RPMI 1640中. 中性红(Amresco公司), MCP-1(PeproTech公司), L1210细胞(南京凯基公司), 瑞-姬氏染液(南京凯基公司), p38MAPK抑制剂SB203580购自Sigma公司. 兔抗大鼠Bip抗体(长沙Abzoom), 兔抗p38多克隆抗体(Santa Cruz, 美国), CO2恒温培养箱(Napco-5410型), 相差显微镜(cdic xds-1b型), 大型坐式离心机(LXJ-Ⅱ型, 上海), Transwell趋化小室(Corning公司).
1.2.1 脾脏巨噬细胞的分离与培养: 大鼠腹腔注射100 g/L水合氯醛(4 mL/kg), 麻醉后处死. 无菌取脾, 剪碎脾脏组织, 然后用50 mL注射器针芯在200目的不锈钢网上研磨组织块, 充分释放脾细胞. 收集脾细胞悬液, RPIM 1640洗涤离心(1000 r/min, 5 min), Tris-NH4Cl按照与沉淀体积5-10:1比例作用5 min, 裂解红细胞. 迅速离心(1000 r/min, 5 min), 去除上清液内的裂解红细胞碎片, PBS洗涤离心3次, RPIM 1640洗涤离心1次, 用含有100 mL/L FBS的RPIM 1640培养基重悬沉淀, 接种于一次性塑料培养瓶中, 在37 ℃, 50 mL/L CO2, 饱和湿度中分别培养过夜后, 弃培养液, 用PBS液小心洗涤未贴壁细胞, 得到较纯的脾脏巨噬细胞. 经瑞-姬氏染色鉴定巨噬细胞纯度>90%, 台盼蓝染色显示细胞存活率>95%.
1.2.2 脾脏巨噬细胞吞噬功能检测: 原代培养的脾巨噬细胞(方法同上), 调整细胞浓度2×109/L, 加入96孔细胞培养板中, 每孔100 μL. 待细胞过夜贴壁后, 弃上清重新加入培养基. 对照组(细胞始终处于37 ℃), 应激组(细胞置于41 ℃恒温箱中1 h), p38抑制剂+应激(p38抑制剂组)细胞中加入10 μL(浓度10 μmoL/L)p38MAPK抑制剂SB203580作用30 min后, 置于41 ℃恒温箱中1 h, 恢复到37 ℃. 均在恢复到37 ℃后60 min检测吞噬功能. 每组6个复孔, 每孔加入100 μL 0.072%中性红, 30 min后弃去中性红, 用PBS洗3次. 每孔加入细胞溶解液(乙酸:无水乙醇 = 50:50)100 μL, 静置过夜, 于酶标仪测A540nm值.
1.2.3 脾脏巨噬细胞杀伤活性检测: 原代培养的脾巨噬细胞(方法同上), 调整细胞浓度2×109/L, 加入96孔细胞培养板中, 每孔100 μL. 待细胞过夜贴壁后, 弃上清重新加入培养基. 分组同上, 恢复到37 ℃, 60 min后检测杀伤活性. 每组六个复孔, 每孔再加入1×108/L的L1210细胞(每孔100 μL校靶比为10:1), 每个样品设6个复孔, 同时设L1210细胞对照. 于37 ℃作用24 h后, 振荡培养板, 使L1210细胞充分悬浮, 每孔吸取100 μL的L1210细胞加入另一个96孔板中, 加入20 μL/孔MTT(5 g/L), 继续培养4 h, 加入DMSO, 10 min后于酶标仪上检测A472 nm值. 杀伤活性按下式计算: 杀伤活性(%) = (1-与巨噬细胞作用后的L1210细胞A值/对照L1210细胞A值)×100%.
1.2.4 脾脏巨噬细胞趋化实验检测: 原代培养的脾巨噬细胞(方法同上), 调整细胞浓度1×1010/L, 待细胞过夜贴壁后, 弃上清重新加入培养基, 将细胞置于41 ℃恒温箱中1 h, 分别在热应激后0、30、60、120、180 min用于MHC抗原的检测, 收集巨噬细胞悬液, 加入PBS, 250 g离心10 min, 弃上清, 重复2次. 每管加入100 μL PBS液. 让后加入10 μm FITC标记的抗MHC-Ⅱ抗体(阴性对照加等量缓冲液), 混匀, 4 ℃避光孵育30 min, 最后加入缓冲液0.5 mL, 细胞浓度为2×106, 流式细胞仪检测. 趋化下室加入600 μL含MCP-1(浓度为10 μg/L)的RPMI 1640的培养液. 将趋化小室放入CO2孵箱中孵育90 min. 弃去上室液体, 小心取出上室, 用湿棉签擦去膜上未穿过膜的细胞. 将下层黏附的细胞经瑞-姬氏染色后, 在高倍镜下观察, 每孔随机计数5个视野中的细胞数目, 实验重复3次. 算出3个复孔的平均值, 作为该组的迁移细胞数.
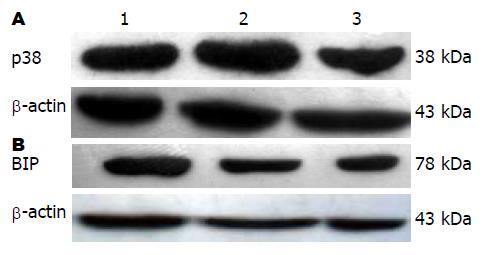
1.2.5 Western blot法测定p38MAPK蛋白表达: 按照蛋白抽提试剂盒抽提每组细胞总蛋白(分组同上), 按Bradford法测量蛋白浓度, 将总蛋白进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE), 电印迹法将凝胶内的蛋白质转至硝酸纤维素膜上, 加入兔抗p38多克隆抗体, 稀释度为1:400, 4 ℃, 孵育20 h. 然后加入辣根过氧化物酶标记的羊抗兔IgG(稀释度1:200) , 室温孵育1 h . TBST洗涤后, ECL显影, X线曝光显影, 用Image Tool 3图像分析软件对蛋白条带进行分析.
1.2.6 Western blot法测定Bip蛋白表达: 按照蛋白抽提试剂盒抽提每组细胞总蛋白, 按Bradford法测量蛋白浓度, 将总蛋白进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE), 电印迹法将凝胶内的蛋白质转至硝酸纤维素膜上, 用含50 g/L脱脂奶粉的TBST溶液室温封闭1.5 h, 再分别与一抗(1:200兔抗大鼠Bip单抗)4 ℃孵育过夜, 用TBST溶液洗脱3次, 再与二抗(1:500HRP标记的山羊抗兔IgG)室温孵育1.5 h, 以TBST溶液洗脱3次后与ECL试剂反应1 min后, X线曝光显影, 用Image Tool 3图像分析软件对蛋白条带进行分析.
统计学处理 计量数据结果以mean±SD表示, 采用SPSS13.0软件进行方差分析及t检验, P<0.05有统计学意义.
在轻度热应激后60 min, 应激组巨噬细胞吞噬功能、杀伤活性、趋化作用较其他2组明显增强, 差异非常显著(均P<0.01). p38MAPK抑制剂预处理大鼠脾脏巨噬细胞后, 与单纯热应激组比较, 热应激后巨噬细胞吞噬、趋化和杀伤活性明显降低(均P<0.01), 与对照组比较无显著差异(均P>0.05, 表1).
检测各组巨噬细胞p38MAPK和Bip蛋白的表达, 在轻度热应激后60 min, 单纯应激组巨噬细胞p38MAPK蛋白的表达较其他2组明显上调, 差异有显著性(p38/β-actin: 4.752±1.386 vs1.373±0.457, 2.863±0.794, 均P<0.01). p38MAPK抑制剂预处理大鼠脾脏巨噬细胞后, 与单纯热应激组比较, 热应激后巨噬细胞Bip蛋白的表达明显下调(1.028±1.061 vs 1.270±0.535, P<0.05), 但与对照组(0.8276±0.7432)比较仍明显上调(P<0.05, 图1).
生物体内几乎所有重要的生命活动都与细胞内信号转导系统有关, MAPK是信号从细胞表面传导到细胞核内部的重要传递者[3], 目前在哺乳动物中大约已鉴定出5类MAPKs, 分别是ERK1/2(extracellular signal-regulated kinases), JNK1/2/3(c-Jun amino-terminal kinases), p38 α、β、γ、δ, ERK3/4和ERK5. MAPKs除参与了胚胎发育、细胞分化、细胞增殖和细胞死亡的过程外[4-5], 还和许多疾病的发生有直接或间接的关系, 如肿瘤、炎症、脑血管疾病及糖尿病等[6-9]. 同时MAPKs也是先天性免疫系统的重要组成部分, An et al在人类黑色素瘤细胞A3752S2凋亡的实验中, 发现PKC能够激活JNK和p38MAPK,进而促进人类黑色素瘤细胞凋亡[10], 而体内和体外实验都证实p38MAPK对CD4 T细胞的功能有影响, 抑制p38MAPK可能对人类自身免疫性疾病产生意料不到的后果[11]. 另有研究发现p38MAPK、ERK信号通路与神经系统疾病的病理生理有密切关系[12]. 众多证据表明, MAPKs通路的激活对正常的免疫和炎症反应至关重要, 在LPS刺激时, p38被激活从而上调TNF、uPA、COX-2、IL-6和IL-8等炎症相关基因的表达. Li et al[13]研究发现, 当病原菌感染后MAPK通路被抑制, 进而抑制先天性免疫应答信号的激活, 增强病原菌的侵袭感染能力. 以上研究结果说明MAPKs信号传导机制的复杂性, 即不同的细胞外刺激可激活不同的MAPK信号通路, 作用于不同的底物, 引起特定的细胞生理反应. 因此, 可以说MAPKs信号转导途径是细胞信号转导网络的核心.
p38MAPK信号转导通路能被细胞应激(渗透压, 休克, 热休克, 缺血, 缺氧等)、机械损伤以及炎性细胞因子等激活并参与细胞的应激反应[14-17], 参与提高细胞或机体对应激环境的耐受性[18-22]以保证细胞或者机体功能的完整性[23-24]. p38MAPK还可以通过磷酸化低相对分子质量热休克蛋白HSP27而参与对心肌的保护作用[25-26].
MAPK在调节HSP对应激及肿瘤、感染等疾病的反应中所起的作用已经有大量的文献报道. TNF-α引起的促炎症反应中, HSP通过MAPK途径对此反应产生抑制效应[27]; Bip是HSP中的成员, 是对内质网应激具有很好的保护作用的一种应激蛋白, 对细胞的存亡往往起到关键性作用[28], 甚至对植物种子热耐受都至关重要[29]. 由于内质网应激与肿瘤的生长有关, MAPK甚至可以通过上调Bip表达而使肿瘤细胞免于受到如化疗等应激所导致的打击而导致肿瘤耐药[30]. 在经过胰岛素处理的小鼠腹腔巨噬细胞细胞中, 由于能够激活Bip及MAPK等信号而促进巨噬细胞的生存[31].
p38MAPK在体外热应激实验中被激活已有大量的研究[32-33], Bip蛋白在热应激中的作用也已经有文献报道[34]. 为了研究何种机制参与了热应激后巨噬细胞功能的变化以及进一步确定MAPK信号通路是否介导了热应激对巨噬细胞功能的调节, 我们用p38MAPK信号通路抑制剂预处理小鼠脾脏巨噬细胞后于41 ℃恒温箱中热应激1 h, 然后分别检测各组巨噬细胞功能的变化. 结果发现单纯热应激后, 巨噬细胞吞噬、杀伤、趋化功能明显增强, 给予p38MAPK信号通路抑制剂SB203580后, 因轻度热应激而引起的p38MAPK蛋白的上调受到明显的抑制; 虽抑制不完全, 但抑制剂SB203580预处理后, 轻度热应激引起的巨噬细胞吞噬功能、杀伤活性和趋化功能明显降低, 而且巨噬细胞因轻度热应激而导致的Bip蛋白上调也受到明显的抑制. 本实验结果提示p38MAPK通路参与了轻度热应激后Bip蛋白介导的对巨噬细胞功能的调节. 由此可见MAPK信号转导通路与脾脏巨噬细胞免疫功能有密切关系. 因此了解MAPK信号转导通路对巨噬细胞免疫功能的调节机制, 有助于理解轻度热应激后的巨噬细胞在感染和肿瘤免疫中的作用机制.
巨噬细胞作为机体对抗入侵病原体第一道防线, 在先天性免疫中发挥着重要作用. 巨噬细胞同时他也是一类重要的专职抗原呈递细胞, 通过分泌细胞因子、细胞表面共刺激分子、MHC分子等调节特异免疫应答反应, 包括体液免疫和细胞免疫. 巨噬细胞将先天性免疫和获得性免疫应答反应有机结合起来, 在先天性免疫和获得性免疫中起着重要的桥梁作用, 因此研究轻度热应激状态下巨噬细胞内信号转导通路活性的变化及其作用, 对于探索轻度热应激对巨噬细胞功能的影响机理有重要意义. 有关热应激对免疫系统的调节机制的研究已取得较大进展, 但由于信号转导通路是多样及可控的[35], 因此目前在热应激对基础研究及临床应用方面尚有多层次和高度复杂的课题等待突破.
目前许多学者正在寻找增强机体免疫力的新方法[36], 期望通过深入研究解热应激对免疫细胞的调节机制, 有效调控免疫细胞的功能,从而对肿瘤及感染的治疗提供新的方法和思路.
脾脏巨噬细胞是血脾屏障的重要组成部分, 无论是在血脾屏障的机械屏障还是生物屏障中均发挥至关重要的作用. 有关血脾屏障的研究还比较表浅, 血脾屏障在如肝硬化、肝癌发展的不同阶段等病理状态下的改变和作用如何?怎样调控血脾屏障等等诸多问题还未解决. 脾脏巨噬细胞无论在先天性还是获得性免疫反应中都居有重要的地位, 是机体的最重要的免疫细胞之一. 目前, 不断有对免疫细胞功能调控的探讨和研究.
李靖, 副教授, 重庆市第三军医大学附属新桥医院肝胆外科
严重的应激对细胞功能往往产生损伤性改变, 在应激过程中, 内质网应激对细胞功能改变起关键性作用.
Park et al利用轻度热应激提升细胞的功能, 促进先天性和获得性免疫力, 提高树突状细胞的抗原提呈作用; Hatzfeld-Charbonnier et al使用轻度热应激结合树突状细胞接种疫苗以增加抗肿瘤反应. 但有关轻度热应激对脾脏巨噬细胞功能影响的研究还未见报道. Bip是最主要的ER伴侣, 参与蛋白质的运输、折叠和降解, 他可以被各种应激条件诱导合成, 在应激引起的内质网反应中起到重要作用.
本文首次探讨轻度热应激对体外脾脏巨噬细胞功能的影响及Bip在其中的作用, 进而探讨p38MAPK信号在其中的作用.
本研究对进一步探讨脾脏巨噬细胞及其他细胞的调控方式及其机制提供参考, 并为探讨血脾屏障的调控奠定基础.
轻度热应激: 一般将相当于机体高热时的体温(高于正常体温的3-5 ℃, 即41 ℃上下)对机体产生的应激看成为轻度热应激.
本文选题新颖, 设计合理, 对揭示热应激促进巨噬细胞免疫功能的机制有一定帮助, 并有助于认识轻度热应激后的巨噬细胞在感染或肿瘤免疫中的作用机制.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Roux PP, Blenis J. ERK and p38 MAPK-activated protein kinases: a family of protein kinases with diverse biological functions. Microbiol Mol Biol Rev. 2004;68:320-344. [PubMed] [DOI] |
| 3. | Slack BE, Siniaia MS. Adhesion-dependent redistribution of MAP kinase and MEK promotes muscarinic receptor-mediated signaling to the nucleus. J Cell Biochem. 2005;95:366-378. [PubMed] [DOI] |
| 4. | Cowan KJ, Storey KB. Mitogen-activated protein kinases: new signaling pathways functioning in cellular responses to environmental stress. J Exp Biol. 2003;206:1107-1115. [PubMed] [DOI] |
| 5. | Troemel ER, Chu SW, Reinke V, Lee SS, Ausubel FM, Kim DH. p38 MAPK regulates expression of immune response genes and contributes to longevity in C. elegans. PLoS Genet. 2006;2:e183. [PubMed] [DOI] |
| 6. | Zhang YL, Dong C. MAP kinases in immune responses. Cell Mol Immunol. 2005;2:20-27. [PubMed] |
| 7. | Lennmyr F, Karlsson S, Gerwins P, Ata KA, Terént A. Activation of mitogen-activated protein kinases in experimental cerebral ischemia. Acta Neurol Scand. 2002;106:333-340. [PubMed] [DOI] |
| 8. | El-Remessy AB, Tang Y, Zhu G, Matragoon S, Khalifa Y, Liu EK, Liu JY, Hanson E, Mian S, Fatteh N. Neuroprotective effects of cannabidiol in endotoxin-induced uveitis: critical role of p38 MAPK activation. Mol Vis. 2008;14:2190-2203. [PubMed] |
| 9. | Elsea CR, Roberts DA, Druker BJ, Wood LJ. Inhibition of p38 MAPK suppresses inflammatory cytokine induction by etoposide, 5-fluorouracil, and doxorubicin without affecting tumoricidal activity. PLoS ONE. 2008;3:e2355. [PubMed] [DOI] |
| 10. | An WW, Wang MW, Tashiro S, Onodera S, Ikejima T. Mitogen-activated protein kinase-dependent apoptosis in norcan-tharidin-treated A375-S2 cells is proceeded by the activation of protein kinase C. Chin Med J (Engl). 2005;118:198-203. [PubMed] |
| 11. | Dodeller F, Schulze-Koops H. The p38 mitogen-activated protein kinase signaling cascade in CD4 T cells. Arthritis Res Ther. 2006;8:205. [PubMed] [DOI] |
| 12. | Irving EA, Bamford M. Role of mitogen- and stress-activated kinases in ischemic injury. J Cereb Blood Flow Metab. 2002;22:631-647. [PubMed] [DOI] |
| 13. | Li H, Xu H, Zhou Y, Zhang J, Long C, Li S, Chen S, Zhou JM, Shao F. The phosphothreonine lyase activity of a bacterial type III effector family. Science. 2007;315:1000-1003. [PubMed] [DOI] |
| 14. | Gorostizaga A, Brion L, Maloberti P, Maciel FC, Podestá EJ, Paz C. Heat shock triggers MAPK activation and MKP-1 induction in Leydig testicular cells. Biochem Biophys Res Commun. 2005;327:23-28. [PubMed] [DOI] |
| 15. | Sanlorenzo L, Zhao B, Spight D, Denenberg AG, Page K, Wong HR, Shanley TP. Heat shock inhibition of lipopolysaccharide-mediated tumor necrosis factor expression is associated with nuclear induction of MKP-1 and inhibition of mitogen-activated protein kinase activation. Crit Care Med. 2004;32:2284-2292. [PubMed] |
| 16. | Jones CA, Greer-Phillips SE, Borkovich KA. The response regulator RRG-1 functions upstream of a mitogen-activated protein kinase pathway impacting asexual development, female fertility, osmotic stress, and fungicide resistance in Neurospora crassa. Mol Biol Cell. 2007;18:2123-2136. [PubMed] [DOI] |
| 17. | Chen RE, Thorner J. Function and Regulation in MAPK Signaling Pathways. Biochim Biophys Acta. 2007;1773:1311-1340. [PubMed] |
| 18. | Thorsen M, Di Y, Tängemo C, Morillas M, Ahmadpour D, Van der Does C, Wagner A, Johansson E, Boman J, Posas F. The MAPK Hog1p modulates Fps1p-dependent arsenite uptake and tolerance in yeast. Mol Biol Cell. 2006;17:4400-4410. [PubMed] [DOI] |
| 19. | Bruchas MR, Land BB, Aita M, Xu M, Barot SK, Li S, Chavkin C. Stress-induced p38 mitogen-activated protein kinase activation mediates kappa-opioid-dependent dysphoria. J Neurosci. 2007;27:11614-11623. [PubMed] [DOI] |
| 20. | Sánchez-Arévalo Lobo VJ, Aceves Luquero CI, Alvarez-Vallina L, Tipping AJ, Viniegra JG, Hernández Losa J, Parada Cobo C, Galán Moya EM, Gayoso Cruz J, Melo JV. Modulation of the p38 MAPK (mitogen-activated protein kinase) pathway through Bcr/Abl: implications in the cellular response to Ara-C. Biochem J. 2005;387:231-238. [PubMed] [DOI] |
| 21. | Lawrence CL, Botting CH, Antrobus R, Coote PJ. Evidence of a new role for the high-osmolarity glycerol mitogen-activated protein kinase pathway in yeast: regulating adaptation to citric acid stress. Mol Cell Biol. 2004;24:3307-3323. [PubMed] [DOI] |
| 22. | Jin Y, Weining S, Nevo E. A MAPK gene from Dead Sea fungus confers stress tolerance to lithium salt and freezing-thawing: Prospects for saline agriculture. Proc Natl Acad Sci USA. 2005;102:18992-18997. [PubMed] [DOI] |
| 23. | Wöll S, Windoffer R, Leube RE. p38 MAPK-dependent shaping of the keratin cytoskeleton in cultured cells. J Cell Biol. 2007;177:795-807. [PubMed] [DOI] |
| 24. | Malago JJ, Koninkx JF, van Dijk JE. The heat shock response and cytoprotection of the intestinal epithelium. Cell Stress Chaperones. 2002;7:191-199. [PubMed] [DOI] |
| 25. | Arnaud C, Joyeux-Faure M, Bottari S, Godin-Ribuot D, Ribuot C. New insight into the signalling pathways of heat stress-induced myocardial preconditioning: protein kinase Cepsilon translocation and heat shock protein 27 phosphorylation. Clin Exp Pharmacol Physiol. 2004;31:129-133. [PubMed] [DOI] |
| 26. | Peter PS, Brady JE, Yan L, Chen W, Engelhardt S, Wang Y, Sadoshima J, Vatner SF, Vatner DE. Inhibition of p38 alpha MAPK rescues cardiomyopathy induced by overexpressed beta 2-adrenergic receptor, but not beta 1-adrenergic receptor. J Clin Invest. 2007;117:1335-1343. [PubMed] [DOI] |
| 27. | Luo X, Zuo X, Zhou Y, Zhang B, Shi Y, Liu M, Wang K, McMillian DR, Xiao X. Extracellular heat shock protein 70 inhibits tumour necrosis factor-alpha induced proinflammatory mediator production in fibroblast-like synoviocytes. Arthritis Res Ther. 2008;10:R41. [PubMed] [DOI] |
| 28. | Zhang K, Kaufman RJ. The unfolded protein response: a stress signaling pathway critical for health and disease. Neurology. 2006;66:S102-S109. [PubMed] [DOI] |
| 29. | Su PH, Li HM. Arabidopsis stromal 70-kD heat shock proteins are essential for plant development and important for thermotolerance of germinating seeds. Plant Physiol. 2008;146:1231-1241. [PubMed] [DOI] |
| 30. | Ranganathan AC, Zhang L, Adam AP, Aguirre-Ghiso JA. Functional coupling of p38-induced up-regulation of BiP and activation of RNA-dependent protein kinase-like endoplasmic reticulum kinase to drug resistance of dormant carcinoma cells. Cancer Res. 2006;66:1702-1711. [PubMed] [DOI] |
| 31. | Misra UK, Pizzo SV. Up-regulation of GRP78 and antiapoptotic signaling in murine peritoneal macrophages exposed to insulin. J Leukoc Biol. 2005;78:187-194. [PubMed] [DOI] |
| 32. | Truman AW, Millson SH, Nuttall JM, Mollapour M, Prodromou C, Piper PW. In the yeast heat shock response, Hsf1-directed induction of Hsp90 facilitates the activation of the Slt2 (Mpk1) mitogen-activated protein kinase required for cell integrity. Eukaryot Cell. 2007;6:744-752. [PubMed] [DOI] |
| 33. | Winkler A, Arkind C, Mattison CP, Burkholder A, Knoche K, Ota I. Heat stress activates the yeast high-osmolarity glycerol mitogen-activated protein kinase pathway, and protein tyrosine phosphatases are essential under heat stress. Eukaryot Cell. 2002;1:163-173. [PubMed] [DOI] |
| 34. | Cho S, Park SM, Kim TD, Kim JH, Kim KT, Jang SK. BiP internal ribosomal entry site activity is controlled by heat-induced interaction of NSAP1. Mol Cell Biol. 2007;27:368-383. [PubMed] [DOI] |
| 35. | Murphy LO, Blenis J. MAPK signal specificity: the right place at the right time. Trends Biochem Sci. 2006;31:268-275. [PubMed] [DOI] |
| 36. | Hatzfeld-Charbonnier AS, Lasek A, Castera L, Gosset P, Velu T, Formstecher P, Mortier L, Marchetti P. Influence of heat stress on human monocyte-derived dendritic cell functions with immunotherapeutic potential for antitumor vaccines. J Leukoc Biol. 2007;81:1179-1187. [PubMed] [DOI] |