修回日期: 2009-05-22
接受日期: 2009-05-25
在线出版日期: 2009-06-18
目的: 研究携带Slug-siRNA的rAAV对裸鼠体内胰腺癌的作用.
方法: 建立人胰腺癌裸鼠皮下移植瘤模型, 2 wk后随机将建模成功的裸鼠分为3组, 每组6只. 构建携带Slug-siRNA的rAAV载体, 采用瘤体内多点注射的方法, 阴性对照组裸鼠按1×109 puf(50 µL)标准注射rAAV-EGFP, 空白对照组裸鼠注射等量生理盐水, 实验组裸鼠按1×109 puf(50 µL)标准注射rAAV2-EGFP-slug-siRNA, 只注射1次. 观察裸鼠的一般情况, 摄食, 活动能力, 每周用电子天平秤体质量, 绘制裸鼠生长曲线. 治疗6 wk后二氧化碳吸入法处死裸鼠, 切取肿瘤称质量; 免疫组织化学SP法检测slug蛋白的表达, TUNEL检测皮下移植瘤细胞凋亡, 透射电镜检测细胞超微结构.
结果: 3组裸鼠分别接受不同的处理后, 在开始的2 wk皮下移植瘤的生长无明显差别, 2 wk以后, 实验组裸鼠皮下移植瘤的体积增长明显滞后于阴性对照组和空白对照组, 差异有统计学意义(P<0.05). 治疗6 wk后, 实验组裸鼠皮下移植瘤的质量明显轻于阴性对照组和空白对照组差异有统计学意义(3.26±0.48 g vs 7.56±1.25 g, 7.50±1.23 g, 均P<0.05). 实验组裸鼠皮下移植瘤的AI值明显高于阴性对照组和空白对照组, 差异有统计学意义(0.27±0.06 vs 0.024±0.01, 0.025±0.01, 均P<0.05); 实验组的抑瘤率明显高于阴性对照组, 差异有统计学差异(71.4% vs 0.04%, P<0.01). 透射电镜下, 实验组肿瘤细胞可见细胞器结构模糊, 核固缩, 染色质边集等现象. 免疫组织化学检测示实验组Slug表达明显减少.
结论: Slug基因被有效沉默, Slug基因沉默后促进细胞凋亡, 抑制胰腺癌实体瘤增殖和生长.
引文著录: 欧树安, 张克君, 严明总, 王齐全. Slug-siRNA干扰Slug基因表达对胰腺癌的抑制作用. 世界华人消化杂志 2009; 17(17): 1713-1719
Revised: May 22, 2009
Accepted: May 25, 2009
Published online: June 18, 2009
AIM: To study the effect on pancreatic cancer in rats of rAAV carrying Slug-siRNA to interfere Slug gene expression.
METHODS: A model of subcutaneous tumor was generated through injection of human pancreatic cancer cells BxPC-3 into the nude mice, two weeks later, the nude mice were divided into 3 groups randomly with 6 per group. A recombinant adeno-associated virus vector containing Slug-siRNA gene (rAAV-Slug-siRNA) was constructed. By continuous infusions over 14 d, in negative controls, 1 × 109 puf (50 µL) rAAV-EGFP was injected, while in black controls, 50 µL normal saline was given, in experimental groups, 1 × 109 puf (50 µL) rAAV2-EGFP-slug-siRNA was injected. The general condition, feeding, activities of the rats, and weight were observed. The growth curve of the rats was drawn. After 6 wk, the rats were killed with CO2, and tumor tissues were cut off and weighed. The expression of Slug protein was detected using the IHC SP method, the apoptosis was detected by TUNEL, and the ultrastructure was detected with TEM.
RESULTS: In the beginning of 2 wk, not any apparent growth change was found in three groups. But 2 wk later, the tumor grew slowly in experimental groups than in negative controls and blank controls (P < 0.05). After treatment of 6 wk, the tumor weight in experimental groups was lower than in negative control group or than blank controls group (3.26 ± 0.48 g vs 7.56 ± 1.25 g, 7.50 ± 1.23 g, all P < 0.05). The AI was significant higher in experimental group than in the negative control group or blank control group (0.27 ± 0.06 vs 0.024 ± 0.01, 0.025 ± 0.01, all P < 0.05). The inhibitory rate was 71.4% in the experimental group, and 0.04% in the negative group, showing a significant difference (P < 0.01). Under TEM, the organelle had fuzzy structure, and karyopyknosis, chromatin margination was found in tumor cells in experimental group. The expression of Slug was down-regulated in experimental groups.
CONCLUSION: RNAi-mediated Slug gene with rAAV silencing could transfect to pancreatic cancer cells and silence Slug effectively and selectively, which results in the growth and proliferation inhibition in pancreatic cancer in vivo.
- Citation: Ou SA, Zhang KJ, Yan MZ, Wang QQ. Inhibitory effect of Slug gene silencing with siRNA on pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1713-1719
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1713.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1713
Slug是转录因子Snail家族中编码锌指蛋白的基因. 最初发现, Slug在背部神经管表达, 参与神经胚的形成与神经干的正常发育[1]. 后来发现, Slug在多种恶性肿瘤中存在明显上调, Slug上调的肿瘤容易出现远处转移、较深的肿瘤浸润深度和较差的预后[2-10]. Pérez-Mancera et al[11]最近报道了Slug转染可诱导实验鼠恶性间充质细胞瘤的(白血病, 肉瘤)发生, 说明Slug与肿瘤的发生有关. Hotz et al[12]最近报道, Slug在正常胰腺组织中无表达, 而在胰腺癌组织中的阳性表达率为50%, 浸润转移的组织中Slug表达更明显, 所以, 胰腺癌转移与Slug基因上调相关. 以往研究发现[13], Slug-siRNA干扰slug表达促进体外胰腺癌细胞生长, 并增强细胞对放射治疗的敏感性. 本研究将构建rAAV2-EGFP-Slug-siRNA载体, 探讨rAAV2-Slug-siRNA对胰腺癌实体瘤生长的作用.
健康纯种BALB/c-nu/nu ♀裸鼠(上海SLAC实验动物公司), 周龄4 wk, 体质量18-22 g; BxPC-3细胞株, TUNEL试剂盒(Roche公司), Slug-shRNA-1质粒由海口市人民医院王齐全副教授惠赠. H600透射电镜(Hitachi公司), 金黄地鼠肾细胞BHK-2(上海细胞研究所).
1.2.1 分组: 实验动物在海南医学院动物实验中心SPF级饲养, 称质量, 编号. 实验对象共分为3组: 阴性对照组, 空白对照组和实验组.
1.2.2 人胰腺癌细胞株BxPC-3的扩大培养与收集: BxPC-3细胞常规培养. 取对数生长期的BxPC-3细胞, 0.25% Trypsin-EDTA消化收集后, 移入75 mL培养瓶中扩大培养, 培养条件同前. 将扩大培养的BxPC-3细胞用0.25% Trypsin-EDTA消化, 计数细胞, 1000 r/min离心5 min, 弃上清, 细胞沉淀用无血清的高糖DMEM液洗涤2次, 1000 r/min离心5 min, 用无血清的高糖DMEM液重悬制成1×1011个/L的细胞悬液.
1.2.3 病毒包装: 建立BHK/Slug-siRNA细胞株, 将BHK/Slug-siRNA移至转瓶培养, 培养液为每个转瓶200 mL含15% FBS的RPMI 1640培养液. 细胞长满后(约为8×108个细胞)将培养液倾出, 加HSV1-rc/ΔUL2(MOI = 1.0), 低速转动吸附病毒2 h. 每个转瓶加200 mL无血清RPMI 1640培养液37 ℃低速转动培养. 24 h后, 将每个转瓶中的液体弃去100 mL, 继续培养24 h待细胞完全病变、容易脱落. 盖紧瓶盖剧烈振摇, 将瓶壁上的细胞全部洗脱至培养液中, 2000 r/min离心10 min去细胞碎片, 所得病毒命名为rAAV2-EGFP-Slug-siRNA. 上清分装至500 mL的三角烧瓶中, 每瓶250 mL, 进行按照说明书纯化. 采用SDS-PAGE电泳检rAAV2-Slug-siRNA纯度; 最后进行目的基因的PCR鉴定和滴度测定[13].
1.2.4 人胰腺癌裸鼠皮下移植瘤模型的建立与治疗: (1)建立模型: 用安尔碘消毒裸鼠腋下背侧皮肤, 取200 µL细胞悬液PBS(约2×107个细胞)摇匀后用皮试针潜行刺入皮下注射, 注射后留针1 min拔出, 继续SPF级饲养. (2)给药: 2 wk后随机将建模成功的裸鼠分为3组, 每组6只. 采用瘤体内多点注射的方法, 阴性对照组裸鼠按1×109 puf(50 µL)标准注射rAAV2-EGFP, 空白对照组裸鼠注射等量生理盐水, 实验组裸鼠按1×109 puf(50 µL)标准注射rAAV2-EGFP-Slug-siRNA, 只注射1次. (3)观察指标: 观察裸鼠的一般情况, 摄食, 活动能力. 每周用电子天平秤体质量, 绘制裸鼠生长曲线. 游标卡尺测量瘤体大小, 按公式V = πab2/6(mm3)计算肿瘤体积(a: 最大径, b: 最小径), 绘制肿瘤生长曲线. 抑瘤率 = 1-(V实验组止-V实验组始)/(V空白对照组止-V空白对照组始)×100%. 治疗6 wk后二氧化碳吸入法处死裸鼠, 切取肿瘤称质量, 然后用锋利刀片快速切分组织. 一部分在3 min内用锋利刀片快速切分成1 mm3大小肿块, 以2.5%戊二醛固定, 4 ℃冷藏, 送电镜检查. 另一部分以100 g/L中性甲醛固定, 送免疫组织化学检测.
1.2.5 IHC SP法检测Slug蛋白的表达: 切下的肿瘤的取材与固定、脱水、透明、包埋、4 µm厚连续切片、免疫组化染色步骤、阳性判断标准同文献[14].
1.2.6 脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)凋亡检测: 切下的肿瘤的取材与固定、脱水、透明、包埋, 4 µm厚石蜡切片. 染色步骤以及阳性判断标准文献[14].
1.2.7 透射电镜检查: 1 mm3组织块在2.5%戊二醛中固定4 h以上. 缓冲液洗2次, 15 min/次. 1%锇酸后固定1 h. 缓冲液洗2次, 15 min/次. 30%、50%丙酮4 ℃脱水, 15 min/次. 70%丙酮和醋酸铀4 ℃过夜. 80%、90%丙酮4 ℃梯度脱水, 每次15 min. 100%丙酮室温脱水3次, 每次10 min. 100%丙酮:环氧树脂618 = 1:1, 1 h. 环氧树脂618包埋2 h. 40 ℃聚合24 h, 60 ℃聚合48 h. 超薄切片机切成50-70 nm薄片, 捞在200目带Formvar支持膜的铜网上. 3%醋酸铀-枸橼酸铅双染色透射电镜观察, 拍照.
统计学处理 采用SAS 9.0统计软件进行统计学处理, 数据以mean±SD表示. 组间均数的比较采用SNK-q检验, 等级资料的比较采用Kruskal-Wallis H检验, 检验水准α = 0.05.
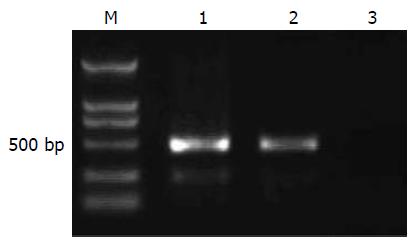
用RNAi-ID-F和RNAi-ID-R引物应能特异性扩增出503 bp左右的EGFP-Slug -siRNA-U6片段, 电泳证明该重组腺相关病毒携带目的基因EGFP-Slug-siRNA(图1).
经测定, rAAV2-EGFP-Slug-siRNA的滴度为9.23×1010 puf, 能够满足体内外动物实验的需要.
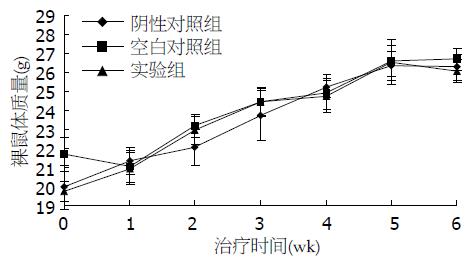
接种后裸鼠皮下形成一柔软皮丘, 大小约4 mm, 72 h后皮丘消退. 约1 wk后接种处可触及粟粒大小的结节, 2 wk后结节长至4 mm左右, 即为建模成功, 成瘤率为100%. 此后肿瘤持续生长, 由圆形或椭圆形、形态规则、活动大逐渐变为分叶状生长、形态不规则、固定, 肿瘤局部皮肤无溃疡和坏死. 4 wk后移植瘤表面可见清晰的血管网形成. 3组裸鼠在治疗期间一般情况良好, 摄食正常, 活动能力强, 无明显消瘦、体质量减轻、恶液质、未见远处转移灶. 3组裸鼠的体质量变化差别无统计学意义(P>0.05, 图2).
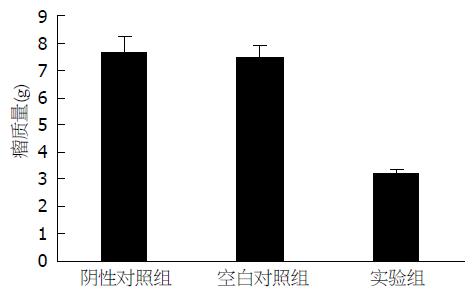
3组裸鼠分别接受不同的处理后, 在开始的2 wk皮下移植瘤的生长无明显差别, 均表现为快速生长. 2 wk以后, 差别逐渐明显, 实验组裸鼠皮下移植瘤的体积增长明显滞后于阴性对照组和空白对照组, 直至治疗结束, 差异有统计学意义(P<0.05). 而阴性对照组和空白对照组裸鼠皮下移植瘤的体积增长无明显差别(P>0.05). 治疗6 wk后切取肿瘤称质量, 实验组裸鼠皮下移植瘤的质量明显轻于阴性对照组和空白对照组, 差异有统计学意义(3.26±0.48 g vs 7.56±1.25 g, 7.50±1.23 g, 均P<0.05). 而阴性对照组和空白对照组裸鼠皮下移植瘤质量差异无统计学意义(P>0.05). 实验组的抑瘤率为71.4%, 阴性对照组的抑瘤率为0.04%, 差异有无统计学差异(P>0.05, 图3).
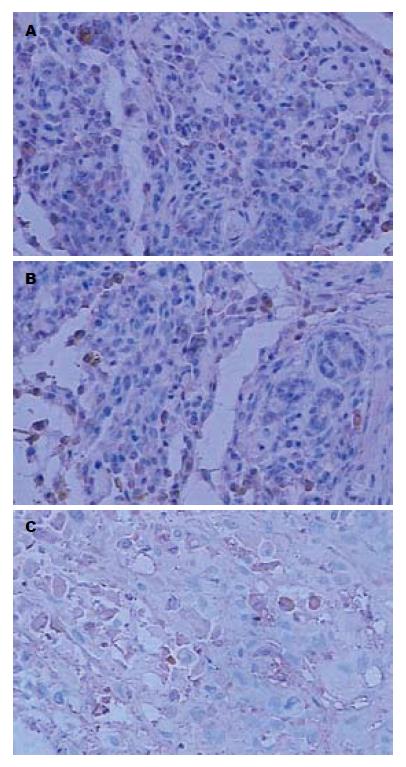
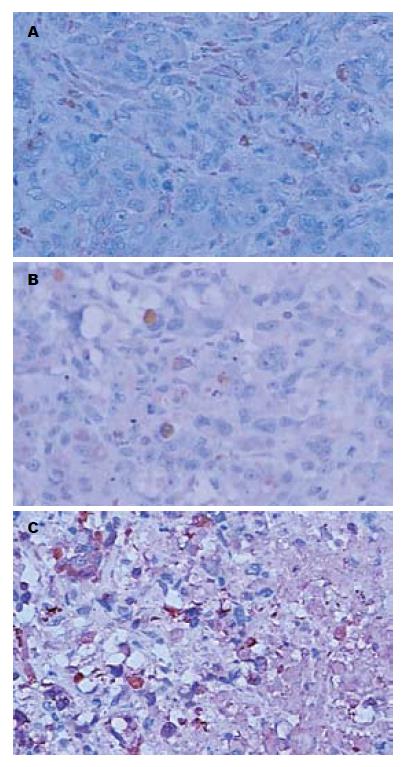
Slug阳性染色定位于肿瘤细胞的胞质和胞核, 呈棕黄色颗粒. 阳性细胞呈散在分布,在移植瘤的边缘包膜下最明显. 在阴性对照组和空白对照组, 阳性细胞分布比较密集, 而实验组阳性细胞分布较稀疏(图4).
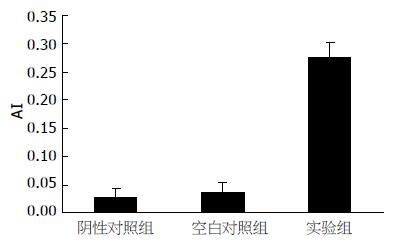
TUNEL检测显示阴性对照组和空白对照组皮下移植瘤棕色核细胞较少, 以蓝色背景为主. 实验组皮下移植瘤棕色核细胞较密集(图5). 实验组裸鼠皮下移植瘤的AI值明显小于阴性对照组和空白对照组, 差异有统计学意义(0.27±0.06 vs 0.024±0.01, 0.025±0.01, 均P<0.05),而阴性对照组和空白对照组裸鼠皮下移植瘤的AI值差异无统计学意义(P>0.05, 图6).
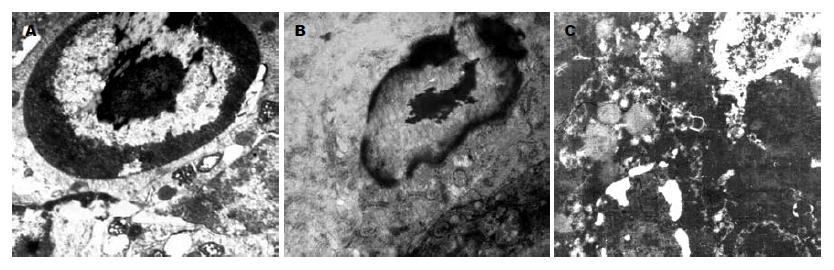
透射电镜下阴性对照组和空白对照组肿瘤细胞胞膜及核膜完整, 细胞器结构清晰, 电子密度均匀, 核大, 核浆比大, 核内染色质均匀. 实验组肿瘤细胞可见细胞器结构模糊, 核固缩, 染色质边集等现象(图7).
胰腺癌具有隐匿性和高度侵袭性特点, 因此早期即可发生转移, 而胰腺癌早期症状不典型, 确诊时大多已处于晚期, 大多数患者是外科手术不能治愈的, 3年生存率不足10%, 5年生存率低于5%, 迄今为止, 胰腺癌仍然是临床治疗最为困难的消化系恶性肿瘤之一[15-17].
胰腺癌对目前使用的化疗和放疗等治疗方法具有高度的抵抗性, 新的药物如Gemcitabine, 虽然已经成为中晚期胰腺癌治疗的首选用药, 但最终会产生耐药性, 上述方法除了能达到减压和减轻疼痛症状的目的外, 却不能控制胰腺癌肿瘤的生长和浸润转移, 也不能显著延长患者的中位生存时间, 因此需要探索新的胰腺癌治疗方法.
由于胰腺癌是机体干细胞多发性基因变异、突变、缺失、错位等导致的有遗传倾向的系统性疾病, 传统的治疗效果欠佳, 解决改变的基因问题, 才是防治胰腺癌的最为可行方法[18].
分子靶向治疗是现代肿瘤治疗领域的突破性和革命性的发展, 代表了肿瘤生物治疗新的发展方向. 分子靶向是针对肿瘤细胞里面的某一个蛋白质分子、一个核苷酸的片段、或者一个基因产物进行治疗. 他利用肿瘤组织或细胞所具有的特异性结构分子作为靶点, 使用某些能与这些靶分子特异结合的抗体、配体等达到直接治疗或导向治疗目的[19]. 分子靶向治疗是以病变细胞为靶点的治疗, 相对于手术、放化疗三大传统治疗手段更具有"治本"功效. 人类基因组计划和人类癌症基因组解剖计划以及高通量技术的应用(包括基因芯片及蛋白质芯片技术等), 在短短的数年时间内分离和鉴定了大量的靶分子, 许多靶点药物已进入临床前和临床研究. 但是, 靶点药物中只有少数药物对某些肿瘤效果显著, 例如: 格列卫, 贺赛汀. 分子靶向药物对胰腺癌的治疗作用不明显, 例如: Erlotinib、Bevacizumab、Marimastat、法呢基转移酶抑制剂等, Celecoxib是靶向COX-2(环氧化酶)的药物, 目前与吉西他滨联合治疗的2期临床试验, 只有17%的患者获部分缓解.
肿瘤分子靶向治疗虽然取得了一定的疗效, 但面临更多的是挑战: 疗效差, 只有10%左右患者取得客观反应; 有效期不长, 需持续不断用药, 停药复发进展; 所有靶向药物缓解时间有限; 靶向药物不可能完全选择性作用于肿瘤细胞, 不可能对机体没有毒性; 临床前及临床开发研究成本高昂, 因此价格昂贵, 每月达2-10万. 除此之外, 目前大部分肿瘤的分子学分型仍不健全或空白, 但分子靶向治疗超前于分子分型诊断. 上述存在的各种原因使靶向药物的应用受到了限制.
基因治疗是肿瘤靶向治疗的重要策略之一, 基因靶向治疗就是将影响肿瘤细胞生长或恶性表型的关键基因靶向导入特定的组织细胞中, 并在细胞中靶向表达, 从而最大限度地杀伤肿瘤细胞, 而不损伤正常细胞, 因此, 寻找理想的靶基因是肿瘤基因治疗的前提. 目前有70%的基因治疗已开始进行临床试验, 但目前仅有Ⅰ/Ⅱ期临床试验的结果证实其安全有效, 极少Ⅲ期临床试验资料[20].
Slug是转录因子Snail家族中编码锌指蛋白的基因, 多个研究报道, Slug在多种恶性肿瘤中存在明显上调, Slug与恶性肿瘤的发生和血管生成有关[4-8]. Mancera et al[11]报道, 转染Slug基因可导致实验鼠肿瘤的发生. 由此推测, 抑制Slug基因表达可能具有抗肿瘤作用.
Hotz et al[12]最近报道, Slug在正常胰腺组织中无表达, 而在胰腺癌组织中的阳性表达率为50%, 浸润转移的组织中Slug表达更明显, 所以, 胰腺癌转移与Slug上调有关, 干扰Slug表达抗胰腺癌转移作用.
先前的研究表明[21], siRNA干扰Slug基因表达抑制体外胰腺癌BxPC-3细胞生长, 并增强其对放射治疗的敏感性. 本研究探讨siRNA干扰Slug基因表达对体内胰腺癌生长的影响.
抑制基因表达有多种方法, RNA干扰(RNA interference, RNAi)可使突变基因稳定沉默, 而不影响正常基因的表达, 且具有简易性、特异性及高效性的特点, 在肿瘤的研究及治疗上有着无可比拟的优势. 但将RNAi技术应用于肿瘤基因治疗仍存在着瓶颈, 其中最关键的环节就是如何高效地将siRNA导入靶组织或细胞使之发挥长期、稳定的抑制作用. rAAV对于肿瘤的基因治疗是理想的载体: 对人体无毒害作用, 免疫反应小, 有效转导非分裂细胞, 他可携带较短的基因序列, 可定点整合至人的19号染色体上, 产生长期基因表达, AAV自身具有抗肿瘤活性. rAAV是一种用于基因治疗的安全而有效的病毒载体, 他的专一性强, 对肿瘤细胞有嗜性, 近年来已成为肿瘤治疗领域中很有希望的方法.
基于上述理论, 我们构建了携带Slug-siRNA的病毒载体, 该载体的病毒滴度满足体内肿瘤治疗的需要.
该研究表明, 以1×109 puf(50 μL)Slug-siRNA作用肿瘤6 wk后, 抑瘤率为71.4%, 阴性对照组的抑瘤率为0.04%. TUNEL检测显示, Slug-siRNA组裸鼠皮下移植瘤的AI值明显小于阴性对照组和空白对照组, 而阴性对照组和空白对照组裸鼠皮下移植瘤的AI值差异无统计学意义(P>0.05); 透射电镜下, 实验组肿瘤细胞可见细胞器结构模糊, 核固缩, 染色质边集等现象. 免疫组化检测示实验组Slug表达明显减少. 证实Slug-siRNA干扰Slug表达抑制胰腺癌实体瘤细胞生长, Slug是胰腺癌基因治疗的有效靶点. 该研究为胰腺癌的基因治疗提供了理论和实践基础.
Slug是转录因子Snail家族中编码锌指蛋白的基因. 最初发现, Slug在背部神经管表达, 参与神经胚的形成与神经干的正常发育. 后来发现, Slug在多种恶性肿瘤中存在明显上调, Slug上调的肿瘤容易出现远处转移、较深的肿瘤浸润深度和较差的预后. 本研究将构建rAAV2-EGFP-Slug-siRNA载体, 探讨rAAV2-Slug-siRNA对胰腺癌实体瘤生长的作用.
谷俊朝, 主任医师, 首都医科大学附属北京友谊医院普外科
胰腺癌具有隐匿性和高度侵袭性特点, 因此早期即可发生转移, 而胰腺癌早期症状不典型, 确诊时大多已处于晚期, 大多数患者外科手术不能治愈, 3年生存率不足10%, 5年生存率低于5%, 迄今为止, 胰腺癌仍然是临床治疗最为困难的消化系恶性肿瘤之一.
Pérez-Mancera et al最近报道了Slug转染可诱导实验鼠恶性间充质细胞瘤的(白血病, 肉瘤)发生, 说明Slug与肿瘤的发生有关. Hotz et al最近报道, Slug在正常胰腺组织中无表达, 而在胰腺癌组织中的阳性表达率为50%, 浸润转移的组织中Slug表达更明显, 所以, 胰腺癌转移与Slug基因上调相关.
rAAV是一种用于基因治疗的安全而有效的病毒载体, 他的专一性强, 对肿瘤细胞有嗜性, 近年来已成为肿瘤治疗领域中很有希望的方法.
本研究立题充分, 设计合理, 若能增加样本量, 进一步研究会更好.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Nieto MA, Sargent MG, Wilkinson DG, Cooke J. Control of cell behavior during vertebrate development by Slug, a zinc finger gene. Science. 1994;264:835-839. [PubMed] [DOI] |
| 2. | Yang AD, Camp ER, Fan F, Shen L, Gray MJ, Liu W, Somcio R, Bauer TW, Wu Y, Hicklin DJ. Vascular endothelial growth factor receptor-1 activation mediates epithelial to mesenchymal transition in human pancreatic carcinoma cells. Cancer Res. 2006;66:46-51. [PubMed] [DOI] |
| 3. | Hajra KM, Chen DY, Fearon ER. The SLUG zinc-finger protein represses E-cadherin in breast cancer. Cancer Res. 2002;62:1613-1618. [PubMed] |
| 4. | Kajita M, McClinic KN, Wade PA. Aberrant expression of the transcription factors snail and slug alters the response to genotoxic stress. Mol Cell Biol. 2004;24:7559-7566. [PubMed] [DOI] |
| 5. | Tripathi MK, Misra S, Chaudhuri G. Negative regulation of the expressions of cytokeratins 8 and 19 by SLUG repressor protein in human breast cells. Biochem Biophys Res Commun. 2005;329:508-515. [PubMed] [DOI] |
| 6. | Martin TA, Goyal A, Watkins G, Jiang WG. Expression of the transcription factors snail, slug, and twist and their clinical significance in human breast cancer. Ann Surg Oncol. 2005;12:488-496. [PubMed] [DOI] |
| 7. | Castro Alves C, Rosivatz E, Schott C, Hollweck R, Becker I, Sarbia M, Carneiro F, Becker KF. Slug is overexpressed in gastric carcinomas and may act synergistically with SIP1 and Snail in the down-regulation of E-cadherin. J Pathol. 2007;211:507-515. [PubMed] [DOI] |
| 8. | Uchikado Y, Natsugoe S, Okumura H, Setoyama T, Matsumoto M, Ishigami S, Aikou T. Slug Expression in the E-cadherin preserved tumors is related to prognosis in patients with esophageal squamous cell carcinoma. Clin Cancer Res. 2005;11:1174-1180. [PubMed] |
| 9. | Shioiri M, Shida T, Koda K, Oda K, Seike K, Nishimura M, Takano S, Miyazaki M. Slug expression is an independent prognostic parameter for poor survival in colorectal carcinoma patients. Br J Cancer. 2006;94:1816-1822. [PubMed] [DOI] |
| 10. | Wu WS, Heinrichs S, Xu D, Garrison SP, Zambetti GP, Adams JM, Look AT. Slug antagonizes p53-mediated apoptosis of hematopoietic progenitors by repressing puma. Cell. 2005;123:641-653. [PubMed] [DOI] |
| 11. | Pérez-Mancera PA, González-Herrero I, Pérez-Caro M, Gutiérrez-Cianca N, Flores T, Gutiérrez-Adán A, Pintado B, Sánchez-Martín M, Sánchez-García I. SLUG in cancer development. Oncogene. 2005;24:3073-3082. [PubMed] [DOI] |
| 12. | Hotz B, Arndt M, Dullat S, Bhargava S, Buhr HJ, Hotz HG. Epithelial to mesenchymal transition: expression of the regulators snail, slug, and twist in pancreatic cancer. Clin Cancer Res. 2007;13:4769-4776. [PubMed] [DOI] |
| 13. | 张 克君, 李 德春. p53正向凋亡调节因子(PUMA)重组腺病毒载体的构建及对体内外胰腺癌增殖的影响. 中华微生物学与免疫学杂志. 2009;25:12-15. |
| 15. | Löhr JM. Medical treatment of pancreatic cancer. Expert Rev Anticancer Ther. 2007;7:533-544. [PubMed] [DOI] |
| 16. | Claude L, Mornex F. [Chemoradiation in pancreatic carcinoma]. Cancer Radiother. 2003;7:254-265. [PubMed] [DOI] |
| 17. | Yeh JJ, Der CJ. Targeting signal transduction in pancreatic cancer treatment. Expert Opin Ther Targets. 2007;11:673-694. [PubMed] [DOI] |
| 18. | Calhoun ES, Hucl T, Gallmeier E, West KM, Arking DE, Maitra A, Iacobuzio-Donahue CA, Chakravarti A, Hruban RH, Kern SE. Identifying allelic loss and homozygous deletions in pancreatic cancer without matched normals using high-density single-nucleotide polymorphism arrays. Cancer Res. 2006;66:7920-7928. [PubMed] [DOI] |
| 19. | Ko EC, Wang X, Ferrone S. Immunotherapy of malignant diseases. Challenges and strategies. Int Arch Allergy Immunol. 2003;132:294-309. [PubMed] [DOI] |
| 20. | Bhattacharyya M, Lemoine NR. Gene therapy developments for pancreatic cancer. Best Pract Res Clin Gastroenterol. 2006;20:285-298. [PubMed] [DOI] |