修回日期: 2009-05-09
接受日期: 2009-05-18
在线出版日期: 2009-06-18
目的: 探讨MT1E基因在肝癌形成过程中不同阶段的表达及其在肝癌细胞中的生物学功能.
方法: DEN诱发大鼠肝癌形成模型, 分别观察造模4、8、16、20 wk后肝脏组织病理形态学的改变以及MT1E基因表达的差异; 针对MT1E基因mRNA序列设计2个siRNA靶点, 分别经质粒重组后电转入SMMC-7721肝癌细胞株中, 实时荧光定量PCR检测MT1E基因的表达, MTT法检测细胞生长增殖.
结果: 大鼠肝癌造模4、8 wk时肝组织主要表现为炎性病变, 而到16 wk后呈现典型的增生病变, 20 wk后已全部发展为肝细胞癌. MT1E基因在造模16 wk后表达明显增加, 与对照组比较差异显著(芯片读数: 11524 vs 5462). 成功筛选到MT1E基因RNA干扰的一个有效靶序列, 电转染72 h后该基因的表达量较空白对照组与阴性对照组明显降低(0.38 vs 1.00, 0.93, P<0.01). 与阴性对照组比较, 有效干扰靶点电转染144 h后细胞的生长增殖得到了明显抑制(0.1700±0.0313 vs 0.5748±0.0480, P<0.01).
结论: 成功应用DEN诱发大鼠肝癌形成, MT1E基因在肝癌形成的后期表达明显升高, 其高表达与肿瘤细胞的恶性增殖有关.
引文著录: 管冬元, 方肇勤, 代小平, 梁超, 胡卫, 吴中华, 高必峰. MT1E在肝癌形成过程中的表达及其在肝癌细胞中的作用. 世界华人消化杂志 2009; 17(17): 1707-1712
Revised: May 9, 2009
Accepted: May 18, 2009
Published online: June 18, 2009
AIM: To investigate the expression of MT1E mRNA at different stages of liver cancer development and its biological functions in hepatocarcinoma cells.
METHODS: Rat hepatocellular carcinoma (HCC) models were induced by diethylnitrosamine (DEN), and the dynamic histological changes of liver tissue and the differential expression of MT1E gene were observed after the 4th, 8th, 16th and 20th weeks. Two siRNA targets toward MT1E gene were designed, recombinant plasmid was transfected into HCC cell line SMMC-7721, the gene expression of MT1E was determined using real-time quantitative PCR, and the cell viability was determined by MTT assay.
RESULTS: At the 4th week and 8th week the major pathological changes presented inflammatory changes in liver tissue, after 16th week presented typical proliferation changes, until 20th week developed into HCC. According to the gene chip results, the expression of MT1E was increased significantly after 16th week, with significant difference compared with control group (gene chip reading: 11524 vs 5462). An effective siRNA target sequence in MT1E was got, the gene expression was decreased greatly at the 72 h after transfection compared with blank control group and negative control group (0.38 vs 1.00, 0.93, both P < 0.01). MTT assay result displayed, the cell growth and proliferation were depressed obviously when interference target was effectively transfected 144 h (0.1700 ± 0.0313 vs 0.5748 ± 0.0480, P < 0.01).
CONCLUSION: DEN-induced rat HCC models were established successfully, the expression of MT1E is increased obviously at the later stage of development of HCC, perhaps related to the malignant proliferation of tumor cells.
- Citation: Guan DY, Fang ZQ, Dai XP, Liang C, Hu W, Wu ZH, Gao BF. Expression of MT1E during the formation of hepatocellular carcinoma and its function in hepatocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1707-1712
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1707.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1707
原发性肝癌(primary hepatic carcinoma, PHC)是我国高发的恶性肿瘤之一, 据统计, 每年约有13万人死于PHC, 占全世界PHC年死亡人数的43.7%. 大量的研究表明, 在PHC的发生与发展过程中存在着多个基因的表达失调. 其中, 有些基因与PHC的关系已做了大量深入的研究工作, 但相当一部分表达失调的基因与PHC的关系尚待进一步的研究. 我们课题组在前期的研究中, 发现一批在二乙基亚硝胺(diethylnitrosamine, DEN)所诱导大鼠PHC形成过程中明显表达上调的基因, 其中包括金属硫蛋白1E(metallothionein 1E, MT1E)[1], 然而, 国内外对MT1E在肝癌细胞中的生物学作用研究甚少. 本文将研究在DEN诱发大鼠肝癌模型中MT1E的表达, 并深入探讨MT1E在肝癌细胞中可能的生物学功能, 以揭示MT1E在肝癌细胞中的作用.
♂Wistar大鼠, 体质量100-120 g, 30只,购自上海中医药大学实验动物中心. 转染细胞为SMMC-7721肝癌细胞株购自中国科学院上海细胞所. 转染载体为pSilencerTM2.1-U6 neo质粒(Ambion公司); BamHⅠ与Hind Ⅲ限制性内切酶(Ambion公司); 质粒纯化试剂盒PureYieldTM Plasmid Midiprep System(Promega公司); MT1E基因的RNAi靶序列分别为: (1)AAAGAGTGCAAATGCACCTCC, (2)AAATGCACCTCCTGCAAGAAG; 基因电转仪为GenePluler XcellTM(Bio-rad公司); MT1E基因干扰效率的实时荧光定量RT-PCR检测引物为: 上游GCTCCATTCTGCTTTCCAAC, 下游AGAGCTGTTCCCACATCAGG, 扩增产物长度为277 bp; GAPDH内参基因的实时荧光定量RT-PCR检测引物为: 上游GAGTCAACGGATTTGGTCGT, 下游TTGATTTTGGAGGGATCTCG, 扩增产物长度为238 bp; 实时荧光定量PCR试剂盒为TaKaRa公司的SYBR Premix Ex Taq(Perfect Real Time)试剂盒; 实时荧光定量PCR仪为Rotor-Gene 3000(GENE公司); 酶标仪为BIO-TEK公司的Elx800型.
1.2.1 大鼠肝癌模型的制备: 随机分为正常组10只、造模组20只, 正常组大鼠常规饲养, 造模组大鼠自由饮用含8×10-5 DEN(购自中国科学院南京土壤研究所)水溶液, 共20 wk. 造模组分别于第4、8、16周末各处死2只大鼠, 其他肝癌造模组与正常组大鼠至20 wk末动物处死.
1.2.2 病理形态学观察: 所有动物处死后, 造模组取病灶比较严重的肝组织或肝癌组织进行常规HE染色.
1.2.3 芯片检测: 取正常组肝组织、造模组病灶比较严重的肝组织或肝癌组织用TRIzol试剂盒提取组织总RNA后, 由美国科罗拉多大学医学院生物芯片检测中心进行Affymetrix rat 230A GeneChip芯片检测.
1.2.4 RNA干扰检测: (1)从GenBank数据库中搜索到人MT1E基因的mRNA序列(登录号为NM_175617.3), 并确认cds区. (2)针对MT1E基因的mRNA序列的cds区, 应用Ambion公司在线的siRNA设计软件设计RNA干扰序列(长度为21 bp), 并进行BLAST比对, 以确定干扰序列的特异性. 同时, 每个靶序列通过该软件可自动生成2条克隆入质粒的序列(含正、反向RNA干扰序列与BamHⅠ与Hind Ⅲ限制性内切酶酶切位点, 长度为64 bp), 该序列由Invitrogen上海分公司合成. (3)将合成后的同一干扰位点上的两条单链DNA, 退火结合成双链后, 重组到经BamHⅠ与Hind Ⅲ双酶切的pSilencerTM2.1-U6 neo质粒中, 并转染到大肠杆菌DH5α中. (4)重组后质粒经大肠杆菌大量扩增后, 由质粒纯化试剂盒得到待转染的含RNA干扰序列的重组质粒, 经DNA测序验证后, 稀释成0.1 g/L. (5)用基因电转仪将重组质粒转入SMMC-7721肝癌细胞中, 电转体系含80 μL重组质粒(0.1 g/L)、400 μL细胞(2×106个/L, 以不含牛血清的1640液悬浮细胞). 同时, 设立空白对照组(去离子水)与阴性对照组(相同浓度的自身环化的质粒). (6)电转染后, 混匀于6 mL含牛血清的1640培养液, 一部分加入到96孔板中, 分别于24、72、144 h后进行MTT检测; 一部分加入到6孔板中, 72 h后提取其总RNA, 进行实时荧光定量RT-PCR检测. 所有细胞均于24 h后换用含G418(浓度400 mg/L)的培养液进行培养. (7)MTT检测: 常规MTT检测, 每个样本平行做4个复孔. (8)实时荧光定量RT-PCR检测: 将电转染72 h后的细胞收集起来, 用TRIzol液提取其总RNA, 各实验组取2 μg总RNA进行反转录, 再以反转录产物为模板, 用TaKaRa公司的SYBR Premix Ex Taq(Perfect Real Time)试剂盒进行标准曲线的绘制, 以及以GAPDH为内参的相对表达量分析. 扩增反应体系为(共计25 μL): 消毒双蒸水9.5 μL, SYBR Premix Ex Taq(2×) 12.5 μL, 上、下游引物(各5 μmol/L) 2 μL, RT产物 1 μL. 扩增反应条件: 95 ℃×30 s; 95 ℃×5 s; 60 ℃×30 s, 40个循环. 结果以采用∆∆CT法加以分析.
统计学处理 基因芯片数据的分析详细步骤和灵敏度问题以及定量的方法参考Affymetrix GeneChip网站的技术手册; 所有计量资料均采用SPSS12.0软件包的方差分析.
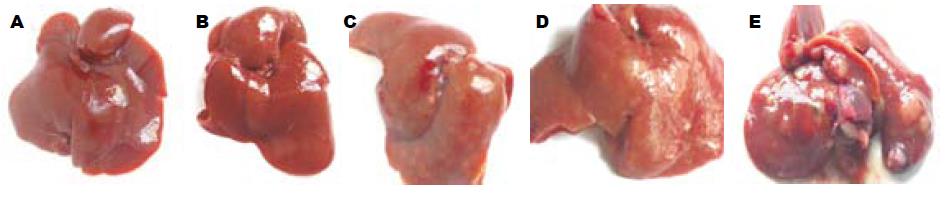
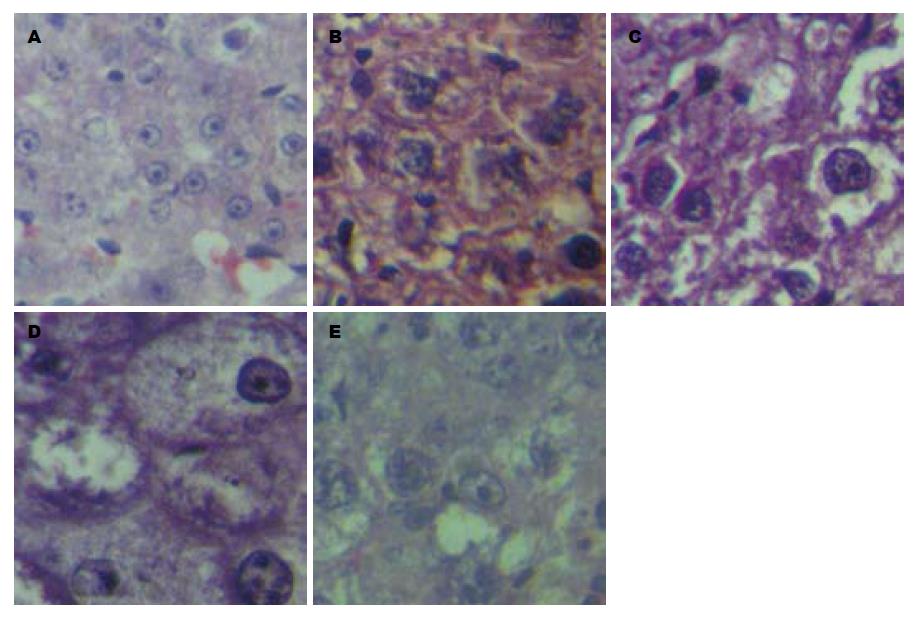
正常组大鼠肝脏经外观与病理检查, 均正常(图1A, 图2A). 在20只造模组中, 除第4、8、16周末各处死2只大鼠及第19周意外死亡2只(经解剖发现腹腔大量出血所致)外, 其余12只大鼠肝癌组织病理观察结果均表现出肝细胞癌病理特征. 第4周, 肝脏外观色泽偏淡, 表面光滑, 但肝脏已轻度肿胀; 光镜下, 肝小叶中央的肝细胞混浊, 轻度水样变性, 伴炎症细胞浸润(图1B, 图2B). 第8周, 肝脏表面呈暗红色, 并有细小的灰白结节; 光镜下, 肝细胞水样变性与炎症细胞浸润较第4周更加明显, 并偶见桥性坏死, 细胞排列出现混乱(图1C, 图2C). 第16周, 肝脏体积明显增大, 表面灰白结节, 直径大小不一; 光镜下, 可见明显的增生结节, 结节内细胞增生相当活跃, 伴显著异型性, 可见双核与多核等病理性有丝分裂相(图1D, 图2D). 第20周, 肝脏体积显著增大, 表面布满大小不一的灰白结节, 分布无规律, 直径在0.1-1.5 cm之间不等, 同时伴有出血斑点(图1E, 图2E); 光镜下, 可见柱状及腺管结构肝细胞癌, 癌细胞形态不一, 有嗜碱性小癌细胞、嗜酸性大癌细胞及透明细胞等几种形态, 癌细胞核的大小、规则不一, 病理性有丝分裂相多见.
所有大鼠在处死时迅速取正常组肝组织、造模组病灶比较严重的肝组织或肝癌组织, 用TRIzol试剂盒提取组织总RNA, 经质量检测与浓度测定后, 将同阶段RNA的样本分别取10 μg混合, 标注为正常组、造模4、8、16、20 wk. RNA经翻转后, 进行Affymetrix rat 230A GeneChip检测(共5张芯片). MT1E基因在正常肝组织本身具有较高的表达水平, 基因芯片中的表达量(芯片读数)为5462, 在肝癌诱发的初期(第4、8周)时, 表达变化不明显, 基因芯片中的表达量(芯片读数)为6649和4285, 但到达后期(第16、20周)时, 表达明显增加, 基因芯片中的表达量(芯片读数)为11524和14639.
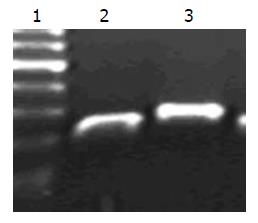
在对MT1E基因RNA干扰靶点的设计过程中, 经BLAST比对后确认得到2个靶序列, 但电转染后72 h经实时荧光定量RT-PCR检测, 只有其中一个靶点为有效靶点, 其序列为AAAGAGTGCAAATGCACCTCC, 其干扰效率(以空白对照组为参照, GAPDH基因为内参, 进行∆∆CT法分析). 结果表明, SMMC-7721肝癌细胞中在电转染MT1E基因干扰序列72 h后, MT1E基因的表达量较空白对照组与阴性对照组明显降低(0.38 vs 1.00, 0.93, P<0.01). 扩增产物经琼脂糖凝胶电泳检验, 具有高度特异性(图3).
应用MTT法检测空白对照组、阴性对照组、RNA干扰组SMMC-7721肝癌细胞的生长增殖. 经多次重复实验结果表明, 空白对照组在电转染144 h后检测MTT的吸收值明显降低, 这是由于细胞在电转染24 h后均采用了含G418抗生素(未转染质粒的细胞生长将被抑制甚至死亡)的培养液进行培养; 阴性对照组在电转染144 h后呈明显的上升趋势, 而RNA干扰组此时的检测结果却进一步下降, 表现出经RNA干扰引起的MT1E基因功能沉默的生物学效应, 即在SMMC-7721肝癌细胞中MT1E基因的生物学功能可能与细胞的恶性增殖有关(表1).
DEN是一种很强的化学毒剂, 其作用的靶器官主要是肝脏, 常用于PHC动物模型的制备, 但亦能诱发食管、肾、鼻腔、气管与肺的肿瘤. 我们的结果并未发现明显的食管、肺等肝外肿瘤的形成, 这可能与造模时间, 造模方式, 动物品系等有关[2]. 一般认为以DEN诱发的大鼠肝癌模型以肝细胞癌为主, 其癌变过程分为炎症反应、非癌性增生性改变和肝癌发生3个阶段, 与人PHC形成过程相似[3]. 本实验观察到在第4周时已出现肝细胞水样变, 第8周时更甚, 同时伴有明显炎症细胞浸润, 为非特异性炎症反应; 第16周时, 肝脏体积增大, 表面有灰白结节明显, 肝小叶结构混乱, 呈现出非典型增生灶形态; 第20周时, 癌肿已形成, 在观测的12个样本中均呈现出典型的肝细胞癌特征.
金属硫蛋白(metallothionein, MT)是一类低相对分子质量、高金属含量、富含半胱氨酸、功能独特的小分子胞质结合蛋白. 根据MT所带电荷性质的差异, 其家族可分为MT1、MT2、MT3和MT4四种异构体. MT1主要存在于哺乳动物和一些无脊椎动物中, 又包括TM1A、TM1B、TM1C、TM1E、TM1F、TM1G、TM1H、TM1I、TM1M、TM1Q、TM1S等多种亚型, 其中, TM1E是常见且重要的一种亚型[4-5]. MT中金属的组成依赖于自然环境和动物体对金属的暴露情况, 在受金属离子诱导后肝TM1主要结合金属锌. 近年来的研究表明, 在包括PHC在内的多种肿瘤组织中MT的含量明显增加[6]. 致癌过程中MT的产生与肿瘤的迅速生长、致癌物质的刺激、癌基因的激活等有关. 其中, 有一些研究结果表明,肿瘤组织上MT的含量与肿瘤的分化程度及预后有密切关系[7]. 也有研究认为, MT1E的高表达与癌细胞的侵袭和转移呈正相关[8].
RNA干扰实验是一种高效、特异的基因沉默手段. 所产生的siRNA与目的基因mRNA的同源序列互补结合后,会特异性地导致该目的基因mRNA发生降解, 进而失去翻译成蛋白质的功能. 目前, RNA干扰实验已成为研究基因功能的强有力的实验方法[9-10], 也在肿瘤的研究领域中得到了广泛的引用[11-16]. 在RNA干扰实验中, 细胞转染通常有脂质体转染与电转染2种方式. 而siRNA的形成通常也有3种方式: (1)直接转染化学合成的siRNA; (2)通过构建质粒转染后生物合成; (3)通过病毒包装转染后生物合成. 我们根据siRNA的设计原则,利用在线软件设计MT1E基因的2个靶点, 分别应用质粒构建与电转染的方法, 将在SMMC-7721肝癌细胞产生特异性的siRNA, 并通过实时荧光定量PCR检测转染后MT1E基因mRNA的表达水平, 结果证实在2个靶序列中以"AAAGAGTGCAAATGCACCTCC"靶序列的效果最好(可达60%以上), 可用于后续生物学功能实验. 应用MTT法, 对MT1E基因干扰后SMMC-7721肝癌细胞的生长增殖进行检测, 结果显示, MT1E基因沉默后其促进细胞增殖的能力被逐步削弱, 在转染144 h后抑制的效率已明显高于阴性对照组(P<0.01), 证明该基因在促进细胞生长增殖方面起重要作用.
本研究表明, 在DEN诱发的大鼠肝癌过程中, MT1E基因的表达在诱癌的后期(即16与20 wk)时明显升高, 我们推测该基因的高表达可能与PHC的发生发展有着密切的联系. 进一步通过RNA干扰实验观察到该基因在SMMC-7721肝癌细胞中得到有效干扰(即产生基因沉默效应)后, 肝癌细胞的生长得到明显地抑制.
总之, 无论是整体动物实验, 还是应用先进的细胞生物学方法, 都相互印证了MT1E基因在PHC发生发展过程中发挥着重要的生物学功能, 其高表达与肝癌细胞的恶性增生有关.
近年来的研究表明, 在多种肿瘤组织中MT的含量明显增加, 致癌过程中MT的产生与肿瘤的迅速生长、致癌物质的刺激、癌基因的激活等有关, 其中, MT1E是其重要的亚型. 那么, 在肝癌的形成过程中, MT1E基因的表达是否发生明显变化, 以及在肝癌细胞的生长增殖过程中该基因的生物学功能如何? 有待于进一步深入研究.
黄志勇, 教授, 华中科技大学同济医学院附属同济医院肝脏外科中心
大量的研究表明, 在原发性肝癌的发生与发展过程中存在着多个基因的表达失调. 其中, 有些基因与肝癌的关系已做了大量深入的研究工作, 如ras等基因, 但相当一部分表达失调的基因与肝癌的关系尚待进一步的研究.
Wu et al研究发现, MT1E的高表达与癌细胞的侵袭和转移呈正相关.
本文以大鼠自大量的研究表明, 在原发性肝癌的发生与发展过程中存在着多个基因的表达失调. 其中, 有些基因与肝癌的关系已做了大量深入的研究工作, 如ras等基因, 但相当一部分表达失调的基因与肝癌的关系尚待进一步的研究. 由引用DEN水溶液诱发肝癌形成模型, 以基因芯片检测与RNAi技术为主要检测手段, 系统观测了在大鼠肝癌形成过程中不同时间段MT1E基因的表达变化, 以及在人肝癌细胞株SMMC-7721中该基因表达明显受到抑制后, 对肝癌细胞生长增殖的影响, 以进一步探讨该基因在肝癌细胞中的生物学功能.
本研究进一步阐明了MT1E在肝癌形成与增殖过程中的生物学功能. 结果表明, MT1E的高表达与肝癌的形成密切相关, 也与肝癌细胞的生长增殖密切相关.
本研究设计合理, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | 阚 卫兵, 方 肇勤, 管 冬元, 赵 晓珍, 吴 中华, 盛 学仕, 高 必峰. 二乙基亚硝胺所诱导大鼠肝癌表达上调的基因. 世界华人消化杂志. 2005;13:2420-2426. [DOI] |
| 2. | Dale MM, Easty GC, Tchao R, Desai H, Andjargholi M. The induction of tumours in the guinea-pig with methylcholanthrene and diethylnitrosamine and their propagation in vivo and in vitro. Br J Cancer. 1973;27:445-450. [PubMed] [DOI] |
| 4. | Mehta A, Flora SJ. Possible role of metal redistribution, hepatotoxicity and oxidative stress in chelating agents induced hepatic and renal metallothionein in rats. Food Chem Toxicol. 2001;39:1029-1038. [PubMed] [DOI] |
| 5. | Zangger K, Shen G, Oz G, Otvos JD, Armitage IM. Oxidative dimerization in metallothionein is a result of intermolecular disulphide bonds between cysteines in the alpha-domain. Biochem J. 2001;359:353-360. [PubMed] [DOI] |
| 8. | Wu Y, Siadaty MS, Berens ME, Hampton GM, Theodorescu D. Overlapping gene expression profiles of cell migration and tumor invasion in human bladder cancer identify metallothionein 1E and nicotinamide N-methyltransferase as novel regulators of cell migration. Oncogene. 2008;27:6679-6689. [PubMed] [DOI] |
| 9. | Zhou HJ, Tsai SY, Tsai MJ. RNAi technology and its use in studying the function of nuclear receptors and coregulators. Nucl Recept Signal. 2003;1:e008. [PubMed] [DOI] |
| 10. | 吴 元明, 陈 苏民. RNA干涉的最新研究进展. 中国生物化学与分子生物学报. 2003;19:411-417. |
| 11. | Brummelkamp TR, Bernards R, Agami R. Stable suppression of tumorigenicity by virus-mediated RNA interference. Cancer Cell. 2002;2:243-247. [PubMed] [DOI] |
| 12. | 陈 杰, 白 春学, 张 敏. RNA干扰技术在哺乳动物中的应用. 生物化学与生物物理进展. 2003;30:650-665. |
| 13. | Brummelkamp TR, Bernards R, Agami R. A system for stable expression of short interfering RNAs in mammalian cells. Science. 2002;296:550-553. [PubMed] [DOI] |
| 14. | Scherr M, Battmer K, Winkler T, Heidenreich O, Ganser A, Eder M. Specific inhibition of bcr-abl gene expression by small interfering RNA. Blood. 2003;101:1566-1569. [PubMed] [DOI] |
| 15. | Wilda M, Fuchs U, Wössmann W, Borkhardt A. Killing of leukemic cells with a BCR/ABL fusion gene by RNA interference (RNAi). Oncogene. 2002;21:5716-5724. [PubMed] [DOI] |
| 16. | Borkhardt A. Blocking oncogenes in malignant cells by RNA interference--new hope for a highly specific cancer treatment? Cancer Cell. 2002;2:167-168. [PubMed] [DOI] |