修回日期: 2009-03-26
接受日期: 2009-03-30
在线出版日期: 2009-05-18
目的: 探讨FAK-ERK信号转导通路在黏着斑激酶相关非激酶(FAK-related non-kinase, FRNK)质粒转染抑制肝星状细胞(hepatic stellate cells, HSCs)胶原合成中的作用.
方法: 在体外, 以FN诱导HSCs增殖, 采用脂质体介导的方法用FRNK表达质粒瞬时转染HSCs, 利用3H-Pro掺入技术测定HSCsⅠ型胶原的合成, Western blot及RT-PCR方法检测FRNK、FAK、p-FAK(Tyr397)、ERK蛋白和mRNA的表达.
结果: FRNK表达质粒成功转染HSCs, 在翻译后水平抑制FAK磷酸化. 在FRNK转染HSC 48 h后胶原合成能力较空质粒组显著下降(498.17±73.20 vs 748.33±61.30, P<0.01). FRNK抑制FAK磷酸化和在翻译和转录水平抑制ERK1、p-ERK的表达, 而FN则促进FAK和ERK1、p-ERK在翻译和转录水平的表达.
结论: FRNK可以使HSCs胶原合成能力降低, FAK-ERK信号转导通路可能发挥了负调控作用.
引文著录: 申建刚, 张晓岚, 魏娟, 霍晓霞, 桑荣霞, 安君艳. FAK-ERK信号转导通路在FRNK抑制肝星状细胞胶原合成中的作用. 世界华人消化杂志 2009; 17(14): 1402-1405
Revised: March 26, 2009
Accepted: March 30, 2009
Published online: May 18, 2009
AIM: To investigate the effect of FAK-ERK signal transduction pathway in hepatic stellate cells (HSCs) collagen synthesis inhibited by FRNK plasmid transfection in vitro.
METHODS: After FN stimulated HSCs, FRNK plasmid mediated by cationic liposome was transfected into HSCs in vitro. HSCs collagen synthesis capability was examined using 3H-Pro incorporation assay. And the protein expression and mRNA expression of FRNK, FAK, p-FAK (Tyr397) and ERK in HSCs were determined using Western blot and RT-PCR, respectively.
RESULTS: The expression of FRNK was enhanced after FRNK had been transiently transfected into HSCs in vitro. Compared with the non-FRNK plasmid group, the collagen synthesis in the FRNK plasmid group was significantly inhibited (498.17 ± 73.20 vs 748.33 ± 61.30, P < 0.01). After exposure of HSCs to FRNK plasmid, the protein and mRNA expression levels of p-FAK, ERK1 and p-ERK were dramatically decreased compared with the non-FRNK plasmid group; on the contrary, compared with the control group, the expression levels of p-FAK, ERK1 and p-ERK in FN group were increased.
CONCLUSION: After FRNK were transfected successfully into HSCs using lipofectamine, the collagen synthesis in HSCs is inhibited. FAK-ERK signal transduction pathway may be involved in this process.
- Citation: Shen JG, Zhang XL, Wei J, Huo XX, Sang RX, An JY. Role of FAK-ERK signal transduction pathway in hepatic stellate cells collagen synthesis inhibited by FRNK plasmid transfection. Shijie Huaren Xiaohua Zazhi 2009; 17(14): 1402-1405
- URL: https://www.wjgnet.com/1009-3079/full/v17/i14/1402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i14.1402
肝星状细胞(hepatic stellate cells, HSCs)活化、增殖进而合成大量胶原等细胞外间质(extracellular matrix, ECM)成分是各种肝脏损伤引起肝纤维化的中心环节[1-2]. 黏着斑激酶(focal adhesion kinase, FAK)处于整合素、生长因子等多条信号转导通路的交汇点, 可以促进HSCs的胶原合成[3]. FAK C-末端含有黏着斑激酶相关非激酶(FAK-related non-kinase, FRNK), FRNK缺乏激酶区, 可以作为FAK的一种内源性抑制因子而参与体内FAK功能的负向调节[4-5]. 本研究应用体外HSCs培养技术, 在脂质体介导下瞬时转染FRNK表达质粒, 以纤维连接蛋白(fibronectin, FN)诱导HSCs增殖[6], 研究FRNK对HSCs胶原合成的影响及其可能机制, 以期为临床防治肝纤维化提供新的防治策略和理论依据.
FRNK表达质粒pRKvsvFRNK由美国(国家卫生研究所)Yamada KM博士惠赠. 无支原体胎牛血清购自杭州四季青生物制品公司. RMPI 1640培养基购自美国Gibco公司. 3H-Pro试剂盒购自中国原子能研究所. 兔抗FAK、ERK1及p-FAK(Tyr397)多克隆抗体及小鼠抗p-ERK mAb购自美国Upstate公司及Santa Cruz公司, FN由复旦大学医学院细胞室提供. RNA提取试剂盒TRIzol购自北京赛百盛基因有限公司, RT-PCR扩增系统购自美国Promega公司. 主要仪器有超净工作台、CO2培养箱、倒置显微镜、LS6500液闪仪、Mulit Image图像分析仪及Robocycler-40PCR热循环仪.
1.2.1 细胞分组及培养: 肝星状细胞系CFSC由美国(Bronx-Lebanon医院中心)Greenwel教授建系并惠赠, 其表型为活化的HSCs. 实验分为对照组、FN组、脂质体组、空质粒组和FRNK表达质粒组, 除对照组外, 其余各组FN浓度均为50 mg/L[6].
1.2.2 FRNK表达质粒瞬时转染: 采用阳离子脂质体介导的方法进行细胞转染, 根据Lipofectamine® Reagent提供的实验步骤操作.
1.2.3 3H-Pro掺入法测定胶原合成: 将HSCs以1×105/孔的密度接种于24孔培养板并使其在24 h内达到近90%融合, 换为不含血清的培养基使其同步化12 h, 并按上述方法分组, 每组设6个复孔. 同步化后按照上述方法转染, 同时加入3H-Pro至终浓度3 mCi/L干预24 h. 置37℃恒温作用3 h. 3 h后每管加100 g/L三氯醋酸500 μL沉淀胶原, 并4℃, 5000 r/min, 离心10 min去上清(去除游离3H-Pro), 并于每管加入2 mL闪烁液溶解沉淀物, 置于闪烁杯, 于液体闪烁记数仪上测定样品cpm值. 按照该公式计算: 胶原合成量(△cpm) = 空白对照管cpm值-加入胶原酶后cpm值.
1.2.4 Western blot技术检测FRNK、FAK、p-FAK(Tyr397)、ERK1及p-ERK蛋白表达: 消化、收集各组细胞, 加入改良的RIPA裂解缓冲液提取细胞胞质蛋白[4], 取适量蛋白上样, 以十二烷基硫酸钠-聚丙烯酰胺分离, 转膜, 封闭, 兔抗FAK多克隆抗体(1∶500)、兔抗p-FAK(Tyr397)多克隆抗体(1∶150)、兔抗ERK1多克隆抗体(1∶500)、小鼠抗p-ERK mAb(1∶200)和山羊抗β-肌动蛋白多克隆抗体(1∶300)作为第一抗体反应, 辣根过氧化物酶标记的山羊抗兔IgG(1∶5000)、山羊抗小鼠IgG
(1∶3000)和兔抗山羊IgG(1∶5000)作为第二抗体反应, 曝光、显影、定影, 结果以目的蛋白与β-肌动蛋白积分吸光度的比值表示.
1.2.5 RT-PCR技术检测FAK mRNA、ERK mRNA表达: 各处理因素干预HSCs 8 h后, 消化、收集上述各组贴壁细胞, 按照TRIzol试剂盒步骤提取细胞RNA, 取2 μg总RNA进行RT-PCR同时扩增目的基因和β-肌动蛋白. ERK正向引物: 5'-GCTGACCCTGAGCACGACCA-3', 反向引物: 5'-CTGGTTCATCTGTCGGATCA-3', 扩增产物大小为451 bp; β-肌动蛋白正向引物: 5'-ACAGAGTACTTGCGCTCAGGAG-3', 反向引物: 5'-GTCACCCACACTGTGCCCATCT-3', 扩增产物大小为548 bp. 扩增产物及DNA相对分子质量标准品进行15 g/L琼脂糖凝胶电泳, 采用Mulit Image凝胶图像分析仪进行吸光度扫描, 结果以目的基因与β-肌动蛋白的积分吸光度的比值表示.
统计学处理 计量资料以mean±SD表示, 细胞凋亡指数以百分率表示, 利用SPSS12.0软件进行统计分析. 多组间比较采用单因素方差分析(One-way ANOVA), 组间比较采用LSD检验, P<0.05为差异有统计学意义.
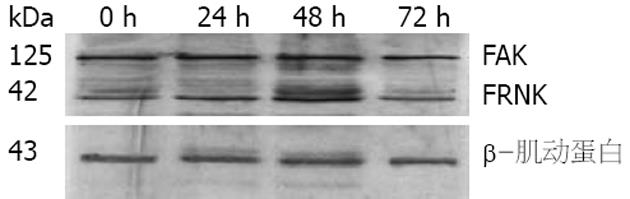
Western blot显示, 在相对分子质量125 000 Da位置出现FAK杂交带, FAK蛋白表达量于转染后0、24、48、72 h均无明显变化(P>0.05); 同时在相对分子质量42 kDa处出现FRNK杂交带, 转染前FN诱导的HSCs有少量的FRNK表达, 随转染时间延长, FRNK表达增强, 转染后48 h表达最强, 72 h表达减弱(F = 547.42, P<0.05, 图1).
本实验利用3H-Pro掺入技术测各组HSCs胶原的合成, 发现经FN处理后, FN组、脂质体组与空质粒组之间的胶原合成无组间差异(P>0.05); 但均显著高于对照组(731.33±38.22, 756.67±85.28, 748.33±61.30 vs 593.67±64.75, P<0.05); 而在FRNK转染HSCs 48 h后胶原合成降至498.17±73.20, 与FN组、脂质体组和空质粒组之间有显著性差异(P<0.01). 表明在FN刺激下HSCs胶原合成增加, 用FRNK转染FN刺激的HSCs可有效地抑制HSCs的胶原合成.
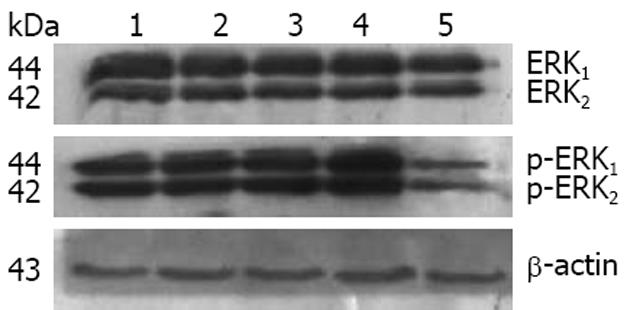
HSCs p-FAK(Tyr397)蛋白在对照组、FN组、脂质体组、空质粒组和FRNK表达质粒组的表达分别为1.10±0.11、1.80±0.13、1.85±0.27, 1.89±0.25和0.40±0.14, FN组较对照组增加63.64%(F = 34.81, P<0.01), FRNK表达质粒组较空质粒组下降78.84 %(P<0.01, 图2).
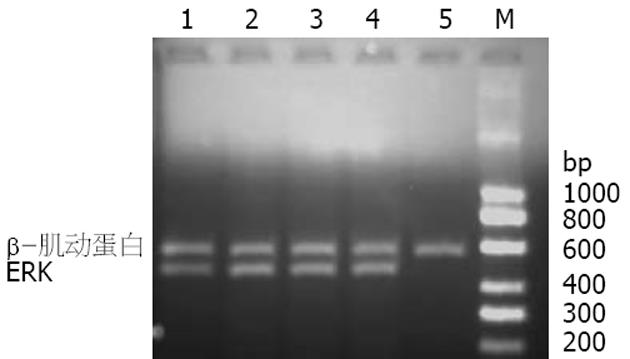
HSCs ERK1蛋白在对照组、FN组、脂质体组、空质粒组和FRNK表达质粒组的表达分别为1.09±0.03、1.27±0.09、1.26±0.04、1.36±0.05和0.96±0.02, FN组较对照组增加16.51%(F = 33.55, P<0.01), FRNK表达质粒组较空质粒组下降29.41%(P<0.01, 图3). HSCs p-ERK蛋白在对照组、FN组、脂质体组、空质粒组和FRNK表达质粒组的表达分别为0.72±0.04、0.91±0.06、0.84±0.05、0.89±0.07和0.29±0.07, FN组较对照组增加26.39%(F = 75.79, P<0.01), FRNK表达质粒组较空质粒组下降67.42%(P<0.01, 图3). HSCs ERK mRNA在对照组、FN组、脂质体组、空质粒组和FRNK表达质粒组的表达分别为0.75±0.09, 1.04±0.09, 1.02±0.10, 1.04±0.14和0.13±0.12, FN组较对照组增加38.67%(F = 37.99, P<0.01), FRNK表达质粒组较空质粒组下降87.50 %(P<0.01, 图4).
以胶原为主的细胞外间质成分在肝组织内的过度沉积是肝纤维化的主要病理特征; HSCs是肝脏合成细胞外间质的最主要细胞, 因此, HSCs活化并合成大量胶原是肝纤维化发生发展的中心环节[1-2].
FAK在调节黏着斑复合物组装及活化下游信号分子方面具有重要作用, 可参与细胞的增殖、凋亡以及胶原代谢等多种生物学效应[3,7-8]. FAK的C-端区包含一个黏着斑定位序列(focal adhesion target, FAT), 其作用是促进FAK定位于黏着斑. FRNK是FAK单独表达C-末端结构域产生的一个FAK相关非激酶蛋白, FRNK虽缺乏激酶区, 但可以作为FAK的一种内源性抑制因子, 通过与FAK竞争在黏着斑上的结合位点参与体内FAK功能的负向调节[4-5]. 所以FRNK可以通过抑制FAK的功能而产生多种生物学效应[9-10]. 本研究通过体外培养HSCs, 在脂质体介导下瞬时转染含FRNK的质粒, 通过3H-Pro掺入技术发现: FN组胶原的合成显著高于对照组(364.33±19.29 vs 257.83±22.59); FRNK质粒组胶原的合成较空质粒组(498.17±73.20 vs 748.33±61.30)下降了33.43%. 表明FRNK能够抑制HSCs的胶原合成.
p-FAK(Tyr397)是FAK的主要磷酸化位点之一, 是FAK自身磷酸化并转变为活性状态的关键部位. FAK活化后, 可通过丝裂原活化蛋白激酶(mitogen activated protein kinases, MAPK)途径引起级联反应, 该信号传导通路可参与细胞迁移、增殖等多种功能活动[11-14]. Hayashida et al[15]证实FAK-ERK信号通路在人肾系膜细胞中可调节TGF诱导的胶原合成.
实验观察到, FN诱导HSCs后, 随着FAK及其磷酸化水平的上调, ERK1及ERK磷酸化水平增加, HSCs胶原合成增加; FRNK过表达后, 随着p-FAK(Tyr397)表达下调, ERK1及ERK磷酸化水平降低, HSCs胶原合成受到抑制. 从而证实FAK-ERK信号传导通路可能参与了FRNK对HSCs胶原合成的负调控作用.
肝星状细胞(HSCs)活化、增殖进而合成大量以Ⅰ型胶原为主的细胞外间质成分, 是各种肝脏损伤引起肝纤维化的中心环节. 探讨能够抑制HSCs胶原合成的方法及机制对防治肝纤维化具有重要意义.
沈薇, 教授, 重庆医科大学附属第二医院消化内科
细胞内信号转导通路可参与细胞的增殖、凋亡以及胶原的代谢等多种生物学效应, FAK处于细胞内多条信号转导通路的交汇点, FAK-ERK信号转导通路是该领域的研究热点之一.
本研究首次运用阳离子脂质体转染FRNK质粒技术, 研究了FAK-ERK信号转导通路对HSCs胶原合成的影响, 证实FAK-ERK信号传导通路可能参与了FRNK对HSCs胶原合成的负调控作用.
本研究通过体外实验证实FAK-ERK信号传导通路可能参与了FRNK对HSCs胶原合成的负调控作用, 这为临床上抑制HSCs胶原合成、逆转肝纤维化提供了新的理论依据和治疗策略.
FRNK与HSC增值以及胶原代谢的关系是该课题小组多年延续的项目, 国内未见其他研究者的报道, 具有一定的新意. 本研究是在既往研究基础的深化, 设计合理, 方法成熟可靠, 结果可信, 对探索肝纤维化的机制、寻找新的治疗途径有一定价值.
编辑: 李军亮 电编:何基才
| 1. | Li JT, Liao ZX, Ping J, Xu D, Wang H. Molecular mechanism of hepatic stellate cell activation and antifibrotic therapeutic strategies. J Gastroenterol. 2008;43:419-428. [PubMed] [DOI] |
| 2. | Hui AY, Friedman SL. Molecular basis of hepatic fibrosis. Expert Rev Mol Med. 2003;5:1-23. [PubMed] [DOI] |
| 3. | Reif S, Lang A, Lindquist JN, Yata Y, Gabele E, Scanga A, Brenner DA, Rippe RA. The role of focal adhesion kinase-phosphatidylinositol 3-kinase-akt signaling in hepatic stellate cell proliferation and type I collagen expression. J Biol Chem. 2003;278:8083-8090. [PubMed] [DOI] |
| 4. | van Nimwegen MJ, van de Water B. Focal adhesion kinase: a potential target in cancer therapy. Biochem Pharmacol. 2007;73:597-609. [PubMed] [DOI] |
| 5. | Parsons JT. Focal adhesion kinase: the first ten years. J Cell Sci. 2003;116:1409-1416. [PubMed] [DOI] |
| 6. | Shen JG, Zhang XL, Huo XX. [The role of FAK-ERK signal transduction pathway in apoptosis of hepatic stellate cell]. Zhonghua Ganzangbing Zazhi. 2008;16:849-853. [PubMed] |
| 7. | Park EK, Park MJ, Lee SH, Li YC, Kim J, Lee JS, Lee JW, Ye SK, Park JW, Kim CW. Cholesterol depletion induces anoikis-like apoptosis via FAK down-regulation and caveolae internalization. J Pathol. 2009; Jan 29. [Epub ahead of print]. [PubMed] |
| 8. | Golubovskaya VM, Kweh FA, Cance WG. Focal adhesion kinase and cancer. Histol Histopathol. 2009;24:503-510. [PubMed] |
| 9. | Kornberg L. Ad-fRNK and Ad-p53 cooperate to augment drug-induced death of a transformed cell line. Anticancer Res. 2006;26:3025-3031. [PubMed] |
| 10. | van Nimwegen MJ, Huigsloot M, Camier A, Tijdens IB, van de Water B. Focal adhesion kinase and protein kinase B ooperate to suppress doxorubicin-induced apoptosis of breast tumor cells. Mol Pharmacol. 2006;70:1330-1339. [PubMed] [DOI] |
| 11. | Chang F, Steelman LS, Shelton JG, Lee JT, Navolanic PM, Blalock WL, Franklin R, McCubrey JA. Regulation of cell cycle progression and apoptosis by the Ras/Raf/MEK/ERK pathway (Review). Int J Oncol. 2003;22:469-480. [PubMed] |
| 12. | Chaturvedi LS, Marsh HM, Basson MD. Src and focal adhesion kinase mediate mechanical strain-induced proliferation and ERK1/2 phosphorylation in human H441 pulmonary epithelial cells. Am J Physiol Cell Physiol. 2007;292:C1701-C1713. [PubMed] [DOI] |
| 13. | Tan TW, Lai CH, Huang CY, Yang WH, Chen HT, Hsu HC, Fong YC, Tang CH. CTGF enhances migration and MMP-13 up-regulation via alphavbeta3 integrin, FAK, ERK, and NF-kappaB-dependent pathway in human chondrosarcoma cells. J Cell Biochem. 2009; Mar 19. [Epub ahead of print]. [PubMed] |
| 14. | Sakurama K, Noma K, Takaoka M, Tomono Y, Watanabe N, Hatakeyama S, Ohmori O, Hirota S, Motoki T, Shirakawa Y. Inhibition of focal adhesion kinase as a potential therapeutic strategy for imatinib-resistant gastrointestinal stromal tumor. Mol Cancer Ther. 2009;8:127-134. [PubMed] [DOI] |
| 15. | Hayashida T, Wu MH, Pierce A, Poncelet AC, Varga J, Schnaper HW. MAP-kinase activity necessary for TGFbeta1-stimulated mesangial cell type I collagen expression requires adhesion-dependent phosphorylation of FAK tyrosine 397. J Cell Sci. 2007;120:4230-4240. [PubMed] [DOI] |