修回日期: 2008-03-03
接受日期: 2008-03-08
在线出版日期: 2008-03-28
目的: 观察逆转录病毒介导绿色荧光蛋白基因在SD大鼠骨髓间充质干细胞(bone marrow stromal cells, BMSCs)中的表达, 为干细胞移植机制的研究提供基础.
方法: 采用密度梯度离心法分离培养BMSCs, 诱导培养液诱导其向成脂肪方向分化, 行细胞表面抗原鉴定, 及油红O染色评价细胞成脂肪情况. 在此基础上, 采用逆转录病毒pLEGFP-N1对细胞进行荧光蛋白标记, 观察细胞形态学改变荧光表达的时间与强度, 计算转染率.
结果: 细胞扩增迅速, 形态良好, 纯度较高, 经诱导后细胞内可见脂滴. 逆转录病毒载体pLEGFP-N1成功标记SD大鼠骨髓间充质干细胞, 并对4 wk体外培养进行了良好的标记.
结论: 逆转录病毒pLEGFP-N1转染效率高, 转染成功的BMSCs可以长期稳定表达目的基因, 是一种理想的病毒载体.
引文著录: 曾智凤, 易著文, 何庆南, 吴小川, 党西强, 何小解, 莫双红. 逆转录病毒介导增强型绿色荧光蛋白基因在大鼠骨髓间充质干细胞中的表达. 世界华人消化杂志 2008; 16(9): 1008-1011
Revised: March 3, 2008
Accepted: March 8, 2008
Published online: March 28, 2008
AIM: To provide basis for the study of stem cell transplantation mechanism by observing the expression of enhanced green fluorescent protein (EGFP) gene mediated by retrovirus in SD rat bone marrow stromal cells (BMSCs).
METHODS: Density gradient centrifugation was conducted to obtain rat BMSCs which were then induced in the adipogenic direction. Their surface antigen and the adipogenic-differentiation potential were detected by oil red O staining. On the basis of the above results, BMSCs were transfected with the recombinant retrovirus pLEGFP-N1 containing EGFP. The morphologic changes of the cells, the expression time and intensity of fluorescent light were observed. The transfection efficiency was calculated.
RESULTS: The morphology and purity of the obtained rat BMSCs were good. The adipocytes were obviously observed after adipogenic induction. EGFP was successfully expressed after BMSCs were transfected with the retroviral vector pLEGFP-N1. The labeled cells were easy to observe within 4 wk.
CONCLUSION: Retrovirus is an ideal vector for high transfection efficiency and long period expression of target genes.
- Citation: Zeng ZF, Yi ZW, He QN, Wu XC, Dang XQ, He XJ, Mo SH. Retrovirus-mediated expression of enhanced green fluorescent protein in rat bone marrow stem cells. Shijie Huaren Xiaohua Zazhi 2008; 16(9): 1008-1011
- URL: https://www.wjgnet.com/1009-3079/full/v16/i9/1008.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i9.1008
骨髓间充质干细胞(bone marrow stromal cells, BMSCs)具有自我更新、多向分化潜能, 易分离培养, 具有巨大的体外扩增潜能, 并且不表达共刺激抗原B7等. 这些特性使得MSC成为近年来成体干细胞研究的热点[1-2]. 起源于中胚层的BMSCs在不同的诱导条件下除具有向中胚层和神经外胚层外组织细胞分化的能力[3-4], 在体外也可诱导分化为肝细胞样或肝系细胞[5-7]. BMSCs移植在肝硬化、重症胰腺炎等疾病领域都展示了诱人的前景[8-10]. 深入认识BMSCs植入后生物学行为, 对于探索其作用机制至关重要. 随着人们对增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)研究的逐渐深入, 解决这一难题成为可能. 本实验旨在探讨逆转录病毒pLEGFP-N1转染BMSCs的可行性, 进而寻找一种较为理想的细胞示踪标记法.
清洁级SD大鼠, 体质量150 g, 由中南大学湘雅二医院实验动物中心提供. F12/DMEM, DMEM培养基, 胰蛋白酶, 胎牛血清为Hyclone公司产品. Ficoll-Paque淋巴细胞分离液为Pharmacia公司产品. 逆转录病毒pLEGFP-N1为Clontech公司产品, 质粒提取试剂盒为Promega公司产品, 脂质体购自Invitrogen公司, PT67包装细胞BD购自Biosciences公司, G418、Polybrene为Aldrich公司产品, 核酸内切酶HindⅢ为TaKaRa产品, 地塞米松、IBMX(3-异丁基-1-甲基黄嘌呤)、胰岛素、吲哚美辛均购自Sigma公司, PE-CD29、fitc-CD34购自Pharmigen公司.
1.2.1 BMSCs培养、成脂肪诱导、表面抗原鉴定: (1)原代、传代培养: 参照薛庆善[18]的体外培养的原理与技术, 稍作改良: 在无菌条件下取SD大鼠股骨、胫骨骨髓细胞, 用密度为1.073×103 g/L Ficoll-Paque淋巴细胞分离液, 采用密度梯度离心联合贴壁培养法分离、纯化MSCs, 得到较纯的贴壁MSCs. 当细胞长满80%瓶壁面积时, 胰酶消化, 细胞变圆时终止消化, 制成单细胞悬液后以1∶1传代, 取第3代细胞进行鉴定和标记实验. (2)成脂肪诱导分化、油红O染色鉴定: 成脂肪诱导培养液, 地塞米松(10-6 mol/L)、IBMX(0.5 mmol/L)、胰岛素(10 mg/L)、吲哚美辛(100 mg/L)、HG-DMEM(含100 mL/L FBS), 每3天换液, 诱导3 wk后, 行油红O染色分析. 具体如下: 消化细胞接种于含预处理小玻片的24孔培养板内, 24 h后取出小玻片经PBS漂洗后用甲醛-钙固定液固定30 min, 进行油红O染色, 甘油胶封片, 置显微镜下观察. (3)表面标记鉴定: 胰酶消化成单细胞悬液, PBS洗涤2次, 分别加入PE或FITC荧光标记的CD29、CD34流式抗体, 4℃孵育30 min, 流式细胞仪检测.
1.2.2 逆转录病毒pLEGFP-N1标记BMSCs: (1)质粒提取、酶切、连接、转化及鉴定: 参照文献[11]的方法, 先对感受态细菌的DH5α进行转化, 铺氨苄青霉素抗性平板, 选菌落进行过夜扩增, 再利用试剂盒从细菌中抽提质粒, 然后HindⅢ酶切质粒4 h, 琼脂糖电泳鉴定. (2)脂质体法转染PT67细胞及阳性克隆的筛选: 参照Invitrogen公司Lipofectamine2000TM转染试剂盒操作说明书进行. 24-48 h倒置荧光显微镜下观察EGFP表达情况, 之后接种在含400 mg/L G418的DMEM培养基的6孔板内, 培养2 wk, 形成十数个抗性克隆. 扩大培养, 更换不含G418的培养基培养48 h, 细胞达到70%左右汇合时吸取上清, 0.45 μm滤膜过滤后冻存于-80℃. (3)病毒滴度的测定: 测定前24 h接种2×105 NIH3T3细胞于6孔板中, 37℃、50 mL/L CO2培养细胞生长达60%汇合时, 将冻存的病毒上清做10-2、10-3、10-4倍稀释, 将1 mL稀释的病毒液加入相应的孔中, 设两个复孔, 并加入多聚季胺(polybrene), 使其终浓度为8 mg/L, 病毒吸附3 h后, 补加3 mL 500 mg/L G418的DMEM培养基继续培养, 2-3 d换液一次, 直至抗性克隆形成并计数. 病毒滴度 = 平均抗性集落数×病毒液稀释倍数, 经G418抗性检测病毒滴度达到2×108 cfu/L. (4) 逆转录病毒转染SD大鼠BMSCs: 收集新鲜高滴度包装细胞株PT67/EGFP-N1上清, 用0.45 μm的滤膜过滤, 再加入终浓度为6 mg/L的Polybrene组成转染液. 收集第3代SD大鼠BMSCs, 按1-2×105个/孔接种于6孔板中, 常规培养12-16 h后, 加入上述转染液, 培养24 h后更换新鲜培养基, 继续培养48 h, G418筛选出阳性克隆.
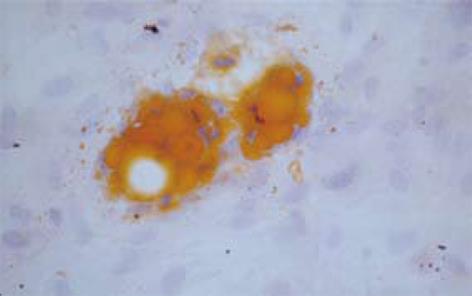
BMSCs在成脂肪诱导培养后细胞形态变得不规则, 诱导2 wk后即可见部分细胞胞内出现数目不等的折光性强的脂滴形成, 到3 wk后可见大部分细胞有脂滴聚集, 部分细胞被脂滴充满, 油红O染色阳性(图1).
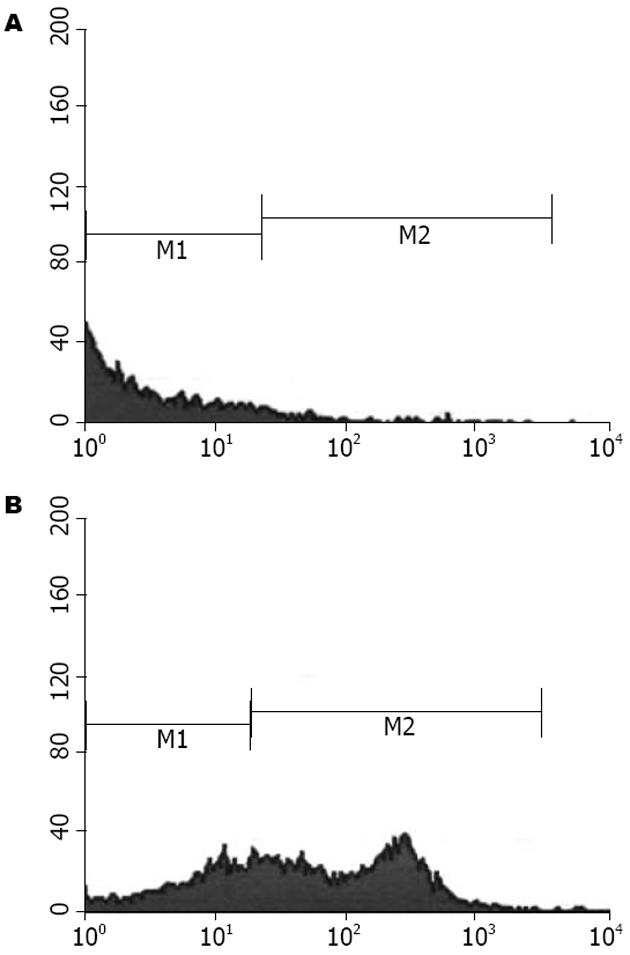
BMSCs表达CD29为(65.15%), 而CD34(10.5%)(图2).
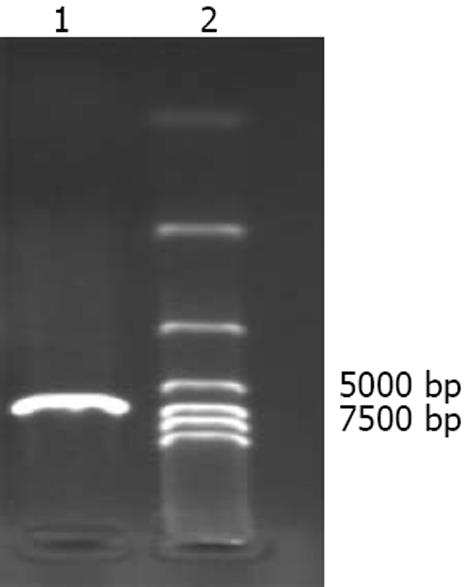
pLEGFP-N1(6.89 kb)含HindⅢ单一酶切位点, 提取质粒经Hind酶切后琼脂糖电泳, 结果与预期值一致(图3).
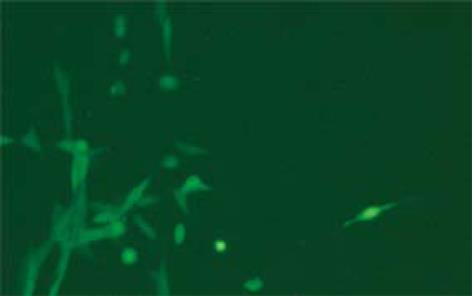
pLEGFP-N1质粒转染PT67细胞后36 h观察到EGFP表达, 经G418筛选后, 超过90%的PT67细胞表达EGFP. 转染BMSCs后2 d普通显微镜下计数细胞数, 同视野下换用蓝色荧光激发光源观察, 计数阳性细胞数, 计算阳性细胞数与该视野下细胞总数的比值, 每孔细胞计数4个视野, 取平均值, 即为此孔细胞pLEGFP-N1的转染率. 同法计算转染后1、2、3 wk的平均转染率. BMSCs转染后2 d, 普通显微镜下可见细胞形态改变, 部分细胞较未转染前变圆, 梭形处收缩; 换用蓝色荧光激发光源观察可见个别细胞出现绿色荧光, 即为表达阳性细胞, 荧光强度极弱. G418筛选1 wk时未感染细胞逐渐死亡, 随换液而清除, 普通显微镜下观察可见细胞形态较前无明显变化, 阳性细胞数增多, 荧光表达增强. 3 wk时转染率超过60%. 传代后阳性细胞比值无明显减少, 荧光强度维持在传代前水平, 高水平表达EGFP. 转染后4 wk荧光强度无明显减弱, 完全可以满足细胞示踪标记的需要(图4).
本实验靶细胞BMSCs是骨髓中的成体干细胞, 因其取材方便, 体外扩增能力强, 具有向多种组织细胞分化的潜能, 可自体移植和不像胚胎干细胞那样涉及伦理道德问题等优点, 近几年受到广泛关注. BMSCs移植技术在相关肝病、胃肠疾病、胰腺疾病等[8-10]方面显示出巨大潜力. 但迄今为止, 还未发现BMSCs特异性表面分子标志, 目前主要是采取多种表面标志组合的表型分析鉴定BMSCs. 本实验结果显示我们分离、培养的细胞高表达CD29、低表达CD34, 说明是骨髓中非造血干细胞来源的干细胞. BMSCs的另外一个重要生物学特征是其多向分化潜能, 包括可分化为成骨细胞、成软骨细胞、肌肉细胞、脂肪细胞等, 这也是支持其临床应用的重要生物学基础. 本实验采用目前文献报道的成熟定向诱导BMSCs分化为成脂肪细胞, 结果显示BMSCs在成脂肪诱导条件下分化为脂肪细胞, 证明此类细胞具有多向分化潜能. 因此我们运用密度梯度离心法成功地分离、培养出较纯的BMSCs.
准确判断MSCs移植是否成活以及在受体内分布情况是深入研究的第一步. 荧光蛋白标记技术是近年来迅速发展起来的一种新型细胞示踪技术, 具有易于检测、表达稳定、特异性强、可以实现活细胞观察等优势, 而EGFP是传统荧光蛋白的突变型, 是在GFP的基础上经碱基修饰改造而来, 荧光强度增加了35倍, 大大提高了检测灵敏度, 是一种较好的报告基因[12-15], 在紫外光或荧光的照射下能自发发出绿色荧光, 观察直观, 易于追踪[16-17]. 而目前研究中所采用的常用示踪标记方法存在很大缺陷, 如荧光素、Hoechst33342等标记时间短且污染周围组织; Y染色体标记虽然效果较好, 但技术要求高, 操作复杂, 花费高, 并不适合干细胞研究中的大量应用. 我们采用EGFP标记大鼠BMSCs获得成功, 结果显示逆转录病毒载体pLEGFP-N1能使标记细胞长期稳定表达EGFP, 没有明显影响细胞活性的现象, 完全可以满足细胞示踪的要求, 为其应用于器官移植打下了良好基础. 这一结果在BMSCs和其他干细胞研究中都将有广泛意义和应用价值.
骨髓间充质干细胞(BMSCs)具有多向分化潜能, 在多种疾病领域显示出广阔的应用前景, BMSCs移植后在受体内的生物学行为引起了人们的极大兴趣, 这需要有效的标记方法将移植细胞与受主细胞区分, 其中绿色荧光蛋白标记技术是最具潜力的标记方法.
陆伦根, 教授, 上海交通大学医学院附属仁济医院消化内科, 上海市消化疾病研究所.
增强型绿色荧光蛋白(EGFP)是近年来发展起来的一种优秀的报告基因, 具有易于检测、表达稳定、特异性强、可以实现活细胞观察等优势, 有望成为BMSCs理想的标记方法.
本文利用逆转录病毒为载体, 使pLEGFP-N1高效转染BMSCs, 转染细胞长期稳定表达EGFP.
逆转录病毒载体pLEGFP-N1成功标记BMSCs, 这使得细胞移植后的深入研究顺利开展成为可能.
本文研究逆转录病毒介导增强型绿色荧光蛋白基因在大鼠骨髓间充干细胞中的表达, 结果显示逆转录病毒pLEGFP-N1转染效率高, 转染成功的BMSCs可以长期稳定表达目的基因, 是一种理想的病毒载体, 全文可取.
编辑: 李军亮 电编:吴鹏朕
| 2. | Verfaillie CM. Adult stem cells: assessing the case for pluripotency. Trends Cell Biol. 2002;12:502-508. [PubMed] [DOI] |
| 3. | Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science. 1997;276:71-74. [PubMed] [DOI] |
| 4. | Deng W, Obrocka M, Fischer I, Prockop DJ. In vitro differentiation of human marrow stromal cells into early progenitors of neural cells by conditions that increase intracellular cyclic AMP. Biochem Biophys Res Commun. 2001;282:148-152. [PubMed] [DOI] |
| 5. | 王 晓, 段 芳龄, 高 天慧. 朱武凌, 陈香宇, 颜伏归, 韩娜,李文晰, 李蔚. 人骨髓多能成体祖细胞的分离培养及向肝细胞样细胞分化的研究. 胃肠病学与肝病学杂志. 2003;12:148-152. |
| 6. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] [DOI] |
| 7. | 孙 嫣, 段 芳龄, 陈 香宇, 孙 艳, 李 玉龙, 曾 艳丽, 王 豪勋. 人骨髓间充质干细胞体外分化为肝细胞样细胞. 胃肠病学和肝病学杂志. 2004;13:244-248. |
| 8. | Cui HF, Bai ZL. Protective effects of transplanted and mobilized bone marrow stem cells on mice with severe acute pancreatitis. World J Gastroenterol. 2003;9:2274-2277. [PubMed] [DOI] |
| 10. | 王 豪勋, 马 军, 段 芳龄, 程 香普, 梅 雪, 唐 芙爱, 郑 鹏远, 薛 乐勋. 骨髓间充质干细胞治疗肝硬化的动物实验研究. 胃肠病学和肝病学杂志. 2006;15:365-368. |
| 11. | 萨姆布鲁克, 拉塞尔. 分子克隆实验指南. 第3版. 北京: 科学出版社 2002; 27-99. |
| 12. | Misteli T, Spector DL. Applications of the green fluorescent protein in cell biology and biotechnology. Nat Biotechnol. 1997;15:961-964. [PubMed] [DOI] |
| 13. | 伍 志坚, 吴 小兵, 曹 晖, 牛 东滨, 王 宏, 侯 云德. 表达绿色荧光蛋白的重组腺病毒伴随病毒的产生. 中华实验和临床病毒学杂志. 2001;15:300-301. |
| 14. | Le LP, Everts M, Dmitriev IP, Davydova JG, Yamamoto M, Curiel DT. Fluorescently labeled adenovirus with pIX-EGFP for vector detection. Mol Imaging. 2004;3:105-116. [PubMed] [DOI] |
| 15. | Magness ST, Jijon H, Van Houten Fisher N, Sharpless NE, Brenner DA, Jobin C. In vivo pattern of lipopolysaccharide and anti-CD3-induced NF-kappa B activation using a novel gene-targeted enhanced GFP reporter gene mouse. J Immunol. 2004;173:1561-1570. [PubMed] [DOI] |
| 16. | Pierce EA, Liu Q, Igoucheva O, Omarrudin R, Ma H, Diamond SL, Yoon K. Oligonucleotide-directed single-base DNA alterations in mouse embryonic stem cells. Gene Ther. 2003;10:24-33. [PubMed] [DOI] |
| 17. | Del Rio M, Larcher F, Serrano F, Meana A, Muñoz M, Garcia M, Muñoz E, Martin C, Bernad A, Jorcano JL. A preclinical model for the analysis of genetically modified human skin in vivo. Hum Gene Ther. 2002;13:959-968. [PubMed] [DOI] |
| 18. | 薛 庆善. 体外培养的原理与技术. 第1版. 北京: 科学出版社 2001; 467-469. |