修回日期: 2008-01-20
接受日期: 2008-01-15
在线出版日期: 2008-03-18
目的: 筛选和克隆肝癌和正常肝组织差异表达的基因片段, 以探讨肝癌的发病机制.
方法: 应用mRNA差异显示技术(mRNA-DD), 比较肝癌及正常肝组织基因表达的差异, 对获得的差异基因片段进行克隆、测序, 测序结果提交GenBank数据库中进行同源性分析, 并对其中一条有明显差异的基因用半定量RT-PCR分析该基因在正常肝组织及肝癌组织中的表达情况.
结果: 凝胶扫描显示在500-600 bp处有一条差异片段, 差异条带经酶切图谱分析证实重组质粒是目的克隆, 将片段测序结果与GenBank数据库进行同源性比较发现该片段与已知基因EEG1高度同源(99%). RT-PCR结果显示在肝癌组织中EEG1 mRNA的表达水平明显低于正常肝癌组织(P = 0.001).
结论: EEG1基因在肝癌组织中的表达明显低于正常肝组织, 提示EEG1基因的表达下调可能与肝癌的发病有关.
引文著录: 黄春玲, 王效民, 张忠英, 邱兴峰, 刘平果, 李岗山, 彭友源. 肝癌差异表达基因EEG1的克隆和鉴定. 世界华人消化杂志 2008; 16(8): 829-832
Revised: January 20, 2008
Accepted: January 15, 2008
Published online: March 18, 2008
AIM: To clone and identify the differentially expressed gene fragments in hepatocellular carcinoma (HCC) and normal liver tissues and to explore the molecular pathogenesis of HCC.
METHODS: Fluorescent mRNA differential display (mRNA-DD) was used to compare the differential gene expression in HCC and normal liver tissue samples. The obtained gene fragments were cloned and sequenced. The sequences were submitted to the GenBank for homologue analysis using BLAST software. RT-PCR was performed to detect the expression of each differential gene fragment in HCC and normal tissue samples.
RESULTS: Gel imaging scan revealed a 500-600 bp differential gene fragment. The sequence of this gene fragment was compared with that in GenBank, showing that this gene fragment was homologous to EEG1 (99%). RT-PCR demonstrated that the expression of this gene fragment was significantly lower in HCC tissue samples than in normal tissue samples (P = 0.001).
CONCLUSION: EEG1 gene expression is much lower in HCC tissue than in normal tissue. Its down-regulated expression in HCC tissues is probably related to the carcinogenesis of HCC.
- Citation: Huang CL, Wang XM, Zhang ZY, Qiu XF, Liu PG, Li GS, Peng YY. Cloning and identification of human hepatocellular carcinoma-related genes. Shijie Huaren Xiaohua Zazhi 2008; 16(8): 829-832
- URL: https://www.wjgnet.com/1009-3079/full/v16/i8/829.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i8.829
原发性肝细胞癌(简称肝癌)是严重危害人类健康的恶性肿瘤之一, 全世界每年新发肝癌约26万例, 其中42.5%分布在中国. 20世纪以来, 我国肝癌年死亡率已上升为恶性肿瘤的第二位, 在城市仅次于肺癌, 在农村仅次于胃癌[1]. 肝癌起病隐匿, 进展迅速, 生存质量差, 生存期短. 为此, 对其发生发展机制的研究成为当前的迫切要求, 随着分子生物学、细胞生物学、分子遗传学和人类基因组学等学科的飞速发展, 人们研究发现肝癌的发生是多因素、多阶段、多基因相互作用的结果. 目前已经发现与人类肝癌的发生有关的基因有: c-erbB-2[2], IGF-Ⅱ[3], p53[4], c-myc[5], TGFα[6], N-ras[7]等, 但仍有许多与肝癌发生发展有关的基因有待进一步确定.
近年来发展了多种筛选差异表达基因的方法, 包括差异显示PCR(differential display)[8], 消减杂交(subtraction hybridization)[9], RDA(representational difference analysis)[10], 基因芯片(microarray)[11]等, 各有其优缺点. 我们利用新近发展起来的荧光标记的差异显示技术对肝癌患者的癌组织和癌旁正常肝组织的基因差异表达进行研究, 以期分离到与肝癌发生发展相关的基因.
外科经手术切除并经病理学确诊的15例肝癌及癌旁正常肝组织标本, 所有病例术前均未接受化学药物的治疗: 男11例, 女4例, 平均年龄45.1岁. 于距肿瘤边缘5 cm外及肿瘤处分别取组织块, 组织离体后立即放入液氮中速冻, 并置于-70 ℃冰箱中保存. TRIzol购自Invitrogen公司, FluoroDD试剂盒购自Genomyx公司, pGEM T-easy试剂盒、Taq DNA聚合酶、DNA回收试剂盒、质粒DNA纯化系统和EcoR Ⅰ酶均购自Promega公司, PCR引物由上海博亚公司合成, DH5α菌株由厦门大学抗癌中心惠赠. Genomyx LR DNA差异显示系统、Genomyx SC荧光图像扫描系统、Mastercycler梯度PCR仪、DU650紫外分光光度计及UVI凝胶成像系统.
参照TRIzol试剂盒说明书提取组织的总RNA, DNaseⅠ清除总RNA中的DNA, 紫外分光光度计测定其浓度及纯度, 10 g/L琼脂糖凝胶电泳检测总RNA质量. 应用Hieroglyph mRNA Profile kit试剂盒进行第一链合成. 选择引物T7(dT12)AP2、T7(dT12)AP7为第一链合成的锚定引物, 各以总RNA 1 μg为模板, 合成cDNA. 反应体系包括1×SuperScriptⅡRT缓冲液, dNTP各25 μmol/L, DTT 10 mmol/L及3 U SuperScriptⅡRT反转录酶, 25 ℃孵育5 min, 42 ℃ 10 min, 50 ℃ 60 min, 72 ℃ 15 min, 至-20 ℃保存待用. 应用FluoroDD Kit试剂盒进行DDRT-PCR扩增: 分别以1.5 μL反转录产物为模板, 体系中包括1×PCR缓冲液Ⅱ, 3.75 mmol/L MgCl2, dNTP各50 μmol/L, 与反转录所用锚定引物相对应的TMR荧光标记的3'端TMR-AP引物0.35 μmol/L, 5'端随机引物ARP 0.35 μmol/L, 及AmpliTaq DNA聚合酶0.5 U, 每一反应总体积为10 μL程序设定如下: 95 ℃预变性2 min, 94 ℃变性15 s, 50 ℃复性30 s, 72 ℃延伸2 min共4个循环, 94 ℃变性15 s, 60 ℃复性30 s, 72 ℃延伸2 min共25个循环, 72 ℃延伸7 min. PCR产物在Genomyx LR电泳仪上样, 在56 g/L聚丙烯酰胺凝胶上以电压3000 V、功率100 W、温度52 ℃的条件电泳4.5 h. 电泳结束后, 将凝胶在荧光图像扫描仪Genomyx SC上扫描. 用手术刀切取含有明显差异的cDNA条带, 加入TE缓冲液50 μL, 37 ℃水浴1 h, 使DNA从胶中溶到TE缓冲液中, 以T7 22-mer(5'-GTAATACGACTCACTATAGGGC-3')和M13 24-mer(5'-AGCGGATAACAATTTCACACAGGA-3')为引物进行再扩增. 扩增条件同第一次PCR. 按凝胶回收试剂盒说明书将扩增产物回收、纯化. 纯化后的片段与pGEM T-Easy载体进行连接反应, 连接产物转化DH5α感受态细胞, 通过α互补实验鉴定阳性克隆, 提取质粒后进行EcoR Ⅰ酶切鉴定. 将提取的阳性克隆质粒DNA纯化及测序(上海博亚公司). 应用BLAST程序将所得到的测序结果与GenBank数据库进行同源性比较. 对感兴趣的片段进行RT-PCR检测, 按序列分析结果设计引物, 上游引物为5'-AAAGCCCAGGATGAGAGGTT-3', 下游引物为5'-ACTGCCGAGGAAGAG TCAAA-3', 扩增产物为326 bp. 以β-actin作内部参照物, 上游引物为5'-CCCTGGACTTCGAGCAAGAGAT-3', 下游引物为5'-GTTTTCTGCGC AAGTTAGG-3'. PCR过程同时设立阴阳对照, 取PCR产物10 μL进行10 g/L琼脂糖凝胶电泳, 紫外灯下观察电泳带, 凝胶成像分析系统(UVI)扫描拍照, 并测定电泳带的密度值, 计算目的片段电泳带密度与β-actin电泳带密度的相对值以衡量目的基因的相对表达水平.
统计学处理 利用SPSS11.0软件包采用非参数检验、配对样本的秩和检验对数据进行分析.
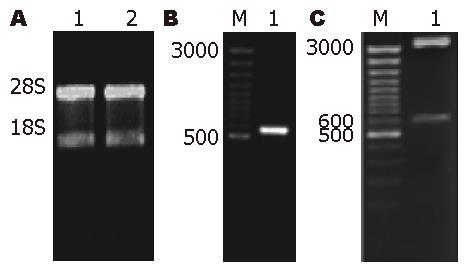
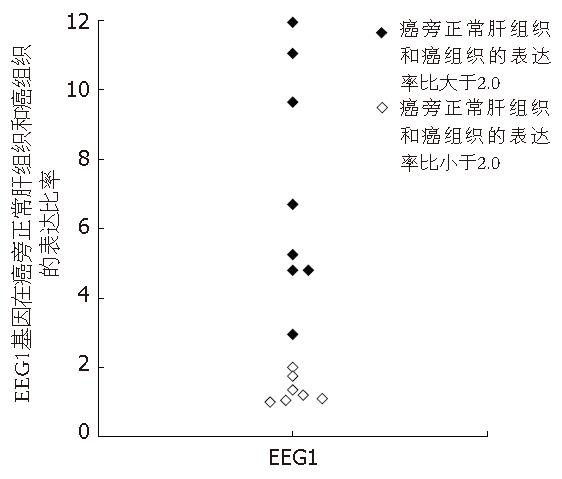
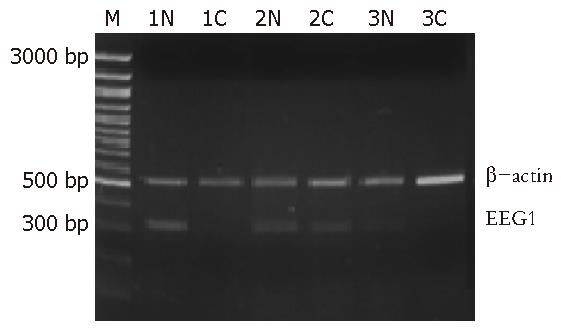
提取的总RNA的纯度经紫外分光光度法检测, A260/A280比值均在1.8-2.0之间, 电泳检测显示提取的RNA条带完整, 28S与18S的比值约为2.0(图1A). 凝胶扫描显示每条泳道均有条带, 条带分布在300-1200 bp且条带清晰. 其中在500-600 bp处有一条差异片段, 在正常肝组织中的表达明显高于癌组织. 将获得的差异条带再次进行PCR扩增, 经琼脂糖凝胶电泳可见明亮清晰的单一条带(图1B)EcoR Ⅰ酶切重组质粒, 得到一约580 bp的片段和约3000 bp的pGEM T-Easy载体, 酶切图谱分析证实重组质粒是目的克隆, 将片段测序结果与GenBank数据库进行同源性比较发现该片段与基因EEG1有99%同源性(图1C). 将EEG1片段在肝癌中的表达状况进行RT-PCR证实后发现, 15例肝癌组织及正常肝组织中, EEG1在肝癌组织中的表达水平显著低于正常肝组织(P = 0.001, 图2, 图3).
mRNA差异显示技术是1992年Liang et al[12]摸索出的用于筛选差异表达基因的一种有效的方法, 经过不断的改进[13-14], 目前这一技术已十分成熟. 他仅需少量的总RNA, 因此所需的组织标本量少, 并且具有简便、灵敏、实验周期短、效率高、可同时比较多种不同生理状态或不同发育阶段的细胞内基因表达差异等优点. 目前该技术已用于多种肿瘤的研究, 是进行分子生物学研究的常用方法. mRNA差异显示技术可以检测出不同生理、病理状态下基因表达的变化, 能有效地筛选肿瘤恶性转化进程中差异表达的基因[15]. 1998年Scuric et al[16]应用mRNA差异显示(DDPCR)技术分析肝癌组织和癌旁正常组织间基因的差异表达情况, 发现其中一个基因在肝癌组织中的表达明显高于正常肝组织, 同源性分析表明该基因与醛化还原酶家族有高度的同源性. 王征旭et al[17]用差异显示法克隆和鉴定了一个肝癌高表达的新基因SWT-2, 研究发现该基因的高表达可能与肝癌细胞的浸润和转移能力有关. Zeng et al[18]用差异显示法分离鉴别了一个在肝癌组织中有很强的表达, 而在癌旁肝组织表达较弱或不表达的新基因HCCA1, 结合临床及病理学的分析表明, HCCA1与HBV或HCV感染、AFP水平及有无肝硬化无关, 而与肝癌的分级、门静脉癌栓形成与否有关.
尽管目前已有不少关于肝癌差异基因的报道, 但由于肝癌的发生是一个多基因参与, 通过不同基因在不同时相的差异表达进行调控的复杂过程[19]. 加强对肝癌相关基因的研究, 必将会加深我们对肝癌本质的认识, 同时能为肝癌早期诊断提供新的分子诊断标记, 为肝癌的基因治疗提供新的可能的靶点. 为此我们应用mRNA差异显示技术研究肝癌及其相应的正常肝组织差异表达的基因, 以期从中筛选出与肝癌发病有关的基因. 我们通过对其中一条差异明显的条带进行克隆, 测序后进行同源性分析发现该序列与已知基因EEG1(embryonic epithelia gene 1)有99%同源性. EEG1又名SLC43A3(solute carrier family 43, member 3)属于膜转运蛋白超家族[20]. EEG1基因是Stuart et al[21]在研究与肾生长发育有关的基因时发现的, 由于该基因在胚胎上皮组织中高度表达, 因此将其命名为"胚胎上皮基因"(EEG1). EEG1位于人11号染色体上, 由14个外显子组成, 全长共20 kb. 研究发现, EEG1在早期的胚胎中高表达, 随着胚胎的发育表达量逐渐下降, 而在成人组织中, 其在成人心脏的表达量最大, 其次是肺、肝、脾和肾. 研究还发现EEG1可编码一种具有膜转运功能的蛋白, 该蛋白可能与胚胎生长发育过程中的营养及代谢物的转运有关. 其具体功能目前尚不十分清楚, 关于该基因在肝癌组织中的表达情况也尚未见到报道. 我们的研究发现EEG1基因在正常肝组织中的表达量较高, 其在肝癌组织中的表达明显低于正常肝组织(P = 0.001), 并通过RT-PCR的验证. 该研究结果提示EEG1在肝癌组织中的表达下调可能与肝癌的发病有关, 该基因的变化可能是肝癌众多发病因素中的某个环节或是病变的结果, 其与肝癌的关系有待进一步的分析.
原发性肝细胞癌(简称肝癌)是严重危害人类健康的恶性肿瘤之一, 尤其近年来在我国肝癌年死亡率已上升为恶性肿瘤的第二位, 发病机制迄今未完全阐明, 治疗棘手, 研究肝癌患者的癌组织和癌旁正常肝组织的基因表达差异, 筛选和克隆肝癌发生, 发展相关的基因, 旨在为探讨肝癌的分子发病机制提供理论依据.
党双锁, 副教授, 西安交通大学第二医院感染科; 杨冬华, 教授, 暨南大学附属第一医院
本文利用差异显示技术研究发现差异表达基因EEG1, 其在肝癌组织中的表达明显低于正常肝组织, 该基因的表达下调可能与肝癌的发病密切相关.
本实验结果提示EEG1在肝癌组织中的表达下调可能与肝癌的发病有关, 虽然目前该工作还处于探索阶段, 但在不久的将来有可能作为肝癌早期诊断的辅助手段而应用于临床.
mRNA差异显示技术: 可同时对多个基因进行分析比较的灵敏、简便的方法, 其基本原理是利用一套带有poly(T)的锚定引物和一套随机引物的组合来覆盖所有的 mRNA家族, 进行反转录和 PCR 扩增以获得不同长度的cDNA片段, 通过测序胶电泳将大小不同的 cDNA片段分离以进行比较.
本文方法先进, 图表清晰, 结果可信.
编辑: 程剑侠 电编: 吴鹏朕
| 1. | 肖 开银, 彭 民浩. 原发性肝癌流行病学研究进展. 中国普外基础与临床杂志. 2000;7:272-274. |
| 2. | Niu ZS, Wang M. Expression of c-erbB-2 and glutathione S-transferase-pi in hepatocellular carcinoma and its adjacent tissue. World J Gastroenterol. 2005;11:4404-4408. [PubMed] [DOI] |
| 3. | Tsai JF, Jeng JE, Chuang LY, You HL, Wang LY, Hsieh MY, Chen SC, Chuang WL, Lin ZY, Yu ML. Serum insulin-like growth factor-II as a serologic marker of small hepatocellular carcinoma. Scand J Gastroenterol. 2005;40:68-75. [PubMed] [DOI] |
| 4. | Sung CO, Yoo BC, Koh KC, Cho JW, Park CK. Prognostic significance of p53 overexpression after hepatic resection of hepatocellular carcinoma. Korean J Gastroenterol. 2005;45:425-430. [PubMed] |
| 5. | Ikeguchi M, Hirooka Y. Expression of c-myc mRNA in hepatocellular carcinomas, noncancerous livers, and normal livers. Pathobiology. 2004;71:281-286. [PubMed] [DOI] |
| 6. | Chung YH, Kim JA, Song BC, Lee GC, Koh MS, Lee YS, Lee SG, Suh DJ. Expression of transforming growth factor-alpha mRNA in livers of patients with chronic viral hepatitis and hepatocellular carcinoma. Cancer. 2000;89:977-982. [PubMed] [DOI] |
| 7. | Kim YC, Song KS, Yoon G, Nam MJ, Ryu WS. Activated ras oncogene collaborates with HBx gene of hepatitis B virus to transform cells by suppressing HBx-mediated apoptosis. Oncogene. 2001;20:16-23. [PubMed] [DOI] |
| 8. | Kim DG. Differentially expressed genes associated with hepatitis B virus HBx and MHBs protein function in hepatocellular carcinoma. Methods Mol Biol. 2006;317:141-155. [PubMed] |
| 9. | Dong XY, Pang XW, Yu ST, Su YR, Wang HC, Yin YH, Wang YD, Chen WF. Identification of genes differentially expressed in human hepatocellular carcinoma by a modified suppression subtractive hybridization method. Int J Cancer. 2004;112:239-248. [PubMed] [DOI] |
| 10. | Huang R, Xing Z, Luan Z, Wu T, Wu X, Hu G. A specific splicing variant of SVH, a novel human armadillo repeat protein, is up-regulated in hepatocellular carcinomas. Cancer Res. 2003;63:3775-3782. [PubMed] |
| 11. | Cheung ST, Leung KL, Ip YC, Chen X, Fong DY, Ng IO, Fan ST, So S. Claudin-10 expression level is associated with recurrence of primary hepatocellular carcinoma. Clin Cancer Res. 2005;11:551-556. [PubMed] |
| 12. | Liang P, Pardee AB. Differential display of eukaryotic messenger RNA by means of the polymerase chain reaction. Science. 1992;257:967-971. [PubMed] [DOI] |
| 13. | Lohmann J, Schickle H, Bosch TC. REN display, a rapid and efficient method for nonradioactive differential display and mRNA isolation. Biotechniques. 1995;18:200-202. [PubMed] |
| 14. | 郝 纯毅, 赵 敏, 李 勇, 邢 宝才, 吕 有勇, 黄 信孚. 降低mRNA差异显示技术假阳性率的一种方法. 中国生物化学与分子生物学报. 2002;18:110-114. |
| 15. | Chung JG, Yeh KT, Wu SL, Hsu NY, Chen GW, Yeh YW, Ho HC. Novel transmembrane GTPase of non-small cell lung cancer identified by mRNA differential display. Cancer Res. 2001;61:8873-8879. [PubMed] |
| 16. | Scuric Z, Stain SC, Anderson WF, Hwang JJ. New member of aldose reductase family proteins overexpressed in human hepatocellular carcinoma. Hepatology. 1998;27:943-950. [PubMed] [DOI] |
| 18. | Zeng JZ, Wang HY, Chen ZJ, Ullrich A, Wu MC. Molecular cloning and characterization of a novel gene which is highly expressed in hepatocellular carcinoma. Oncogene. 2002;21:4932-4943. [PubMed] [DOI] |
| 19. | Wang XW, Hussain SP, Huo TI, Wu CG, Forgues M, Hofseth LJ, Brechot C, Harris CC. Molecular pathogenesis of human hepatocellular carcinoma. Toxicology. 2002;181-182:43-47. [PubMed] [DOI] |
| 20. | Hediger MA, Romero MF, Peng JB, Rolfs A, Takanaga H, Bruford EA. The ABCs of solute carriers: physiological, pathological and therapeutic implications of human membrane transport proteinsIntroduction. Pflugers Arch. 2004;447:465-468. [PubMed] [DOI] |
| 21. | Stuart RO, Pavlova A, Beier D, Li Z, Krijanovski Y, Nigam SK. EEG1, a putative transporter expressed during epithelial organogenesis: comparison with embryonic transporter expression during nephrogenesis. Am J Physiol Renal Physiol. 2001;281:F1148-F1156. [PubMed] |