修回日期: 2008-01-15
接受日期: 2008-01-25
在线出版日期: 2008-02-28
目的: 对人DNA聚合酶δ进行纯化和鉴定, 通过检测β-L-D4A对人DNA聚合酶β和δ的作用, 观察β-L-D4A的毒副作用.
方法: 运用多次离子交换层析的方法提取、纯化人Hela细胞的DNA聚合酶δ; 检测β-L-D4A对人DNA聚合酶β和δ的酶动力学作用.
结果: 提纯并鉴定了DNA聚合酶δ, 收得率是15%, 比活力是1911 Ukat/mg. β-L-D4A为抑制剂时, 对人DNA聚合酶β和δ的酶动力学参数分别是Km = 1.86 μmol/L, 2.45 μmol/L, IC50 = 25.21 μmol/L和150.1 μmol/L, Ki = 24.03 μmol/L和132.7 μmol/L, 结果均提示β-L-D4A对DNA聚合酶β和δ的抑制作用远小于拉米夫定.
结论: β-L-D4A是人DNA聚合酶β和δ的竞争性抑制剂, 他对这两种酶的毒副作用远小于拉米夫定, 可望成为更高效低毒的抗HBV类药物.
引文著录: 李岩, 林菊生, 张颖慧, 王晓燕, 何星星, 汪鸿, 高玲玲. 新型核苷类似物β-L-D4A对人DNA聚合酶β和δ的作用及其机制. 世界华人消化杂志 2008; 16(6): 621-628
Revised: January 15, 2008
Accepted: January 25, 2008
Published online: February 28, 2008
AIM: To purify and characterize the DNA polymerase δ and investigate the side effects of β-L-D4A (a novel nucleoside analog) on human DNA polymerases β and δ.
METHODS: Human DNA polymerase δ was separated from crude extract of human Hela cells by ion exchange chromatography. Detailed kinetic parameters were determined for β-L-D4A against DNA polymerases β and δ.
RESULTS: Human DNA polymerase δ was purified and characterized with a yield of 15% and a specific activity of 1911 Ukat/mg. When β-L-D4A was used as an inhibitor, the kinetic parameters of human DNA polymerases β and δ were Km = 1.86 μmol/L and 2.45 μmol/L, IC50 = 25.21 μmol/L and 150.1 μmol/L, Ki = 24.03 μmol/L and 132.7 μmol/L, respectively, suggesting that the inhibitory effect of β-L-D4A on human DNA polymerases β and δ was less than that of lamivudine.
CONCLUSION: β-L-D4A is a competitive inhibitor of DNA polymerases β and δ. Its toxic side effects on DNA polymerases β and δ are less than lamivudine. It can be expected to become a high efficient and low toxic anti-HBV agent.
- Citation: Li Y, Lin JS, Zhang YH, Wang XY, He XX, Wang H, Gao LL. Effect of β-L-D4A on human DNA polymerases β and δ and its mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 621-628
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/621.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.621
乙型肝炎病毒(HBV)是一种全球性广泛传播的传染病[1], 我们在前一项国家自然基金课题"抗乙肝病毒药物筛选模型和新化合物的研究"的强力资助下[2], 发现一种新型抗HBV化合物(β-L-D4A). 我们对其体外抗HBV作用进行研究, 发现他具有比拉米夫定具有更强的抑制HBV DNA复制的作用[3-4]. 因为核苷及核苷类似物在抗病毒逆转录酶的同时, 其最大的副作用就是对正常组织中存在的DNA聚合酶也有抑制作用, 从而对宿主细胞和线粒体具有较大的毒性, 因此本课题对该药物进行毒副作用的研究[5].
迄今为止, 在哺乳类细胞中已发现数十种DNA聚合酶, 其中负责DNA修复的关键酶是DNA聚合酶β[6], 而DNA聚合酶δ则是领头链的主要复制酶, 在染色体DNA复制中起着重要作用, 而且他与染色体DNA的修复也密切相关[7-8]. 鉴于这两种DNA聚合酶的重要作用, 本课题购买DNA聚合酶β并于国内首次提纯DNA聚合酶δ并鉴定其活性和纯度, 采用体外DNA聚合酶活性抑制实验来测定我们发现的新型化合物(β-L-D4A)的毒副作用.
人DNA聚合酶β购自R&D公司. β-L-D4A三磷酸盐由武汉大学药学院协助化学合成, 拉米夫定三磷酸盐由美国yale大学药学院YC. Cheng教授提供. HeLa细胞由华中科技大学同济医学院免疫教研室馈赠, 二乙氨基乙基纤维素即DEAE纤维素(DE-52)和磷酸纤维素(P11)购自Whatman公司, 羟基磷灰石(HTP)购自Bio-Rad 公司, 检测酶活性所需要的底物α-32P-dTTP购自Amersham, 活化小牛胸腺DNA购自于Sigma公司, 抗DNA聚合酶δ的mAb购自ABR-Affinity BioReagents, 其他试剂购自Gibco.
1.2.1 人DNA pol δ的纯化及鉴定: 无特殊说明, 所有的缓冲液均包含1 mmol/L DTT, 0.1 mmol/L EDTA和0.01% NP-40, 在P11层析中不加NP-40, 而在HTP层析步骤中不加EDTA. 所有的步骤均在0-4 ℃进行. (1)细胞处理: 细胞进行常规培养, 收集处于对数生长期的HeLa细胞进行冰冻, 取40 g冰冻HeLa细胞于冰上重悬于含有50 mmol/L Tris-Cl(pH7.9), 1 mmol/L EDTA, 0.5 mmol/L DTT, 300 mL/L甘油的溶液中, 用Dounce匀浆器30 min冰上匀浆进行破细胞. 收集所得液体, 加入KCl使其终浓度为200 mmol/L, 缓慢搅拌10 min, 40000 g离心60 min, 收集上清, 加入EDTA使其终浓度为2 mmol/L, 获得成分A. 测定活性和蛋白浓度. (2)P11处理: 将上步所得成分A用Hepes调整pH为7.2, 用4倍体积的10 mmol/L Hepes(pH7.2), 100 mL/L丙三醇稀释. 加入80 mL已用50 mmol/L Hepes(pH7.2), 100 mL/L丙三醇平衡好的P11中, 缓慢混合1 h, 4000 r/min离心5 min, 弃上清. 沉淀用400 mL的Tris-Cl(pH7.6), 50 mmol/L KCl的缓冲液进行重悬和再沉淀. 沉淀再次重悬于160 mL含有0.4 mol/L KCl的平衡液中, 4000 r/min离心5 min, 保留上清, 该步骤重复2次, 将两次所得上清混合后, 用滤网除去溶液中所含的P11颗粒, 获得成分B. 取少量测定蛋白量及酶活性. (3)HTP层析: 将上步成分B加入已用50 mmol/L Tris-Cl(pH7.6)和0.2 mol/L KCl平衡好的P11柱子(2.6 cm×30 cm)上(参见Bio-Rad公司试剂说明书), 2倍于柱子体积的相同平衡液进行洗脱. 然后, 选用含有0.2 mol/L KCl的5倍于柱子体积的0.005-0.04 mol/L阶梯浓度梯度的pH7.6的KPO4进行洗脱. 收集洗脱液, 并进行测定A280, 结果显示在0.015-0.02 mol/L KPO4出现了一个较宽的峰值. 将峰值处所得溶液分别收集后, 将其余所得成分用固体蔗糖浓缩12 h, 使其体积为1/5, 然后加到500 mL Tris-Cl(pH7.6)中透析12 h, 得到成分C. 取少量测定蛋白量及酶活性. (4)DE-52层析: 将上步所得C用Tris-OH调整pH为8.5, 用4倍体积的10 mmol/L Tris-Cl(pH8.5)稀释后, 加入到已用50 mmol/L Tris-Cl(pH8.5)平衡好的DE-52的柱子(1.2 cm×10 cm)上, 用2倍于柱子体积的相同平衡液进行洗脱. 然后, 选用含有50 mmol/L Tris-Cl(pH8.5)的8倍于柱子体积的0.01-0.35 mol/L阶梯浓度梯度的KCl进行洗脱. 收集洗脱液, 并进行测定A280, 结果显示在0.1 mol/L KCl处出现了一个尖耸的峰值, 用15倍柱子体积的0.1 mol/L KCl缓冲液再次洗脱, 收集洗脱液, 与0.05-0.15 mol/L处所得洗脱溶液相混合, 取少量测定蛋白量及酶活性. (5)蛋白浓度测定: 用Bradford法试剂盒测定, 按照使用说明书进行操作. (6)酶活性检测反应体系: 反应体系包括: DNA pol δ 2 μL, 50 μmol/L dCTP, 50 μmol/L dGTP, 50 μmol/L dATP, 50 μmol/L α-32Pd TTP(100 cpm/pmol), 100 mg/L活化DNA, 50 mmol/L Tris-HCl, pH7.5, 0.5 mmol/L MnCl2, 100 mmol/L KCl, 2.5 mmol/L DTT, 总反应体系为50 μL, 37 ℃孵育15 min后, 转到DE81滤纸上, 50 g/L Na2HPO4洗涤3次, 每次10 min, 双蒸水洗涤2次, 每次5 min, 最后用液闪法进行计数测定. (7)SDS-PAGE变性-聚丙烯酰胺凝胶电泳: 堆积胶5%, 所用电压为80 V, 分离胶为10%, 电压120 V, 考马斯亮蓝染色, 脱色后在凝胶成像系统下拍摄. (8)Western blot: DE52层析后组分进行Western blot, 4 ℃转移过夜, 50 g/L脱脂奶粉封闭30 min, 鼠抗DNA聚合酶δ(1:1000)室温孵育1.5 h, 羊抗鼠二抗孵育, 最后用DAB在膜上显色.
1.2.2 药物对DNA pol β和δ的活性抑制测定: (1)测定Km: 以拉米夫定的三磷酸盐为对照, 选择1, 3, 5, 7, 10 μmol/L α-32Pd TTP(100 cpm/pmol), 加入药物10 μmol/L, 其他条件同酶活性检测反应体系, 当进行DNA pol β的测定时, 将DNA pol δ换成等单位的DNA pol β, 进行液闪测定. 数据选用Graphpad prism 4 Demo软件进行Lineweaver-Burk双倒数作图求得Km. (2)测定IC50: 参照所求Km, α-32Pd TTP(100 cpm/pmol)浓度为3 μmol/L, 药物浓度进行浓度梯度设定, 其他同酶活性检测反应体系, 同样当进行DNA pol β的测定时, 将DNA pol δ换成等单位的DNA pol β, 进行液闪测定. 抑制率(%) = (1-药物组液闪计数/空白对照液闪计数)×100%. (3)测定Ki: 参照所求IC50, 选择五个不同的药物浓度梯度, 分别与2和5 μmol/L α-32Pd TTP(100 cpm/pmol)作用, 其余试剂同酶活性检测反应体系, 同样当进行DNA pol β的测定时, 将DNA pol δ换成等单位的DNA pol β, 测定液闪计数. 用Dixon作图法求Ki.
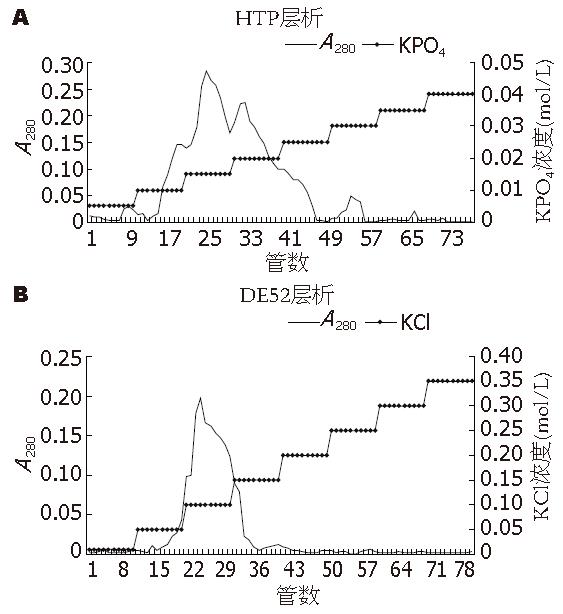
2.1.1 HTP层析: 细胞的处理及P11处理的目的是去除大量的核酸及杂蛋白. HTP层析柱经梯度KPO4洗脱后依次测定收集管内的洗脱液A280值, 发现当用0.015 mol/L洗脱时, 在第21管开始逐渐出现一个较大的洗脱峰, 33管附近出现一个小的洗脱峰, 到用0.025 mol/L KPO4缓冲液洗脱大约45管时A280开始明显下降. 说明该蛋白主要集中在从0.015 mol/L至0.02 mol/L KPO4缓冲液洗脱的部分, 分别收集两峰部分的洗脱液, 进行酶的活性鉴定, 证实了前一个峰含有目的蛋白组分, 后一个峰则为杂蛋白. 用Bradford法试剂盒测定蛋白浓度, 经计算蛋白量是13 mg(图1A).
2.1.2 DE52层析: DE52层析柱经梯度KCl洗脱时测定A280值, 结果显示峰值集中在21-30管的收集液中, 这时所用的KCl缓冲液浓度是0.1 mol/L, 收集0.05-0.15 mol/L KCl洗脱的11-40管洗脱液, 取少量测定蛋白量及酶活性, 证实其正是目的蛋白, 量为0.36 mg(图1B).
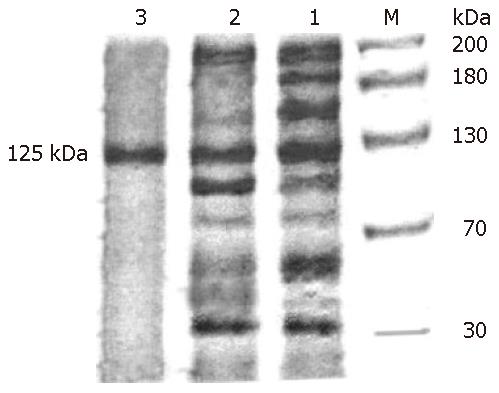
2.1.3 SDS-PAGE和Western blot: 将每个步骤所得蛋白浓缩后进行SDS-PAGE电泳, 发现其杂蛋白条带逐渐减少, 最后显示仅余一条蛋白带, 为鉴定该条带是否为目的蛋白, 对DE52层析后组分进行Western blot, 证实了该蛋白确实是目的蛋白DNA聚合酶δ, 说明该蛋白得到了有效的纯化(图2, 图3).
2.1.4 纯化过程中对每一步的总蛋白、总活力、比活力、纯化倍数以及收得率进行比较: 随着纯化步骤的深入, 总蛋白和总活力呈逐步下降的趋势, 而比活力和纯化倍数则逐步升高, 收得率则逐步降低, 表明杂蛋白逐渐减少而目的蛋白逐步得到纯化(表1).
| 步骤 | 总蛋白/mg | 总活力/Ukat | 比活力/(Ukat/mg) | 纯化倍数 | 收得率(%) |
| 细胞粗提成分 | 88 | 4460 | 51 | 1 | 100 |
| P11处理后成分 | 30 | 3321 | 110 | 2 | 74 |
| HTP层析 | 13 | 2558 | 197 | 4 | 57 |
| DE52层析 | 0.36 | 688 | 1911 | 37 | 15 |
2.2.1 Km的测定: β-L-D4A对DNA聚合酶β的作用, 无任何抑制剂时, 其直线回归方程为y = 7.981x+6.051(r2 = 0.9962), 经计算得Km值为1.33 μmol/L; 拉米夫定做抑制剂时, y = 11.640x+6.165(r2 = 0.9992), Km值为1.89 μmol/L, 而β-L-D4A是抑制剂时, y = 10.984x+5.918(r2 = 0.9994), Km值为1.86 μmol/L如(图4A). β-L-D4A对DNA聚合酶δ的作用, 无任何抑制剂时, 其直线回归方程为y = 8.889+17.486x(r2 = 0.9994)经计算得Km值为1.96 μmol/L; 拉米夫定做抑制剂时, y = 9.162+26.666x(r2 = 0.9992), Km值为2.91 μmol/L, 而β-L-D4A是抑制剂时, y = 8.766+21.467x(r2 = 0.9994), Km值为2.45 μmol/L(图4B).
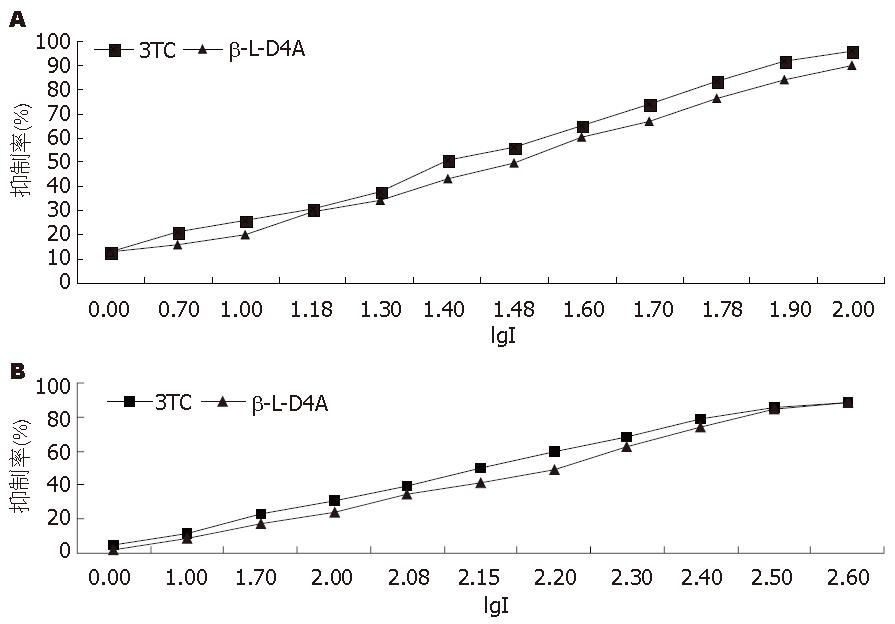
2.2.2 IC50的测定: 采用半对数作图, β-L-D4A对DNA聚合酶β的作用, 拉米夫定的IC50是20.14 μmol/L, 而β-L-D4A的IC50是25.21 μmol/L(图5A). β-L-D4A对DNA聚合酶δ的作用, 拉米夫定的IC50是127.5 μmol/L, 而β-L-D4A的IC50是150.1 μmol/L. β-L-D4A对两种酶的半数抑制浓度均大于拉米夫定(图5B).
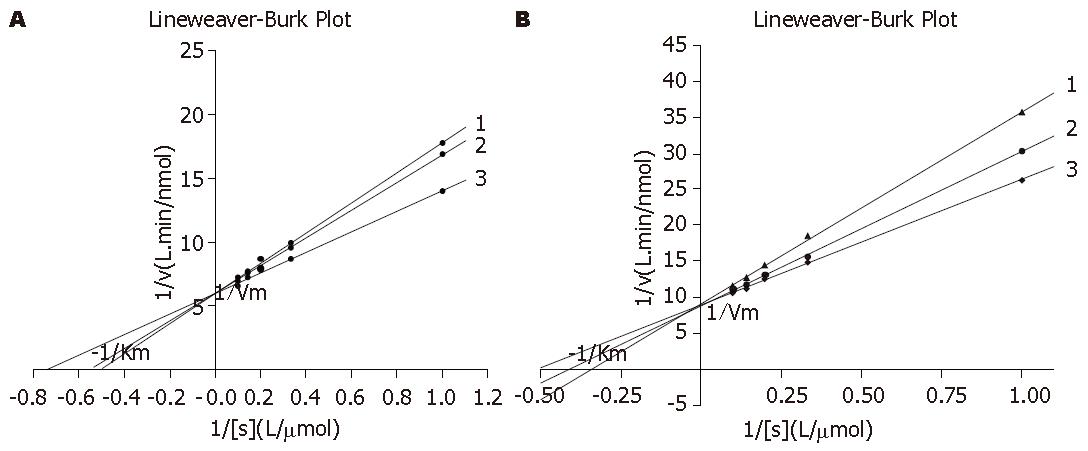
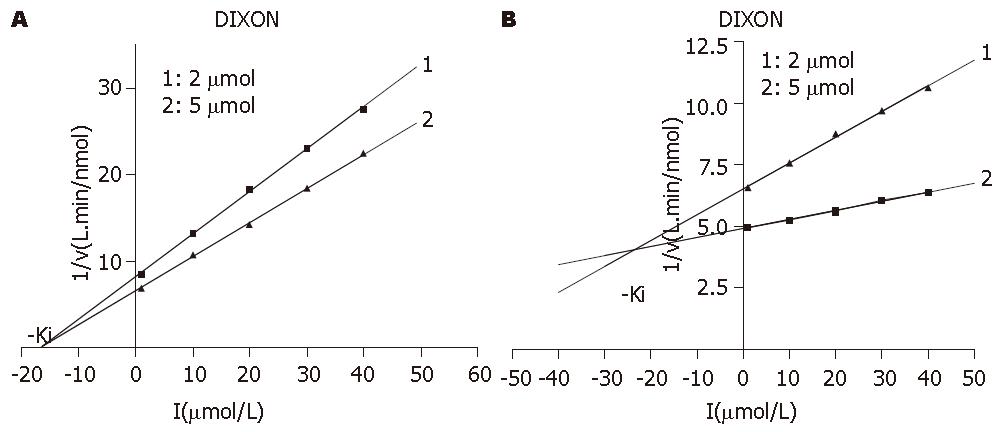
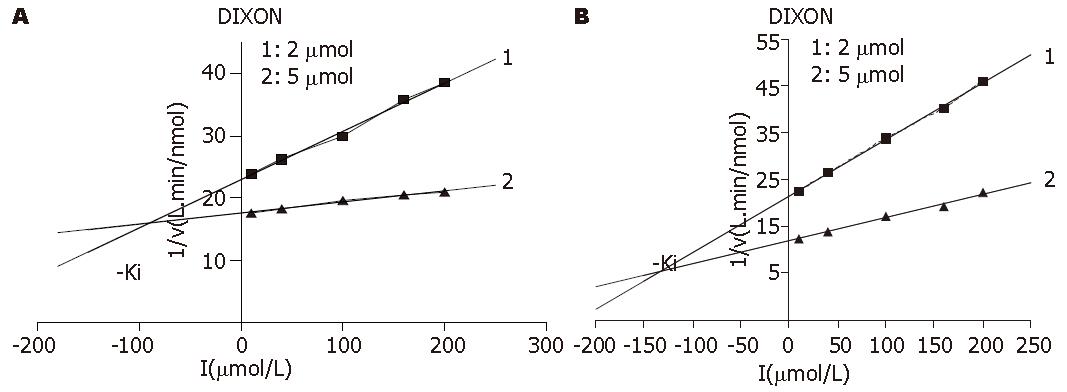
2.2.3 Ki的测定: 图中两直线交点的横坐标的绝对值即是Ki. 图6是化合物对人DNA聚合酶β的Ki测定. 图6A是拉米夫定, 两条直线回归方程分别是: y = 0.490x+8.130(r2 = 0.9992), y = 0.394x+6.567(r2 = 0.9994), 计算得Ki = 16.15 μmol/L, 图6B是β-L-D4A, 两条直线回归方程分别为: y = 0.105x+6.555(r2 = 0.9970), y = 0.037x+4.926(r2 = 0.9944), 计算得Ki = 24.03 μmol/L. 图7是化合物对人DNA聚合酶δ的Ki测定, 图7A是拉米夫定, 两条直线回归方程分别为: y = 0.078x+22.896(r2 = 0.9948), y = 0.018x+17.520(r2 = 0.995), 计算得Ki = 89.6 μmol/L. 而图7B是β-L-D4A, 两条直线回归方程分别为: y = 0.121x+21.432(r2 = 0.9986), y = 0.049x+11.944(r2 = 0.9923), 计算得Ki = 132.7 μmol/L.
近年来, 对HBV感染的治疗主要是α-干扰素和核苷类化合物[9]. 前者的持久应答率低, 需要胃肠外投药, 以及高费用等缺点限制了其应用[10-11]. 核苷类化合物如拉米夫定(3TC), 治疗费用较低, 而且可以经口服用, 比较方便, 但实验研究与临床应用结果均表明, 停药后病毒复制又重新恢复, 而且耐药株与变异株的产生随着用药时间的延长而增加[12-13]. 因此, 抗HBV新药的研制是一项十分紧迫的研究课题. 前期实验中β-L-D4A强大的抑制病毒逆转录酶的作用, 使其有可能成为新型的我国自主研制开发的临床药物[14-15]. 为对该药物做系统的全面的评估, 我们采用现在国际上公认的对核苷类药物毒副作用机制的研究体系即体外进行药物对酶的动力学研究, 观察药物对纯化的正常DNA聚合酶的抑制作用, 以便于作出全面的评价[16].
在真核生物中存在着多种DNA聚合酶, 如DNA聚合酶α参与染色体DNA的复制[17-18], DNA聚合酶β主要负责修复[19-20], DNA聚合酶γ负责线立体DNA的复制[21-22], 而DNA pol δ则参与了复制和修复两个重要过程[23-24]. 因为他是细胞核染色体DNA领头链的主要复制酶, 同时也具有非常独特的内在的3'→5'核酸外切酶的活性[25]. 这四种DNA聚合酶占DNA聚合酶总量的90%以上, 因此, 我们对这四种主要的DNA聚合酶进行了研究, 其中DNA聚合酶α和γ已投稿, 本研究主要报告β和δ的研究结果.
在检测所有样本中DNA聚合酶活性之前, 必须建立体外检测酶活性的最佳条件. DNA聚合酶的最佳反应体系是: Mn2+, 0.5 mmol/L; 50 mmol/L Tris-HCl; pH7.5; 37 ℃; 1 mmol/L β-巯基乙醇和1 mmol/L EDTA. 缓冲液中β-巯基乙醇﹑EDTA和乙二醇的加入对保持缓冲液的稳定性和酶活性具有重要意义. 尽管离子交换层析的柱反应对条件改变相当敏感, 但是摸索到合适条件时, 层析分离的方法简单且具有重复性.
在本实验中, 经过SDS-PAGE有一条Mr 125000的带, 与不同方法获得的不尽相同. 这主要是因为酶的翻译后修饰有关, 而且在纯化过程中, 广泛的蛋白水解作用也会导致酶形式的不同[26]. 从结果中我们可以看到, 随着纯化的一步步进行, 总蛋白和总活力在减少, 而比活力逐渐增加. SDS-PAGE中, 条带逐渐减少直至一条, Mr 125000, Western blot证实了其特异性, 而比活力为1911 Ukat/mg则证实了该纯化方法是有效的. 所得的DNA pol δ为核苷类药物毒副作用的研究打下了基础.
一般认为, 核苷类化合物在进入细胞后, 经过磷酸化由一磷酸化合物至二磷酸化合物, 最后形成三磷酸化合物才能类似于正常的核苷酸参与到核苷酸链的延伸反应, 从而达到DNA链的终止反应. 因此, 我们选择了两种药物的三磷酸形式进行本实验[27-28].
本实验结果显示: 两种药物对两种酶DNA聚合酶β和δ Km的测定显示三条直线均交于y轴, 而在x轴的截距各不相同, 即抑制剂的加入, 改变了Km, 而最大反应速度Vmax不变, 提示拉米夫定和β-L-D4A均是两种DNA聚合酶的竞争性抑制剂. 这提示拉米夫定和β-L-D4A可能都是在抑制HBV DNA复制的过程中, 由于DNA聚合酶β和δ具有与HBV逆转录酶相同的作用底物, 因此对DNA聚合酶δ也形成了竞争性的抑制.
两个药物对DNA聚合酶β和δ的IC50的测定结果显示, β-L-D4A抑制酶活性降低为50%时的药物浓度分别是25.21 μmol/L和150.1 μmol/L, 均大于拉米夫定的20.14和127.5 μmol/L, 明显说明拉米夫定比β-L-D4A具有更强的抑制作用.
因为IC50的测定与底物和药物浓度梯度设置相关密切, 为了更客观的研究两个药物的抑制作用, 我们对两个药物的Ki(抑制常数)进行了测定. 结果显示β-L-D4A对DNA聚合酶β和δ的Ki分别为24.03 μmol/L和132.7 μmol/L, 均大于拉米夫定的16.15 μmol/L和89.6 μmol/L, 证实了β-L-D4A对两种DNA聚合酶的抑制作用均更弱.
核苷及核苷类似物是一些化学合成类似于天然核苷的药物[29-30]. 他抗乙肝病毒复制主要有通过抑制逆转录作用干扰负链DNA的合成和作用于闭合环状DNA[31]. 实验表明核苷类药物对闭合环状DNA作用不佳, 他主要是掺入新合成的HBV的DNA链中导致链终止, 从而抑制病毒复制[32]. 而且, 他们竞争性地抑制病毒的DNA依赖的逆转录酶活性[33-34]. 因为, 正常细胞的DNA聚合酶β和δ与HBV DNA聚合酶在作用底物和机制上的相似性, 核苷类药物在抑制病毒聚合酶时同样会竞争性抑制正常的DNA聚合酶β和δ的活性[35-36].
我们从Km, IC50, Ki等不同的酶动力学参数对拉米夫定和β-L-D4A都进行了抑制作用的评价, 均显示拉米夫定具有更强的抑制DNA聚合酶β和δ的作用, 提示拉米夫定对宿主细胞具有更大的毒副作用.
因此, 我国自主研制开发的新型核苷类化合物β-L-D4A可望成为更高效低毒的抗HBV类药物, 亦有望同拉米夫定联合用药提高疗效或减短用药疗程, 并减少变异株和耐药株的出现.
现在对HBV病毒感染的治疗缺乏有效的高效低毒的药物. 在本文的前期实验中新型核苷类化合物-β-L-D4A具有强大的抑制病毒逆转录酶的作用. 为对该化合物进行系统的全面的评估, 本文进行了酶的动力学研究, 观察药物对纯化的正常人DNA聚合酶的抑制作用, 以便于作出全面的评价.
高泽立, 副教授, 上海交通大学医学院附属第三人民医院感染科.
近年来对慢性HBV感染治疗的研究热点集中在2', 3'双脱氧核苷(DDNs). 据报道新型核苷类化合物-β-L-D4A在体外实验中对2.2.15细胞具有高效的抑制病毒复制的作用, 但对于该药物毒副作用尚无相关报道.
既往研究显示, 绝大多数抗HBV或HIV的核苷类化合物在不同程度的抗病毒复制的同时, 也对正常人体内的人DNA聚合酶产生抑制作用, 而抑制作用的强度限制了很多具有高效抗病毒化合物的应用.
本研究首次采用国际上公认的研究核苷类化合物毒副作用的系统来评价新型的化合物-β-L-D4A的安全性.
新型核苷类化合物-β-L-D4A有望成为新的更高效低毒的抗HBV病毒的药物.
本文创新性强, 内容详实, 具有一定的临床参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Anderson RD, Chinnakotla S, Guo L, Perrillo RP, Klintmalm GB, Davis GL. Intramuscular hepatitis B immunoglobulin (HBIG) and nucleosides for prevention of recurrent hepatitis B following liver transplantation: comparison with other HBIG regimens. Clin Transplant. 2007;21:510-517. [PubMed] [DOI] |
| 2. | Wu JM, Lin JS, Xie N, Liang KH. Inhibition of hepatitis B virus by a novel L-nucleoside, beta-L-D4A and related analogues. World J Gastroenterol. 2003;9:1840-1843. [PubMed] [DOI] |
| 3. | Wu JM, Lin JS, Xie N, Jiang FC, Liang KH. [Effect and mechanism of beta-L-D4A (a novel nucleoside analog) against hepatitis B virus]. Zhonghua Gan Zang Bing Za Zhi. 2003;11:268-270. [PubMed] |
| 4. | Wu JM, Lin JS, Xie N, Qiu GF, Hu XM. [Synthesis of a novel L-nucleoside, beta-L-D4A and its inhibition on the replication of hepatitis B virus in vitro]. Yao Xue Xue Bao. 2005;40:825-829. [PubMed] |
| 5. | Oshige M, Takenouchi M, Kato Y, Kamisuki S, Takeuchi T, Kuramochi K, Shiina I, Suenaga Y, Kawakita Y, Kuroda K. Taxol derivatives are selective inhibitors of DNA polymerase alpha. Bioorg Med Chem. 2004;12:2597-2601. [PubMed] [DOI] |
| 6. | Vens C, Hofland I, Begg AC. Involvement of DNA polymerase beta in repair of ionizing radiation damage as measured by in vitro plasmid assays. Radiat Res. 2007;168:281-291. [PubMed] [DOI] |
| 7. | Parsons JL, Preston BD, O'Connor TR, Dianov GL. DNA polymerase delta-dependent repair of DNA single strand breaks containing 3'-end proximal lesions. Nucleic Acids Res. 2007;35:1054-1063. [PubMed] [DOI] |
| 8. | Luciani MG, Campregher C, Fortune JM, Kunkel TA, Gasche C. 5-ASA affects cell cycle progression in colorectal cells by reversibly activating a replication checkpoint. Gastroenterology. 2007;132:221-235. [PubMed] [DOI] |
| 9. | Marcellin P, Lada O, Asselah T. Treatment of chronic hepatitis B with the combination of pegylated interferon with lamivudine. Hepatol Res. 2007;37:S55-S61. [PubMed] [DOI] |
| 10. | Kao JH. Appropriate use of interferon for treatment of chronic hepatitis B. Hepatol Res. 2007;37:S47-S54. [PubMed] [DOI] |
| 11. | Akyuz F, Kaymakoglu S, Demir K, Aksoy N, Karaca C, Danalioglu A, Onel D, Badur S, Besisik F, Cakaloglu Y. Lamivudine monotherapy and lamivudine plus interferon alpha combination therapy in HBeAg negative chronic hepatitis B not responding to previous interferon alpha monotherapy. Acta Gastroenterol Belg. 2007;70:20-24. [PubMed] |
| 12. | Lu HY, Zhuang LW, Yu YY, Ivan H, Si CW, Zeng Z, Li J, Hou DM, Chen XY, Han ZH. Intrahepatic HBV DNA as a predictor of antivirus treatment efficacy in HBeAg-positive chronic hepatitis B patients. World J Gastroenterol. 2007;13:2878-2882. [PubMed] |
| 13. | Hou J, Schilling R, Janssen HL, Hansen BE, Heijtink R, Sablon E, Williams R, Lau GK, Schalm SW, Naoumov NV. Genetic characteristics of hepatitis B virus genotypes as a factor for interferon-induced HBeAg clearance. J Med Virol. 2007;79:1055-1063. [PubMed] [DOI] |
| 14. | Wu Jm, Lin JS, Chen BT, Zheng XM, Zhao HB, Liang KH. [Establishment and identification of highly expressing and replicating hepatitis B virus genome transgenic mouse models]. Zhonghua Gan Zang Bing Za Zhi. 2003;11:338-340. [PubMed] |
| 15. | Wu JM, Lin JS, Jiang FC, Zhang JY, Liang KH. [Inhibition of the replication of hepatitis B virus in vitro by a novel nucleoside analogue (beta-L-D4A)]. Zhonghua Gan Zang Bing Za Zhi. 2003;11:446. [PubMed] |
| 16. | Wang Z, Bennett EM, Wilson DJ, Salomon C, Vince R. Rationally designed dual inhibitors of HIV reverse transcriptase and integrase. J Med Chem. 2007;50:3416-3419. [PubMed] [DOI] |
| 17. | Beckman J, Kincaid K, Hocek M, Spratt T, Engels J, Cosstick R, Kuchta RD. Human DNA polymerase alpha uses a combination of positive and negative selectivity to polymerize purine dNTPs with high fidelity. Biochemistry. 2007;46:448-460. [PubMed] [DOI] |
| 18. | Maeda N, Kokai Y, Ohtani S, Sahara H, Kuriyama I, Kamisuki S, Takahashi S, Sakaguchi K, Sugawara F, Yoshida H. Anti-tumor effects of dehydroaltenusin, a specific inhibitor of mammalian DNA polymerase alpha. Biochem Biophys Res Commun. 2007;352:390-396. [PubMed] [DOI] |
| 19. | Crespan E, Hübscher U, Maga G. Error-free bypass of 2-hydroxyadenine by human DNA polymerase lambda with Proliferating Cell Nuclear Antigen and Replication Protein A in different sequence contexts. Nucleic Acids Res. 2007;35:5173-5181. [PubMed] [DOI] |
| 20. | Hu DL, Tang HW, Liang HR, Tang DS, Liu YM, Ji WD, Yuan JH, He Y, Zhu ZY, Yang JP. Possible role of DNA polymerase beta in protecting human bronchial epithelial cells against cytotoxicity of hydroquinone. Biomed Environ Sci. 2007;20:171-177. [PubMed] |
| 21. | Luoma PT, Eerola J, Ahola S, Hakonen AH, Hellström O, Kivistö KT, Tienari PJ, Suomalainen A. Mitochondrial DNA polymerase gamma variants in idiopathic sporadic Parkinson disease. Neurology. 2007;69:1152-1159. [PubMed] [DOI] |
| 22. | Yakubovskaya E, Lukin M, Chen Z, Berriman J, Wall JS, Kobayashi R, Kisker C, Bogenhagen DF. The EM structure of human DNA polymerase gamma reveals a localized contact between the catalytic and accessory subunits. EMBO J. 2007;26:4283-4291. [PubMed] [DOI] |
| 23. | Rytkönen AK, Vaara M, Nethanel T, Kaufmann G, Sormunen R, Läärä E, Nasheuer HP, Rahmeh A, Lee MY, Syväoja JE. Distinctive activities of DNA polymerases during human DNA replication. FEBS J. 2006;273:2984-3001. [PubMed] [DOI] |
| 24. | Friedberg EC. The eureka enzyme: the discovery of DNA polymerase. Nat Rev Mol Cell Biol. 2006;7:143-147. [PubMed] [DOI] |
| 25. | Chen J, Zacharek A, Li Y, Li A, Wang L, Katakowski M, Roberts C, Lu M, Chopp M. N-cadherin mediates nitric oxide-induced neurogenesis in young and retired breeder neurospheres. Neuroscience. 2006;140:377-388. [PubMed] [DOI] |
| 26. | Wu T, Froeyen M, Kempeneers V, Pannecouque C, Wang J, Busson R, De Clercq E, Herdewijn P. Deoxythreosyl phosphonate nucleosides as selective anti-HIV agents. J Am Chem Soc. 2005;127:5056-5065. [PubMed] [DOI] |
| 27. | Uckun FM, Qazi S, Venkatachalam T. N'-[2-(2-thiophene) ethyl]-N'-[2-(5-bromopyridyl)]thiourea (HI-443), a rationally designed non-nucleoside reverse transcriptase inhibitor compound with potent anti-HIV activity. Arzneimittelforschung. 2007;57:278-285. [PubMed] |
| 28. | Parikh UM, Zelina S, Sluis-Cremer N, Mellors JW. Molecular mechanisms of bidirectional antagonism between K65R and thymidine analog mutations in HIV-1 reverse transcriptase. AIDS. 2007;21:1405-1414. [PubMed] [DOI] |
| 29. | Caccamo L, Agnelli F, Reggiani P, Maggi U, Donato MF, Gatti S, Paone G, Melada E, Rossi G. Role of lamivudine in the posttransplant prophylaxis of chronic hepatitis B virus and hepatitis delta virus coinfection. Transplantation. 2007;83:1341-1344. [PubMed] [DOI] |
| 30. | Kawaoka T, Suzuki F, Akuta N, Suzuki Y, Arase Y, Sezaki H, Kawamura Y, Hosaka T, Kobayashi M, Ikeda K. Efficacy of lamivudine therapy in elderly patients with chronic hepatitis B infection. J Gastroenterol. 2007;42:395-401. [PubMed] [DOI] |
| 31. | Fung J, Lai CL, Yuen JC, Wong DK, Tanaka Y, Mizokami M, Yuen MF. Adefovir dipivoxil monotherapy and combination therapy with lamivudine for the treatment of chronic hepatitis B in an Asian population. Antivir Ther. 2007;12:41-46. [PubMed] |
| 32. | Gish RG. Improving outcomes for patients with chronic hepatitis B. Curr Gastroenterol Rep. 2007;9:14-22. [PubMed] [DOI] |
| 33. | Leemans W, Janssen HL, de Man R. Future prospectives for the management of chronic hepatitis B. World J Gastroenterol. 2007;13:2554-2567. [PubMed] [DOI] |
| 34. | de Baar MP, de Rooij ER, Smolders KG, van Schijndel HB, Timmermans EC, Bethell R. Effects of apricitabine and other nucleoside reverse transcriptase inhibitors on replication of mitochondrial DNA in HepG2 cells. Antiviral Res. 2007;76:68-74. [PubMed] [DOI] |
| 35. | Qi X, Xiong S, Yang H, Miller M, Delaney WE. In vitro susceptibility of adefovir-associated hepatitis B virus polymerase mutations to other antiviral agents. Antivir Ther. 2007;12:355-362. [PubMed] |
| 36. | D'Ugo E, Kondili LA, Canitano A, Catone S, Giuseppetti R, Gallinella B, Palmieri G, Orobello S, Argentini C, Glück R. Rapid emergence of a viral resistant mutant in WHV chronically infected woodchucks treated with lamivudine and a pre-S/S CHO-derived hepatitis B virus vaccine. Vaccine. 2007;25:4895-4902. [PubMed] [DOI] |