修回日期: 2008-01-15
接受日期: 2008-01-25
在线出版日期: 2008-02-28
目的: 构建蛋白酪氨酸磷酸酶-3(PRL-3)绿色荧光蛋白真核表达载体pEGFP-N1-PRL-3, 为PRL-3基因功能研究奠定基础.
方法: 设计人PRL-3特异性引物, 提取人大肠癌细胞系SW620细胞总RNA, 应用RT-PCR方法获取人PRL-3全长cDNA, 分别克隆至T载体及真核绿色荧光蛋白表达载体pEGFP-N1, 应用PCR、酶切及DNA测序进行鉴定, 确认后转染大肠癌细胞SW480, 应用G418进行筛选获取PRL-3稳定表达细胞克隆, 应用荧光定量PCR检测PRL-3基因表达.
结果: 获得522 bp的PRL-3基因编码序列并成功构建了真核绿色荧光蛋白表达载体pEGFP-N1-PRL-3, 该重组载体能够在SW480细胞中稳定表达.
结论: 成功构建真核绿色荧光蛋白表达载体pEGFP-N1-PRL-3和建立PRL-3稳定表达SW480细胞, 为进一步深入研究PRL-3基因在大肠癌发生发展中的作用奠定基础.
引文著录: 柳玉红, 李建明, 周军, 丁彦青. PRL-3真核绿色荧光蛋白表达载体的构建及其在结肠癌SW480细胞中的表达. 世界华人消化杂志 2008; 16(6): 602-606
Revised: January 15, 2008
Accepted: January 25, 2008
Published online: February 28, 2008
AIM: To construct the eukaryotic fluorescent expression vector of PRL-3 pEGFP-N1-PRL-3 and establish the PRL-3 gene over-expression cell model of human colon carcinoma.
METHODS: PRL-3 full length cDNA was amplified by RT-PCR with total RNA extracted from human colon carcinoma SW480 cells as template, and cloned into pGEM-T easy vector or eukaryotic expression vector pEGFP-N1. Recombinant plasmid of pEGFP-N1-PRL-3 was identified by restriction endonuclease analysis and DNA sequencing. pEGFP-N1-PRL-3 plasmid was transfected into SW480 cells. PRL-3 over-expression in SW480 cells was screened by G418 selection. PRL-3 expression was determined by real-time reverse transcription polymerase chain reaction (PCR) analysis.
RESULTS: The recombinant pEGFP-N1-PRL-3 plasmid with entirely coding elements of human PRL-3 gene was constructed and identified by restriction endonuclease analysis and DNA sequencing. The PRL-3 expression in SW480 cells was 2.78-fold that of control group.
CONCLUSION: Establishment of PRL-3 gene over-expression cell model of human colon carcinoma provides a fundamental tool to study the role of PRL-3 gene in metastasis of human colorectal carcinoma.
- Citation: Liu YH, Li JM, Zhou J, Ding YQ. Construction of pEGFP-N1-PRL-3 vector and its expression in SW480 cells. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 602-606
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/602.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.602
蛋白酪氨酸磷酸酶-3(phosphatase of regenerating liver-3, PRL-3), 属于PRL家族, 是一种相对分子质量只有20 kDa的蛋白磷酸酶, 正常情况下在心脏和骨骼肌中都有表达. 新近的研究表明PRL-3与肿瘤转移有非常密切的关系[1], 尤其是他在大肠癌的侵袭转移中的作用更加引人注目[2-3]. 有研究认为PRL-3在肿瘤侵袭转移中的作用与其促进细胞增殖、迁移、侵袭及黏附有关, 而且他能增强细胞生长、迁移以及肿瘤的浸润和转移能力[4-9]. 绿色荧光蛋白(GFP)是20世纪90年代中期发展起来的一种全新的报告分子[2]. GFP分子质量小, 易与其他目的基因形成融合基因, 对细胞无毒副作用, 而且其化学性质稳定, 使用方便, 可以在活体细胞中定时观察, 因而连接有GFP的载体pEGFP-N1在分子生物学中被广泛应用. 为进一步研究探讨PRL-3基因在结直肠癌的发生发展和侵袭转移中的作用, 我们克隆了人PRL-3基因并构建了真核绿色荧光蛋白表达载体pEGFP-N1-PRL-3, 并将其转染真核细胞, 观察其表达情况, 为进一步的工作奠定了基础.
TRIzol试剂和RT-PCR试剂盒为Invitrogen公司产品; 克隆载体pGEM-T Easy Vector、AMV逆转录酶为Promega公司产品; PrimeSTAR HS DNA高保真酶、限制性内切酶、T4连接酶、标准分子质量DNA Marker、质粒小量提取试剂盒、DNA凝胶回收试剂盒、DNA片段纯化试剂盒、PrimeScriptTM RT Reagent Kit、SYBRR Premix Ex TaqTM荧光定量PCR试剂盒均购自TaKaRa公司; pEGFP-N1购自Clontech公司、SW480人大肠癌细胞、大肠杆菌DH5a、BL21(DE3)菌株均为本室保存.
1.2.1 引物的设计与合成: 根据已报道的PRL-3基因序列(GenBank Accession Number: NM_032611), 依据PCR引物设计原则和PrimeSTAR HS DNA高保真酶的特性, 利用在线引物设计工具(http://seq.yeastgenome.org/cgi-bin/web-primer)设计能特异性扩增人PRL-3 cDNA全长的引物序列, 同时分别在上游引物和下游引物的5'端引入EcoR Ⅰ和BamH Ⅰ两酶切位点, 引物由上海英骏生物技术有限公司合成, 序列如下: P1: 5'-GAATTCTAATGGCTCGGATGAACCGC-3'; P2: 5'-GGATCCTACATAACGCAGCACCGGGT-3'.
1.2.2 RT-PCR: 取适量培养的大肠癌细胞株SW480, 加入1 mL TRIzol试剂, 提取总RNA, 以2 μg总RNA为模板, 按照试剂盒说明书进行反转录获得cDNA, 以cDNA产物为模板, P1和P2为引物, PCR扩增约522 bp的片段, 总反应体积为50 μL, 循环参数为: 94 ℃ 2 min; 94 ℃ 20 s, 56 ℃ 20 s, 72 ℃ 40 s, 30个循环, 再于72 ℃延伸5 min. 取5 μL PCR产物行10 g/L琼脂糖凝胶电泳分析.
1.2.3 PRL-3基因序列测定: PRL-3扩增产物使用Agarose Gel DNA Purification Kit回收DNA, 经加A尾处理后, 插入克隆载体pGEM-T Easy载体中, 构建pGEM-T-PRL-3, 然后转化DH5a感受态, 涂LB板(Amp+)后, 次日随机挑取5个克隆, 37 ℃水平摇床振荡培养, 小量提取质粒pGEM-T- PRL-3, 经PCR及EcoR Ⅰ和BamH Ⅰ双酶切鉴定, 鉴定正确的质粒交由上海英骏生物技术有限公司进行DNA序列测定.
1.2.4 pEGFP-N1-PRL-3真核表达载体的构建: pEGFP-N1和pGEM-T-PRL-3分别用EcoR Ⅰ和BamH Ⅰ酶切后, 琼脂糖电泳回收载体大片段和目的片段; 连接上述目的基因和载体片段, 构建pEGFP-N1-PRL-3原核表达载体, 转化DH5a感受态细胞, 用含KA+的LB平板筛选阳性克隆, 小量提取pEGFP-N1-PRL-3质粒, 经PCR及EcoR Ⅰ和BamH Ⅰ双酶切鉴定.
1.2.5 质粒测序鉴定和质粒中量提取: 对pEGFP-N1-PRL-3质粒进行测序鉴定, 与GenBank公布的序列(NM_032611)进行blast比对. 无菌条件下, 分别取上述菌落扩增的新鲜菌液1 mL, 加入49 mL卡那霉素抗性LB培养基中, 37 ℃摇菌过夜. 次日, 4 ℃, 6000 g离心15 min收集细胞, 按照Qiagen公司的质粒中量提取试剂盒说明书操作, 加入4 mL Buffer P1重悬细菌, 加入4 mL Buffer P2, 轻柔混匀, 上下颠倒4-6次, 室温放置4 min, 加入4 mL预冷的Buffer P3, 上下颠倒4-6次, 冰上放置15-20 min, 4 ℃ 15000 g离心30 min, 将上清移至一个新离心管, 4 ℃ 15000 g再次离心30 min. 用4 mL Buffer QBT平衡QIAGEN-tip100柱, 将第二次离心的上清移入QIAGEN-tip100柱内, 液体以自身的重力自然流出, 加入10 mL Buffer QC洗QIAGEN-tip100柱2次, 加入Buffer QF 5 mL, 洗脱质粒, 收集此次的流出液, 加入3.5 mL异丙醇混匀, 立即4 ℃ 15000 g离心30 min, 弃上清, 加入2 mL 700 mL/L乙醇洗涤沉淀, 4 ℃ 15000 g离心15 min, 弃上清, 空气干燥5-10 min, 用100 μL灭菌水溶解沉淀, 测A值, -20 ℃保存备用.
1.2.6 细胞转染及克隆筛选: 转染前一天将SW480细胞接种至24孔板中, 2×105个细胞/孔, 使细胞达到90%-95%汇合, 转染时用Opti-MEM培养基400 μL换去完全培养基. 分别用50 μL的Opti-MEM稀释0.8 μg质粒DNA和2 μL LipofectamineTM 2000, 室温孵育5 min, 将50 μL的LipofectamineTM 2000混合物加入质粒DNA中, 总体积为100 μL, 轻轻混匀, 室温孵育20 min, 将100 μL的DNA-LipofectamineTM 2000混合物加入24孔板孔中, 轻轻混匀, 培养6 h后更换完全培养基, 37 ℃孵育48 h后加入含G418(浓度为800 mg/L)的培养液, 进行筛选, 筛选3 wk后建成抗性单克隆, 挑取单克隆, 扩大培养. 以pEGFP-N1质粒为转染对照(mock).
1.2.7 荧光定量PCR: 待细胞长至状态良好, 铺满瓶壁后, 用冰预冷的PBS洗2遍, 用TRIzol试剂常规提取细胞总RNA, 提取的总RNA用DNaseI去除痕量基因组DNA. 按照TaKaRa(PrimeScriptTM RT Reagent Kit)逆转录试剂盒操作程序进行逆转录反应, RNA的量为1 μg, 引物为Oligo dT Primer、Random 6 mers. 反应条件为: 37 ℃ 15 min、85 ℃ 5 s. 荧光定量PCR反应体系为25 μL, 内含终浓度为500 ng的cDNA模板、终浓度为250 nmol/L的上下游引物及12.5 μL的2×SYBR Green PCR Master混合物. PRL-3上游引物: 5'-GAAGG CCAAGTT CTG TGA GG-3', 下游引物: 5'-TCCAGG TAGGTGAGCT GCTT-3', 扩增片段186 bp(NM_032611), 以β-actin基因为内对照(NM_001101), 扩增产物222 bp, 上游引物: 5'- GATGCAGAAGGAGAT CACTG-3', 下游引物: 5'-GGGTGTAACGCA ACTAAGTC-3'. 将反应管置Mx3000PTM Real Time PCR反应仪(Stratagene公司)中, 反应条件为95 ℃ 10 s、95 ℃ 5 s, 55 ℃ 30 s, 45个循环, 荧光信号监测. 定量的方法以2ΔΔCt(Ct代表循环阈值)表示基因的表达量, 以空载体EGFP-SW480细胞为对照细胞, 公式如ΔΔCt = (Ct(taget gene)-Ct(β-actin)转染细胞-(Ct(taget gene)- Ct(β-actin)对照细胞, 实验重复3次.
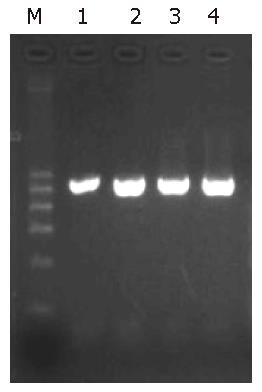
PCR成功扩增出人PRL-3全长cDNA, PRL-3基因PCR产物的电泳结果可见大小为522 bp左右的特异性条带(图1).
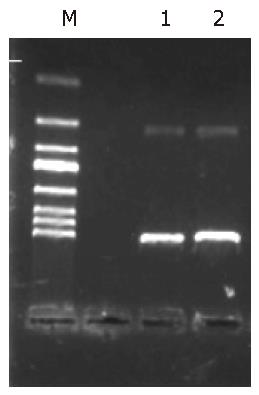
构建的质粒用EcoR Ⅰ和BamH Ⅰ双酶切鉴定, 得到约4.7 kb和522 bp左右的片段, 与预期结果一致(图2).
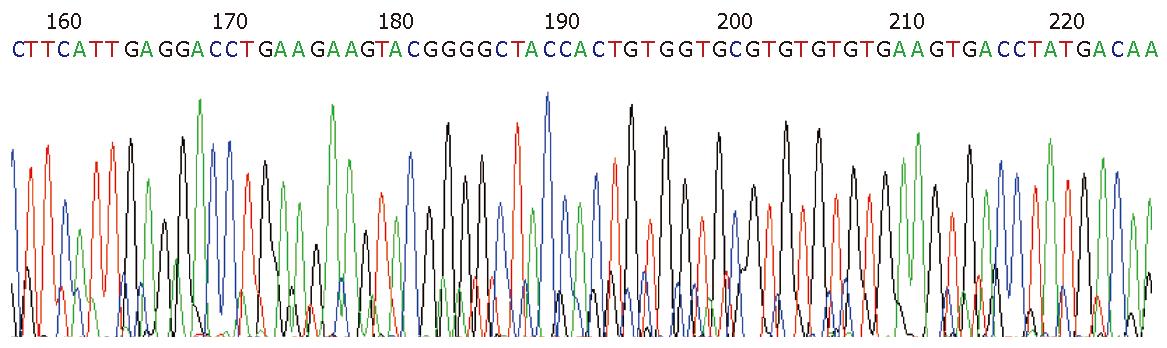
电泳回收目的片段插入pGEM-T Easy克隆载体中, 形成pGEM-T-PRL-3, EcoR Ⅰ和BamH Ⅰ双酶切鉴定得到正确克隆, 克隆测序结果与GenBank里的人PRL-3基因序列相一致(图3).
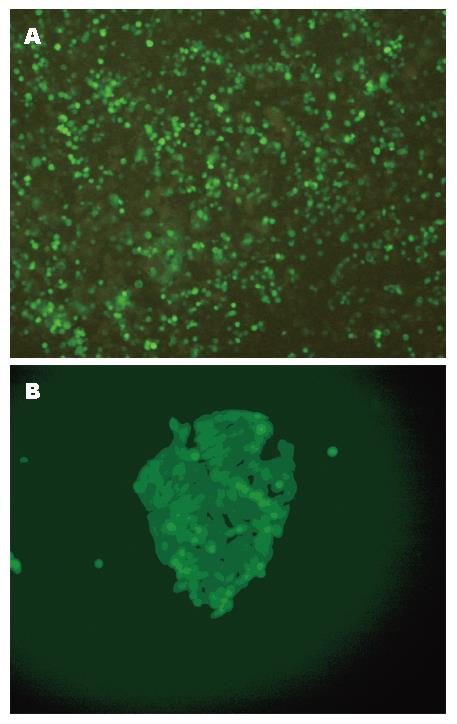
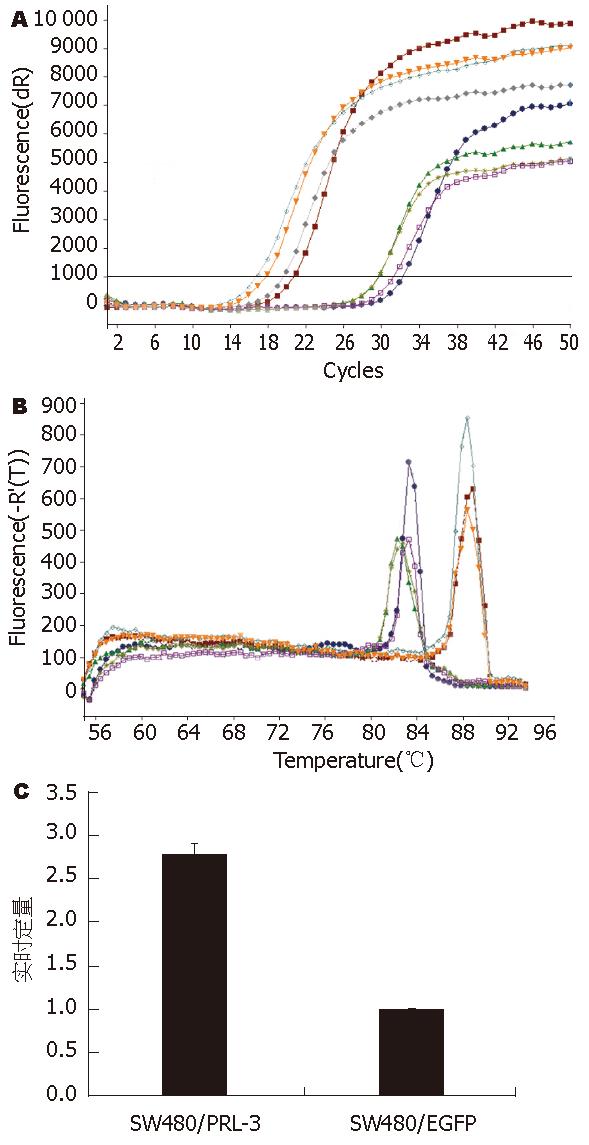
用pEGFP-N1-PRL-3转染SW480/EGFP细胞, 转染后48 h的瞬时转染图像, G418药物筛选3 wk后形成单克隆(图4), 克隆扩大培养后收集细胞进行荧光定量PCR检测. 荧光定量PCR的结果显示, 溶解曲线表明扩增的为特异序列, 通过公式计算稳定转染pEGFP-N1-PRL-3的细胞PRL-3基因表达增高, 是未转染细胞的2.78倍, 命名为SW480/PRL(图5).
PRL-3是现已发现与大肠癌转移相关的少数特异性表达分子之一[2], 根据PRL-3基因和蛋白质的结构特征, 他属于一类新近发现的蛋白质酪氨酸磷酸酶家族成员, 该亚型有三个成员RPL-1、PRL-2及PRL-3. PRLs具有PTP活性位点标签序列HCXXGXXR, 因而归属于蛋白质酪氨酸磷酸酶家族. PRLs含有C-末端CAAX序列可进行异戊烯化, PRLs以异戊烯化依赖方式存在于浆膜和内体(endosome)结构, 这一生物化学特征提示他们在细胞信号传递中发挥作用. 这三种蛋白质分子质量大约为20 kDa, 具有超过75%的同源性, 在功能上具有相似性[10-12].
应用基因表达系列分析(SAGE)技术分析大肠癌肝转移基因表达谱时发现, PRL-3是在18例大肠癌肝转移标本中唯一持续高表达的基因[2], 进一步发现, 无论具体转移的部位如何, 大多数大肠癌的转移标本中PRL-3的转录水平均明显增加[3]; 而该基因在正常大肠上皮中极少表达或不表达[2-3]. 不同的研究小组也已经分别证实这一结果[13-14]. 而其他研究还表明PRL-3参与胃癌的转移, 与卵巢癌的发生发展关系密切, 可促进小鼠黑色素瘤细胞运动和转移, 并可调节肿瘤细胞与细胞外基质的黏附[4,6,15]. 将转染野生型PRL-3的细胞经尾静脉注射入裸鼠体内, 1-2 wk内即可形成明显的肺转移, 甚至发生由广泛肺转移引起的动物死亡; 如果PRL-3失活则不引起明显的转移[16]. 可以说PRL-3与肿瘤转移的关系已明确, 但是对PRL-3生物学特性的了解仍很模糊, 从2001年Bert vogelstein实验室发现PRL-3与大肠癌转移的独特联系开始[2], 后续出现了一些PRL-3的相关研究, 但在对PRL-3生物学特性的了解方面一直没有突破. 我们仍不知道PRL-3促进细胞迁移和侵袭的机制以及他参与的信号途径, 而这些问题的解决有利于揭示PRL-3的功能特性. 因此, 本研究应用RT-PCR方法, 从培养的大肠癌细胞SW480中提取RNA, 逆转录为cDNA为模板, 扩增出目的基因, 经T载体克隆后, 成功构建了人PRL-3绿色荧光蛋白真核表达载体, 稳定转染人大肠癌SW480细胞, 为建立可视化动物转移模型及进一步从分子水平探讨大肠癌的发生发展机制提供了有效的工具, 具有重要的实验价值.
大肠癌是一种常见、严重威胁人类生命健康的恶性肿瘤. 转移是导致大肠癌患者死亡的重要原因. 因此, 阐明大肠癌转移机制, 控制转移是当前研究的重要方向. 研究证明, 肿瘤转移过程中有众多的基因参与, PRL-3在大肠癌发生发展中起重要作用. PRL-3 属于蛋白质酪氨酸磷酸酶家族(PTP)成员, 是现已发现与大肠癌转移相关的少数特异性表达分子之一. PRL-3作为大肠癌转移研究中的"魅力"基因受到广泛关注.
徐智, 教授, 北京大学第三医院外科.
PRL-3促进肿瘤转移的机制、PRL-3的作用底物及其相互作用蛋白是本课题领域的研究热点及重点. PRL-3促进细胞迁移和侵袭的机制是亟待解决的问题.
Saha et al发现在结肠癌伴肝转移的组织中PRL-3 高表达, 他们通过对结肠癌肝转移的组织标本进行基因表达连续分析(SAGE)发现在 18 例结肠癌伴肝转移的标本中PRL-3均高表达, 而在正常结肠上皮组织中 PRL-3 不表达, 认为该基因与结肠癌的肝转移有密切的关系.
本文构建了真核绿色荧光蛋白表达载体, 为后续的转移机制研究奠定了基础.
本研究克隆了人PRL-3基因并构建了GFP表达载体pEGFP-N1-PRL-3, 并将其转染真核细胞, 观察其表达情况, 为进一步的工作奠定了基础.
本研究设计合理, 方法新颖, 结果可靠, 文笔流畅, 对进一步研究有铺垫作用.
编辑: 孙学英 电编: 郭海丽
| 1. | Wang L, Peng L, Dong B, Kong L, Meng L, Yan L, Xie Y, Shou C. Overexpression of phosphatase of regenerating liver-3 in breast cancer: association with a poor clinical outcome. Ann Oncol. 2006;17:1517-1522. [PubMed] [DOI] |
| 2. | Saha S, Bardelli A, Buckhaults P, Velculescu VE, Rago C, St Croix B, Romans KE, Choti MA, Lengauer C, Kinzler KW. A phosphatase associated with metastasis of colorectal cancer. Science. 2001;294:1343-1346. [PubMed] [DOI] |
| 3. | Bardelli A, Saha S, Sager JA, Romans KE, Xin B, Markowitz SD, Lengauer C, Velculescu VE, Kinzler KW, Vogelstein B. PRL-3 expression in metastatic cancers. Clin Cancer Res. 2003;9:5607-5615. [PubMed] |
| 4. | Wu X, Zeng H, Zhang X, Zhao Y, Sha H, Ge X, Zhang M, Gao X, Xu Q. Phosphatase of regenerating liver-3 promotes motility and metastasis of mouse melanoma cells. Am J Pathol. 2004;164:2039-2054. [PubMed] [DOI] |
| 5. | Zeng Q, Dong JM, Guo K, Li J, Tan HX, Koh V, Pallen CJ, Manser E, Hong W. PRL-3 and PRL-1 promote cell migration, invasion, and metastasis. Cancer Res. 2003;63:2716-2722. [PubMed] |
| 6. | Miskad UA, Semba S, Kato H, Yokozaki H. Expression of PRL-3 phosphatase in human gastric carcinomas: close correlation with invasion and metastasis. Pathobiology. 2004;71:176-184. [PubMed] [DOI] |
| 7. | Rouleau C, Roy A, St Martin T, Dufault MR, Boutin P, Liu D, Zhang M, Puorro-Radzwill K, Rulli L, Reczek D. Protein tyrosine phosphatase PRL-3 in malignant cells and endothelial cells: expression and function. Mol Cancer Ther. 2006;5:219-229. [PubMed] [DOI] |
| 8. | Guo K, Li J, Wang H, Osato M, Tang JP, Quah SY, Gan BQ, Zeng Q. PRL-3 initiates tumor angiogenesis by recruiting endothelial cells in vitro and in vivo. Cancer Res. 2006;66:9625-9635. [PubMed] [DOI] |
| 9. | Fiordalisi JJ, Keller PJ, Cox AD. PRL tyrosine phosphatases regulate rho family GTPases to promote invasion and motility. Cancer Res. 2006;66:3153-3161. [PubMed] [DOI] |
| 10. | Diamond RH, Cressman DE, Laz TM, Abrams CS, Taub R. PRL-1, a unique nuclear protein tyrosine phosphatase, affects cell growth. Mol Cell Biol. 1994;14:3752-3762. [PubMed] [DOI] |
| 11. | Cates CA, Michael RL, Stayrook KR, Harvey KA, Burke YD, Randall SK, Crowell PL, Crowell DN. Prenylation of oncogenic human PTP(CAAX) protein tyrosine phosphatases. Cancer Lett. 1996;110:49-55. [PubMed] [DOI] |
| 12. | Zeng Q, Si X, Horstmann H, Xu Y, Hong W, Pallen CJ. Prenylation-dependent association of protein-tyrosine phosphatases PRL-1, -2, and -3 with the plasma membrane and the early endosome. J Biol Chem. 2000;275:21444-21452. [PubMed] [DOI] |
| 13. | Peng L, Ning J, Meng L, Shou C. The association of the expression level of protein tyrosine phosphatase PRL-3 protein with liver metastasis and prognosis of patients with colorectal cancer. J Cancer Res Clin Oncol. 2004;130:521-526. [PubMed] [DOI] |
| 14. | Kato H, Semba S, Miskad UA, Seo Y, Kasuga M, Yokozaki H. High expression of PRL-3 promotes cancer cell motility and liver metastasis in human colorectal cancer: a predictive molecular marker of metachronous liver and lung metastases. Clin Cancer Res. 2004;10:7318-7328. [PubMed] [DOI] |
| 15. | Polato F, Codegoni A, Fruscio R, Perego P, Mangioni C, Saha S, Bardelli A, Broggini M. PRL-3 phosphatase is implicated in ovarian cancer growth. Clin Cancer Res. 2005;11:6835-6839. [PubMed] [DOI] |
| 16. | Guo K, Li J, Tang JP, Koh V, Gan BQ, Zeng Q. Catalytic domain of PRL-3 plays an essential role in tumor metastasis: formation of PRL-3 tumors inside the blood vessels. Cancer Biol Ther. 2004;3:945-951. [PubMed] [DOI] |