修回日期: 2008-01-15
接受日期: 2008-01-22
在线出版日期: 2008-02-18
目的: 用重叠延伸PCR(overlap extension PCR)法获得人工优化的干扰素-重组复合干扰素(consensus interferon, cIFN)基因, 用原核表达系统对其进行表达, 鉴定表达的cIFN活性.
方法: 根据大肠杆菌的偏爱密码子, 人工设计cIFN的高表达基因, 用overlap PCR法合成cIFN全基因, 用基因重组技术构建其原核表达载体pRA-cIFN, 在大肠杆菌BL21中进行高效表达, 用SDS-PAGE和Western blotting鉴定cIFN表达, 用GuHCl阶段透析法进行蛋白变性、复性, 用TALON(His)6亲和层析柱进行纯化, 用ELISA、MTS比色定量法及血凝抑制试验检测cIFN的免疫活性和生物活性.
结果: 成功合成了cIFN全基因, 其DNA长度与理论长度534 bp相符; 用基因重组技术成功构建了cIFN原核表达载体pRA-cIFN, 并用大肠杆菌BL21进行了高效表达, SDS-PAGE和Western blotting鉴定结果显示, 表达蛋白主要以包涵体形式存在, 其分子质量符合理论值23.3 kDa; 用GuHCl阶段透析法成功进行包涵体蛋白的复性, 亲和层析法纯化后cIFN的ELISA、MTS比色定量法及血凝抑制试验结果显示, 表达蛋白具有明显的cIFN免疫学活性、剂量依赖性PLC/PRF/5细胞增殖抑制作用和HBsAg分泌抑制作用.
结论: 重叠延伸PCR法是获得重组复合基因的有效简便的方法, 我们通过重叠延伸PCR法获得并表达的cIFN具有明显的抗病毒、抗细胞增殖活性.
引文著录: 刘顺爱, 浅野龙太郎, 郭晶晶, 刘志英, 余康康, 徐道振. 重叠延伸PCR法克隆重组复合干扰素. 世界华人消化杂志 2008; 16(5): 479-483
Revised: January 15, 2008
Accepted: January 22, 2008
Published online: February 18, 2008
AIM: To obtain the recombinant consensus interferon (cIFN) gene by overlap extension PCR and to express it using a prokaryotic expression system to identify its activities.
METHODS: Overlap extension PCR was performed to obtain the cIFN gene and to construct the high expression vector for the production of cIFN protein according the preferred codon of E.coli. The expression vector pRA-cIFN was transformed with BL21 (DE3) E.coli straining. The expression of cIFN was identified by SDS-PAGE and Western blotting and purified by metal-chelating chromatography, and refolded by stepwise dialysis method. Then, the immune and biological activities of cIFN were detected by ELISA, MTS chromometry and hemagglutination inhibition test.
RESULTS: The cIFN gene was obtained by overlap extension PCR. Its DNA length was 534 bp which is consistent with its theoretical length. SDS-PAGE and Western blotting showed that the pressed cIFN protein in E.coli BL21 (DE3) was in the form of inclusion bodies and its molecular weight was 23.3 kDa. We achieved the refolding of E.coli-expressed cIFN with a stepwise dialysis method. The biological activity of the refolded cIFN was detected by ELISA, MTS chromometry and hemagglutination inhibition test, showing that cIFN had obvious immunological activities, dose-dependent suppressive activity of PLC/PRF/5 cell proliferation and HBsAg secretion inhibitory activity.
CONCLUSION: Overlap extension PCR is a simple method to obtain the recombinant genes. cIFN protein produced in this study has significant anti-virus and anti-tumor cell proliferation activities.
- Citation: Liu SA, Asano R, Guo JJ, Liu ZY, Yu KK, Xu DZ. Cloning recombinant consensus interferon with overlap extension polymerase chain reaction. Shijie Huaren Xiaohua Zazhi 2008; 16(5): 479-483
- URL: https://www.wjgnet.com/1009-3079/full/v16/i5/479.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i5.479
干扰素(IFN)是一类具有抗病毒、抗肿瘤、免疫调节等多种生物学活性的重要细胞因子, 目前广泛应用于病毒感染性疾病的临床治疗, 但当前的IFN产品存在临床疗效尚不够理想、难以清除病毒、复发率较高、副作用多等缺陷, 有必要寻找更有效的药物来治疗难治性感染和复发感染. 重组复合干扰素(consensus interferon, cIFN)是非天然存在的Ⅰ型IFN, 是通过对已知IFNα各亚型序列筛选, 采用每个位点上最常出现的氨基酸决定簇, 用基因重组技术复合而成[1]. cIFN对Ⅰ型受体的亲和力比IFNα高数倍, 生物活性高出5-10倍, 临床试验也显示比IFNα具有更好的效果. 美国Amgen公司已生产cIFN, 活性比原IFNα强10倍, 在临床应用上很受欢迎, 已进入我国市场, 我国也有多家单位正在研制复合干扰素, 还没有一家获准生产. 重叠延伸PCR(overlap extension PCR)方法是用重叠延伸连接两个或多个目的序列的基因复合和基因重构的简便有效方法[2-4]. 基于以上cIFN的优点和重叠延伸PCR方法的有效简便性, 我们用重叠延伸PCR方法合成cIFN全基因, 再用大肠杆菌表达系统实现了高效表达, 拟使用于病毒性肝炎的靶向治疗等应用研究.
大肠杆菌高效表达载体pRA获赠于日本东北大学大学院生物工学蛋白质研究室, 表达HBsAg的肝癌细胞系-PLC/PRF/5细胞获赠于日本东北大学加龄医学研究所医用细胞资源中心, 相关的分子生物学、免疫学及生化学试剂在相应的生物试剂公司购买.
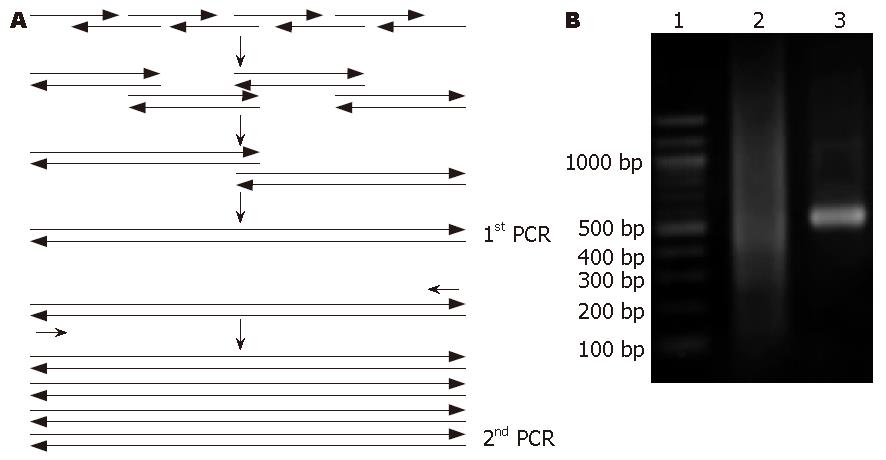
1.2.1 重叠延伸PCR法进行cIFN全基因合成: 参考文献[1]的序列, 又根据大肠杆菌的偏爱密码子, 人工设计重组复合干扰素的高表达基因. 人为地把cIFN全基因分成8个片段并合成其长片段寡核苷酸, 相临的每两个片段之间均有一部分重叠序列, 并在N-末端和C-末端各导入限制性内切酶Nco Ⅰ、Sac Ⅱ的酶切位点. 混合此8个长片段寡核苷酸后进行第一次PCR; 把第一次PCR产物作为模板, 使用两末端引物继续进行第二次PCR. 图1A为重叠延伸PCR的模式图.
1.2.2 构建cIFN表达载体pRA-cIFN: 用限制性内切酶NcoⅠ和SacⅡ进行cIFN基因和pRA载体的双酶切, 用T4连接酶连接后经JM109工程菌的克隆筛选, 得到cIFN的表达载体pRA-cIFN, 表达载体pRA被设计为重组基因的N-末端有目的蛋白纯化用的(His)6 tag和活性测定用的c-myc基因. 用ABI PRISM 3100 Genetic Analyzer测序以鉴定表达载体的序列准确性.
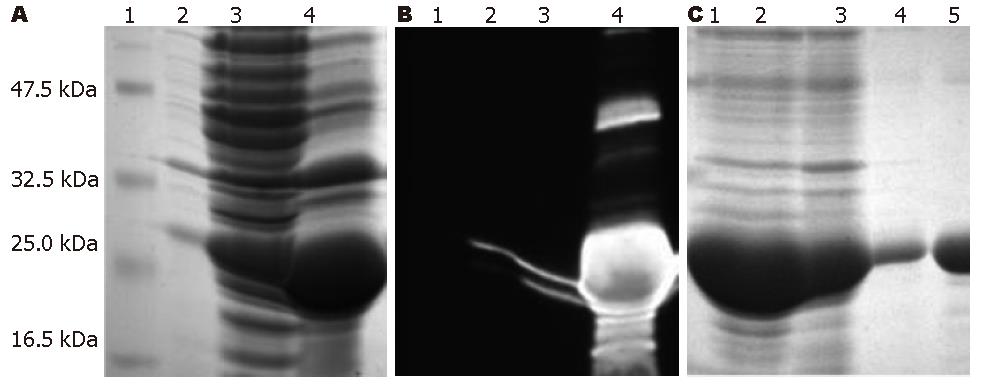
1.2.3 cIFN的表达、纯化及变性复性: 把构建好的表达载体pRA-cIFN转化到BL21大肠杆菌中, 使用2YT培养基进行大量培养. 收集的细菌沉淀用超声破碎后经47 ℃, 11000 g离心20 min, 其沉淀中富含cIFN表达蛋白的包涵体. 参照文献[5-7], 用6 mol/L GuHCl变性cIFN包涵体蛋白, 用TALON(His)6 tag亲和层析柱纯化蛋白, 纯化后的目的蛋白依次用6、3、2、1、0.5、0 mol/L GuHCl阶段透析法进行复性. 用SDS-PAGE和Western blotting进行蛋白的表达鉴定.
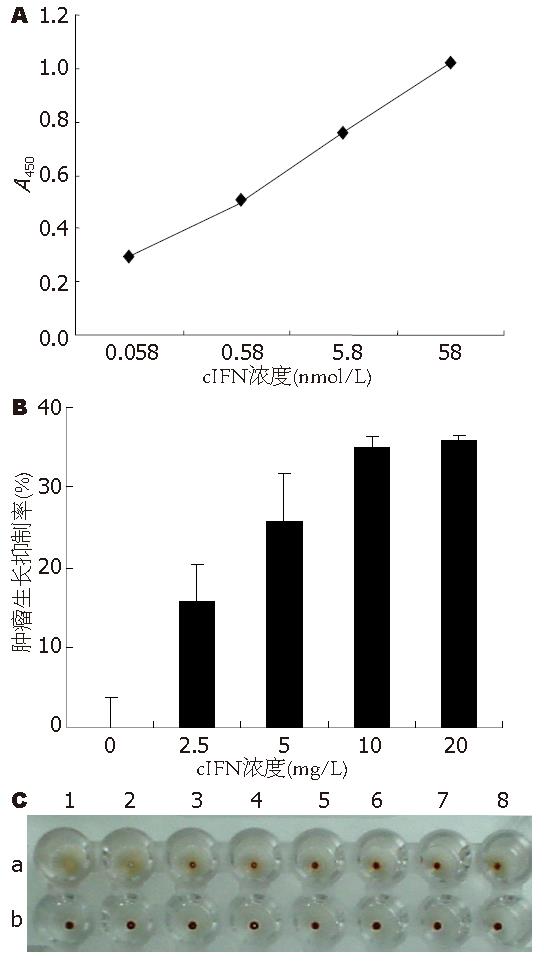
1.2.4 cIFN的免疫活性测定: 用IFNα双抗体夹心ELISA试剂盒检测cIFN的抗原活性, 加入的cIFN浓度依次为0.058、0.58、5.8、58 nmol/L, 按说明书进行操作, 最后测A450.
1.2.5 MTS比色定量法测定cIFN的细胞增殖抑制活性: PLC/PRF/5细胞铺至96孔板后CO2孵箱培养过夜, 加入cIFN继续培养48 h, cIFN浓度依次为20、10、5、2.5 mg/L. 弃培养上清后加入MTS, 测A492, 按公式计算cIFN对PLC/PRF/5细胞的增殖抑制率. 增殖抑制率(%) = [1-(Aexperiment well-Abackground well)/(Acontrol well-Aback ground well)]×100%.
1.2.6 血凝抑制试验检测cIFN的抗HBV活性: PLC/PRF/5细胞铺至96孔板后CO2孵箱培养过夜, 加入cIFN继续培养, cIFN浓度依次为0、1.56、3.125、6.25、12.5、25、50 mg/L, 干预培养48 h后收集培养上清. 用HBsAg血凝抑制检测试剂盒检测培养上清中HBsAg含量, 观察cIFN的HBsAg分泌抑制作用, 拟说明cIFN的抗HBV活性.
通过重叠延伸PCR方法成功获得了cIFN的全基因(图1B), 加上酶切位点其全长符合理论长度534 bp. 用此cIFN基因成功构建了原核表达载体pRA-cIFN, 基因测序结果显示表达载体的基因序列完全正确.
用BL21大肠杆菌实现了cIFN的高效表达(图2A-B), 分别显示cIFN表达蛋白的SDS-PAGE和Western blotting结果, 其分子质量符合理论大小23.3 kDa. 结果显示目的蛋白主要以包涵体形式表达, 培养上清中和超声破碎上清中的可溶性表达蛋白量较低. cIFN表达蛋白的纯化前和纯化后SDS-PAGE结果图2C为, 经(His)6 tag亲和层析柱纯化后包涵体形式的表达蛋白能达到比较高的纯度.
把纯化后的cIFN经GuHCl阶段透析法变性复性后进行ELISA干扰素活性测定, 结果显示cIFN具有很强的IFNα抗原活性(图3A).
MTS比色定量法测定cIFN对肝癌细胞系PLC/PRF/5的细胞增殖抑制实验结果显示, 所表达的cIFN在干预浓度10 mg/L时其细胞增殖抑制率能达到35%, 说明cIFN具有明显的细胞增殖抑制作用(图3B).
用HBsAg血凝抑制检测试剂检测cIFN干预培养后的PLC/PRF/5细胞培养上清中HBsAg含量, 结果显示cIFN在1.56 mg/L时明显抑制PLC/PRF/5细胞分泌HBsAg, 说明表达的cIFN具有明显的抗HBV作用(图3C).
IFN是一类具有多种生物学活性的重要细胞因子, 是迄今为止研究得最为详尽, 同时也是第一个利用基因工程技术开发生产并用于临床治疗的细胞因子, 目前广泛应用于病毒感染性疾病的抗病毒治疗. IFN的抗病毒机制是其与细胞膜特异性受体结合, 在细胞内产生抗病毒蛋白, 通过激活核苷酸内切酶, 使病毒单链RNA和mRNA降解, 抑制病毒合成, 是目前治疗病毒性肝炎首选一线药物之一[8-9], 临床使用已多年. 但当前的IFN产品尚存在临床疗效尚不够理想、副反应较大等缺陷, 其原因可能与宿主和病毒因素有关以外, 还与IFN产品本身的性质、剂型及给药方式等也有关系, 很多研究小组和制药行业正致力于寻找更适合于临床应用的疗效更强、毒副作用更低的新型IFN[10-12].
目前临床上用于病毒性肝炎治疗的IFN包括普通IFNα、cIFN和聚乙二醇化干扰素α(PEG-IFNα), 后两者均为改变IFN的性质或剂型而制成的新型IFN. cIFN是通过筛选已知IFNα各亚型序列后用基因重组技术复合而成的非天然IFN, 和普通IFN相比, 其体外抗病毒、抗增殖、激活自然杀伤细胞和基因诱导活性都有明显增高. PEG-IFNα是在IFNα分子上交联无活性、无毒性的PEG分子, 延缓IFNα注射后的吸收和体内清除过程, 其半衰期较长, 每周1次给药即可维持有效血药浓度. 除此之外, 正在研究的IFN剂型还有融合IFN和特异性抗体而制成的抗体导向IFN、融合IFN和白蛋白而制成的长效IFN等[13]. 抗体导向IFN是把单克隆抗体作为载体的导向药物, 从理论上讲, 这种剂型IFN因其导向载体-单克隆抗体特异性高, 可以特异性地把IFN集中在HBV感染细胞周围, 不仅提高疗效和降低毒副作用, 而且还可以延长IFN的半衰期, 是非常有应用前景的新型IFN剂型. 我院正在进行实验室阶段或临床试验阶段的新型IFN研究.
在进行不同剂型IFN研究时, 其核心主体-IFN本身的性质至管重要. cIFN是一种新型IFN, 因其和Ⅰ型IFN受体的亲和力较强, 其生物学活性优于普通IFN. cIFN已分别被美国FDA和我国卫生部批准用于治疗慢性乙型肝炎和慢性丙型肝炎, 国内外已有很多关于cIFN治疗慢性乙型肝炎和慢性丙型肝炎的成功报道[14-21]. cIFN治疗慢性乙型肝炎在抗病毒应答率、持续抗病毒应答率及诱导HBeAg/抗HBe血清转换方面均优于普通IFN. cIFN治疗慢性丙型肝炎的研究报道多于慢性乙型肝炎, 尤其对复发和其他IFN无效的丙型肝炎患者, cIFN可获得较高的疗效. 因其良好的应用前景, 国内有实验室进行cIFN的表达及相关制备工艺研究[22-23].
根据以上理论基础及临床需要, 我们正在开展cIFN及其导向药物研究, 本文报道有关cIFN蛋白的表达及其活性测定结果. cIFN是人工优化的非天然IFN, 不能用传统的PCR方法扩增其基因. 重叠延伸PCR方法是现有基因的重要改造手段, 也可作为已知序列的基因全合成的有效手段. 我们参考已报道的cIFN序列, 又根据大肠杆菌的偏爱密码子, 人工设计了cIFN的高表达基因, 之后用重叠延伸PCR方法成功合成了cIFN的全基因, 其基因长度为534 bp. 我们用此基因构建了原核表达载体, 在大肠杆菌表达系统实现了高效表达, 其分子质量为23.3 kDa. 活性测定结果显示, 在本研究中获得的cIFN蛋白具有明显的剂量依赖性PLC/PRF/5细胞增殖抑制活性和抗HBV活性, 我们将用此cIFN进行病毒性肝炎的靶向治疗等应用研究.
干扰素是目前治疗病毒性肝炎的首选一线药物之一, 临床使用已多年, 但尚存在临床疗效不够理想、副反应较大等缺陷, 其原因可能与宿主和病毒因素有关以外, 还与IFN产品本身的性质、剂型及给药方式等有关系.
朱传武, 副主任医师, 苏州市第五人民医院传染科
本研究根据大肠杆菌的偏爱密码子, 人工设计了cIFN的高表达基因, 并用重叠延伸PCR方法成功合成cIFN的全基因, 实现了大肠杆菌表达系统中的高效表达.
cIFN作为一种高效的新型干扰素, 不仅可以单独使用, 也可以用于抗体导向干扰素、长效干扰素等新剂型干扰素. 抗体导向干扰素可以把干扰素特异性地集中在病毒感染细胞周围, 是非常有应用前景的新型干扰素剂型.
重组复合干扰素(cIFN): 是通过筛选已知IFNα各亚型氨基酸序列每个位点上最常出现的氨基酸, 再用基因重组技术复合而成的新型非天然干扰素. cIFN和普通IFNα相比, 受体的亲和力和生物活性均明显提高.
本文研究具有新颖性, 实验方法具备一定的难度, 研究结果有待进一步开发利用, 具有应用价值.
编辑: 周晓武 电编: 郭海丽
| 1. | Blatt LM, Davis JM, Klein SB, Taylor MW. The biologic activity and molecular characterization of a novel synthetic interferon-alpha species, consensus interferon. J Interferon Cytokine Res. 1996;16:489-499. [PubMed] [DOI] |
| 2. | Warrens AN, Jones MD, Lechler RI. Splicing by overlap extension by PCR using asymmetric amplification: an improved technique for the generation of hybrid proteins of immunological interest. Gene. 1997;186:29-35. [PubMed] [DOI] |
| 3. | Zhao QT, Ma LY, Xue GZ, Zhao AZ, Dou KF. [Expression, purification and activity analysis of human single-chain antibody against hepatocellular cancer]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2007;23:649-651. [PubMed] |
| 4. | Heckman KL, Pease LR. Gene splicing and mutagenesis by PCR-driven overlap extension. Nat Protoc. 2007;2:924-932. [PubMed] [DOI] |
| 5. | Asano R, Takemura S, Tsumoto K, Sakurai N, Teramae A, Ebara S, Katayose Y, Shinoda M, Suzuki M, Imai K. Functional construction of the anti-mucin core protein (MUC1) antibody MUSE11 variable regions in a bacterial expression system. J Biochem. 2000;127:673-679. [PubMed] [DOI] |
| 6. | Takemura S, Asano R, Tsumoto K, Ebara S, Sakurai N, Katayose Y, Kodama H, Yoshida H, Suzuki M, Imai K. Construction of a diabody (small recombinant bispecific antibody) using a refolding system. Protein Eng. 2000;13:583-588. [PubMed] [DOI] |
| 7. | Makabe K, Asano R, Ito T, Tsumoto K, Kudo T, Kumagai I. Tumor-directed lymphocyte-activating cytokines: refolding-based preparation of recombinant human interleukin-12 and an antibody variable domain-fused protein by additive-introduced stepwise dialysis. Biochem Biophys Res Commun. 2005;328:98-105. [PubMed] [DOI] |
| 10. | 张 辉, 段 招军, 朱 建高, 彭 夫望, 李 武平, 高 寒春, 谢 志萍, 王 玉娥, 侯 云德. 人新型干扰素κ的基因克隆、表达、纯化及其抗病毒活性的初步研究. 中华实验和临床病毒学杂志. 2005;19:223-226. |
| 11. | 彭 夫望, 高 寒春, 谢 志平, 张 辉, 李 启明, 段 招军, 侯 云德. 重组人干扰素Epsilon的表达纯化及生物学性质研究. 中华实验和临床病毒学杂志. 2005;19:227-231. |
| 12. | 王 刚, 李 武平, 张 成海, 衣 作安, 郑 丽舒, 张 辉, 段 招军, 侯 云德. 新型重组人IFN-λ2的高效表达、纯化与抗病毒活性研究. 中华实验和临床病毒学杂志. 2005;19:232-235. |
| 14. | Kemmer N, Neff GW. Managing chronic hepatitis C in the difficult-to-treat patient. Liver Int. 2007;27:1297-1310. [PubMed] [DOI] |
| 15. | Witthoeft T, Fuchs M, Ludwig D. Recent i.v.-drug users with chronic hepatitis C can be efficiently treated with daily high dose induction therapy using consensus interferon: an open-label pilot study. World J Gastroenterol. 2007;13:579-584. [PubMed] [DOI] |
| 16. | Cornberg M, Hadem J, Herrmann E, Schuppert F, Schmidt HH, Reiser M, Marschal O, Steffen M, Manns MP, Wedemeyer H. Treatment with daily consensus interferon (CIFN) plus ribavirin in non-responder patients with chronic hepatitis C: a randomized open-label pilot study. J Hepatol. 2006;44:291-301. [PubMed] [DOI] |
| 17. | Böcher WO, Schuchmann M, Link R, Hillenbrand H, Rahman F, Sprinzl M, Mudter J, Löhr HF, Galle PR. Consensus interferon and ribavirin for patients with chronic hepatitis C and failure of previous interferon-alpha therapy. Liver Int. 2006;26:319-325. [PubMed] [DOI] |
| 18. | Yao GB, Fu XX, Tian GS, Xu DZ, Hao LJ, Huangfu YS, Su CX. A multicenter, randomized, controlled trial of interferon alfacon-1 compared with alpha-2a-interferon in Chinese patients with chronic hepatitis C virus infection. J Gastroenterol Hepatol. 2000;15:1165-1170. [PubMed] [DOI] |
| 20. | 李 晓娟, 于 岩岩, 斯 崇文, 高 健, 田 德英, 许 家璋, 盛 吉芳, 胡 大荣, 徐 道振, 王 耀宗. 复合干扰素治疗复发及无应答慢性丙型肝炎效果观察. 中华传染病杂志. 2004;22:327-330. |
| 22. | Hao Y, Chu J, Wang Y, Zhang S, Zhuang Y. Expression and aggregation of recombinant human consensus interferon-alpha mutant by Pichia pastoris. Biotechnol Lett. 2006;28:905-909. [PubMed] [DOI] |
| 23. | Hao Y, Chu J, Wang Y, Zhuang Y, Zhang S. The inhibition of aggregation of recombinant human consensus interferon-alpha mutant during Pichia pastoris fermentation. Appl Microbiol Biotechnol. 2007;74:578-584. [PubMed] [DOI] |