修回日期: 2008-01-15
接受日期: 2008-01-23
在线出版日期: 2008-02-18
目的: 探讨线粒体损伤在黄芩甙诱导肝癌细胞凋亡中的作用及可能的机制.
方法: 应用细胞培养技术培养肝癌细胞BEL-7402, 透射电镜观察线粒体的变化; 应用流式细胞仪检测细胞凋亡百分率及线粒体膜电位、细胞内Ca2+的改变, 荧光发光法检测细胞色素(cytochrome C, Cyt C)含量, Bcl-2蛋白表达和流式细胞仪测定caspase-3活性.
结果: 黄芩甙诱导肝癌细胞BEL-7402凋亡呈剂量依赖关系, 线粒体结构出现明显改变; 肝癌细胞线粒体膜电位降低, 6 h、24 h、48 h分别为85.49±2.17、82.59±2.18、28.45±2.39; 细胞内Ca2+和Cyt C的释放增加, Bcl-2蛋白表达下降和caspase-3活性增加. 在6 h、24 h、48 h时细胞线粒体膜电位, 细胞内Ca2+和Cyt C的释放分别为(6 h: 85.49±2.17、19.56±2.09、35.36±3.21; 24 h: 82.59±2.18、14.76±1.03、44.57±5.56; 48 h: 28.45±2.39、88.79±4.32、78.63±7.65).
结论: 线粒体损伤在黄芩甙诱导肝癌细胞凋亡中起重要作用, 其机制可能为抑制肝癌细胞Bcl-2蛋白表达, 促进caspase-3活性增加, 使细胞内Ca2+增加, 激发线粒体膜通透性转运孔开放, 降低线粒体跨膜电位, 促进Cyt C的释放.
引文著录: 郭霞, 郭昱. 黄芩甙对肝癌细胞BEL-7402线粒体膜电位、细胞内Ca2+和Cyt C的影响. 世界华人消化杂志 2008; 16(5): 468-472
Revised: January 15, 2008
Accepted: January 23, 2008
Published online: February 18, 2008
AIM: To study the effect of mitochondria membrane injury on baicalin-induced liver cancer cell apoptosis and its possible mechanism.
METHODS: Hepatocellular carcinoma (HCC) BEL-7402 cells were cultured. Changes in mitochondria ultra-structure were observed under transmission electron microscope. Changes in mitochondria membrane potential, intracellular Ca2+ and apoptosis rate were detected by flow cytometry. Cytochrome C level was detected using fluorescence method. Expression of protein bcl-2 and activity of capases-3 were assessed by flow cytometry.
RESULTS: Baicalin induced BEL-7402 cell apoptosis in a dose-dependent manner and significantly changed the ultra-structure of mitochondria. The level of mitochondria membrane potential was significantly decreased (85.49 ± 2.17, 82.59 ± 2.18, 28.45 ± 2.39, respectively, at 6, 24 and 48 h). The release of intracellular Ca2+ and cytochrome C was increased, while the expression of Bcl-2 was decreased and the activity of caspase-3 was increased. The values for mitochondria membrane potential, intracellular Ca2+ and cytochrome C were 19.56 ± 2.09, 14.76 ± 1.03 and 88.79 ± 4.32 at 6 h; 82.59 ± 2.1, 14.76 ± 1.03 and 44.57 ± 5.56 at 24 h; 28.45 ± 2.39, 88.79 ± 4.32 and 78.63 ± 7.65 at 48 h.
CONCLUSION: Baicalin induces apoptosis of HCC BEL-7402 cells in a dose- dependent manner and mitochondria play an important role in apoptosis by inhibiting Bcl-2 protein expression in liver cancer cells, increasing the activity of caspase-3 and the level of intracellular Ca2+, promoting mitochondrial membrane permeability and cytochrome C release, decreasing mitochondrial transmembrane potential.
- Citation: Guo X, Guo Y. Effect of baicalin on mitochondrial membrane potential, Ca2+ and cytochrome C in HCC cell line BEL-7402. Shijie Huaren Xiaohua Zazhi 2008; 16(5): 468-472
- URL: https://www.wjgnet.com/1009-3079/full/v16/i5/468.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i5.468
黄芩甙是从唇形科植物黄芩中提取、分离出来的一种黄酮类化合物, 是黄芩的主要有效成分之一, 除传统意义上的解热、利胆、保肝、抗菌等药理作用外, 近年来发现黄芩甙具有抗肿瘤作用[1-2]. 诱导肿瘤细胞凋亡是重要的抗肿瘤策略之一. 既往对凋亡的形态观察重点在细胞核的变化上, 线粒体作为能量器官其形态又会有什么变化? 因此, 本研究拟观察黄芩甙作用后线粒体超微结构以及细胞内Ca2+的含量、线粒体膜电位和细胞色素C(Cytochrome C, Cyt C)的变化, 探讨线粒体损伤在黄芩甙诱导肝癌细胞凋亡中的机制.
人肝癌细胞株BEL-7402由本室冻存; 黄芩甙由四川汉坤植化有限公司提供(纯度≥95% 分子质量446.35 kDa); RPMI-1640培养液, Bcl-2、Cyt C mAb为北京中山试剂公司产品; JEM2000EX透射电镜, 流式细胞仪Epics XLⅡ型为美国Beckman Coulter公司产品.
1.2.1 细胞培养: 人肝癌细胞株BEL-7402培养于RPMI-1640培养液, 内含100 g/L小牛血清、100000 U/L青霉素、100 mg/L链霉素, 置37 ℃, 50 mL/L CO2, 恒温密闭式孵箱内培养传代.
1.2.2 黄芩甙对肝癌细胞凋亡的影响: 空白对照组、1.25、2.5、5、10、20、40 mg/L黄芩甙处理组分别作用48 h后, 制备各细胞悬液, PI染色流式细胞计数测定凋亡率.
1.2.3 透射电镜: 取对数生长期细胞接种于培养瓶内, 分别加入10 mg/L黄芩甙及等量培养液作用48 h, 收集细胞, 常规透射电镜样品制备, 透射电镜下观察亚细胞结构.
1.2.4 流式细胞仪检测线粒体膜电位、细胞内Ca2+: 空白对照组、10 mg/L黄芩甙处理组分别作用6、24、48 h后制备各细胞悬液, PBS洗涤、弃上清, 分别加入下列染液: 1 mmol/L rhodamine 123, 1 mmol/L Fluo-3, 37 ℃孵育20 min, 37 ℃孵育20 min, PBS洗涤、重悬、流式检测.
1.2.5 免疫荧光检测Cyt C: 40 g/L多聚甲醛固定细胞20 min, PBS洗涤后用山羊血清封闭30 min, 加入抗大鼠Cyt C单克隆抗体, 4 ℃过夜, PBS洗涤后加入FITC荧光标记二抗, 37 ℃孵育40 min, 90%碱性甘油封固, 用Novo start全自动荧光发光检测仪对荧光强度进行定量分析.
1.2.6 Bcl-2蛋白表达检测: 作用48 h后, 消化细胞105左右, PBS洗涤2次后, 20 g/L中性甲醛固定30 min, 0.3%皂素渗透5 min, 弃上清, 加1:50稀释的鼠抗人Bcl-2蛋白单克隆抗体, 冰上孵育45 min, PBS洗涤后, 流式细胞检测Bcl-2表达.
1.2.7 caspase-3活性检测: 作用48 h后, 按300 μL细胞悬液加1 μL FITC-DEVD-FMK, 37 ℃ 50 mL/L CO2孵育30 min, 用Wash buffer重悬细胞2次后加300 μL Wash buffer混匀, 置于冰上, 流式细胞检测.
统计学处理 计量资料数据以mean±SD表示, 用SPSS10.0软件进行统计分析. 多组间的均数差异性比较采用单因素方差分析(one-way ANOVA)及LSD检验. P<0.05为有统计学意义.
1.25、2.5、5、10、20、40 mg/L黄芩甙分别作用肝癌细胞48 h后, 凋亡百分率分别为2.32%±0.72%、2.42%±0.68%、9.86%±1.98%、17.59%±3.26%、22.27%±3.89%、24.34%±3.79%, 与对照组(2.18%±0.66%)比较, 后四者有统计学意义(P<0.01), 呈量效关系.
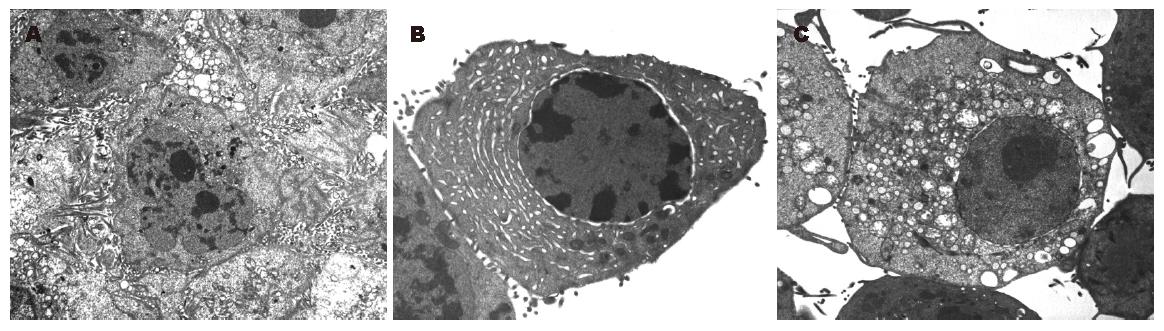
发现对照组肝癌细胞具有肿瘤细胞典型特点: 核大而圆, 染色质疏松, 核仁明显, 有多个大核仁, 形态不规则, 常见核仁边集现象, 细胞质较少, 细胞器都比较简单, 细胞表面微绒毛细长且密集. 黄芩甙处理组, 细胞核变小, 皱缩, 异染色质增多, 核仁减少、浓缩甚至消失, 核质比减少. 部分细胞呈现典型的凋亡改变: 染色质凝集、固缩, 聚集于核膜下呈境界分明的团块状、花瓣状或新月体形. 线粒体数量增多, 有的为基质密度增高, 内外膜间隙增宽, 内嵴发育较好, 但体积变化不明显; 有的线粒体体积增大, 肿胀呈空泡状(图1).
对照组在不同时间的线粒体膜电位较稳定, 保持在较高水平, 6 h、24 h处理组与对照组比差别不大, 48 h处理组显著降低, 两组差异显著(P<0.01, 表1).
目前已逐渐认识到线粒体是细胞凋亡的"中心执行者"[3-4], 某些与凋亡相关的基因产物(蛋白质和酶)均可定位于线粒体. 在细胞凋亡的诱导期, 线粒体的结构和功能就开始发生一些特征性的变化[5-7]. Reed et al[5]认为在细胞凋亡时线粒体超微结构的改变主要为: 线粒体嵴失去紧密排列和有序折叠的外表, 同时在膜间隙中充满了浓缩的基质, 而线粒体本身的大小改变不明显. 我们在观察肝癌细胞发生凋亡时, 除了见到典型的凋亡核型, 同时还发现线粒体的变化有两种表现: 一种基质密度增高, 内外膜间隙增宽, 但体积变化不明显; 一种线粒体体积增大, 肿胀呈空泡状. 前者与Reed et al所描述的在凋亡中线粒体的改变相似. 沈忠英et al[6]在研究三氧化二砷作用于食管癌细胞系时, 认为凋亡的早期改变为线粒体增多, 中后期是线粒体肿胀. 所以, 线粒体的这种基质密度增高的改变可能是凋亡发生的早期改变.
已证实线粒体膜通透性转运改变是凋亡过程中的重要环节, 在致凋亡因子的刺激下, 线粒体膜通透性转运孔(permeability transiton pore, MPTP)开放, 线粒体跨膜电位降低或丧失, 线粒体基质中释放出凋亡蛋白, 使细胞凋亡[7-8]. 近年来陆续有报道线粒体跨膜电位的耗散是细胞凋亡级联反应过程中最早发生的事件, 而一旦线粒体跨膜电位耗散, 细胞就会进入不可逆的凋亡过程[9-10]. MPTP是跨膜多蛋白孔, 定位于线粒体内外膜接触点, 可能由电压依赖的阴离子通道(VDAC)-腺苷酸移位酶-亲环蛋白D三联复合物构成, 有开放与关闭二种构象. MPTP孔道作为许多生理效应的感受器(二价阳离子、ATP、ADP、NAD、ΔΨm、pH、巯基与多肽)整合了电生理、氧化还原与细胞代谢状态的信息. 在正常情况下, MPTP只允许相对分子质量小于1500的分子通过, 质子可自由通过线粒体膜形成稳定的线粒体膜电位, 如果MPTP开放, 导致线粒体膜电位下降或缺失, 且MPTP作用有自放大的效应. 如果能稳定线粒体膜电位就能防止细胞凋亡或可阻止凋亡的进展. 我们的研究结果发现对照组肝癌细胞在不同时间的线粒体膜电位较稳定, 保持在较高水平, 黄芩甙作用6 h、24 h时与对照组比差别不大, 48 h时显著降低肝癌细胞线粒体跨膜电位. 认为黄芩甙通过某种途径使MPTP开放, 导致线粒体膜电位下降, 而阻止凋亡的进展.
Ca2+是细胞代谢活动重要的第二信使[11]. 他可能是使MPTP开放的刺激信号. Carboni et al[12]提出钙依赖性的MPTP孔调节模式, 认为MPTP孔有低导性和高导性两种不同的开放方式, 前者是一种可逆的正常调节过程, 后者为不可逆的细胞死亡信号. 两种开放方式均受线粒体Ca2+浓度的升高直接或间接调控. 线粒体Ca2+超载, 启动高导性MPTP孔开放, 线粒体膜电位下降, 线粒体膨胀, 外膜破裂, 诱导细胞凋亡. 季宇彬et al将羊栖菜多糖作用于人胃癌SGC-7901细胞, 观测到细胞内Ca2+浓度升高, 且细胞凋亡指数增加, 提示可能是通过Ca2+启动凋亡机制. Takel et al研究表明, 抑制细胞Ca2+升高, 可防止凋亡的发生[13]. 我们观察到黄芩甙作用后肝癌细胞凋亡增加、细胞内Ca2+含量的增加、线粒体膜电位的下降, 三者在时间上的变化趋于一致, 并伴有线粒体的肿胀. 认为线粒体途径在黄芩甙诱导细胞凋亡中起重要作用, 其机制为增加细胞内Ca2+含量, 激发MPTP开放, 降低线粒体跨膜电位. 但是影响细胞外钙的内流, 还是调整细胞内钙库的释放, 尚需进一步研究. 此外, 细胞内Ca2+信号的改变与凋亡发生的阶段密切相关[14-15], 有研究表明一旦凋亡发生, 细胞内依赖Ca2+-Mg2+核酸酶被大量激活后, 细胞内游离Ca2+可能被结合而浓度下降. 我们只观察到黄芩甙增加细胞内Ca2+含量, 这可能与细胞所处的凋亡阶段有关, 处于本阶段的细胞尚未发生不可逆的凋亡.
Cyt C作为一种信号物质, 也在细胞凋亡中发挥着重要的作用. 正常情况下, 他存在于线粒体内膜和外膜之间的腔中, 凋亡信号刺激使其从线粒体释放至细胞质. Cyt C一旦释放可引起两种后果, 一是与Apaf-1(apoptotic protease activating factor-1)结合, 在ATP/dATP的介导下, 使caspase-9前体裂解为活化的caspase-9, 活化的caspase-9再激活caspase-3, 引起细胞凋亡. 二是由于Cyt C释放入胞质, 细胞内Cyt C减少或缺失, 可直接导致呼吸链电子传递中断, 最后导致细胞坏死[16]. Cyt C的释放是线粒体外膜通透性增高的结果. Bcl-2蛋白主要聚集在线粒体外膜, 阻止Cyt C的释放, 使胞质内caspase不能激活, 细胞凋亡受阻. caspase-3是最重要的凋亡执行者之一, 在激活的caspase-3能降解Bcl-2蛋白, 阻止其抗凋亡作用. caspase-3一旦被激活, 细胞凋亡的发生将不可逆转. 我们的研究结果发现黄芩甙能抑制肝癌细胞Bcl-2蛋白表达, 增加caspase-3活性, 促进Cyt C的释放.
黄芩甙诱导肝癌细胞凋亡的可能途径为增加细胞内Ca2+含量, 降低线粒体跨膜电位, 促进Cyt C的释放. Bcl-2蛋白表达的下降和caspase-3活性增加调控上述过程. 透射电镜下线粒体的改变进一步支持线粒体损伤在黄芩甙诱导肝癌细胞凋亡中的作用.
近年来发现黄芩甙诱导肿瘤细胞凋亡, 但既往对凋亡的形态观察重点在细胞核的变化上, 线粒体作为能量器官其形态又会有什么变化研究甚少. 本研究拟观察黄芩甙作用后线粒体超微结构以及细胞内Ca2+的含量、线粒体膜电位和细胞色素C的变化, 探讨线粒体损伤在黄芩甙诱导肝癌细胞凋亡中的机制.
党双锁, 副教授, 西安交通大学第二医院感染科
目前诱导肿瘤细胞凋亡, 已成为抗肿瘤的重要策略之一, 许多学者已逐渐认识到线粒体是细胞凋亡的"中心执行者", 线粒体膜通透性转运改变是线粒体调节凋亡的重要机制.
本研究深入探讨了线粒体损伤在黄芩甙诱导肝癌细胞凋亡中的机制.
本研究为揭示黄芩甙抗肿瘤作用机制提供了有用的资料, 为其进一步开发应用奠定了基础.
线粒体膜通透性转运孔: 是跨膜多蛋白孔, 定位于线粒体内外膜接触点, 可能由电压依赖的阴离子通道(VDAC)-腺苷酸移位酶-亲环蛋白D三联复合物构成, 有开放与关闭两种构象.
本文研究方法可行, 目的明确, 但讨论应结合自己的研究成果展开, 突出主题.
编辑: 周晓武 电编: 郭海丽
| 1. | Chao JI, Su WC, Liu HF. Baicalein induces cancer cell death and proliferation retardation by the inhibition of CDC2 kinase and survivin associated with opposite role of p38 mitogen-activated protein kinase and AKT. Mol Cancer Ther. 2007;6:3039-3048. [PubMed] [DOI] |
| 2. | Lu HF, Hsueh SC, Ho YT, Kao MC, Yang JS, Chiu TH, Huamg SY, Lin CC, Chung JG. ROS mediates baicalin-induced apoptosis in human promyelocytic leukemia HL-60 cells through the expression of the Gadd153 and mitochondrial-dependent pathway. Anticancer Res. 2007;27:117-125. [PubMed] |
| 3. | Lin HH, Hsu HL, Yeh NH. Apoptotic cleavage of NuMA at the C-terminal end is related to nuclear disruption and death amplification. J Biomed Sci. 2007;14:681-694. [PubMed] [DOI] |
| 4. | Brenner C, Kroemer G. Apoptosis. Mitochondria--the death signal integrators. Science. 2000;289:1150-1151. [PubMed] [DOI] |
| 5. | Reed JC, Green DR. Remodeling for demolition: changes in mitochondrial ultrastructure during apoptosis. Mol Cell. 2002;9:1-3. [PubMed] [DOI] |
| 8. | Danial NN. BCL-2 family proteins: critical checkpoints of apoptotic cell death. Clin Cancer Res. 2007;13:7254-7263. [PubMed] [DOI] |
| 9. | Liu J, He H, Zhang Z, Jiang S, Akahoshi T, Yang J, Li J, He T. Mitochondria play a role in the development of non-apoptotic programmed cell death of neutrophils induced by ONO-AE-248. Cell Mol Immunol. 2007;4:447-453. [PubMed] |
| 10. | 黄 伟, 张 瑶珍. 线粒体膜与肿瘤进展. 国外医学∙生理、病理科学与临床分册. 2002;22:9-11. |
| 11. | Chang WH, Chen CH, Lu FJ. Different effects of baicalein, baicalin and wogonin on mitochondrial function, glutathione content and cell cycle progression in human hepatoma cell lines. Planta Med. 2002;68:128-132. [PubMed] [DOI] |
| 12. | Carboni GL, Gao B, Nishizaki M, Xu K, Minna JD, Roth JA, Ji L. CACNA2D2-mediated apoptosis in NSCLC cells is associated with alterations of the intracellular calcium signaling and disruption of mitochondria membrane integrity. Oncogene. 2003;22:615-626. [PubMed] [DOI] |
| 13. | Takei N, Endo Y. Ca2+ ionophore-induced apoptosis on cultured embryonic rat cortical neurons. Brain Res. 1994;652:65-70. [PubMed] [DOI] |
| 14. | Ichas F, Mazat JP. From calcium signaling to cell death: two conformations for the mitochondrial permeability transition pore. Switching from low- to high-conductance state. Biochim Biophys Acta. 1998;1366:33-50. [PubMed] [DOI] |
| 15. | Adams JM, Cory S. Apoptosomes: engines for caspase activation. Curr Opin Cell Biol. 2002;14:715-720. [PubMed] [DOI] |