修回日期: 2008-01-14
接受日期: 2008-01-21
在线出版日期: 2008-02-08
目的: 总结肝门部胆管癌神经浸润的方式和规律, 探讨肿瘤浸润神经的途径和机制.
方法: 光镜观察73例肝门部胆管癌患者1082张组织病理切片, 总结归纳肿瘤浸润神经的方式和规律; 分析肿瘤浸润神经与肿瘤分化程度、肿瘤浸润范围、肿瘤标志物水平等临床病理学因素的关系; 通过免疫组织化学CD34、D2-40染色分别显示肿瘤浸润神经与微血管和微淋巴管的关系.
结果: 肝门部胆管癌神经浸润率为91.78%, 高、中、低分化腺癌组肿瘤神经浸润发生率之间的差异无统计学意义(P>0.05). Logistic回归分析显示肿瘤浸润胆管壁全层与神经浸润间的相关性具有统计学意义(P<0.01). 高分化腺癌与中、低分化组微血管密度之间的差异有统计学意义(P<0.05). 肿瘤浸润神经有五种方式, 肿瘤可以发生微血管和微淋巴管的侵犯, 未发现肿瘤通过血管、淋巴管途径浸润神经.
结论: 肝门部胆管癌神经浸润率高; 肿瘤侵犯胆管壁全层后直接浸润神经, 而不是经过血管和淋巴管途径; 行根治性切除时应紧贴血管外膜仔细剥除其周围神经纤维组织.
引文著录: 李成刚, 黄志强, 韦立新, 董家鸿, 刘军桂, 王燕生. 肝门部胆管癌神经浸润特征的临床病理学分析. 世界华人消化杂志 2008; 16(4): 379-384
Revised: January 14, 2008
Accepted: January 21, 2008
Published online: February 8, 2008
AIM: To elucidate the characteristics and mechanism of perineural invasion in hilar cholangiocarcinoma.
METHODS: A clinicopathologic study was conducted on tissue sections from 73 patients with hilar cholangiocarcinoma to observe the incidence and modes of perineural invasion. Clinicopathologic factors, such as tumor differentiation and pathologic stage, were analyzed when perineural invasion was observed in the sections. Immunohistochemical staining for CD34 and D2-40 in cancer tissue samples was performed to clarify the association of perineural invasion with vessels.
RESULTS: The overall incidence of perineural invasion was 91.78% (67 of 73 patients). However, the incidence of perineural invasion did not show any remarkable difference in various differentiated adenocarcinomas. Logistic regression analysis identified that penetration of bile duct was significantly correlated with perineural invasion (P < 0.01). The microvessel density (MVD) was significantly lower in well-differentiated adenocarcinomas than in moderately- and poorly- differentiated adenocarcinomas (P < 0.05). Five patterns were observed as the tumor cells invaded nerve fibers. Although tumor cells were found to invade microvessels and microlymphatics, immunohistochemical staining for CD34 and D2-40 respectively showed no association between perineural invasion and lymphatic or vascular invasion.
CONCLUSION: Perineural invasion is common in hilar cholangiocarcinoma and does not develop via the lymphatic or vascular network, but is a continuous extension from the primary tumor. Nerve plexus around the membrana adventitia should be completely divested during radical excision of hilar cholangiocarcinoma.
- Citation: Li CG, Huang ZQ, Wei LX, Dong JH, Liu JG, Wang YS. Clinical pathology of perineural invasion in hilar cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(4): 379-384
- URL: https://www.wjgnet.com/1009-3079/full/v16/i4/379.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i4.379
肝门部胆管癌在诊断和手术切除率上都取得了很大的进展, 但大多数患者在得到确诊时已是疾病的晚期, 总体预后仍然不佳[1-5]. 只有根治性切除才能使患者获得最佳疗效, 但术后肿瘤的复发率非常高[2-3]. 在人体多种实体瘤中, 肿瘤常常围绕神经组织发生扩散, 因此很多学者都强调, 在切除肿瘤组织的同时, 应该注意对瘤组织周围神经组织的清除. 尽管有研究表明, 肝门部胆管癌神经浸润对患者预后有不良影响[4], 但各组报道间的肿瘤神经浸润发生率差异很大, 肿瘤浸润神经的途径和确切机制尚不清楚. 本研究旨在阐明肝门部胆管癌神经浸润发生率及肿瘤浸润神经的方式及其与血管和淋巴管的关系.
本组73例患者均为2003-08/2007-01在北京解放军总医院肝胆外科治疗的肝门部胆管癌病例, 男41例, 女32例, 男女比例1.28:1, 年龄32-82(平均57.4±11.9)岁. 共获得患者1082张组织病理切片.
1.2.1 肿瘤浸润神经的判断标准: 光镜下观察发现肿瘤包绕神经外膜、侵入神经周围间隙和神经纤维内部生长者, 即确认为肿瘤浸润神经. 图像采集应用奥林帕斯BX51型显微镜及Image pro plus 5.0图像处理软件.
1.2.2 免疫组织化学方法: 鼠抗人CD34 mAb(1:50)、鼠抗人D2-40 mAb(1:50)、免疫组化SP试剂盒, 均购于北京中杉生物公司. 石蜡切片, 片厚3-4 μm, 梯度酒精水化, 30 mL/L H2O2室温孵育30 min, 微波炉抗原修复10 min, 分别滴加CD34、D2-40一抗(1:100)工作液4 ℃孵育过夜; 加入即用型兔抗鼠二抗工作液, 37 ℃孵育30 min, 3, 3'二氨基联苯胺(DAB)显色剂显色; 复染, 脱水, 中性树胶封片. 用TBS替代一抗、二抗作阴性对照, 已知阳性切片作阳性对照.
1.2.3 微血管密度(microvessel density, MVD)测定方法: 两名病理医师双盲法统计结果. MVD计数方法用Weidner[5]方法计数: 任何被CD34抗体染色的单个内皮细胞或细胞团, 不管有没有形成管腔, 只要与周围的微血管、肿瘤细胞和其他连接组织有一个清楚的分离, 都认为是一个可计数的微血管. 每一标本先低倍镜(×10)下选5个微血管数最多的区域即"热点", 在每一个区域中计数一个高倍镜(×20)下的微血管数取其均值计为MVD值.
统计学处理 结果以mean±SD表示, 经SPSS11.0统计软件处理, 依据资料类型的不同分别采用χ2检验、Logistic回归分析和单因素方差分析.
本研究中73例患者, 病理学诊断全部为腺癌(表1); 神经与淋巴结浸润发生率分别为91.78%(67/73)和27.40%(20/73); 高、中、低分化腺癌组肿瘤神经浸润发生率之间的差异无统计学意义(P>0.05).
| 病理类型 | n | 神经浸润 | 淋巴结浸润 |
| 高分化腺癌 | 9 | 8 | 1 |
| 中分化腺癌 | 34 | 32 | 9 |
| 低分化腺癌 | 28 | 25 | 9 |
| 黏液腺癌 | 2 | 2 | 1 |
| 合计 | 73 | 67 | 20 |
73例中仅2例肿瘤未侵犯胆管壁全层(高分化腺癌1例, 中分化腺癌1例), 均未发生神经浸润; 其余71例侵犯胆管壁全层, 其中67例(94.37%)发生神经浸润. 将淋巴结浸润、血清CA19-9水平、Bismuth-Corllet分型和胆管壁侵犯程度与神经浸润作Logistic单变量回归分析, 结果显示肿瘤侵犯胆管壁全层与神经浸润间的相关性具有统计学意义(P<0.01).
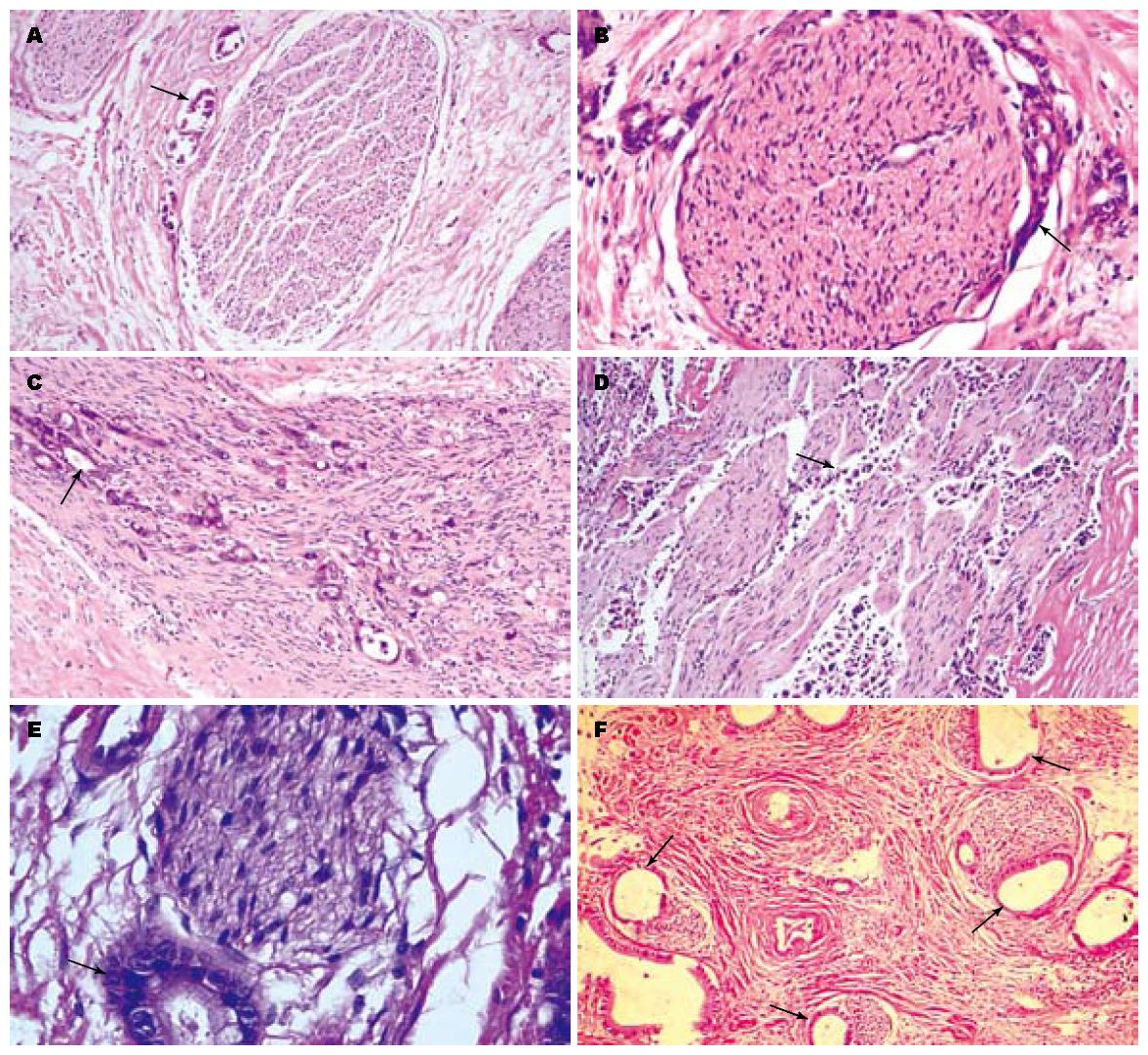
胆管癌细胞浸润神经主要方式可归纳为5种类型: Ⅰ型, 包绕神经束膜生长; Ⅱ型, 神经周围间隙内生长; Ⅲ型, 神经纤维内弥漫性生长; Ⅳ型, 神经内膜间隙内生长; Ⅴ型, 直接浸润无被膜包绕的神经末梢. 同一患者病灶内肿瘤浸润神经的方式相似, 但可有多种浸润方式并存, 肿瘤浸润神经方式的发生频率由高至低依次是: Ⅱ型>Ⅲ型>Ⅴ型>Ⅰ型>Ⅳ型(图1A-F).
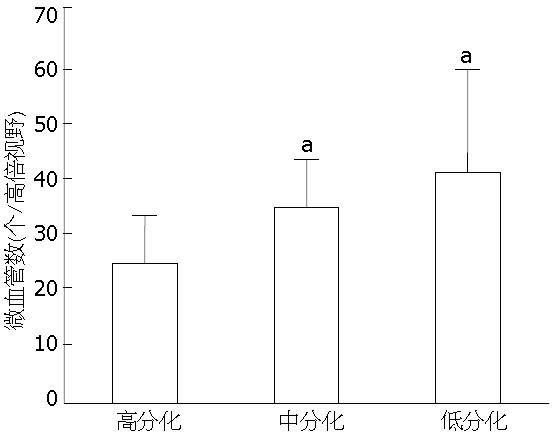
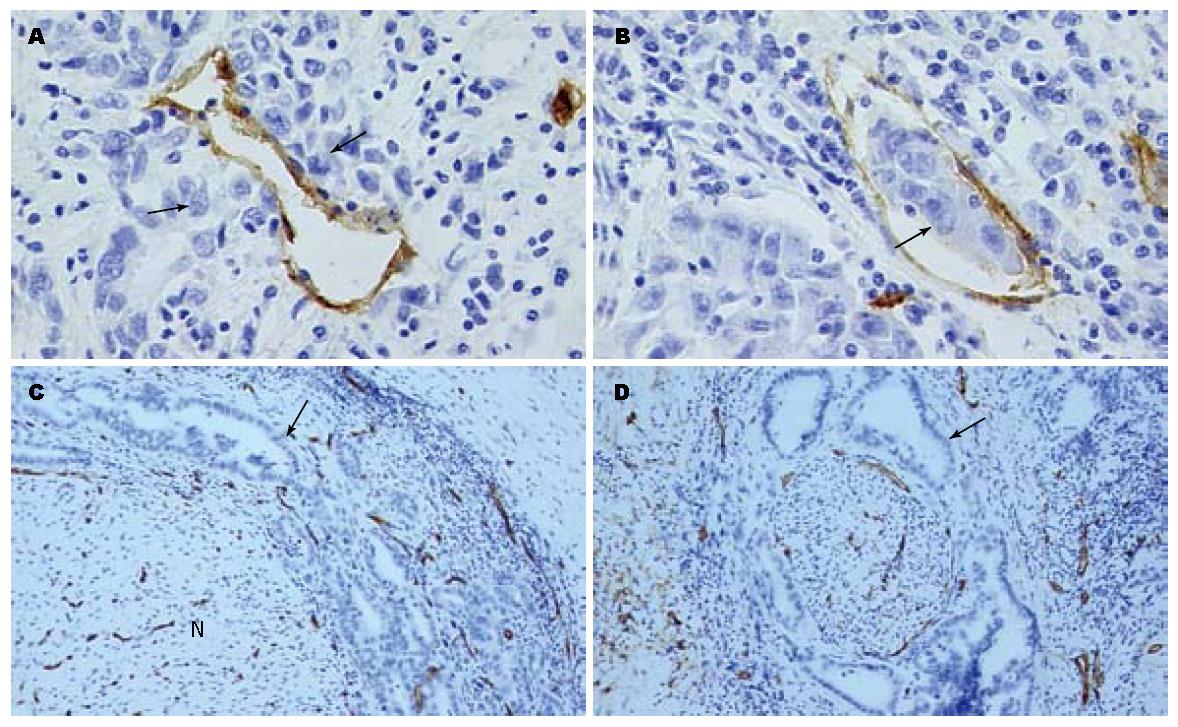
CD34特异性染色于血管内皮细胞胞膜, 棕褐色着色. 高分化腺癌与中、低分化组微血管密度之间的差异有统计学意义(P<0.05), 而中、低分化腺癌组之间差异无统计学意义(P>0.05)(图2). 肿瘤可以发生微血管浸润(图3A-B), 肿瘤浸润神经时伴有微血管增生(图3C), 但未发现肿瘤细胞通过血管途径浸润神经(图3C-D).
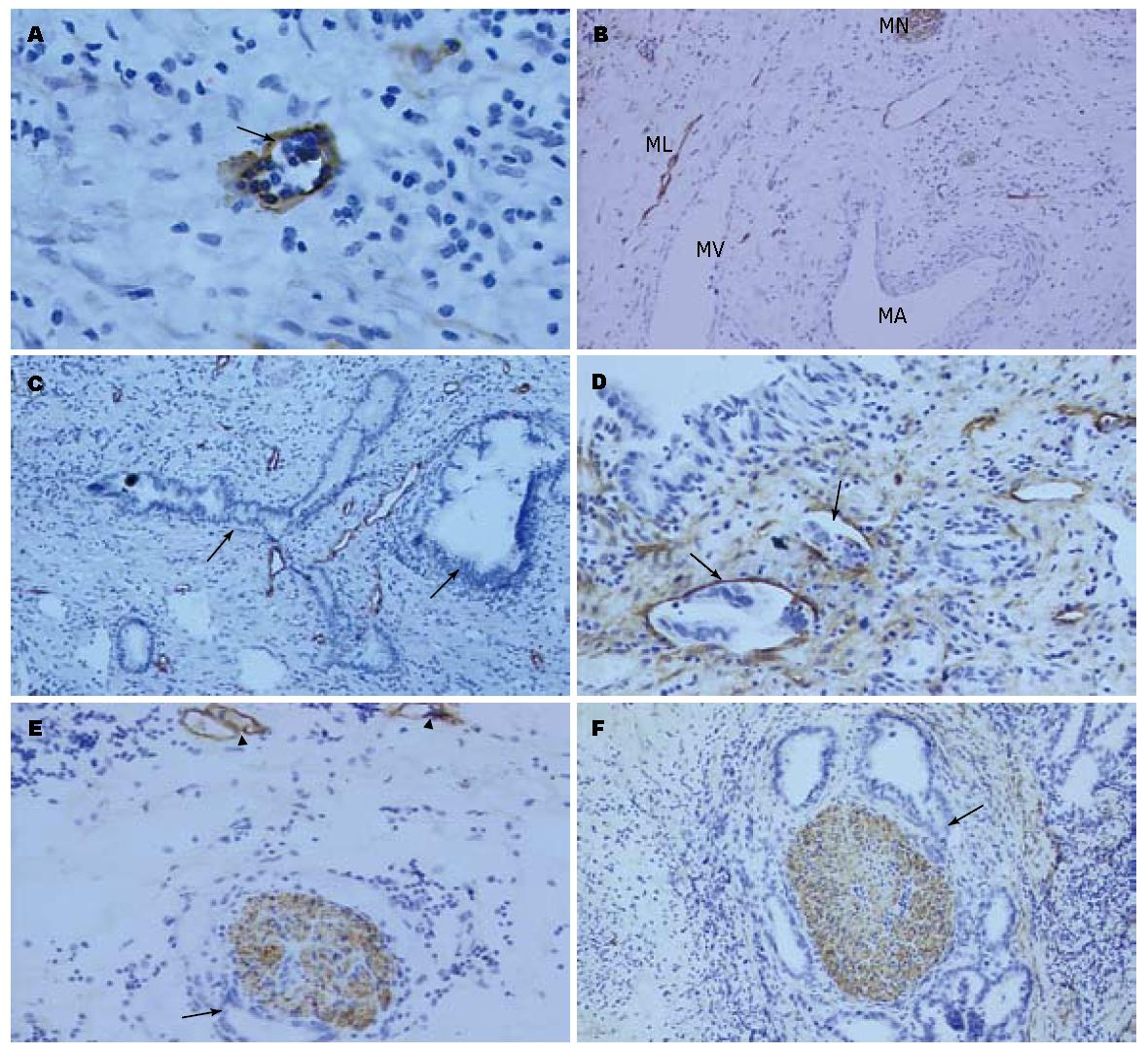
D2-40染色于淋巴管内皮细胞膜, 棕褐色着色; 神经细胞胞质着色, 为棕褐色颗粒状; 血管不染色(图4A-B). 肿瘤区域内观察到丰富的淋巴管存在, 虽然有些患者未发现局部淋巴结侵犯, 但肿瘤已浸润局部微淋巴管(4C-D); 肿瘤浸润神经时无淋巴管增生, 未发现肿瘤通过淋巴管途径浸润神经(图4E-F).
肝门部胆管癌无法根治性手术的原因多为肝十二指肠韧带、淋巴结和门静脉的侵犯, 而行根治性手术后患者5年生存率仅能达到30%-50%, 并且术后复发率很高[1-3]. 肝门部胆管癌即使发现体积很小或患者无症状时, 已发生了胆管系统、神经纤维及局部淋巴结的转移[6-7]. 有研究表明, 肿瘤发生神经浸润后, 患者生存时间显著缩短, 而第一站淋巴结转移对预后无显著影响[4]. 然而, 近15年来国内外关于肝门部胆管癌神经浸润发生率的报道为28.6%-100%[2,8-14], 结果极不一致. 我们分析原因主要来自两方面: 一方面是研究样本量太少, 另一方面是病理医生未报告. 我们的研究表明, 肝门部胆管癌神经浸润率高达91.78%. 观察中发现, 肿瘤主病灶区域内无神经纤维分布, 进展期肿瘤呈辐射状由胆管壁向周围组织浸润性生长, 肿瘤浸润神经常发生在肿瘤侵犯胆管壁全层之后. 虽然观察到肝门部胆管癌可以发生微血管和微淋巴管侵犯, 但其发生的频率远低于神经浸润. 我们以前的研究也发现, 肿瘤细胞可以在神经纤维内部以"跳跃"性方式生长并发生远处转移[15]. 因此, 我们认为神经浸润可能是肿瘤切除后局部复发的重要原因, 而肿瘤的局部残留, 微血管、微淋巴管的浸润也可能是潜在的复发因素. 肿瘤的神经浸润应该引起临床医生的重视, 并研究相应的治疗对策, 对提高患者预后并预防术后肿瘤复发可能具有重要意义.
以往认为肿瘤是沿着"最小阻力"方向侵犯神经的, 或是沿着血管和淋巴管途径转运的[16-17]. Hassan et al[18]应用电镜观察发现, 神经周围间隙与血管、淋巴管并不是连续的; 肿瘤浸润神经的三维重建也显示肿瘤浸润神经是肿瘤的直接延续[15,19]. 在我们的研究中, 通过微淋巴管和微血管特异性染色, 未观察到肿瘤细胞通过血管、淋巴管浸润神经. 我们的结果进一步证实了, 肿瘤浸润神经是一相对"独立的事件", 不是经过血管、淋巴管途径, 而是肿瘤侵犯胆管壁全层后直接蔓延的结果, 这与Yamaguchi et al[6]的研究结果相似. 但肿瘤浸润神经时伴有血管增生, 增生的血管可能进一步促进了肿瘤对神经的侵犯和远处转移. 另外, 我们还观察到, 肿瘤在神经纤维内部生长时也不是沿着"最小阻力"方向生长的, 肿瘤在神经纤维内部的生长方式也是多样的, 可以在神经纤维内部弥漫性生长, 最终破坏整条神经纤维. 有研究表明肿瘤浸润神经与神经营养因子(neurotrophin, NT)及其受体(如Trk)有关[20-23]. 基于他们针对肿瘤神经浸润的特异性实验治疗已有研究报道[24-25], 但目前的研究尚处于动物试验阶段, 离临床实际应用尚有距离.
由于肝门部胆管癌具有高的神经浸润发生率, 肝门部胆管癌行根治性切除术时, 对肝十二指肠韧带及一、二级胆管所在的Glisson鞘"骨骼化"时, 应仔细剥除胆管与肝动脉和门静脉间的神经纤维组织, 以防肿瘤细胞通过浸润的神经组织而发生局部残留和术后的局部复发. 然而, 剥离血管外膜是否可以满足神经纤维清除的需要, "去神经支配"的肝脏功能是否受到影响, 尚需要更多的研究工作证实. 基于以上研究结果, 我们认为, 肝门部胆管癌神经浸润发生率高, 术后应给予局部抗神经浸润治疗; 亟待研制新型、高效亲神经的肿瘤化疗药物; 研究活体组织中神经纤维染色剂, 指导术中对肿瘤周围神经组织的清除, 确定肿瘤切除的范围; 从而预防肿瘤通过神经浸润而发生的远处转移和局部复发.
肝门部胆管癌术后复发率超过50%, 当前对此类疾病进行的各类治疗, 包括手术方式的改进和切除范围的扩大, 总体上并不能提高患者的治疗效果, 如何降低术后复发率、延长患者生存时间是长期以来困扰外科医生的难题.
周伟平, 教授, 上海东方肝胆外科医院肝外三科
肿瘤浸润神经对患者预后有不良影响, 肿瘤浸润神经是肿瘤术后复发的重要因素, 但其发生的机制和途径尚知之甚少, 对应的治疗策略尚停留在分子和动物实验水平, 距离临床应用尚有距离.
本研究对大样本病例进行了系统研究, 明确了肝门部胆管癌神经浸润的真实发生率, 总结了肿瘤浸润神经的方式和一般规律, 有助于学术交流时相关概念的明确. 对肿瘤浸润神经的机制和途径进行了探讨, 为临床外科治疗此类疾病提供了实验依据.
本文有助于临床外科治疗肝门部胆管癌时手术范围的确定, 制定相应的治疗策略, 有望减少肿瘤术后复发率, 延长患者生存时间和改善生存质量.
肝门部胆管癌: 曾经有Klatskin瘤、肝管分叉部癌、肝内大胆管癌、上段胆管癌等称谓, 在肝胆管癌的分类上, 现在能大致达成的共识是: 凡侵犯肝门部肝管分叉者, 不论其开始时在肝外还是肝内胆管, 都归于肝门部胆管癌.
本文选题先进, 且贴近临床, 有较强的指导意义, 是一篇较好的论文.
编辑: 程剑侠 电编: 郭海丽
| 2. | 周 宁新, 黄 志强, 张 文智, 黄 晓强, 王 敬, 刘 荣, 纪 文斌, 肖 梅, 孟 翔飞. 402例肝门部胆管癌临床分型、手术方式与远期疗效的综合分析. 中华外科杂志. 2006;44:1599-1603. |
| 4. | Silva MA, Tekin K, Aytekin F, Bramhall SR, Buckels JA, Mirza DF. Surgery for hilar cholangiocarcinoma; a 10 year experience of a tertiary referral centre in the UK. Eur J Surg Oncol. 2005;31:533-539. [PubMed] [DOI] |
| 5. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 6. | Yamaguchi R, Nagino M, Oda K, Kamiya J, Uesaka K, Nimura Y. Perineural invasion has a negative impact on survival of patients with gallbladder carcinoma. Br J Surg. 2002;89:1130-1136. [PubMed] [DOI] |
| 7. | Chijiiwa K, Ohsato T, Shinohara M, Tanaka M. Clinico-pathological findings of asymptomatic intrahepatic cholangiocellular carcinoma: report of two cases and review of the literature. Eur J Surg Oncol. 1996;22:186-188. [PubMed] [DOI] |
| 8. | Nimura Y, Kamiya J, Kondo S, Nagino M, Uesaka K, Oda K, Sano T, Yamamoto H, Hayakawa N. Aggressive preoperative management and extended surgery for hilar cholangiocarcinoma: Nagoya experience. J Hepatobiliary Pancreat Surg. 2000;7:155-162. [PubMed] [DOI] |
| 9. | Nakagohri T, Asano T, Kinoshita H, Kenmochi T, Urashima T, Miura F, Ochiai T. Aggressive surgical resection for hilar-invasive and peripheral intrahepatic cholangiocarcinoma. World J Surg. 2003;27:289-293. [PubMed] [DOI] |
| 10. | Aishima S, Kuroda Y, Nishihara Y, Iguchi T, Taguchi K, Taketomi A, Maehara Y, Tsuneyoshi M. Proposal of progression model for intrahepatic cholangiocarcinoma: clinicopathologic differences between hilar type and peripheral type. Am J Surg Pathol. 2007;31:1059-1067. [PubMed] [DOI] |
| 11. | Robles R, Figueras J, Turrión VS, Margarit C, Moya A, Varo E, Calleja J, Valdivieso A, Valdecasas JC, López P. Spanish experience in liver transplantation for hilar and peripheral cholangiocarcinoma. Ann Surg. 2004;239:265-271. [PubMed] [DOI] |
| 12. | Seyama Y, Kubota K, Sano K, Noie T, Takayama T, Kosuge T, Makuuchi M. Long-term outcome of extended hemihepatectomy for hilar bile duct cancer with no mortality and high survival rate. Ann Surg. 2003;238:73-83. [PubMed] [DOI] |
| 13. | Su CH, Tsay SH, Wu CC, Shyr YM, King KL, Lee CH, Lui WY, Liu TJ, P'eng FK. Factors influencing postoperative morbidity, mortality, and survival after resection for hilar cholangiocarcinoma. Ann Surg. 1996;223:384-394. [PubMed] [DOI] |
| 14. | Kurosaki I, Tsukada K, Watanabe H, Hatakeyama K. Prognostic determinants in extrahepatic bile duct cancer. Hepatogastroenterology. 1998;45:905-909. [PubMed] |
| 16. | Gebhardt C, Meyer W, Reichel M, Wünsch PH. Prognostic factors in the operative treatment of ductal pancreatic carcinoma. Langenbecks Arch Surg. 2000;385:14-20. [PubMed] [DOI] |
| 17. | Takahashi S, Hasebe T, Oda T, Sasaki S, Kinoshita T, Konishi M, Ueda T, Ochiai T, Ochiai A. Extra-tumor perineural invasion predicts postoperative development of peritoneal dissemination in pancreatic ductal adenocarcinoma. Anticancer Res. 2001;21:1407-1412. [PubMed] |
| 18. | Hassan MO, Maksem J. The prostatic perineural space and its relation to tumor spread: an ultrastructural study. Am J Surg Pathol. 1980;4:143-148. [PubMed] [DOI] |
| 19. | Maxwell P, Hamilton PW, Sloan JM. Three-dimensional reconstruction of perineural invasion in carcinoma of the extrahepatic bile ducts. J Pathol. 1996;180:142-145. [PubMed] [DOI] |
| 20. | Sakamoto Y, Kitajima Y, Edakuni G, Sasatomi E, Mori M, Kitahara K, Miyazaki K. Expression of Trk tyrosine kinase receptor is a biologic marker for cell proliferation and perineural invasion of human pancreatic ductal adenocarcinoma. Oncol Rep. 2001;8:477-484. [PubMed] [DOI] |
| 21. | Zhu Z, Kleeff J, Kayed H, Wang L, Korc M, Büchler MW, Friess H. Nerve growth factor and enhancement of proliferation, invasion, and tumorigenicity of pancreatic cancer cells. Mol Carcinog. 2002;35:138-147. [PubMed] [DOI] |
| 22. | Zhang Y, Dang C, Ma Q, Shimahara Y. Expression of nerve growth factor receptors and their prognostic value in human pancreatic cancer. Oncol Rep. 2005;14:161-171. [PubMed] |
| 23. | Iwahashi N, Nagasaka T, Tezel G, Iwashita T, Asai N, Murakumo Y, Kiuchi K, Sakata K, Nimura Y, Takahashi M. Expression of glial cell line-derived neurotrophic factor correlates with perineural invasion of bile duct carcinoma. Cancer. 2002;94:167-174. [PubMed] [DOI] |
| 24. | Miknyoczki SJ, Wan W, Chang H, Dobrzanski P, Ruggeri BA, Dionne CA, Buchkovich K. The neurotrophin-trk receptor axes are critical for the growth and progression of human prostatic carcinoma and pancreatic ductal adenocarcinoma xenografts in nude mice. Clin Cancer Res. 2002;8:1924-1931. [PubMed] |
| 25. | Tanaka J, Sato E, Saito Y, Kusano T, Koyama K. Preparation of a conjugate of mitomycin C and anti-neural cell adhesion molecule monoclonal antibody for specific chemotherapy against biliary tract carcinoma. Surg Today. 1998;28:1217-1220. [PubMed] [DOI] |