修回日期: 2008-12-05
接受日期: 2008-12-08
在线出版日期: 2008-12-18
目的: 构建一种含人肿瘤休眠蛋白基因(restin)的质粒, 以绿色荧光蛋白作为报告基因, 观察其在胃癌细胞中的表达, 为探讨其抗肿瘤作用的分子机制打下基础.
方法: 从人胚肾组织中, 以RT-PCR方法扩增restin基因片段, 将restin片段和增强型绿色荧光表达质粒pEGFP-C1酶切、纯化、连接、转化、筛选, 构建pEGFP-restin重组质粒, 转染胃癌细胞, 荧光显微镜下观测绿色荧光蛋白的表达, 并对表达产物进行Western blot鉴定.
结果: RT-PCR产物经琼脂糖电泳, 在预期位置(600 bp)处阳性条带表达; 重组载体经酶切分析, 插入片段表达restin基因; pEGFP-restin重组质粒成功转染胃癌细胞, 在荧光显微镜下强绿色荧光蛋白表达, Western blot鉴定结果显示pEGFP-restin上的restin基因在BGC-803细胞中正确表达.
结论: 成功构建了pEGFP-restin重组质粒, 为进一步研究restin的功能提供了重要的实验材料.
引文著录: 戴聪, 李锦毅. pEGFP-restin重组质粒的构建及其在BGC-803胃癌细胞中的表达. 世界华人消化杂志 2008; 16(35): 3937-3940
Revised: December 5, 2008
Accepted: December 8, 2008
Published online: December 18, 2008
AIM: To construct a vector containing human restin gene and observe its expression in gastric cancer cells BGC-803 with green fluorescence protein as the reporter gene.
METHODS: Restin gene was amplified from mRNA of fetal kidney tissue by RT-PCR. The RT-PCR products and pEGFP-C1 were simultaneously digested, then purified, ligated, and transformed to construct the recombinant vector pEGFP-restin. Then the recombinant pEGFP-restin was transfected into gastric cancer cells BGC-803. The expression of green fluorescence protein was observed by fluorescence microscopy, and Western blot was used to examine the expression of target protein.
RESULTS: Agarose gel elctrophrosis showed a 600-bp band of the RT-PCR product, which matched the expected size. Through digestion, the inserted DNA sequence was confirmed to be the premature gene of restin, which was ligated to pEGFP-C1 and transfected into BGC-803 cells successfully. The strong expression of green fluorescence protein was observed by fluorescence microscopy, and the expression of target protein was identified using Western blot.
CONCLUSION: The recombinant vector pEGFP-restin is successfully constructed, providing important subject for further investigation of restin function.
- Citation: Dai C, Li JY. Construction of pEGFP-restin recombinant plasmid and its expression in BGC-803 gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(35): 3937-3940
- URL: https://www.wjgnet.com/1009-3079/full/v16/i35/3937.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i35.3937
1999年Ramchandran et al[1]发现, restin蛋白可以通过抑制肿瘤血管生成而达到控制裸鼠肿瘤生长的作用. restin蛋白与人体胶原ⅩⅤα1链羧基末端非胶原结构域(NC10 domain of α1 chain of collagen type ⅩⅤ)具有相同的氨基酸序列, 由180个氨基酸组成, 广泛分布于各种组织基底膜, 尤其在心脏、骨骼肌、胎肝肾、胎盘中高表达[2-3]. 我们前期研究发现, restin基因通过抑制肿瘤血管形成, 在肿瘤浸润及转移中发挥作用, 但目前其分子机制尚不清楚[4]. 本实验构建了真核表达载体pEGFP-restin, 转染至胃癌细胞株BGC-803, 在荧光显微镜下观察到重组蛋白的表达, 并对表达的蛋白产物进行了Western blot鉴定. 为研究restin蛋白抗肿瘤作用奠定了实验基础.
pEGFP-C1质粒由军事医学科学院庞博博士惠赠, 胃癌细胞株BGC-803由北京肿瘤医院基础所惠赠, 人胚肾组织本院妇产科提供. One Step PCR Kit(AMV)试剂盒、T4 DNA连接酶、限制性内切酶BamHⅠ和EcoRⅠ、DL2000 Plus DNA-Marker, 购自北京天佑达生物科技有限公司. TRIzol-RNA提取试剂盒、DNA凝胶纯化试剂盒, 购自北京全式金生物技术有限公司. 脂质体Lipofectamin购于美国Invitronen公司. PVDF膜购自美国Millipore公司. β-actin单克隆抗体、抗restin抗体购自美国Stratagene公司.
1.2.1 restin基因序列的生物信息学分析及引物合成: 使用Primer5.0引物设计并合成引物, 上游序列引入BamHⅠ酶切位点P1: 5'-ggatccatttcaagtgccaatcatgagaagcct-3'; 下游序列引入EcoRⅠ酶切位点P2: 5'-gaattcttacttcctagcgtctgtcatgaaact-3'.
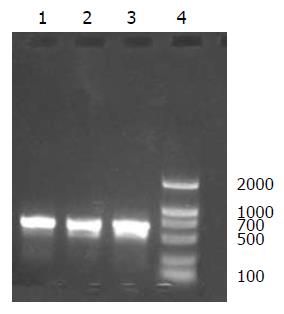
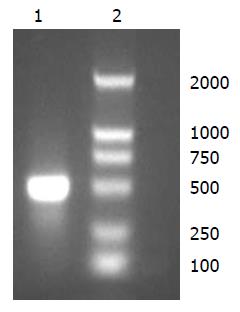
1.2.2 restin cDNA的克隆扩增与鉴定: 取人胚肾组织研碎, TRIzol法提取总RNA, TaKaRa One Step RNA PCR Kit(AMV)行RT-PCR, 反应体系50 μL: dNTP 1 μL, RNA 1 μg, P1、P2引物各1 μL, AMV-Taq DNA聚合酶1 μL, AMV-反转录酶1 μL, 10×Buffer(mol/L) 2 μL, 去离子水补充至50 μL. 反应程序: 50 ℃ 30 min, mRNA逆转录为cDNA; 94 ℃预变性2 min; 30个PCR循环: 94 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸60 s; 72 ℃延伸10 min. RT-PCR 产物2 μL进行15 g/L琼脂糖凝胶电泳, 与标准DNA片段(Marker)对照, 紫外线检测仪观察.
1.2.3 真核表达载体pEGFP-restin的构建、鉴定与测序: 回收PCR产物, BamHⅠ和EcoRⅠ双酶切, T4连接酶连接, 重组质粒命名为pEGFP-restin, 连接产物转化感受态DNA5α, 卡那霉素和蓝-白斑筛选阳性克隆, 接种LB培养基, 摇菌过夜, 质粒提取, PCR及酶切鉴定, 最后测序证实.
1.2.4 重组质粒: pEGFP-restin体外转染胃癌细胞: 用脂质体LipofectamineTM 2000介导转染BGC-803胃癌细胞. 根据转染质粒的不同分为: pEGFP-restin转染组; 未转染重组质粒的BGC-803细胞空白对照组. 转染方法按照LipofectaminTM 2000说明书进行: 转染前胰酶消化BGC-803细胞, 接种100 mL培养瓶, 每瓶计数细胞在3×106个, 培养过夜细胞融合率达90%-95%, 4 μg pEGFP-restin质粒溶于RPMI 1640, 8 μL LipofectaminTM 2000溶于50 μL RPMI 1640, 混合物滴入培养瓶孵育. 设对照组: 无质粒DNA的脂质体与BGC-803孵育.
1.2.5 荧光显微镜观察绿色荧光蛋白表达: 在激发波长488 nm, 发射波长507 nm的荧光显微镜(Nikon-TE300)下, 观察转染后胃癌细胞内绿色荧光表达.
1.2.6 表达产物的Western blot鉴定: 转染36 h后, 分别将野生型BGC-803细胞、转染空质粒pEGFP-C1和转染pEGFP-restin的BGC-803细胞培养皿置于冰上, 用冰预冷的PBS漂洗两遍, 加入150 μL细胞裂解液, 刮取细胞移入1.5 mL EP管中, 3000 r/min离心5 min后, 收集上清. 分别上样, 进行120 g/L SDS-PAGE分离蛋白质, 并电转移至PVDF膜上. 将PVDF膜移入培养皿中, 加入50 g/L脱脂奶粉, 封闭1 h, TTBS漂洗3次后, 加入鼠抗人restin抗体(1:1000), 4 ℃孵育过夜; TTBS漂洗3次, 再加入辣根过氧化酶标记的羊抗鼠IgG抗体(1:2000), 孵育1 h. 最后曝光显色, 通过IS2000R多功能影像系统获得图像. 以β-actin为内对照, 分别检测三组实验细胞restin的表达.
总RNA经琼脂糖凝胶电泳分析, 观察到5、18、28S条带, 有较好的完整性; RNA样本经紫外分光光度计测定值A260 nm/A280 nm, 介于1.8-2.0, RNA纯度较高.
RNA制备目的cDNA, 以restin mRNA为模板, 反转录及Taq酶进行RT-PCR扩增, 得到目的基因片段, 经10 g/L琼脂糖凝胶电泳见特异性扩增条带, 大小约600 bp, 与理论值相符(图1-2).
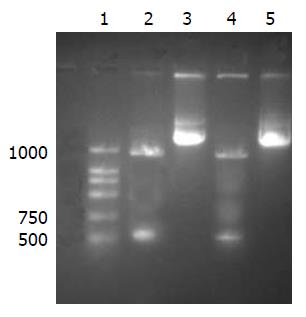
pEGFP-restin重组质粒经BamHⅠ和EcoRⅠ双酶切后电泳显示, PCR产物及目的基因片段长度相符, 初步确定得到预期重组质粒(图3), 对酶切鉴定的重组质粒pEGFP-restin测序, 结果正确, 无碱基突变.
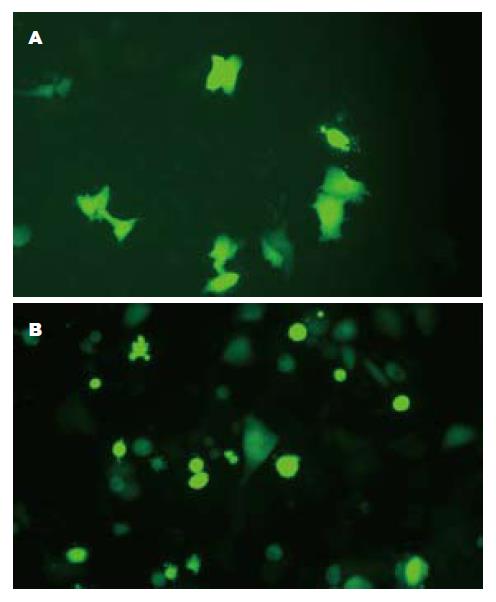
重组质粒pEGFP-restin的表达采用脂质体法对胃癌细胞BGC-803转染和G418筛选, 荧光显微镜观察, 细胞内可见绿色荧光表达(图4).
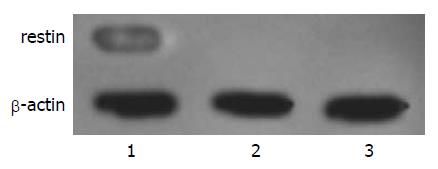
在转染pEGFP-restin重组质粒的BGC-803细胞裂解液上清中, 发现有一特异性蛋白条带, 而转染pEGFP-C1空载体及野生型的BGC-803细胞裂解液上清中, 均未发现相应条带, 表明pEGFP-restin上的restin基因在BGC-803细胞中得到了表达(图5).
restin蛋白是Ramchandran et al[1]在1999年发现的血管生成抑制因子, 该因子能够抑制裸鼠移植瘤的生长. 国内Xu et al[5]曾经利用大肠杆菌表达了鼠源的restin蛋白, 该蛋白可抑制牛主动脉内皮细胞(BAEC)的生长, 并且引起BAEC凋亡, restin蛋白与内皮抑素同为来自胶原蛋白的血管生成抑制因子, 但与内皮抑素(endostatin)一样无任何毒副作用, 是一种稳定的蛋白质.
绿色荧光蛋白(green fluorescent protein, GFP)来源于海洋生物水母, 在蓝光或紫光下可发出荧光, 可以进行实时检测, 己被广泛的用作报告基因进行在体和离体的实验研究[6-7]. 同时在研究基因表达, 细胞分化及蛋白在生物体内定位和转运方面作用显著[8-11], 而且还能检测目的基因的高效转染和表达[12-13].
本课题构建了pEGFP-restin表达质粒, 对克隆载体pEGFP-C1进行BamHⅠ和EcoRⅠ双酶切, 设计了restin cDNA与pEGFP-C1相同的酶切位点, 将载体片段和插入片段连接起来, 形成非同源的黏-黏末端, 进行定向克隆, 既有效地限制了载体分子的自身环化, 降低了非重组子的背景, 又提高了连接效率. 转化感受态菌DNA5α中, pEGFP-C1表达载体上含有卡那霉素抗性基因, 构建的重组质粒保留了相同的抗性基因, 转化了重组质粒的感受态菌在含卡那霉素的LB培养基上存活, 取抗性克隆进行小量制备, 经BamHⅠ和EcoRⅠ双酶切得到4.7 kb载体片段和600 bp插入片段, 由此鉴别含有restin基因的重组质粒. 将重组质粒转染入BGC-803细胞中, 经G418筛选出表达pEGFP-restin的融合蛋白, N端为增强型绿色荧光蛋白EGFP, C端为restin蛋白, 荧光显微镜下可直接观察到细胞发出较强的绿色荧光, 且荧光强度不衰减, 说明融合蛋白在BGC-803细胞中高表达, 对细胞生长繁殖无不良影响. 并经Western blot鉴定正确表达出restin蛋白, 为初步探讨体内restin蛋白抑制肿瘤血管形成的研究奠定了实验基础. 同时GFP转染肿瘤细胞后,将随着肿瘤细胞的分裂,生长而传给下代,也将随着肿瘤细胞的死亡而消亡[14-17], 因此可以动态连续检测restin蛋白对肿瘤细胞侵袭和转移的影响.
目前传统的肿瘤治疗特异性差, 毒副作用大, 而靶向基因治疗能通过细胞因子、受体及信号传导过程在肿瘤局部发挥作用, 可有效避免骨髓抑制、胃肠道反应及心脏损害等毒性反应, 靶向基因治疗将成为抗肿瘤的一个重要途径.
李淑德, 教授, 中国人民解放军第二军医大学长海医院消化内科
restin基因与内皮抑素同源, 有研究表明其可抑制肿瘤血管细胞生成, 通过将其与GFP构建, 转染入胃癌细胞, 将为动态连续观测restin蛋白抑制肿瘤血管形成及肿瘤细胞侵袭和转移的研究奠定实验基础.
自1971年Folkman首次提出"肿瘤的生长浸润依赖于肿瘤内新生血管的形成"以来, 在这一领域的研究逐渐深入, 针对肿瘤新生血管的治疗策略层出不穷, 有理由相信抗血管生成治疗特别是靶向基因治疗将成为抗肿瘤的一个重要途径.
本文通过将restin基因与GFP构建成重组质粒, 转染胃癌细胞, 并经Western blot鉴定表达蛋白、荧光显微镜观察转染的细胞, 为研究restin蛋白抑制肿瘤血管形成及肿瘤细胞侵袭和转移奠定了实验基础.
本研究构建pEGFP-restin重组质粒,筛选出pEGFP-restin融合蛋白并在胃癌细胞中表达, 对揭示胃癌转移的分子机制有重要意义.
编辑: 史景红 电编: 吴鹏朕
| 1. | Ramchandran R, Dhanabal M, Volk R, Waterman MJ, Segal M, Lu H, Knebelmann B, Sukhatme VP. Antiangiogenic activity of restin, NC10 domain of human collagen XV: comparison to endostatin. Biochem Biophys Res Commun. 1999;255:735-739. [PubMed] [DOI] |
| 2. | Myers JC, Dion AS, Abraham V, Amenta PS. Type XV collagen exhibits a widespread distribution in human tissues but a distinct localization in basement membrane zones. Cell Tissue Res. 1996;286:493-505. [PubMed] [DOI] |
| 3. | Hagg PM, Horelli-Kuitunen N, Eklund L, Palotie A, Pihlajaniemi T. Cloning of mouse type XV collagen sequences and mapping of the corresponding gene to 4B1-3. Comparison of mouse and human alpha 1 (XV) collagen sequences indicates divergence in the number of small collagenous domains. Genomics. 1997;45:31-41. [PubMed] [DOI] |
| 5. | Xu R, Xin L, Zhang JM, Li ZP, Gan RB. [Restin expressed in vivo suppresses the growth of tumors in nude mice]. Shengwu Huaxue Yu Shengwu Wuli Xuebao (Shanghai). 2002;34:571-575. [PubMed] [DOI] |
| 6. | Kisgati M, Asmis R. Generation of retroviruses for the overexpression of cytosolic and mitochondrial glutathione reductase in macrophages in vivo. Cytotechnology. 2007;54:5-14. [PubMed] [DOI] |
| 7. | Santos MG, Jorge SA, Brillet K, Pereira CA. Improving heterologous protein expression in transfected Drosophila S2 cells as assessed by EGFP expression. Cytotechnology. 2007;54:15-24. [PubMed] [DOI] |
| 8. | Malecaze F, Couderc B, de Neuville S, Serres B, Mallet J, Douin-Echinard V, Manenti S, Revah F, Darbon JM. Adenovirus-mediated suicide gene transduction: feasibility in lens epithelium and in prevention of posterior capsule opacification in rabbits. Hum Gene Ther. 1999;10:2365-2372. [PubMed] [DOI] |
| 9. | Hanawa H, Hematti P, Keyvanfar K, Metzger ME, Krouse A, Donahue RE, Kepes S, Gray J, Dunbar CE, Persons DA. Efficient gene transfer into rhesus repopulating hematopoietic stem cells using a simian immunodeficiency virus-based lentiviral vector system. Blood. 2004;103:4062-4069. [PubMed] [DOI] |
| 10. | Lin Y, Luo E, Chen X, Liu L, Qiao J, Yan Z, Li Z, Tang W, Zheng X, Tian W. Molecular and cellular characterization during chondrogenic differentiation of adipose tissue-derived stromal cells in vitro and cartilage formation in vivo. J Cell Mol Med. 2005;9:929-939. [PubMed] [DOI] |
| 11. | Zhong F, Zhong ZY, Liang S, Li XJ. [Transfection of GFP mRNA in dendritic cells and analysis of some factors involved]. Xibao Yu Fenzi Mianyixue Zazhi. 2006;22:716-719. [PubMed] |
| 13. | Malecaze F, Couderc B, de Neuville S, Serres B, Mallet J, Douin-Echinard V, Manenti S, Revah F, Darbon JM. Adenovirus-mediated suicide gene transduction: feasibility in lens epithelium and in prevention of posterior capsule opacification in rabbits. Hum Gene Ther. 1999;10:2365-2372. [PubMed] [DOI] |
| 14. | Staton CA, Stribbling SM, Tazzyman S, Hughes R, Brown NJ, Lewis CE. Current methods for assaying angiogenesis in vitro and in vivo. Int J Exp Pathol. 2004;85:233-248. [PubMed] [DOI] |
| 15. | Shepherd FA. Angiogenesis inhibitors in the treatment of lung cancer. Lung Cancer. 2001;34 Suppl 3:S81-S89. [PubMed] [DOI] |
| 16. | Sako A, Kitayama J, Koyama H, Ueno H, Uchida H, Hamada H, Nagawa H. Transduction of soluble Flt-1 gene to peritoneal mesothelial cells can effectively suppress peritoneal metastasis of gastric cancer. Cancer Res. 2004;64:3624-3628. [PubMed] [DOI] |
| 17. | Liu H, Peng CH, Liu YB, Wu YL, Zhao ZM, Wang Y, Han BS. Inhibitory effect of adeno-associated virus-mediated gene transfer of human endostatin on hepatocellular carcinoma. World J Gastroenterol. 2005;11:3331-3334. [PubMed] |