修回日期: 2008-10-21
接受日期: 2008-10-27
在线出版日期: 2008-12-08
目的: 探讨雷公藤内酯醇(triptolide, TL)通过抑制5-脂氧合酶(5-lipoxygenase, 5-LOX)代谢通路对胰腺癌细胞生长增殖及凋亡的影响.
方法: 台盼蓝染色检测TL对胰腺癌细胞PANC-1、ASPC-1和SW1990的杀伤作用;流式细胞术分析凋亡率; Real-time PCR和Western blot检测TL对5-LOX表达的影响; ELISA检测5-LOX下游产物LTB4的含量. 构建5-LOX表达质粒, 筛选稳定转染的SW1990细胞株(SW1990/5-LOX), Western blot检测野生型、转染空质粒、转染5-LOX基因的SW1990细胞5-LOX蛋白表达水平, 并检测胰腺癌细胞高表达5-LOX对TL诱导凋亡的影响.
结果: TL能诱导胰腺癌细胞凋亡, TL 50 μg/L作用24 h后活细胞比例为PANC-1 70.5%±6.8%, ASPC-1 61.2%±5.6%, SW1990 52.8%±5.3%, 比对照组显著减少(P<0.05); 凋亡细胞数12 h组与对照组相比, 有差异(24.2±3.23 vs 9.5±2.18, P<0.05). TL能显著抑制5-LOX表达及LTB4生成. 稳定转染后, 细胞内5-LOX蛋白表达量是Wt组的4倍左右, 培养上清中LTB4表达水平也显著高于Wt组(P<0.01). 过表达5-LOX使SW1990细胞增强了对TL诱导凋亡的抵抗作用, 细胞死亡和凋亡率均明显低于对照组(P<0.01或0.05).
结论: TL可以在体外诱导胰腺癌细胞增殖抑制和细胞凋亡, 该效应与TL抑制5-LOX代谢通路的活性可能有直接关系, 提示TL可能开发成临床治疗胰腺癌的有效药物.
引文著录: 丁晓凌, 周国雄, 周晓荣, 汪晓莺. 雷公藤内酯醇对5-LOX代谢通路和胰腺癌细胞凋亡的影响. 世界华人消化杂志 2008; 16(34): 3835-3839
Revised: October 21, 2008
Accepted: October 27, 2008
Published online: December 8, 2008
AIM: To investigate the effects and the mechanism of triptolide (TL) on proliferation and apoptosis of pancreatic cancer in vitro.
METHODS: Pancreatic tumor cell lines PANC-1, ASPC-1 and SW1990 were treated with different concentrations of TL for 24 h and then, cell death was determined by Typan Blue Staining. Annexin V/PI double staining was performed to evaluate TL-induced apoptosis using flow cytometry. The expression of 5-lipoxygenase (5-LOX) and concentration of its downstream product LTB4 were determined by real time PCR, Western blot and ELISA. 5-LOX cDNA stable transfected SW1990 cells were established successfully. After treatment with TL, it was examined for overexpression of 5-LOX on TL-induced apoptosis.
RESULTS: TL induced prominent growth inhibition and apoptosis in human pancreatic cancer cell lines. After treatment at 50 μg/L, the cell viability was 70.5% ± 6.8%, 61.2% ± 5.6% and 52.8% ± 5.3% of PANC-1, ASPC-1 and SW1990, respectively, which were significantly decreased compared with control group (P < 0.05). The apoptosis at 12 h evaluated by AnnexinV positive cells increased in TL-treated group compared with control group (24.2 ± 3.23 vs 9.5 ± 2.18, P < 0.05). TL significantly down-regulated 5-LOX expression in these cell lines and decreased LTB4 concentration in supernatant (P < 0.01, compared with control group). Furthermore, overexpression of 5-LOX in SW1990 cells made them more resistant to TL induced apoptosis, significantly inhibited the TL mediated cell death and apoptosis (P < 0.01 or 0.05, compared with control group).
CONCLUSION: Inhibition of 5-LOX pathway of arachidonic acid metabolism is associated with TL's anti-proliferation and pro-apoptotic activity. It also provides evidence that TL has clinic therapeutic value for patients with pancreatic cancer.
- Citation: Ding XL, Zhou GX, Zhou XR, Wang XY. Triptolide suppresses 5-lipoxygenase metabolic pathway and induces apoptosis in pancreatic tumor cell lines. Shijie Huaren Xiaohua Zazhi 2008; 16(34): 3835-3839
- URL: https://www.wjgnet.com/1009-3079/full/v16/i34/3835.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i34.3835
胰腺癌是常见的恶性肿瘤之一, 5年生存率小于2%[1-2], 确诊时多已属晚期, 丧失了根治性手术的机会. 因此, 深入探讨发病机制, 寻找新的诊治手段是当前胰腺癌研究的热点. 流行病学资料和动物研究表明高脂饮食, 特别是花生四稀酸(arachidoic acid, AA)和亚油酸等多不饱和脂肪酸的摄入增加与胰腺癌关系密切[3-4]. 5-脂氧合酶(5-lipoxygenase, 5-LOX)是催化AA转化为白三烯(leukotriene, LT)和5-羟基二十碳四烯酸(5-HETE)的关键酶. 近年来有文献报道在胰腺癌组织中有5-LOX上调, 而且5-LOX阻断剂能够在体外抑制肿瘤细胞增殖, 并诱导细胞凋亡[5], 提示干预5-LOX途径可能具有潜在的临床治疗胰腺癌的价值. 雷公藤内酯醇(triptolide, TL)是从卫矛科植物雷公藤中抽提到的三氧二萜内酯化合物单体, 具有显著的抗炎、免疫抑制作用[6]. 有资料表明, TL可抑制乳腺癌、前列腺癌、肺癌等多种肿瘤细胞增殖、诱导细胞凋亡[7-9]. 我们研究了TL在体外对胰腺癌细胞增殖及凋亡的影响, 并探讨其抗肿瘤效应与抑制5-LOX代谢途径的关系.
TL购自福建医学科学研究所, 人胰腺癌细胞株SW1990细胞由上海交通大学附属第一人民医院消化内科王兴鹏教授惠赠. 人胰腺癌细胞株ASPC-1购自上海中科院细胞库. 人胰腺癌细胞株PANC-1由上海市免疫学研究所周芸惠赠. 细胞在含100 mL/L胎牛血清的DMEM培养液常规培养, 于对数生长期时加入含TL的培养液作为处理组, 对照组加入含0.01% DMSO培养液.
1.2.1 细胞增殖与凋亡检测: 台盼蓝染色检测TL对细胞增殖抑制作用. 细胞培养对数期加入50 μg/L TL处理细胞, 收集细胞, 凋亡检测采用BD公司提供的ApoAlert Annexin-V kit, 2×105细胞用PBS洗1次, 加入200 μL结合溶液并悬浮细胞, 再加5 μL Annexin V和5 μL PI置于室温避光15 min, 上流式细胞仪检测, Annexin V阳性代表凋亡细胞.
1.2.2 Real-time PCR: TRIzol提取总RNA, 逆转录定量PCR试剂盒购自TaKaRa公司, ∆∆Ct法对结果进行分析[10]. 引物序列如下: 5-LOX上游引物5'-ACCACGGAGATGGTAGAGTGCAG-3', 下游引物 5'-GCAGCTCAAAGTCCACGATGAA-3'; β-actin上游引物5'-ATTGCCGACAGGATGCAGA-3', 下游引物 5'-GAGTACTTGCGCTCAGGAGGA-3'.
1.2.3 质粒构建和转染: 从SW1990细胞克隆5-LOX的cDNA, 合成上游引物5'-CGCCATGCCCTCCTACACGGTCAC-3'和下游引物5'-CTGCTCGAGTGCTCAGATGGCCACACTGTT-3', 下游引物含XhoⅠ内切酶识别位点, PCR条件: 94 ℃ 4 min, 94 ℃ 1 min, 58 ℃ 1 min, 72 ℃ 4 min, 28个循环后72 ℃ 10 min中止. 将5-LOX基因克隆到pGEMT-easy(Promega)载体中, 测序确认, 用EcoR和XhoⅠ双酶切, 将5-LOX cDNA插入表达质粒pcDNA3.1中(pcDNA3.1/5-LOX), 细胞转染用FuGENE 6转染试剂(Roche), 同时设pcDNA3.1空质粒转染组. 用1 g/L G418(Calbiochem)筛选稳定转染的细胞株, 并以500 mg/L G418维持培养.
1.2.4 ELISA检测LTB4含量: 检测试剂盒购自R&D公司, 按说明书操作.
1.2.5 Western blot检测: 提取总蛋白, 100 g/L聚丙烯酰胺凝胶电泳, 转PVDF膜, 含50 g/L脱脂奶粉的TBS封闭, 1:1000加入抗5-LOX一抗(Cayman), 4 ℃过夜, 1:5000加入HRP标记二抗, 作用2 h, ECL显色, 曝光洗片.
统计学处理 采用STATA 7.0统计软件分析, 数据以mean±SD表示, 两组计量资料用t检验; 多组计量资料用单因素方差分析. P<0.05为显著性判断水准.
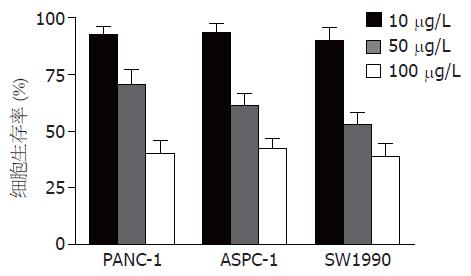
用10、50、100 μg/L的TL处理PANC-1、ASPC-1和SW1990细胞, 台盼兰试验可以检测到显著的细胞死亡. 如图1所示, 50 μg/L TL可以导致明显的细胞死亡, 24 h后活细胞比例为PANC-1 70.5%±6.8%, ASPC-1 61.2%±5.6%, SW1990 52.8%±5.3%, 比对照组(>95%)及10 μg/L组显著减少(P<0.05).
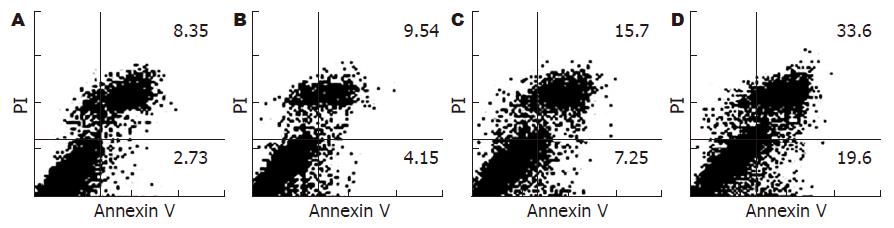
为了检测TL是否能诱导胰腺癌细胞凋亡, 我们用50 μg/L TL作用SW1990 细胞0-24 h, Annexin V/PI双染法流式细胞仪检测细胞凋亡率. 结果发现50 μg/L TL可使大量SW1990细胞凋亡, 表现为Annexin V阳性细胞数明显增加, 12 h组与对照组相比(24.2±3.23 vs 9.5±2.18, P<0.05). 图2为其中一次实验结果. 可见, TL对胰腺癌细胞株的杀伤作用与其诱导凋亡有关.
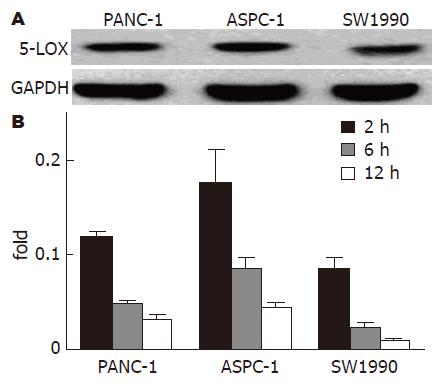
Western blot检测到在PANC-1, ASPC-1和SW1990细胞株中均有5-LOX蛋白的表达(图3A). 用50 μg/L TL处理细胞, Real time PCR检测5-LOX基因的表达. 结果发现, TL可以显著抑制PANC-1, ASPC-1和SW1990细胞5-LOX mRNA表达(图3B), 图中倍率变化(fold)表示TL处理后与处理前5-LOX mRNA比值(以β-actin为内参校准). 这种抑制作用在TL处理后2 h就可以观察到, 12 h后更加明显, 提示5-LOX可能是TL的靶基因.
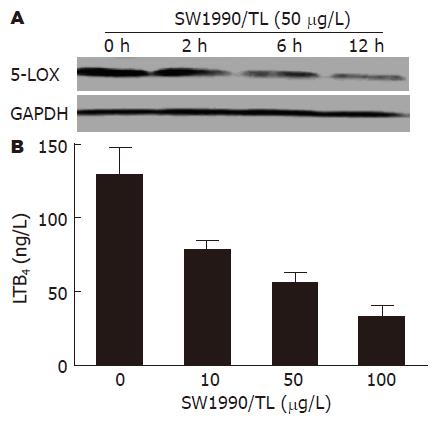
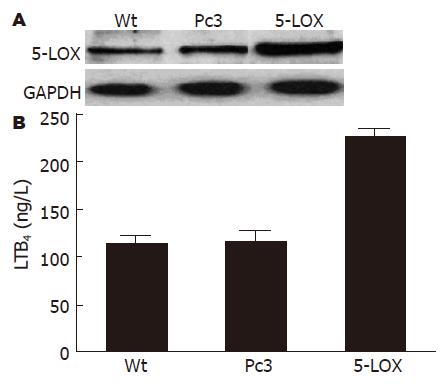
进一步, 我们用50 μg/L TL处理SW1990细胞, Western blot检测细胞中5-LOX蛋白表达情况. 结果发现, TL可以显著抑制SW1990细胞5-LOX蛋白表达(图4A). ELISA检测证实不同浓度的TL作用SW1990细胞6 h后, 上清中5-LOX的主要产物LTB4的浓度明显下降, 这与TL抑制肿瘤细胞表达5-LOX是一致的(图4B).
为探讨抑制5-LOX表达是否直接参与TL诱导的细胞凋亡, 构建了5-LOX表达质粒, 并筛选到稳定转染的SW1990细胞株(SW1990/5-LOX). Western blot检测野生型(Wt组)、转染空质粒(Pc3组)、转染5-LOX基因(5-LOX组)的SW1990细胞5-LOX蛋白表达水平, 结果显示(图5A), 在稳定转染的细胞株中, 5-LOX表达量是野生型SW1990的4倍左右. 此外, ELISA结果证实, 5-LOX组细胞培养上清中LTB4表达水平显著高于Wt组(P<0.01, 图5B).
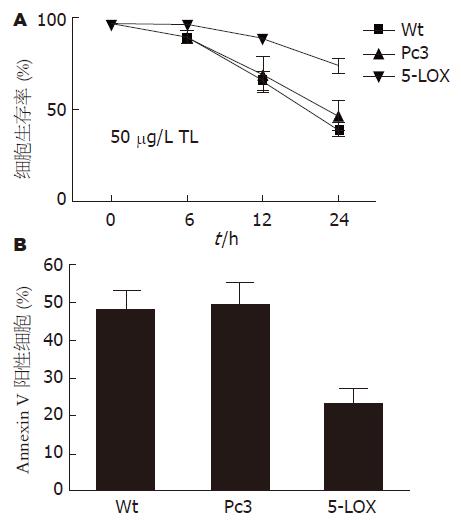
虽然细胞增殖结果表明, 5-LOX转染没有改变细胞正常的生长状态(数据未列出). 但我们发现, 50 μg/L TL处理以上三组细胞后, SW1990/5-LOX细胞死亡明显少于空质粒转染对照组和野生组(P<0.05, 图6A). 而且, 50 μg/L TL处理24 h后凋亡细胞(以Annexin V阳性细胞计)也明显低于空质粒转染对照组(图6B, P<0.01). 这些结果显示: 过表达5-LOX可以显著抑制TL诱导的SW1990细胞凋亡.
20世纪70年代以来, 我国医学工作者发现TL能够治疗多种白血病, 甚至使患者痊愈. 近几年对TL的抗肿瘤研究方兴未艾, 引起国内外医药界的广泛重视. 本研究发现, TL可以诱导人胰腺癌细胞增殖并诱导细胞凋亡, 提示TL可能开发成临床治疗胰腺癌的有效药物. 深入研究发现, TL可以抑制肿瘤细胞5-LOX基因的表达, 我们还证明, 下调5-LOX表达与TL促凋亡的作用密切相关.
研究表明[11], 在胰腺癌及癌早期病变中均检测到5-LOX表达上调. 在人胰腺癌组织中, 免疫组化研究也证实5-LOX蛋白表达增加, 但在正常胰导管细胞中不表达5-LOX. 此外, 5-LOX下游主要产物LTB4也在胰腺癌组织, 而不是正常导管细胞中有高水平表达, 这些结果提示, 5-LOX在胰腺癌高表达可能与肿瘤细胞发生发展有关. 已有研究发现, 5-LOX抑制剂通过抑制其酶活性可以抑制胰腺癌移植瘤的生长[12-13]. 在本研究中, TL被证明不仅能抑制5-LOX基因的表达, 而且可以抑制LTB4的生成. 这一方面加深了我们对TL作用机制的了解; 另一方面, 既然TL能抑制胰腺癌细胞中5-LOX代谢途径, 协同使用TL和特异性酶抑制剂, 比如齐留通等, 能否进一步增强抗肿瘤效应是值得尝试的课题.
我们还观察到, 高表达5-LOX的胰腺癌细胞能在一定程度上抵抗TL诱导的凋亡作用. 这表明, 抑制5-LOX代谢途径与TL促凋亡的活性可能有直接的关系. 另外, 在临床治疗中, 常规化疗药物往往对胰腺癌患者没有明显效果[14], 我们推测, 胰腺癌细胞高表达5-LOX的特征可能与这种低反应性有关. 到目前为止, TL抑制胰腺癌细胞5-LOX表达的机制还不清楚, 早期研究提示, TL通过阻断NF-κB反式激活来发挥免疫抑制作用[15]. 在5-LOX基因启动子中, 存在数个与NF-κB相互作用的保守区[16]. TL是否通过NF-κB来抑制5-LOX表达还有待进一步研究.
胰腺癌恶性度高, 预后差, 目前研究热点包括阐明胰腺癌发病的分子机制, 寻找早期诊断方法和开发新的治疗途径.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
近年来研究发现, TL可抑制多种肿瘤细胞增殖、诱导细胞凋亡, 但分子机制仍不十分清楚. 在胰腺癌发病机制方面, 发现胰腺癌细胞高表达5-LOX, 而抑制5-LOX代谢通路能诱导胰腺癌细胞凋亡.
本研究结果显示TL通过抑制细胞5-LOX代谢诱导胰腺癌细胞凋亡, 加深了对TL抗肿瘤分子机制的理解, 提示TL具有潜在的用于临床治疗胰腺癌的价值.
该文章研究方法先进, 讨论客观, 行文流畅, 对探索临床治疗胰腺癌新的药物, 有重要指导意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Germanos S, Gourgiotis S, Stavrothanasopoulou A, Alepas P, Zampitis N, Panteli A. Diagnostic and therapeutic approach to pancreatic adenocarcinoma. J Gastrointestin Liver Dis. 2006;15:257-263. [PubMed] |
| 3. | Ding XZ, Hennig R, Adrian TE. Lipoxygenase and cyclooxygenase metabolism: new insights in treatment and chemoprevention of pancreatic cancer. Mol Cancer. 2003;2:10. [PubMed] [DOI] |
| 5. | Hennig R, Ding XZ, Tong WG, Schneider MB, Standop J, Friess H, Büchler MW, Pour PM, Adrian TE. 5-Lipoxygenase and leukotriene B(4) receptor are expressed in human pancreatic cancers but not in pancreatic ducts in normal tissue. Am J Pathol. 2002;161:421-428. [PubMed] |
| 6. | Chen BJ. Triptolide, a novel immunosuppressive and anti-inflammatory agent purified from a Chinese herb Tripterygium wilfordii Hook F. Leuk Lymphoma. 2001;42:253-265. [PubMed] [DOI] |
| 8. | Carter BZ, Mak DH, Schober WD, McQueen T, Harris D, Estrov Z, Evans RL, Andreeff M. Triptolide induces caspase-dependent cell death mediated via the mitochondrial pathway in leukemic cells. Blood. 2006;108:630-637. [PubMed] [DOI] |
| 9. | Miyata Y, Sato T, Ito A. Triptolide, a diterpenoid triepoxide, induces antitumor proliferation via activation of c-Jun NH2-terminal kinase 1 by decreasing phosphatidylinositol 3-kinase activity in human tumor cells. Biochem Biophys Res Commun. 2005;336:1081-1086. [PubMed] [DOI] |
| 10. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 11. | Hennig R, Grippo P, Ding XZ, Rao SM, Buchler MW, Friess H, Talamonti MS, Bell RH, Adrian TE. 5-Lipoxygenase, a marker for early pancreatic intraepithelial neoplastic lesions. Cancer Res. 2005;65:6011-6016. [PubMed] [DOI] |
| 12. | Tong WG, Ding XZ, Witt RC, Adrian TE. Lipoxygenase inhibitors attenuate growth of human pancreatic cancer xenografts and induce apoptosis through the mitochondrial pathway. Mol Cancer Ther. 2002;1:929-935. [PubMed] |
| 14. | Shi X, Liu S, Kleeff J, Friess H, Büchler MW. Acquired resistance of pancreatic cancer cells towards 5-Fluorouracil and gemcitabine is associated with altered expression of apoptosis-regulating genes. Oncology. 2002;62:354-362. [PubMed] [DOI] |
| 15. | Qiu D, Zhao G, Aoki Y, Shi L, Uyei A, Nazarian S, Ng JC, Kao PN. Immunosuppressant PG490 (triptolide) inhibits T-cell interleukin-2 expression at the level of purine-box/nuclear factor of activated T-cells and NF-kappaB transcriptional activation. J Biol Chem. 1999;274:13443-13450. [PubMed] [DOI] |
| 16. | Silverman ES, Le L, Baron RM, Hallock A, Hjoberg J, Shikanai T, Storm van's Gravesande K, Auron PE, Lu W. Cloning and functional analysis of the mouse 5-lipoxygenase promoter. Am J Respir Cell Mol Biol. 2002;26:475-483. [PubMed] |