修回日期: 2008-10-28
接受日期: 2008-11-03
在线出版日期: 2008-12-08
目的: 观察p38MAPK在实验性大鼠肝纤维化(hepatic fibrosis, HF)发生过程中表达量的变化及其定位, 从而揭示p38MAPK信号传导通路与HF形成之间的关系.
方法: 采用CCl4 sc诱导大鼠HF模型, 36只♂SD大鼠(体质量在180-220 g)随机分为正常对照组(12只)和CCl4造模组(24只), 造模3、6、9 wk结束时分别随机处死各组大鼠. 取其肝脏观察HF形成过程中不同时间段各组大鼠肝组织病理变化, 用RT-PCR技术检测p38MAPK mRNA在造模过程中肝组织中的表达变化, 免疫组化方法检测p38MAPK在造模过程中肝组织中蛋白表达量的变化, 及其在肝组织中的表达分布情况.
结果: 与正常对照组比较, CCl4诱导的实验性大鼠HF不同时间段纤维化程度明显加重, 随着HF的形成, p38MAPK在mRNA水平和蛋白水平都表现出增加的趋势, 并且主要表达于肝脏的间质细胞, 肝细胞未见染色.
结论: p38MAPK在HF的形成中持续上调, 参与HF形成的病理过程, p38MAPK信号传导通路活化可能促进CCl4诱导的HF的形成.
引文著录: 吴文娟, 杨妙芳, 许小兵, 张晓华, 季洪赞, 袁柏思, 朱人敏. p38MAPK在大鼠实验性肝纤维化发生中的表达及其意义. 世界华人消化杂志 2008; 16(34): 3822-3827
Revised: October 28, 2008
Accepted: November 3, 2008
Published online: December 8, 2008
AIM: To investigate the expression and its location of p38MAPK in CCl4-induced hepatic fibrosis in rats and hence to reveal the relationship between hepatic fibrosis and the p38 MAPK signal transduction.
METHODS: A rat model of hepatic fibrosis was established by subcutaneous injection of carbonte trachloride (CCl4). Thirty-six male SD rats (weight 180-220 g) were randomly divided into two groups: normal control group (n = 12) and model group (n = 24). They were randomly scarified at 3, 6 and 9 weeks after injection of CCl4 respectively. Their liver tissues were analyzed for histopathological changes. Gene expression of p38MAPK was measured by reverse transcription-PCR and immunohistochemistry was used to detect the protein expression and localization.
RESULTS: The level of fibrosis was markedly aggravated at different time spots in the process of CCl4-induced hepatic fibrosis in rats. With the aggravation of hepatic fibrosis, the expression of p38MAPK mRNA and p38MAPK protein increased gradually, mainly in the mesenchymal cells.
CONCLUSION: Up-regulated p38MAPK is involved in CCl4-induced hepatic fibrosis in rats, and p38MAPK signal transduction may promote CCl4-induced hepatic fibrosis in rats.
- Citation: Wu WJ, Yang MF, Xu XB, Zhang XH, Ji HZ, Yuan BS, Zhu RM. Expression and its location of p38MAPK in CCl4-induced hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(34): 3822-3827
- URL: https://www.wjgnet.com/1009-3079/full/v16/i34/3822.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i34.3822
p38MAPK信号传导通路是丝裂原活化蛋白激酶(mitongen activited protein kinase, MAPK)家族的重要组成成员, 在炎症反应、细胞应激反应、细胞迁移、细胞凋亡以及细胞表型转分化等方面起着重要作用[1]. 最近的研究发现, p38MAPK特异性抑制剂SB203580干扰博莱霉素诱导的肺纤维化动物模型后纤维化程度明显减轻[2]. Chin et al[3]报道, 转化生长因子β1(TGF-β1)通过活化p38MAPK诱导属肾小球系膜细胞的前胶原Ⅰ的合成, 提示p38MAPK在TGF-β1诱导的细胞外基质(ECM)合成中起重要作用. 到目前为止, p38与肝纤维化(hepatic fibrosis, HF)发生的关系研究较少, 本实验拟通过CCl4诱导HF的发生, 观察p38MAPK在HF发生中的表达情况, 从而进一步探讨p38MAPK信号传导通路活化与HF发生的关系.
清洁级♂SD大鼠, 体质量180-220 g, 购自中国人民解放军南京军区南京总医院实验动物中心. CCl4(天津市永记商贸有限公司), 兔抗大鼠mAb α-SMA, 大鼠抗小鼠mAb p-p38购自Cell Signal公司. 二抗购自Dako公司. TRIzol RNA提取试剂盒是Gibco公司的产品. RT-PCR试剂盒购自大连宝生物公司. 根据GenBank序列设计引物, 由上海生工合成.
1.2.1 大鼠HF模型的建立: 给大鼠sc 400 mL/L CCl4/橄榄油溶液, 每次剂量为6 mL/kg, 首剂量加倍, 2次/wk, 持续9 wk, 造模期间大鼠自由饮水、摄食.
1.2.2 实验动物分组及处理: 将36只清洁级♂SD大鼠随机分为正常对照组(12只)和CCl4造模组(24只), 正常对照组sc生理盐水, CCl4造模组建立HF模型. 整个实验过程共9 wk. 造模3、6、9 wk结束时分别处死(末次sc CCl4 72 h). 正常对照组大鼠4只和造模组大鼠8只, 取5 mm×5 mm×5 mm肝右叶放入冻存管, -70 ℃冰箱冻存. 取其肝左叶经40 g/L的甲醛固定, 石蜡包埋, 2-3 μm厚度连续切片, 做HE和Masson染色确定其病理变化, 并进一步做免疫组化观察α-SMA, 磷酸化p38MAPK(p-p38MAPK)在肝脏组织中的表达变化.
1.2.3 病理组织观察: 取各组大鼠新鲜肝左叶, 用40 g/L甲醛溶液固定, 制作病理石蜡切片, 分别作HE和Masson染色, 显微镜下观察肝组织结构、肝细胞炎症反应及纤维组织增生情况. Masson染色光镜下胶原呈绿色, 采用Image Pro Plus(IPP)Version 5.0图像分析软件, 每张切片随机取5个视野, 图像放大200倍, 测量阳性染色面积, 取平均值, 计算其占视野面积的百分数.
1.2.4 免疫组化: 采用免疫组化EnVision法检测α-SMA、p-p38MAPK蛋白表达. 高温、高压抗原修复, 修复液为1 mmol/L EDTA(pH 8.0), 常规DAB显色, 苏木素复染及中性树脂封固. 显色结果采用IPP5.0图像分析软件, 每张切片随机取5个视野, 图像放大200倍, 测量阳性染色面积, 取平均值, 计算其占视野面积的百分数.
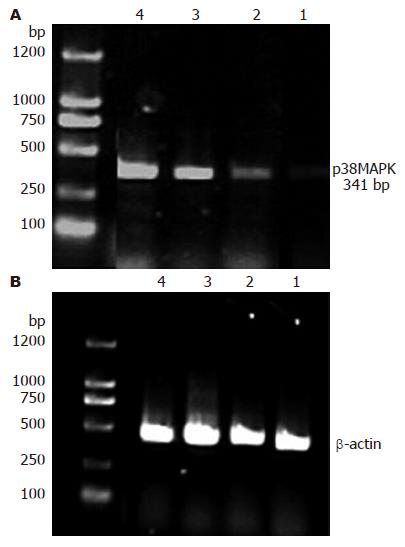
1.2.5 逆转录聚合酶链反应(RT-PCR): (1)引物合成: 具体序列如下: p38: Forward Primer 5'-tccaagggctacaccaaatc-3', Reverse Primer 5'-tgttccaggtaagggtgagc-3', 引物长度: 341 bp, β-actin大鼠β-actin: Forward Primer 5'-gagagggaaatcgtgcgtgac-3', Reverse Primer 5'-catctgctggaaggtggaca-3'. (2)提取总RNA及RT-PCR过程: 各取约50-100 mg组织, 采用TRIzol试剂盒提取总RNA, 在使用分光光度计在260/280 nm处检测总RNA的质量和纯度之后, 使用cDNA合成试剂盒将mRNA反转录为cDNA. cDNA采用相应特异性引物进行PCR扩增. 25 μL的反应体积包括1 μL上、下游特异性引物(各0.5 μL)、0.124 μL的Taq聚合酶、5 μL cDNA、13.876 μL灭菌蒸馏水和5 μL 5×PCR Buffer. PCR反应过程: 在起始2 min 94 ℃热启动之后, 反应进入35个循环, 其中94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延长2 min. (3)取PCR反应产物10 μL, 在20 g/L琼脂糖凝胶上电泳30 min, 图像分析仪采集图像, 以内参β-actin为基准, 作半定量分析.
统计学处理 实验数据以mean±SD表示, 应用SPSS11.0统计软件对数据进行方差分析, P<0.05具有显著性意义.
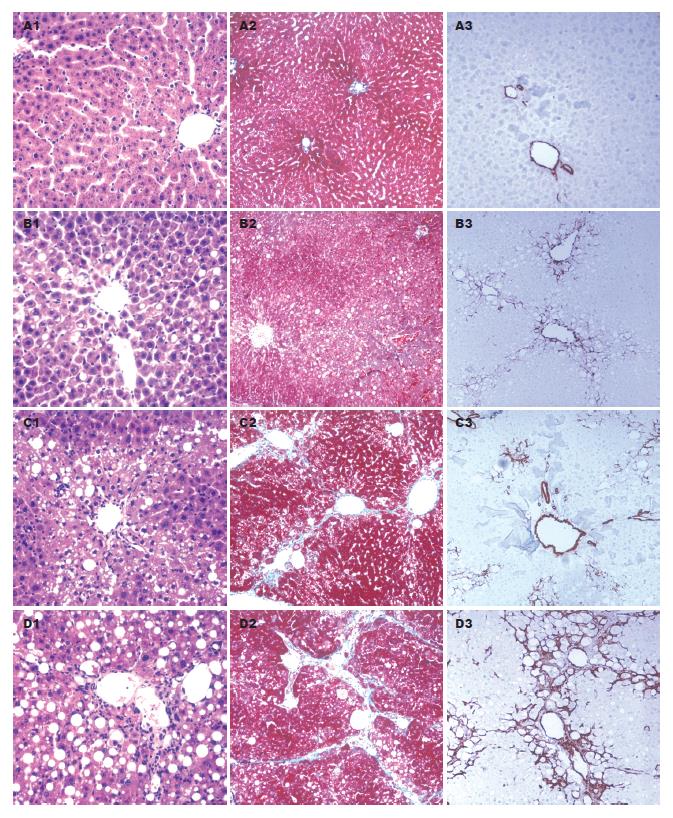
2.1.1 肝脏HE染色病理学显示: 正常对照组在各个时间点肝小叶结构完整, 肝细胞排列整齐, 无炎细胞浸润, 无纤维间隔形成. 3 wk时模型组肝小叶结构不甚完整, 多数肝细胞气球样变性, 汇管区部分炎性细胞浸润. 6 wk时模型组肝细胞气球样变明显, 见有灶性坏死, 肝小叶及汇管区内大量淋巴, 单核细胞浸润, 纤维间隔开始形成. 9 wk时模型组肝小叶结构破坏, 多数肝细胞气球样变, 肝细胞灶性坏死, 大量淋巴细胞, 单核细胞浸润, 纤维组织间隔形成明显(图1).
2.1.2 肝脏Masson染色结果显示: Masson染色光镜下可见绿色为胶原纤维, 正常对照组少量绿色的胶原纤维分布于汇管区和中央静脉管壁, 模型组3、6、9 wk可见粗大的绿色的胶原纤维大量分布于汇管区和中央静脉管壁以及不完全纤维间隔中, 且随造模时间的延长, 其分布越来越多. 模型组9 wk纤维组织大量增生, 并向内延伸形成纤维隔, 部分已包绕肝组织团块, 形成假小叶, 与正常对照组有显著性意义(P<0.05, 图1, 表1).
正常对照组汇管区动脉和中央静脉壁有少量α-SMA阳性细胞, 肝窦壁阴性; 模型组肝组织中α-SMA阳性表达明显增加, 胞质呈棕黄色, 大量表达于纤维增生的汇管区、中央静脉周围纤维间隔及靠近纤维间隔的肝窦周围, 且随造模时间的延长, 其表达分布越来越多, 与正常对照组相比有显著性意义(P<0.05, 图1, 表1).
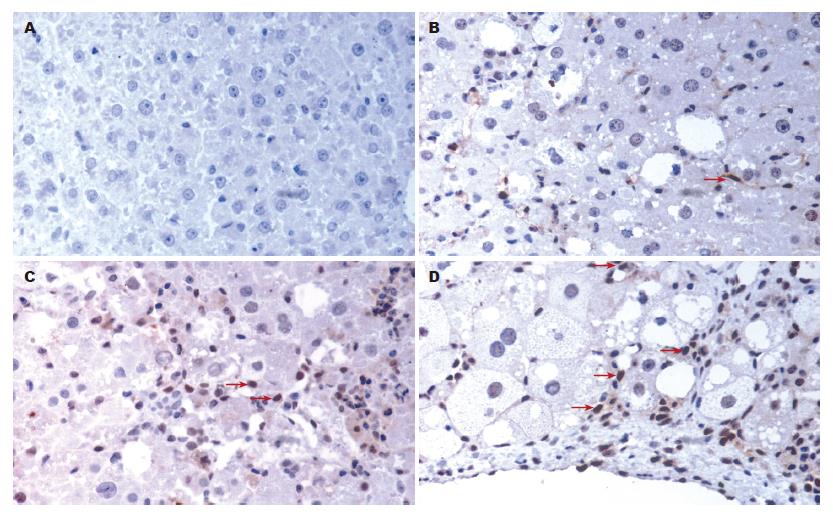
2.3.1 免疫组化结果显示: 正常对照组3、6、9 wk实验大鼠肝组织中p-p38MAPK几乎无阳性表达, 模型组肝组织中可见p-p38MAPK阳性表达, 低倍镜下可见小叶中央静脉周围、汇管区及肝小叶内均有条索状、星芒状p-p38MAPK阳性表达. 高倍镜下, p-p38MAPK阳性表达主要分布于肝脏间质细胞中. 且随造模时间的延长, p-p38MAPK的阳性表达明显增多、增强, 与正常对照组相比具有显著性意义(P<0.05, 表1, 图2).
2.3.2 RT-PCR检测结果显示: 与正常对照组比较, 各组大鼠肝组织中p38MAPK mRNA均表达增加(均P<0.01), 且随造模时间的延长, p38MAPK mRNA表达亦呈显著递增趋势(图3).
HF是肝脏对各种病因所致的慢性肝损伤的一种修复反应, 其实质是以胶原分泌为主的细胞外基质(extracellular matrix, ECM)的过度沉积[4]. 活化的肝星状细胞(hepatic stellate cell, HSC)是肝内ECM的主要来源[5-6]. 在各种致纤维化的损伤下, HSCs表型从富含维生素A的静息细胞表型转变为具有增殖性、分化性的肌成纤维表型[7]. 伴随着HSCs的激活, 大量的细胞因子及其信号传导通路被激活, 不仅可以维持HSCs的活化表型还可以维持HSCs的增殖活性和分泌活性[8]. 近年来细胞因子及其信号传导通路在HF形成中的作用得到越来越多的研究. 其中MAPK可以易位至胞核并激活转录因子的蛋白激酶, 成为多种信号途径的汇集点, 因此对于MAPK的研究受到更多的关注. MAPK属于Ser/Thr蛋白激酶家族, 主要成员有3个: ERK(细胞外信号调节激酶), JNK(c-Jun氨基末端激酶)和p38MAPK. 其中对于ERK信号传导通路在HF形成中的作用研究较多, 大量研究发现各种肝损伤可导致PDGF受体的上调和PDGF分泌的增加, 活化的PDGF受体进一步引起信号分子Ras的聚集, 从而进一步活化ERK, 活化的ERK调节核内转录因子的转录; 并能介导细胞周期蛋白(Cyclin)D, E表达, 促使HSC从G1期进入S期并增殖[9]. 我科研组有研究观察ERK及其下游核糖体S6蛋白激酶随着纤维化的进展其表达量均进行性增加[10]. 然而对于p38MAPK在HF形成中的作用目前研究较少.
p38MAPK信号传导通路是MAP家族的重要组成成员, 经外界刺激而激活, 故又称为MAPK应激信号通路. 在各种细胞外刺激包括紫外线、热休克、渗透压休克、内毒素、细胞因子如白细胞介素-1(IL-1)、肿瘤坏死因子(TNF)和G蛋白偶联受体等的激活作用下, 相继磷酸化激活TAK/ASK/NLK, MKK3/MKK6, 进而p38MAPK三肽基区的Thr、Tyr被双磷酸化而被激活[11], 激活的p38可磷酸化转录因子ATF-2、Elk-1[12-14], 导致他们的转录活性的升高, 从而进一步调节最终的生物应答反应. TGF-β是HF形成中最主要的促纤维化细胞因子, 其可通过TGF-β/SMAD通路促进HF的形成. 近年的研究发现TGF-β也可以诱导p38MAPK信号传导通路的活化[15].
本实验免疫组化及RT-PCR结果显示, p-p38MAPK在正常对照组中未见阳性表达, 而p38MAPK mRNA仅有极少量表达, 说明在正常生理状态下肝组织中p38MAPK是以无活性的非磷酸化形成存在. 在模型组中, 随着造模时间的延长和HF程度的加重, p-p38MAPK及p38MAPK mRNA表达均逐渐增多、增强, p38MAPK表达水平与HF程度呈显著正相关. 说明在HF形成中, p38MAPK被激活, 活化的p38MAPK转移入核内, 磷酸化下游转录因子, 调节目的基因的表达, 从而可能由此参与了大鼠HF形成. 另外免疫组化结果显示p-p38MAPK主要表达于肝间质细胞的胞核中, 肝细胞中未见表达, 可见p38MAPK信号传导通路主要作用于肝间质细胞. HSC和Kupffer细胞是肝间质细胞的主要成分, HSC被认为在HF形成的起着决定性的作用, 多种细胞因子及其信号传导通路通过促进HSC的活化、增殖, 进一步促进HF的发生. 本实验中HSC的活化标准物α-SMA的表达随造模时间的延长逐渐增加, 增强, 且主要表达于纤维增生的汇管区、中央静脉周围纤维间隔及靠近纤维间隔的肝窦周围, 与胶原的表达呈显著正相关, 而p38MAPK的表达与α-SMA及胶原的表达均呈显著正相关, 因此可以推测p38MAPK信号传导通路可能通过诱导HSC的活化、增殖促进HF的形成.
肝损伤早期Kupffer细胞可以释放多种细胞因子作用于HSC促进HSC的活化、增殖. 近年来, Kupffer细胞在HF形成中的作用也在逐渐被认为所重视, Kupffer是肝脏内活性氧(ROS)的主要来源, ROS诱导氧化反应, 加重HF. Imamura et a1[16]研究发现, 抑制Kupffer的浸润, 可抑制HSCs的激活, 从而抑制HF的形成. Nieto[17]研究发现, HSC和Kupffer细胞共同培养后, 比HSC单独培养时, 一方面有更多的转化表型, 另一方面增殖性也明显增加, α1(Ⅰ)和α2(Ⅰ)前胶原基因的表达明显增加, 此研究另一个重要的发现是H2O2和IL-6可能是通过活化p38MAPK信号传导通路增加HSC的增殖和胶原的表达. 因此我们仍需要继续研究p38MAPK信号传导通路通过何种方式促进HF的形成, 其是否可将HSC和Kupffer相联系, 这为我们研究及治疗HF提出了新的思路.
肝纤维化(HF)已成为一个危害人类生命健康的世界性问题, 如果能阻止其发生, 肝硬化及其并发症就能得到有效控制. 随着分子生物学的发展, 许多研究进一步阐明了HF发病的分子机制, 对HF的信号转导通路的研究结果显示有多条通路参与了HF的发生发展. p38MAPK是丝裂原活化蛋白激酶(MAPK)家族中重要的一员, 他在HF发生、发展的过程中起着重要的作用.
张晓岚, 教授, 河北医科大学第二医院消化内科; 刘绍能, 主任医师, 中国中医科学院广安门医院消化科
p38MAPK信号传导通路是参与HF的重要信号传导通路, 肝组织p38MAPK表达的上调是导致细胞外基质过度合成、沉积的重要原因. 通过干预p38MAPK分子表达有望成为抗HF的有效途径.
本文用免疫组化和RT-PCR的方法直接检测HF进展过程中肝组织中p38MAPK表达量的变化, 分析其与HF发生的可能关系.
本文主要研究在肝组织MAPK信号传导通路中重要成员p38MAPK在HF进展中的表达变化, 可为HF的防治提供新的思路.
本研究设计较合理, 结果可靠, 具有一定的科学性、创新性和可读性.
编辑: 史景红 电编: 何基才
| 1. | Ono K, Han J. The p38 signal transduction pathway: activation and function. Cell Signal. 2000;12:1-13. [PubMed] [DOI] |
| 2. | Matsuoka H, Arai T, Mori M, Goya S, Kida H, Morishita H, Fujiwara H, Tachibana I, Osaki T, Hayashi S. A p38 MAPK inhibitor, FR-167653, ameliorates murine bleomycin-induced pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 2002;283:L103-L112. [PubMed] |
| 3. | Chin BY, Mohsenin A, Li SX, Choi AM, Choi ME. Stimulation of pro-alpha(1)(I) collagen by TGF-beta(1) in mesangial cells: role of the p38 MAPK pathway. Am J Physiol Renal Physiol. 2001;280:F495-F504. [PubMed] |
| 4. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 5. | Goddard CJ, Smith A, Hoyland JA, Baird P, McMahon RF, Freemont AJ, Shomaf M, Haboubi NY, Warnes TW. Localisation and semiquantitative assessment of hepatic procollagen mRNA in primary biliary cirrhosis. Gut. 1998;43:433-440. [PubMed] |
| 6. | Kinnman N, Francoz C, Barbu V, Wendum D, Rey C, Hultcrantz R, Poupon R, Housset C. The myofibroblastic conversion of peribiliary fibrogenic cells distinct from hepatic stellate cells is stimulated by platelet-derived growth factor during liver fibrogenesis. Lab Invest. 2003;83:163-173. [PubMed] |
| 7. | Eng FJ, Friedman SL. Fibrogenesis I. New insights into hepatic stellate cell activation: the simple becomes complex. Am J Physiol Gastrointest Liver Physiol. 2000;279:G7-G11. [PubMed] |
| 8. | Gong W, Roth S, Michel K, Gressner AM. Isoforms and splice variant of transforming growth factor beta-binding protein in rat hepatic stellate cells. Gastroenterology. 1998;114:352-363. [PubMed] [DOI] |
| 9. | Feng DY, Zheng H, Tan Y, Cheng RX. Effect of phosphorylation of MAPK and Stat3 and expression of c-fos and c-jun proteins on hepatocarcinogenesis and their clinical significance. World J Gastroenterol. 2001;7:33-36. [PubMed] |
| 11. | Raingeaud J, Gupta S, Rogers JS, Dickens M, Han J, Ulevitch RJ, Davis RJ. Pro-inflammatory cytokines and environmental stress cause p38 mitogen-activated protein kinase activation by dual phosphorylation on tyrosine and threonine. J Biol Chem. 1995;270:7420-7426. [PubMed] [DOI] |
| 12. | Raingeaud J, Whitmarsh AJ, Barrett T, Dérijard B, Davis RJ. MKK3- and MKK6-regulated gene expression is mediated by the p38 mitogen-activated protein kinase signal transduction pathway. Mol Cell Biol. 1996;16:1247-1255. [PubMed] |
| 13. | Dérijard B, Raingeaud J, Barrett T, Wu IH, Han J, Ulevitch RJ, Davis RJ. Independent human MAP-kinase signal transduction pathways defined by MEK and MKK isoforms. Science. 1995;267:682-685. [PubMed] [DOI] |
| 14. | Janknecht R, Hunter T. Convergence of MAP kinase pathways on the ternary complex factor Sap-1a. EMBO J. 1997;16:1620-1627. [PubMed] [DOI] |
| 15. | Tsukada S, Westwick JK, Ikejima K, Sato N, Rippe RA. SMAD and p38 MAPK signaling pathways independently regulate alpha1(I) collagen gene expression in unstimulated and transforming growth factor-beta-stimulated hepatic stellate cells. J Biol Chem. 2005;280:10055-10064. [PubMed] [DOI] |
| 16. | Imamura M, Ogawa T, Sasaguri Y, Chayama K, Ueno H. Suppression of macrophage infiltration inhibits activation of hepatic stellate cells and liver fibrogenesis in rats. Gastroenterology. 2005;128:138-146. [PubMed] [DOI] |
| 17. | Nieto N. Oxidative-stress and IL-6 mediate the fibrogenic effects of [corrected] Kupffer cells on stellate cells. Hepatology. 2006;44:1487-1501. [PubMed] [DOI] |