修回日期: 2008-10-13
接受日期: 2008-10-21
在线出版日期: 2008-11-18
目的: 分析幽门螺杆菌(H. pylori)细胞毒素相关蛋白A(CagA)对人胃腺癌黏膜上皮细胞(AGS)Ca2+相关蛋白磷酸化的影响, 进一步揭示H. pylori的致病机制.
方法: 采用金属离子亲和吸附富集技术富集H. pylori、H. pylori CagA缺失株(H. pylori △CagA)与AGS细胞相互作用4 h, 以及培养相同时间的AGS细胞的磷酸化蛋白, 利用二维凝胶电泳技术分离磷酸化蛋白, ImageMaster 2D分析软件识别差异蛋白, MALDI-TOF/TOF质谱鉴定确认蛋白.
结果: H. pylori △CagA作用的AGS细胞, 与培养相同时间的AGS细胞比较表达量不变, 而H. pylori △CagA作用的AGS细胞表达量发生了明显变化, 表明此蛋白的变化是单纯由CagA引起的; 此类蛋白点共鉴定出19个, 其中3个蛋白点与Ca2+相关. 钙离子结合蛋白(nucleobindin-2 precursor, CALNUC)在AGS细胞以及H. pylori △CagA与AGS相互作用的2-D胶中表达量接近, 而H. pylori与AGS相互作用后该蛋白表达量明显降低.
结论: H. pylori CagA进入AGS细胞可能会影响内质网、线粒体及高尔基体的钙稳态, 诱发内质网、线粒体、高尔基体凋亡或增殖途径, 而成为胃炎、胃溃疡、胃癌发生的诱因之一.
引文著录: 肖迪, 赵飞, 宋衍燕, 孟凡亮, 何利华, 张慧芳, 张建中. CagA对AGS细胞Ca2+相关蛋白磷酸化的影响. 世界华人消化杂志 2008; 16(32): 3610-3615
Revised: October 13, 2008
Accepted: October 21, 2008
Published online: November 18, 2008
AIM: To analyze the differential expression of Ca2+-associated protein (CagA) in human gastric adenocarcinoma epithelial cells (AGS) infected with H. pylori CagA and to move forward a single step for revealing CagA pathogenic mechanism.
METHODS: Proteins of AGS cells infected with H. pylori 26695 for 4 h, AGS cells infected withH. pylori 26695 △CagA for 4 h, and the uninfected AGS cells as a control group were extracted. Phosphorylated proteins were enriched by metal ion affinity adsorption enrichment techniques. The samples were separated by 2-dimensional polyacrylamide gel electrophoresis (2-DE) technique. Computer assisted image analysis was used to analyze the differential proteomic expression. The significantly differentially expressed proteins were unambiguously assigned identities by matrix-assisted laser desorption/ionization-time of flight mass spectrometry (MALDI-TOF/TOF).
RESULTS: AGS cells treated with H. pylori △CagA showed the same expression as those cultured with the same period of AGS cells. However, expression of AGS cells treated with H. pylori △CagA had significant changes, indicating such a change was simply caused by CagA. Nineteen such protein spots were identified, of which, 3 protein spots were Ca2+-associated. Calcium-binding protein (nucleobindin-2 precursor, CALNUC) had almost the same expression either in AGS cells or 2-D gel under interaction of H. pylori △CagA with the AGS. However, such protein expression was markedly decreased following interaction between H. pylori and AGS.
CONCLUSION: CRT and CALNUC may affect the calcium homeostasis of endoplasmic reticulum, mitochondria and golgi, and then induce the apoptosis or proliferation pathway, which thus serves as a predisposing factor for gastritis, gastric ulcer and gastric cancer.
- Citation: Xiao D, Zhao F, Song YY, Meng FL, He LH, Zhang HF, Zhang JZ. Influence of Helicobacter pylori CagA on Ca2+-associated phosphorylated proteins of AGS cells. Shijie Huaren Xiaohua Zazhi 2008; 16(32): 3610-3615
- URL: https://www.wjgnet.com/1009-3079/full/v16/i32/3610.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i32.3610
细胞毒素相关蛋白A(cytotoxin-associated protein A, CagA)是Ⅰ型幽门螺杆菌(H. pylori)的主要毒力因子, 与H. pylori导致的疾病相关. CagA的抗体滴度在胃癌患者中比健康人高[1], CagA阳性菌株较CagA阴性菌株导致胃炎、胃腺癌的几率大[2]. CagA通过Ⅳ型分泌系统进入到宿主细胞中[3], 能与多种蛋白相互作用, 激活不同的信号通路[4-5], 影响宿主细胞增殖和凋亡[6-7], CagA的作用机制尚未清晰. Ca2+离子通路在细胞中扮演着重要角色, 作为细胞内重要的第二信使, 游离钙参与了几乎所有的细胞反应, 从收缩、胞吐到基因表达、细胞死亡都是被胞质内局部或全部游离Ca2+浓度的变化控制的. 细胞的钙稳态是细胞正常生存的基础, 在维持细胞钙稳态的过程中, 与Ca2+相关的蛋白起着重要作用, 而具有特定意义的蛋白大都是痕量或修饰的. 磷酸化是蛋白质翻译后修饰的一种重要方式, 参与几乎所有的生命活动过程. H. pylori与人胃腺癌黏膜上皮细胞(human gastric adenocarcinoma epithelial, AGS)细胞接触1 h即有CagA进入细胞[3], 我们实验室通过表达谱芯片的研究发现H. pylori攻击AGS 4 h细胞内基因差异最大(待发表). 本文采用金属离子亲和吸附结合质谱分析的方法, 研究H. pylori以及H. pylori △CagA攻击宿主细胞4 h后, 宿主细胞Ca2+相关磷酸化蛋白的变化情况, 从离子通路的角度阐述CagA对宿主细胞的作用机制, 进一步揭示H. pylori的致病机制.
H. pylori 26695国际标准株、H. pylori 26695CagA缺失株、AGS细胞(ATCC CRL1739)由本研究室保存. 磷酸化蛋白富集试剂盒FocusTM-PhosphoRichTM与蛋白纯化试剂盒Perfect-FocusTM购于G-Biosciences(G-Bio, St Louis, MO.USA). 主要设备: 4700型飞行时间质谱仪(MALDI-TOF/TOF-MS, Applied Biosystems, Foster City, CA, USA), 等电聚焦电泳仪(EttanTM DALTtwelve System, GE Healthcare, Uppsala, Sweden), Ettan DALT Ⅱ垂直电泳仪(GE Healthcare, Uppsala, Sweden).
1.2.1 蛋白样品的制备及磷酸化蛋白富集: AGS细胞培养: AGS细胞用100 mL/L的胎牛血清1640培养基, 在50 mL/L CO2气体培养环境, 37℃培养48 h. H. pylori培养: 将菌株接种于含10%绵羊全血哥伦比亚琼脂平板上, 置50 mL/L O2、100 mL/L CO2、850 mL/L N2的微需氧气体环境中37℃培养72 h. 细菌攻击细胞: 刮取菌苔用PBS洗3次, 5000 r/min离心10 min, 去上清, 充分打碎菌块, 测定A600值, 按照A600 = 2.2×108、 细胞每皿计数按照1×107计算, 细胞与细菌的比例按照1:300, 二者相互作用4 h, 弃去细胞培养液体, 预冷的PBS洗3次, 细胞刮刮取细胞培养皿底部的细胞, 置于10 mL PBS液中, 4000 r/min, 4℃离心10 min, 取沉淀, 重复3次. 每皿细胞加入1.5 mL的裂解液, 30 kHz冰浴超声直至完全溶解; 按10 mL/L加入蛋白酶、核酸酶抑制剂; 室温孵育1 h, 12 000 r/min, 4℃离心30 min, 取上清. Bradford法定量. 采用金属吸附磷酸化蛋白富集试剂盒FocusTM-PhosphoRichTM富集H. pylori 26695、H. pylori △CagA攻击后AGS细胞以及相同时间点的AGS细胞蛋白样品中的磷酸化蛋白, 用纯化试剂盒Perfect-FocusTM纯化、除盐制备2D样品, 具体操作见试剂盒说明书或参见http://www.GBiosciences.com.
1.2.2 二维凝胶电泳及胶内蛋白酶解: 每块24 cm胶蛋白上样量均为800 µg. 等电聚焦, 使用24 cm pH3-10非线性干胶条, 设置聚焦仪程序: 20℃表面温度, 50 µA电流/胶条, 30 V, 5 h; 60 V, 5 h; 100 V, 1 h; 600 V, 1 h; 1000 V, 1 h; 8000 V, 10 h; 聚焦至VhT 90 000左右. 等电聚焦结束后, 将干胶条分别在130 mmol/L的DTT和135 mmol/L的碘乙酰氨中振荡平衡15 min后转至15%的聚丙烯酰胺凝胶上; 二向电泳条件: 25℃, 自动泵, 2.5 W/胶30 min, 18 W/胶, 4.5 h. 胶用考马斯亮兰染色, 扫描仪采集图像, ImageMasterTM 2D Platinum 5.0分析软件分析图像. 胶内酶解方法参见文献[8].
1.2.3 质谱分析及数据处理: MALDI-TOF/TOF-MS测定采用频率为200 Hz的Nd: YAG激光器, 波长为355 nm, 正离子模式采样, 默认校准(误差小于50×10-6). CID内采用空气碰撞, 2000次叠加. 利用4000 Series ExplorerTM software version 3.0软件采集样品; 从800 kDa到4000 kDa采集一级谱图, 采用interpretation从高到低采集10个母离子. 使用GPS工作站(GPS ExplorerTM v3.6, mascot v2.1)搜索NCBI的非冗余数据库以及Swiss-Prot数据库. 设置可变修饰Carboxymethyl(C)、Oxidation(M)、Phospho(ST)、Phospho(Y)、Phospho+PL(S)、Phospho+PL(T)、Phospho+PL(Y), 搜索母离子偏差设为0.3 kDa、MS/MS片段偏差设为0.3 kDa. 蛋白得分CI%高于95%, 且至少有两个肽段得分大于50或一个肽段得分大于60, 磷酸化肽段得分至少大于10, 确认蛋白及磷酸化肽段[9]. 根据蛋白登录号(accession number)在http://www.expasy.org检索蛋白对应基因、蛋白功能以及亚细胞定位.
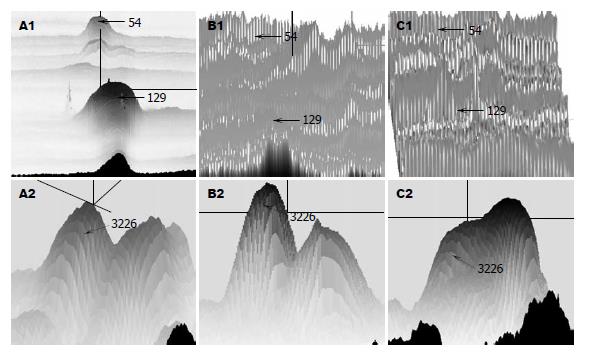
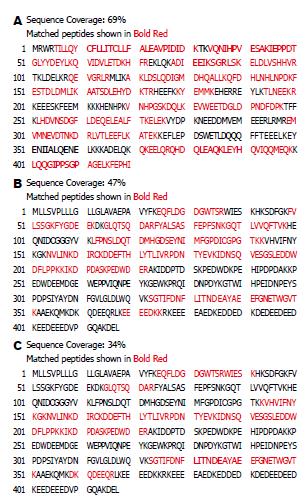
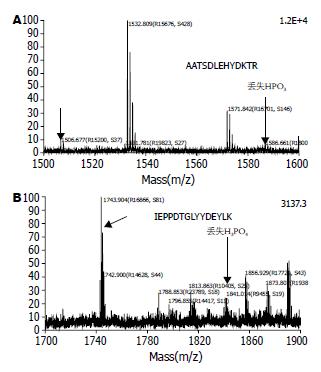
H. pylori △CagA作用的AGS细胞, 与培养相同时间的AGS细胞比较表达量不变, 而H. pylori △CagA作用的AGS细胞表达量发生了明显变化, 表明此蛋白的变化是单纯由CagA引起的; 此类蛋白点共鉴定出19个, 其中3个蛋白点与Ca2+相关. 图1为3个点的3D放大图, 质谱鉴定及数据处理结果见表1-2. 54、129均为钙网织蛋白(Calreticulin, CRT), 其序列匹配覆盖率分别为47%、34%(图2A-B). 他们在AGS细胞以及H. pylori △CagA与AGS相互作用的2-DE分离胶中均没有出现(图1B-C); 而在H. pylori与AGS作用的2-DE分离胶中有较大的相对含量(图1A). 图中3226为钙离子结合蛋白(nucleobindin-2 precursor, CALNUC), 其序列匹配覆盖率为69%(图2C). 2-DE图显示该蛋白在AGS细胞以及H. pylori △CagA与AGS相互作用的2-D胶中表达量接近, 而H. pylori与AGS相互作用后该蛋白表达量明显降低. CALNUC质谱图出现明显的中性丢失峰, 54和129未见中性丢失峰出现(图3).
| 蛋白序号 | Swiss-Prot进入号 | 蛋白名称 | 蛋白分子质量 | 等电点 | 蛋白得分CI% | 离子得分CI% |
| 3226 | P80303 | 核组蛋白-2 | 50 191.4 | 5.03 | 100.000 | 100.000 |
| (nucleobindin-2 precursor) | ||||||
| 54 | P27797 | 钙网织蛋白 | 48 111.8 | 4.29 | 97.157 | 99.759 |
| (calreticulin precursor) | ||||||
| 129 | P27797 | 钙网织蛋白 | 48 083.8 | 4.29 | 99.799 | 98.597 |
| (calreticulin precursor) |
含有丝氨酸磷酸化或苏氨酸磷酸化的肽段在CID时会发生β消除反应, 导致中性丢失磷酸或去磷酸根, 质谱图中会有质量偏差98 kDa或80 kDa的峰出现, 而磷酸化的酪氨酸通常不发生这样的丢失[10]. CALNUC的谱图中可见中性丢失磷酸基团的1841.9, 其对应峰为1743.8以及中性丢失磷酸根的1586.6, 其对应峰为1506.6. CRT没有出现中性丢失峰, 提示其CagA进入后通过一系列的信号转导导致了CRT磷酸化, 其位点可能发生在酪氨酸上. CRT目前还没有已知的磷酸化位点, 其位点的确定还需进一步研究确定.
H. pylori黏附于AGS表面, CagA通过Ⅳ型分泌系统进入细胞, 导致胞内CRT发生磷酸化. CRT是重要的内质网中与Ca2+有关的分子伴侣蛋白, 他通过调节IP3R以及SERCA的功能而影响内质网的储钙能力[11-12]. CRT的磷酸化可能会降低或失去了调节IP3R以及SERCA的能力, 破坏了钙稳态, 出现钙剥夺或钙超载, 影响内质网的功能, 从而破坏蛋白质合成、翻译和折叠, 因此会产生未叠和错叠蛋白而产生内质网应激, 过渡的应激会激活相应的凋亡分子, 促进或导致细胞凋亡[13-14]. 内质网和线粒体在细胞内空间结构上接近, 内质网通过其表面的IP3R或RyR释放Ca2+进入细胞质的同时, 线粒体内的Ca2+也升高超载, 导致线粒体结构裂解, 亦会引起细胞凋亡[15]. 实验结果提示, H. pylori CagA进入AGS细胞导致CRT发生磷酸化, 破坏内质网、线粒体的钙稳态, 通过影响钙离子通路, 促进细胞凋亡.
有研究表明CRT亦可通过影响p53的降解、核定位、改变Ca2+稳态影响内质网与线粒体之间的联系而促进细胞的凋亡[16-17]. c-Src也是细胞增殖、存活和转移等多种信号通路的重要成分[18], 其活性依赖于胞内CRT的丰度. CRT的磷酸化导致AGS细胞内质网内钙水平的变化, 会刺激c-Src的活性, 激活其调节通路. CRT表达异常与多种类型肿瘤的形成有关[18-19]. 本实验结果提示, CagA导致CRT磷酸化, 从而改变与其相互作用蛋白的活性, 可能会诱导肿瘤的形成.
CALNUC是在高尔基体和细胞质中发现的EF手Ca2+结合蛋白, CALNUC在G蛋白与Ca2+调节信号转导中起重要作用, CALNUC与SERCA钙泵以及IP3R一起在高尔基体膜构成一个细胞钙池, 共同维持高尔基体钙存储池的稳态[20]. CagA进入导致CALNUC磷酸化蛋白表达量下调, 这表明细胞中的CALNUC总体表达量降低了, 或者表达量没变但该磷酸化蛋白发生了去磷酸化. 磷酸化CALNUC的变化会导致高尔基体内Ca2+稳态受到影响. 有研究表明, CALNUC过表达会导致高尔基体内钙离子浓度高出存储量的2-3倍. 可见, CagA导致的CALNUC磷酸化水平异常会破坏高尔基体的钙稳态, 影响细胞的钙离子通路调节. CALNUC磷酸化水平的变化是否会通过调节钙离子通路而成为胃癌发生的因素还没有定论, 需要进一步研究, 但有研究发现在多种癌症组织中CALNUC过表达[21].
CagA阳性H. pylori感染AGS细胞后, 可导致两种与胞内Ca2+密切相关的磷酸化微量蛋白CRT、CALNUC发生变化, 此变化可能会影响内质网、线粒体及高尔基体的钙稳态, 诱发内质网、线粒体、高尔基体凋亡或增殖途径. 哪种途径占优势临床上则会表现不同的结局, 如果细胞倾向于凋亡则临床上表现为胃炎、胃溃疡; 如果细胞倾向于增殖则临床上将可能演变成胃癌[6-7]. 本实验的研究结果从一个新的角度解释了这种倾向, 为H. pylori致病机制的早日明示奠定基础.
H. pylori感染与胃癌发生密切相关. 细胞毒素相关蛋白A(CagA)在H. pylori诱导的疾病特别是胃癌的发展中起重要作用, CagA的作用机制尚未清晰. H. pylori胃癌、胃炎相关株极其CagA缺失株的蛋白质组学研究尚未发现其相关疾病的标志性蛋白.
刘正稳, 教授, 西安交通大学医学院第一附属医院传染科
感染期长、人群传染率高、耐药性增高已使H. pylori感染成为慢性消化系统疾病中的一个非常突出的问题. 围绕CagA展开的H. pylori相关疾病致病机制的研究一直是研究热点, 寻找可用于早期诊断及预后监测的标志性蛋白以及疫苗相关抗原都是亟待解决的课题.
张建中课题组表达谱芯片的研究发现H. pylori攻击AGS 4 h细胞内基因差异最大. 宋衍燕 et al发现H. pylori与AGS细胞相互作用过程中, 细菌、细胞蛋白表达均存在明显时序性变化, 早期主要表现为黏附相关的蛋白表达变化, 后期向有利于细菌存活和增殖的方向发展, 并呈现出与免疫逃逸和病理损伤相关的变化.
从第二信使Ca2+的角度并结合磷酸化蛋白质组学用于H. pylori致癌机制的研究, 从新的角度揭示CagA的致病机制. 研究H. pylori与AGS细胞相互作用后所有类型的磷酸化蛋白, 覆盖了目前只针对酪氨酸研究(酪氨酸抗体较理想)的状态, 对于完全合理地解释H. pylori与AGS的相互作用具有明显突破.
该研究所发现Ca2+相关蛋白为潜在的生物标记蛋白, 为H. pylori相关疾病的早期诊断、治疗以及预后监测提供有价值的线索.
本研究的内容有一定的重要性和新颖性, 为本领域的研究提供了一些有意义的信息.
编辑: 史景红 电编:郭海丽
| 1. | Maeda S, Yoshida H, Ogura K, Yamaji Y, Ikenoue T, Mitsushima T, Tagawa H, Kawaguchi R, Mori K, Mafune K. Assessment of gastric carcinoma risk associated with Helicobacter pylori may vary depending on the antigen used: CagA specific enzyme-linked immunoadsorbent assay (ELISA) versus commercially available H. pylori ELISAs. Cancer. 2000;88:1530-1535. [PubMed] |
| 2. | Nobuta A, Asaka M, Sugiyama T, Kato M, Hige S, Takeda H, Kato T, Ogoshi K, Keida Y, Shinomura J. Helicobacter pylori infection in two areas in Japan with different risks for gastric cancer. Aliment Pharmacol Ther. 2004;20 Suppl 1:1-6. [PubMed] [DOI] |
| 3. | Odenbreit S, Puls J, Sedlmaier B, Gerland E, Fischer W, Haas R. Translocation of Helicobacter pylori CagA into gastric epithelial cells by type IV secretion. Science. 2000;287:1497-1500. [PubMed] [DOI] |
| 4. | Tsutsumi R, Takahashi A, Azuma T, Higashi H, Hatakeyama M. Focal adhesion kinase is a substrate and downstream effector of SHP-2 complexed with Helicobacter pylori CagA. Mol Cell Biol. 2006;26:261-276. [PubMed] [DOI] |
| 5. | Mimuro H, Suzuki T, Tanaka J, Asahi M, Haas R, Sasakawa C. Grb2 is a key mediator of helicobacter pylori CagA protein activities. Mol Cell. 2002;10:745-755. [PubMed] [DOI] |
| 6. | Shiotani A, Iishi H, Ishiguro S, Tatsuta M, Nakae Y, Merchant JL. Epithelial cell turnover in relation to ongoing damage of the gastric mucosa in patients with early gastric cancer: increase of cell proliferation in paramalignant lesions. J Gastroenterol. 2005;40:337-344. [PubMed] [DOI] |
| 7. | Xia HH, Wong BC, Zhang GS, Yang Y, Wyatt JM, Adams S, Cheung K, Lam SK, Talley NJ. Antralization of gastric incisura is topographically associated with increased gastric epithelial apoptosis and proliferation, but not with CagA seropositivity. J Gastroenterol Hepatol. 2004;19:1257-1263. [PubMed] [DOI] |
| 8. | Guedes Sde M, Vitorino R, Tomer K, Domingues MR, Correia AJ, Amado F, Domingues P. Drosophila melanogaster larval hemolymph protein mapping. Biochem Biophys Res Commun. 2003;312:545-554. [PubMed] [DOI] |
| 9. | Nousiainen M, Sillje HH, Sauer G, Nigg EA, Korner R. Phosphoproteome analysis of the human mitotic spindle. Proc Natl Acad Sci U S A. 2006;103:5391-5396. [PubMed] [DOI] |
| 10. | Delom F, Chevet E. Phosphoprotein analysis: from proteins to proteomes. Proteome Sci. 2006;4:15. [PubMed] [DOI] |
| 11. | Verkhratsky A, Toescu EC. Endoplasmic reticulum Ca(2+) homeostasis and neuronal death. J Cell Mol Med. 2003;7:351-361. [PubMed] [DOI] |
| 12. | Foskett JK, White C, Cheung KH, Mak DO. Inositol trisphosphate receptor Ca2+ release channels. Physiol Rev. 2007;87:593-658. [PubMed] [DOI] |
| 13. | Xu C, Bailly-Maitre B, Reed JC. Endoplasmic reticulum stress: cell life and death decisions. J Clin Invest. 2005;115:2656-2664. [PubMed] [DOI] |
| 14. | Zhang K, Kaufman RJ. The unfolded protein response: a stress signaling pathway critical for health and disease. Neurology. 2006;66:S102-S109. [PubMed] [DOI] |
| 15. | Rizzuto R, Pinton P, Ferrari D, Chami M, Szabadkai G, Magalhaes PJ, Di Virgilio F, Pozzan T. Calcium and apoptosis: facts and hypotheses. Oncogene. 2003;22:8619-8627. [PubMed] [DOI] |
| 16. | Arnaudeau S, Frieden M, Nakamura K, Castelbou C, Michalak M, Demaurex N. Calreticulin differentially modulates calcium uptake and release in the endoplasmic reticulum and mitochondria. J Biol Chem. 2002;277:46696-46705. [PubMed] [DOI] |
| 17. | Holaska JM, Black BE, Rastinejad F, Paschal BM. Ca2+-dependent nuclear export mediated by calreticulin. Mol Cell Biol. 2002;22:6286-6297. [PubMed] [DOI] |
| 18. | Ishizawar R, Parsons SJ. c-Src and cooperating partners in human cancer. Cancer Cell. 2004;6:209-214. [PubMed] [DOI] |
| 19. | Papp S, Fadel MP, Kim H, McCulloch CA, Opas M. Calreticulin affects fibronectin-based cell-substratum adhesion via the regulation of c-Src activity. J Biol Chem. 2007;282:16585-16598. [PubMed] [DOI] |
| 20. | Lin P, Yao Y, Hofmeister R, Tsien RY, Farquhar MG. Overexpression of CALNUC (nucleobindin) increases agonist and thapsigargin releasable Ca2+ storage in the Golgi. J Cell Biol. 1999;145:279-289. [PubMed] [DOI] |
| 21. | Chen Y, Lin P, Qiu S, Peng XX, Looi K, Farquhar MG, Zhang JY. Autoantibodies to Ca2+ binding protein Calnuc is a potential marker in colon cancer detection. Int J Oncol. 2007;30:1137-1144. [PubMed] |