修回日期: 2008-01-01
接受日期: 2008-01-15
在线出版日期: 2008-01-28
目的: 探讨移植骨髓基质细胞(BMSCs)减轻小鼠肝纤维化的作用.
方法: ♂BALB/c小鼠BMSCs分离培养及经门静脉移植到♀BALB/c小鼠肝脏, 二乙基亚硝胺诱导肝纤维化. 60只♀小鼠随机分为对照组, 模型组及治疗组. 3 mo后测定ALT、AST、透明质酸酶(HA)和层黏连蛋白(LN)浓度, 及肝脏羟基脯氨酸(Hyp)含量. 免疫组化检测肝脏α-平滑肌肌动蛋白(α-SMA)表达, 及荧光原位杂交鉴定移植的BMSCs向肝细胞的分化.
结果: BMSCs在添加肝细胞生长因子(HGF) 的培养基中体外培养能分化为肝细胞样细胞. 与模型组相比, 移植BMSCs能显著降低血清ALT、AST、HA和LN的水平以及肝脏Hyp含量和α-SMA的表达(208±44 U/L vs 341±66 U/L, 372±84 U/L vs 506±81 U/L, 289±74 μg/L vs 362±83 μg/L, 178±48 μg/L vs 232±63 μg/L, 900±141 mg/g liver vs 1255±205 mg/g liver, 均P<0.01). 荧光原位杂交显示DEN诱导的损伤肝脏中有骨髓来源的肝细胞, 3 mo后10%的肝细胞来源于BMSCs.
结论: 在肝纤维化模型中, 经门静脉移植的BMSCs能分化为肝细胞, 有效地恢复肝功能和减轻肝纤维化.
引文著录: 郑进方, 吴昌雄, 陈劲松, 张震生, 肖占祥, 邢贻雷, 周开伦, 梁力建. 经门静脉骨髓基质细胞移植治疗肝纤维化. 世界华人消化杂志 2008; 16(3): 259-264
Revised: January 1, 2008
Accepted: January 15, 2008
Published online: January 28, 2008
AIM: To investigate the effect of transplanted bone marrow stromal cells (BMSCs) on liver fibrosis in mice.
METHODS: BMSCs harvested from male BALB/c mice were cultured and transplanted into female syngenic BALB/c mice via portal vein. After partial hepatectomy, liver fibrosis was induced by diethylnitrosamine (DEN). Controls received BMSCs and non-supplemented drinking water, model group received DEN-spiked water, and experimental group received BMSCs and DEN. The mice were killed after three months. Alanine aminotransferase (ALT), aspartate aminotransferase (AST), hyaluronic acid (HA) and laminin (LN) in serum, hydroxyproline (Hyp) content in liver were assessed. Alpha-smooth muscle actin (α-SMA) in liver was tested by immunohistochemistry. Bone marrow-derived hepatocytes in liver sections were identified by fluorescent in situ hybridization (FISH).
RESULTS: BMSCs differentiated into hepatocyte-like phenotypes after hepatocyte growth factor (HGF) treatment in vitro. Serum ALT, AST, HA and LN were markedly reduced by transplanted BMSCs(208 ± 44 U/L vs 341 ± 66 U/L, 372 ± 84 U/L vs 506 ± 81 U/L, 289 ± 74 μg/L vs 362 ± 83 μg/L, 178 ± 48 μg/L vs 232 ± 63 μg/L). Liver Hyp level (900 ± 141 mg/g vs 1255 ± 205 mg/g) and α-SMA staining in mice receiving BMSCs were lower than those in the model group, consistent with the altered liver pathology. FISH analysis revealed the presence of donor-derived hepatocytes in the injured liver after cross-gender mouse BMSCs transplantation. About 10% of cells were bone marrow-derived cells in the injured liver after three months.
CONCLUSION: BMSCs transplanted via portal vein can convert into hepatocytes with replacement of the DEN-induced liver injury, restore liver function and reduce liver fibrosis.
- Citation: Zheng JF, Wu CX, Chen JS, Zhang ZS, Xiao ZX, Xing YL, Zhou KL, Liang LJ. Intra-portal transplantation of bone marrow stromal cells ameliorates liver fibrosis in mice. Shijie Huaren Xiaohua Zazhi 2008; 16(3): 259-264
- URL: https://www.wjgnet.com/1009-3079/full/v16/i3/259.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i3.259
肝纤维化及肝硬化是一个棘手的肝脏疾病. 虽然肝移植是治疗晚期肝硬化的有效方法, 但存在供体缺乏、手术损伤、免疫排斥及费用昂贵等问题. 肝细胞移植被认为是器官移植的替代方法之一, 但肝细胞是一种静止细胞, 移植的肝细胞增殖数量少, 难以达到临床治疗效果, 而且肝细胞难以培养和保存[1]. 研究报道骨髓细胞在合适的条件下能分化为肝细胞[2-3]. 骨髓细胞向肝细胞的转化是通过横向分化还是骨髓细胞与肝细胞的融合目前不清楚[4-5]. 另外, 骨髓中哪类细胞能分化为肝细胞也不清楚, 但骨髓细胞移植能减轻CCl4引起的肝纤维化[6]. 研究显示骨髓基质细胞(bone marrow stromal cells, BMSCs) 在添加肝细胞生长因子(hepatocyte growth factor, HGF)的培养基中体外培养能分化为肝细胞样细胞[7]. 自身骨髓细胞容易获得, 因此骨髓细胞移植可能是一种治疗慢性肝损害及肝纤维化的有希望的策略. 本研究旨在探讨移植BMSCs向肝细胞的分化, 及对肝损害和肝纤维化的治疗作用.
BALB/c小鼠, 周龄6-8 wk, 体质量 20-25 g, 购于中山大学医学动物中心. 二乙基亚硝胺(DEN, Sigma-Aldrich, MO). DMEM培养基(Roche Pharma, Switzerland). 肝细胞生长因子(HGF, Sigma-Aldrich, MO), 抗体包括鼠抗AFP多克隆抗体(Santa Cruz, CA), 兔抗白蛋白多克隆抗体(Dako, Denmark), 兔抗α-平滑肌肌动蛋白(α-SMA)多克隆抗体(NeoMarkers, CA), 小鼠Y染色体荧光原位杂交(FISH)探针(Cambio, UK). SABC免疫组化检测试剂盒为武汉博士德生物公司产品.
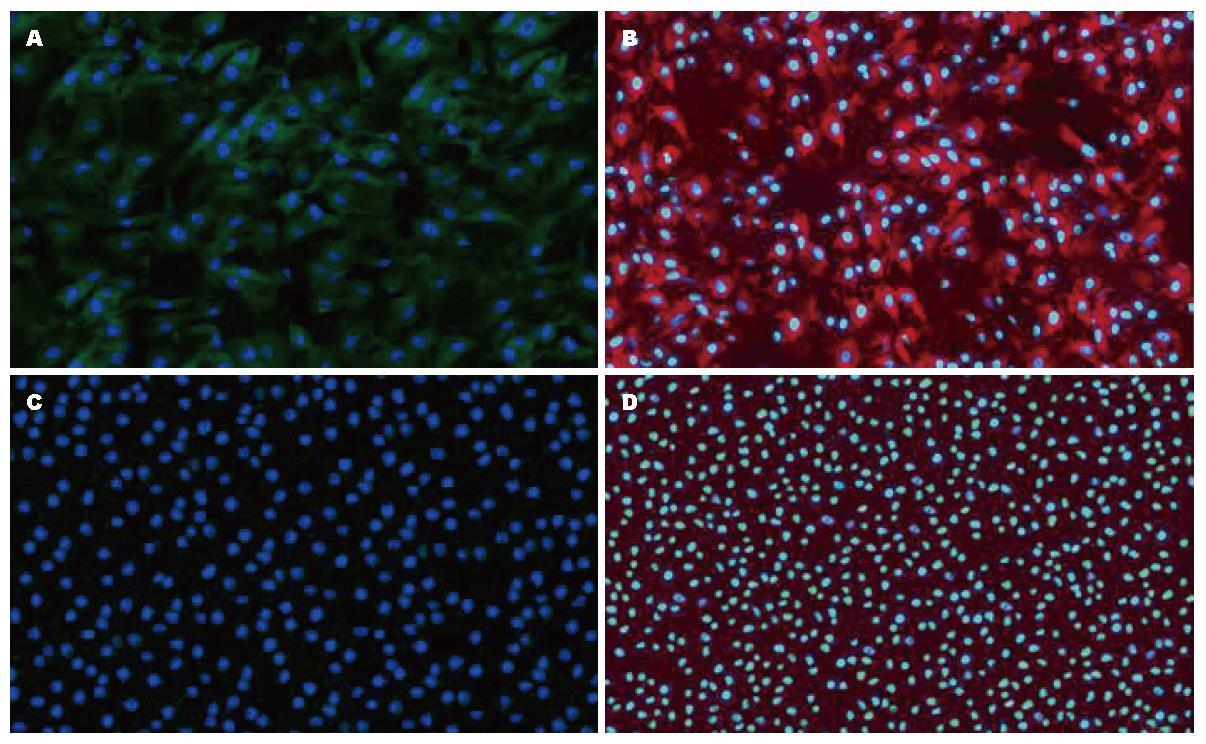
1.2.1 BMSCs的分离与培养: 取♂小鼠的股骨和胫骨, 注射器针头插入骨髓腔内用DMEM培养液冲出骨髓细胞制备成悬液. 细胞悬液用Ficoll(density1.077 kg/L)梯度离心(1500 r/min)10 min. 收集中间界面的BMSCs, 在DMEM培养基内培养. 培养基另外加入100 mL/L胎牛血清、2 mmol/L谷氨酰胺、100 kU/L青霉素和100 mg/L链霉素. 细胞在37 ℃、50 mL/L CO2培养箱中进行培养, 每3 d换液一次. 除去悬浮的细胞, 细胞长至90%汇合时进行传代培养, 取培养3-4代的BMSCs做细胞移植实验. 培养基中添加50 μg/L的HGF诱导分化BMSCs, 每3 d换液一次, 21 d后收集做免疫荧光检查.
用免疫荧光鉴定诱导分化细胞表达AFP和白蛋白的情况. 诱导分化的细胞包埋及多聚甲醛固定. 甲醇及Triton X-100分别处理标本, 滴加50 mg/L BSA封闭液, 再滴加一抗小鼠抗AFP多克隆抗体或兔抗白蛋白多克隆抗体, 4 ℃孵育过夜. 滴加FITC或PE结合的二抗(Sigma-Aldrich, 1:100)孵育30 min. 细胞核用DAPI(Sigma-Aldrich, MO)显示蓝色荧光.
1.2.2 BMSCs的分离和移植: 取分离及培养3-4代的♂BMSCs制备成细胞悬液, 朌胎兰染色计数活细胞>95%. ♀小鼠麻醉后行2/3肝切除, 分离的BMSCs用胰岛素注射器经肠系膜静脉注射到肝脏, 每只小鼠移植1×106个细胞.
1.2.3 肝纤维化诱导及分组: BMSCs移植后小鼠恢复1 wk, DEN加入饮用水中, 浓度为100 μg/L, 连续饮用12 wk诱导纤维化[8]. 60只♀小鼠随机分为3组(n = 20): A: 对照组, BMSCs移植及饮正常水; B: 模型组, 饮水中加DEN诱导肝纤维化; C: 治疗组, BMSCs移植及饮含DEN的水. 细胞移植1, 2, 3 mo麻醉小鼠取肝脏标本. 每个时间点取约5-8只小鼠. 细胞移植3 mo后取血肝功能指标和肝纤维化指标. 取肝脏标本测定羟基脯氨酸(Hyp)含量及病理学检查.
1.2.4 肝功能、肝纤维化指标及肝脏Hyp含量测定: 血清ALT、AST、总胆红素用常规实验室方法测定, 血清透明质酸酶(HA)和层黏连蛋白(LN)用放免试剂盒测定. Hyp含量用试剂盒测定, 其含量用mg/g表示.
1.2.5 肝脏病理学检查: HE染色和α-SMA的免疫组化染色确定肝脏炎症及肝纤维化程度. 一抗用兔抗α-SMA多克隆抗体.
Y染色体荧光原位杂交(Fluorescent in situ hybridization, FISH)显示肝脏内移植的雄性细胞, 按FISH试剂盒的实验步骤操作(http://www.cambio.co.uk/), 用FITC放大试剂盒(Cambio, Cambridge, UK)放大荧光信号, 细胞核用DAPI显示为蓝色荧光. 切片用LSM 510 META共聚焦显微镜观察.
统计学处理 数据用mean±SD表示, 用SPSS10.0软件分析, P<0.05为有统计学差异.
本实验在培养基中添加HGF培养BMSCs, 免疫荧光检测AFP和白蛋白的表达. 发现加HGF培养的BMSCs培养21 d后细胞表达AFP(图1A)和白蛋白(图1B), 而未加HGF培养的BMSCs培养21 d后的细胞无AFP和白蛋白表达(图1C-D). 结果提示HGF能诱导BMSCs向肝细胞分化.
BMSCs移植组DEN诱导小鼠的死亡率为80%, 模型组DEN诱导小鼠的死亡率为85%, 两组间无显著性差异(P>0.05). 与正常对照组相比, 模型组DEN导致血清ALT和AST显著升高(P<0.01). BMSCs移植实验组明显降低转氨酶水平(P<0.01), 但仍高于正常对照组(P<0.01).
本研究测定了肝纤维化的指标, 包括血清HA、LN水平和肝脏Hyp含量. 细胞移植治疗组血清HA、LN水平明显低于模型组(P<0.05), 但仍高于正常对照组(P<0.01). 细胞移植治疗组肝脏Hyp含量明显低于模型组(P<0.01), 但高于正常对照组(P<0.01)(表1).
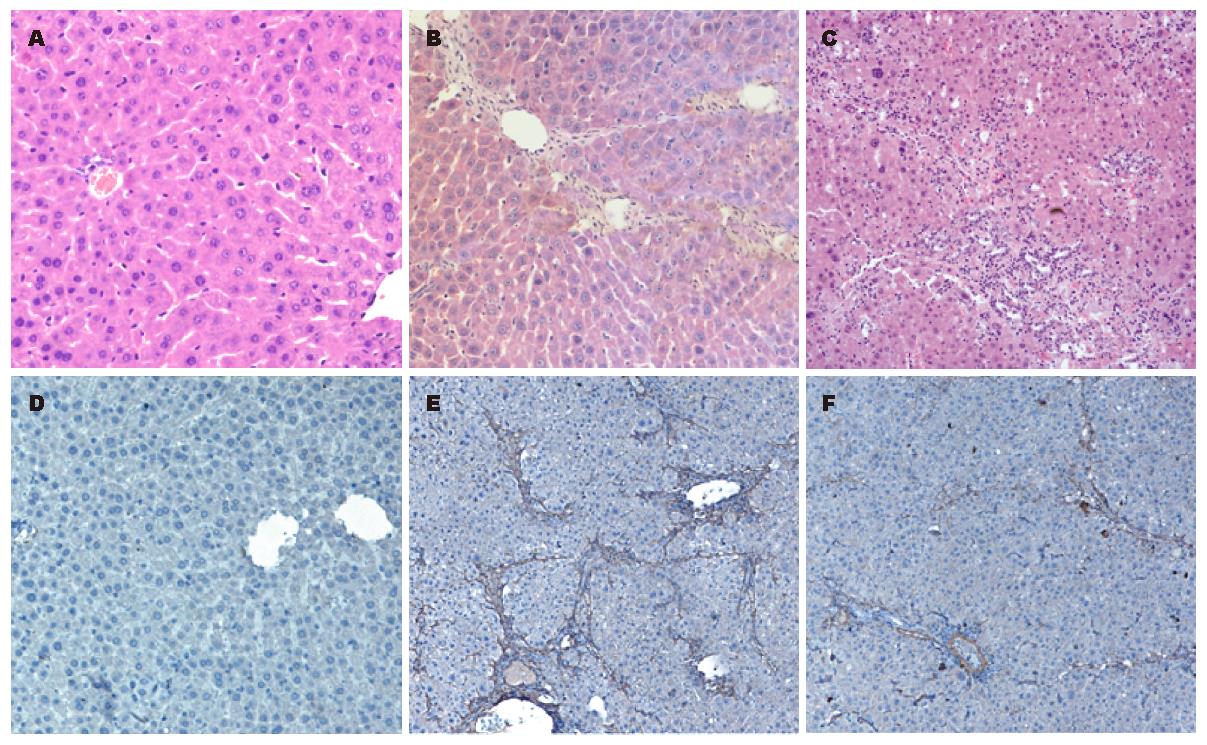
HE染色和免疫组化显示BMSCs移植对肝脏病理学的影响. HE染色显示正常对照组肝脏结构完整, 无炎症及纤维化改变(图2A). 模型组中DEN诱导肝脏炎症细胞浸润和肝纤维化形成, 伴肝脏失去完整结构(图2B). 而BMSCs移植治疗组肝脏炎症和肝纤维化明显减轻(图2C).
通过α-SMA免疫组化显示肝星状细胞活性来证实肝纤维化发展. 正常对照组α-SMA只表达于肝脏血管平滑肌细胞(图2D). 模型组活化的肝星状细胞表达α-SMA增加, 呈网状结构(图2E). 而BMSCs移植治疗组的肝星状细胞活性明显受抑制(图2F).
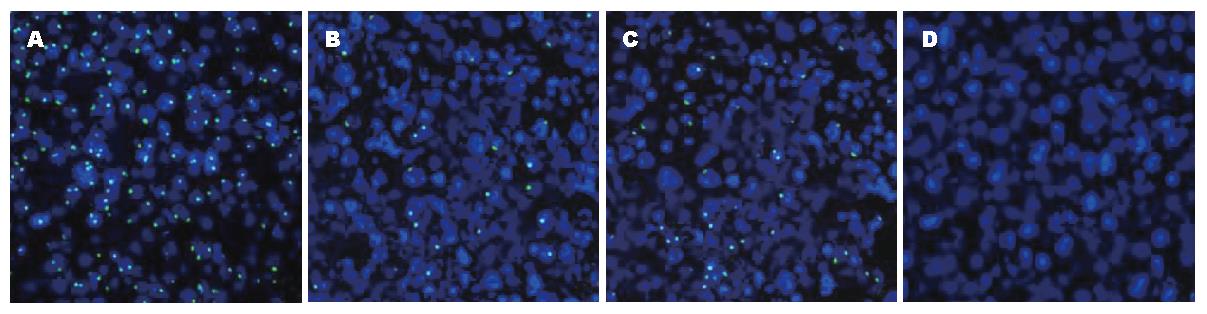
本研究用♂BMSCs移植到♀小鼠肝脏, 研究BMSCs在正常小鼠肝脏及DEN诱导小鼠肝脏内分化增殖的情况. 用Y染色体FISH的方法显示骨髓来源的肝细胞. ♂小鼠肝脏作为阳性对照, 肝细胞核内绿色荧光显示Y染色体(图3A). 骨髓基质细胞移植及DEN诱导2 mo后小鼠肝脏内有约4%的Y染色体阳性肝细胞(图3B), 移植3 mo后肝脏内有10%的肝细胞Y染色体阳性(图3C). 结果提示经门静脉移植的BMSCs经DEN诱导向肝细胞分化及增殖. 而无DEN诱导的小鼠, BMSCs移植3 mo后肝脏内未发现Y染色体阳性的细胞(图3D).
虽然骨髓中的细胞被证实有向肝细胞转化的能力, 但骨髓中何种类型的细胞能分化为肝细胞目前仍不清楚. BMSCs包含多向分化潜能的干细胞, 如分化为神经干细胞和造血干细胞[9]. 本研究证实BMSCs在添加肝细胞生长因子的培养基中培养21 d能分化为表达AFP和白蛋白的肝细胞样细胞.
越来越多的证据显示骨髓细胞能分化为特定的细胞类型. 在一定的条件下移植的骨髓细胞在肝脏内分化为肝细胞[10]. 有研究报道在FAH小鼠模型中肝脏内有30%-50%的肝细胞来源于移植的骨髓细胞的分化与增殖[2]. 转化为肝细胞的骨髓细胞可能是间充质细胞[11]. 但有部分研究报道即使存在很强转化的压力下, 骨髓细胞转变为肝细胞仅仅是一种可能性很小的事件[12]. 另外有研究报道骨髓细胞与肝细胞的细胞融合是骨髓转化为肝细胞的主要来源[4]. 主要由髓系单核细胞与肝细胞融合产生功能性的肝细胞增殖[6].
本实验用DEN诱导肝纤维化模型来研究BMSCs移植治疗纤维化的效果. DEN是一种肝毒性的诱癌剂, 能诱导肝纤维化, 与人类的肝纤维化相似. 我们的结果显示BMSCs移植能明显降低DEN诱导的血清转氨酶水平和改善肝纤维化指标. BMSCs移植组肝脏α-SMA表达较模型组明显减少. 肝脏α-SMA表达代表肝星状细胞的活性, 也是肝纤维化形成的关键因素[13]. BMSCs移植能有效的抑制肝脏炎症和肝纤维化形成.
我们进一步探讨BMSCs移植恢复肝脏损伤的潜在机制. BMSCs移植及DEN持续诱导肝损伤后, 我们用荧光原位杂交的方法研究BMSCs在肝脏内向肝细胞分化的能力. 研究结果显示在持续性肝损伤情况下, BMSCs能向肝细胞分化, 随时间延长而逐渐增加. 3 mo肝脏内约10%的细胞为骨髓来源的肝细胞.
本研究中肝脏内有较多骨髓来源的肝细胞, 其结果与某些报道不一致[12], 原因可能包括以下几方面. 首先, 注射途径可能是影响骨髓细胞转化为肝细胞的重要因素之一. 本研究中经门静脉向肝脏内直接注射骨髓细胞可能比经尾静脉周围血管注射更有利于骨髓细胞向肝细胞分化. 在心脏和血管疾病中, 病变部位直接注射自身骨髓细胞更容易在缺血的局部补充内皮祖细胞及新生血管形成[14]. 其次, 骨髓细胞转化为肝细胞的压力决定骨髓来源的肝细胞增殖的数量[15]. 本研究发现BMSCs移植到小鼠肝脏后DEN诱导肝损伤, 肝脏内发现有骨髓来源的肝细胞增殖, 而无DEN诱导的肝脏内未发现骨髓来源的肝细胞. DEN诱导的持续肝损伤是BMSCs向肝细胞分化和增殖的重要因素, 移植BMSCs向肝细胞的分化增殖与改善肝功能和抑制肝纤维化有关. 该结果提示骨髓来源的肝细胞通过替代受损的肝细胞来减轻肝损害.
总之, 在持续损伤性肝脏中, 向肝内直接移植的BMSCs能有效地增殖分化为肝细胞. 移植的BMSCs通过替代受损的肝细胞来有效地恢复肝损害和减轻肝纤维化. 本研究提示自身的骨髓细胞移植是一种有前途的治疗慢性肝脏疾病的方法.
肝细胞移植是器官移植的替代方法之一. 但肝细胞难以培养和保存及数量少, 难以达到临床治疗效果. 研究报道, 骨髓细胞能分化为肝细胞, 其移植可以减轻肝纤维化.
党双锁, 副教授, 西安交通大学医学院第二附属医院感染科; 刘海林, 主任医师, 上海交通大学医学院附属第九人民医院消化科.
研究报道骨髓细胞在合适的条件下能分化为肝细胞. 骨髓细胞向肝细胞的转化是通过横向分化还是骨髓细胞与肝细胞的融合目前不清楚.
骨髓基质细胞移植可能成为一种治疗慢性肝损害及肝纤维化的方法.
本文立意较新, 方法得当, 结果有一定的参考价值, 是一篇好的学术文章.
编辑: 程英升 电编: 吴鹏朕
| 1. | Muraca M, Gerunda G, Neri D, Vilei MT, Granato A, Feltracco P, Meroni M, Giron G, Burlina AB. Hepatocyte transplantation as a treatment for glycogen storage disease type 1a. Lancet. 2002;359:317-318. [PubMed] [DOI] |
| 2. | Jang YY, Collector MI, Baylin SB, Diehl AM, Sharkis SJ. Hematopoietic stem cells convert into liver cells within days without fusion. Nat Cell Biol. 2004;6:532-539. [PubMed] [DOI] |
| 3. | Sato Y, Araki H, Kato J, Nakamura K, Kawano Y, Kobune M, Sato T, Miyanishi K, Takayama T, Takahashi M. Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion. Blood. 2005;106:756-763. [PubMed] [DOI] |
| 4. | Wang X, Willenbring H, Akkari Y, Torimaru Y, Foster M, Al-Dhalimy M, Lagasse E, Finegold M, Olson S, Grompe M. Cell fusion is the principal source of bone-marrow-derived hepatocytes. Nature. 2003;422:897-901. [PubMed] [DOI] |
| 5. | Quintana-Bustamante O, Alvarez-Barrientos A, Kofman AV, Fabregat I, Bueren JA, Theise ND, Segovia JC. Hematopoietic mobilization in mice increases the presence of bone marrow-derived hepatocytes via in vivo cell fusion. Hepatology. 2006;43:108-116. [PubMed] [DOI] |
| 6. | Sakaida I, Terai S, Yamamoto N, Aoyama K, Ishikawa T, Nishina H, Okita K. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology. 2004;40:1304-1311. [PubMed] [DOI] |
| 7. | Wang PP, Wang JH, Yan ZP, Hu MY, Lau GK, Fan ST, Luk JM. Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction. Biochem Biophys Res Commun. 2004;320:712-716. [PubMed] [DOI] |
| 8. | Kofman AV, Morgan G, Kirschenbaum A, Osbeck J, Hussain M, Swenson S, Theise ND. Dose- and time-dependent oval cell reaction in acetaminophen-induced murine liver injury. Hepatology. 2005;41:1252-1261. [PubMed] [DOI] |
| 9. | Mangi AA, Noiseux N, Kong D, He H, Rezvani M, Ingwall JS, Dzau VJ. Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts. Nat Med. 2003;9:1195-1201. [PubMed] [DOI] |
| 10. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] [DOI] |
| 11. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] [DOI] |
| 12. | Kanazawa Y, Verma IM. Little evidence of bone marrow-derived hepatocytes in the replacement of injured liver. Proc Natl Acad Sci USA. 2003;100 Suppl 1:11850-11853. [PubMed] [DOI] |
| 13. | Lau DT, Luxon BA, Xiao SY, Beard MR, Lemon SM. Intrahepatic gene expression profiles and alpha-smooth muscle actin patterns in hepatitis C virus induced fibrosis. Hepatology. 2005;42:273-281. [PubMed] [DOI] |
| 14. | Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, Amano K, Kishimoto Y, Yoshimoto K, Akashi H. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 2002;360:427-435. [PubMed] [DOI] |
| 15. | Körbling M, Katz RL, Khanna A, Ruifrok AC, Rondon G, Albitar M, Champlin RE, Estrov Z. Hepatocytes and epithelial cells of donor origin in recipients of peripheral-blood stem cells. N Engl J Med. 2002;346:738-746. [PubMed] [DOI] |