修回日期: 2008-09-12
接受日期: 2008-09-15
在线出版日期: 2008-10-18
目的: 探讨胡黄连苷Ⅱ(picroside Ⅱ)对氧化应激损伤L-02细胞的保护作用.
方法: H2O2损伤的L-02细胞作为氧化应激损伤模型, MTT法检测细胞增殖状况, 膜联蛋白(Annexin-V)和碘化丙啶(PI)染色流式细胞术(flow cytometry, FCM)检测细胞凋亡, 罗丹明123染色FCM检测细胞线粒体膜电位(mitochondrial potential membrane, △Ψm), 双氢罗丹明123染色FCM检测细胞内活性氧(reactive oxygen species, ROS)的含量.
结果: 0.6 mmol/L H2O2可诱导L-02细胞凋亡, 细胞内ROS浓度增加, 细胞线粒体跨膜电位明显下降. 预先经过0.05, 0.5, 5 mmol/L浓度的胡黄连苷Ⅱ处理后, H2O2诱导的L-02细胞凋亡明显减少(30.8%±9.09%, 10.2%±9.82%, 8.2%±7.10% vs 42.8%±8.28%, 均P<0.01), 同时明显减弱H2O2对细胞内ROS浓度和线粒体跨膜电位的影响.
结论: 胡黄连苷Ⅱ对氧化应激损伤L-02细胞具有保护作用, 其机制可能与降低细胞内ROS含量, 进而抑制△Ψm的降低有关.
引文著录: 顾伟, 范昕建, 吴疆, 牛智强. 胡黄连苷Ⅱ对H2O2损伤L-02细胞的保护作用. 世界华人消化杂志 2008; 16(29): 3274-3278
Revised: September 12, 2008
Accepted: September 15, 2008
Published online: October 18, 2008
AIM: To study the protective effect of Picroside Ⅱ on L-02 cell damage induced by oxidative stress.
METHODS: L-02 cells damage induced by hydrogen peroxide (H2O2) were chosen to establish the model of hepatocellular oxidative stress. The proliferation of L-02 cells was observed using 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide (MTT) assay. The apoptosis of L-02 cells was detected using Annexin-V/propidium iodide, propidium iodide stain flow cytometry (FCM). The mitochondrial membrane potential (△Ψm) was analyzed by rhodamine123 stain FCM and the level of reactive oxygen species (ROS) in L-02 cells was determined using dihy-drohodamine123 stain FCM.
RESULTS: 0.6 mmol/L H2O2 induced L-02 cell apoptosis, increased intracellular accumulation of ROS, decreased mitochondrial membrane potential. After treatment with 0.05, 0.5, 5 mmol/L Picroside Ⅱ, H2O2-induced apoptosis in L-02 significantly reduced (30.8% ± 9.09%, 10.2% ± 9.82%, 8.2% ± 7.10% vs 42.8% ± 8.28%, all P < 0.01). At the same time significantly reduced were H2O2-induced intracellular accumulation of ROS and mitochondrial membrane potential.
CONCLUSION: Picroside Ⅱ has protective effect on L-02 cell damage induced by oxidative stress and the effect might be attributed to its removal of ROS and increased △Ψm level.
- Citation: Gu W, Fan XJ, Wu J, Niu ZQ. Protective effect of PicrosideⅡ against H2O2-induced damage in L-02 cells. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3274-3278
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3274.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3274
胃胡黄连为常用中药材之一, 其味苦性寒, 为玄参科植物胡黄连或西藏胡黄连的根茎, 有明显的保肝利胆作用. 胡黄连化学成分主要分为三类: 环烯醚萜类, 葫芦素类和酚甙类, 另外还含有少量的甘露醇, 胡黄连醇, 胡黄连甾醇, 香荚兰乙酮及芳香酸等, 其中胡黄连苷Ⅱ(picroside Ⅱ C23H28O13分子质量512)为环烯醚萜甙类的主要有效成分, 他有明显的保护肝脏损伤、抗氧化、调节免疫等作用[1-3]. 但是他的抗肝损伤的药理作用还不是很清楚, 本研究采用细胞培养的方法, 探讨胡黄连苷Ⅱ对双氧水(H2O2)导致的肝细胞(L-02细胞株)的损伤的保护作用及其抗氧化损伤的机制.
流式细胞仪(EPICS ELITE ESP, Beckman Coulter), CO2培养箱(Sanyo), 倒置生物显微镜(Olympus), 全自动酶标仪(BIO-TEK ELX800), 25 cm2细胞培养瓶、96孔培养板(Corning Incorporated). DMEM培养基(Gibco, Grand Island, NY, USA), 小牛血清(兰州民海生物有限公司), Annexin V-FIFC细胞凋亡检测试剂盒购于凯基生物科技发展有限公司, 琼脂糖, 溴化乙锭(EB), 甲基噻唑蓝(MTT), 二甲基亚砜(DMSO)购于Sigma(St. Louis, MO, USA), 胡黄连苷Ⅱ(picrosideⅡ, 批号111596-200402)标准品、购于中国药品生物制品检定所, 胡黄连苷Ⅱ用无血清培养液(DMEM)溶解. 罗丹明123(Rhodamine123, Rh123, 用DMSO溶解配成1 g/L, 于-20℃冻存备用)、双氢罗丹明123 (Dihydrohodamine123, DHR, 用DMSO溶解配成1 mol/L, 于-20℃冻存备用)购于Sigma. 人肝细胞细胞株L-02, 来自ATCC, 四川大学教育部移植免疫重点实验室细胞室保种. 细胞接种在含100 mL/L小牛血清的DMEM培养液中, 在37℃, 50 mL/L CO2培养箱中培养.
1.2.1 MTT法检测: 将稀释为含5 ×106/L个细胞的细胞悬液接种于96孔培养板中, 100 μL/孔, 待细胞长成对数生长期, 即可用于实验. 选择长成对数生长期的细胞, 换去原培养液, 加入不同药物浓度(0, 0.05, 0.5, 5 mmol/L)的胡黄连苷Ⅱ100 μL/孔, 37℃, 50 mL/L CO2条件下培养3 h, 然后加入含H2O2 1.2 mmol/L的培养液100 μL/孔,使H2O2终浓度为0.6 mmol/L. 继续培养1 h, 造成H2O2损伤模型. 每个浓度作3个复孔, 分别培养24、48、72 h 后, 每孔加2 g/L MTT 20 μL, 再培养4 h, 倾去培养液, 加DMSO 100 μL/孔, 待甲臜完全溶解后, 用酶联免疫仪在波长570 nm处读取吸光度(A570). 取3孔A值的均数按公式计算细胞生存率: 细胞存活率 = (A-A空白)/(A模型-A空白) ×100%. 重复3次.
1.2.2 磷脂酰丝氨酸外翻分析法(Annexin-V法): 每瓶2×106个细胞的密度接种在25 cm2细胞培养瓶中, 培养24 h后, 加入浓度为0(对照组)、0.05、0.5、5 mmol/L(用药组)胡黄连苷Ⅱ培养液在37℃, 50 mL/L CO2条件下培养3 h, 加入含H2O2的培养液, 使其终浓度为0.6 mmol/L, 培养24 h后, 用2.5 g/L胰蛋白酶消化细胞, 制成单个细胞悬液, 收集1×106以上细胞, 用PBS离心洗涤, 加入500 μL Binding Buffer和FITC标记的膜联蛋白V(Annexin-V)5 μL和5 μL碘化丙啶(propidium iodide, PI)在4℃反应30 min, 上流式细胞仪检测(激发波长: 488 nm; 发射波长: 610 nm).
1.2.3 细胞线粒体膜电位(△Ψm)的检测: Rh123是一种可透过细胞膜的阳离子荧光染料, 是一种线粒体跨膜电位的指示剂. 其在正常细胞中能够依赖线粒体跨膜电位进入线粒体基质, 荧光强度减弱或消失. 而在凋亡发生时, 线粒体膜完整性破坏, 线粒体膜通透性转运孔开放, 引起△Ψm的崩溃, Rh123重新释放出线粒体, 从而发出强黄绿色荧光, 可用流式细胞仪检测, 通过荧光信号的强弱来检测线粒体膜电位的变化. 因此, 可通过检测细胞Rh123的荧光强度反映细胞△Ψm. 药物处理24 h后, 用2.5 g/L胰蛋白酶消化贴壁的L-02细胞, 收集1×106细胞用PBS洗2次. 取储存于-20℃、溶于DMSO的1 g/L Rh123, 用不含小牛血清的DMEM稀释至10 μg/L, 重悬上述细胞, 避光于37℃孵育45 min后进行流式细胞仪测定(激发波长: 488 nm; 发射波长: 525 nm), 测定数据按流式细胞仪所配置的软件进行数据处理. 计数10 000个活细胞, 以阳性细胞的平均荧光强度(mean flourscence indensity, MFI)表示△Ψm.
1.2.4 细胞内ROS含量的检测[4]: DHR是一种极易被氧化的亲脂性染料, 可自由进出细胞膜, 进入细胞后可被ROS(主要为超氧化物、过氧化氢和过氧化亚硝基)氧化成一种具有正电荷、能发出荧光的Rh123, 并被泵入线粒体内, 从而维系在细胞内, 经过一定时间的累积, 即可通过流式细胞仪检出相应的荧光. 药物处理16 h后, 倾去陈旧培养基, 用无血清的DMEM洗2次, 加入用无血清的DMEM稀释至终浓度为1 μmol/L的DRH, 避光于37℃孵育1 h后, 收集细胞, PBS洗1次, 制成1×108/L的悬液, 上流式细胞仪检测(激发波长: 488 nm; 发射波长: 525 nm), 测定数据按流式细胞仪所配置的软件进行数据处理. 每个样品测定10 000个活细胞, 直方图分析Rh123的平均荧光强度(MFI), 该值即代表细胞ROS水平.
统计学处理 全部数据经SPSS13.0统计软件进行统计分析, 数据mean±SD表示, 组间比较用independent-samptes t检验.
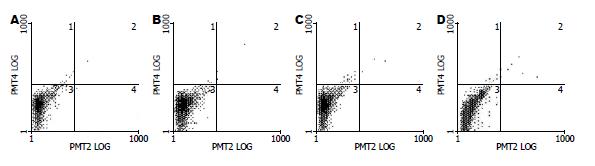
采用Annexin-V法染色FCM检测细胞凋亡以了解胡黄连苷Ⅱ能否直接诱导L-02细胞凋亡. 结果发现, 0(正常对照组)、0.05、0.5 和5 mmol/L胡黄苷Ⅱ作用24 h后, L-02细胞的凋亡率分别为1.7%±8.48%、1.2%±8.21%、0.8%±4.22%和2.2%±8.43%, 与对照组1.7%±8.48%比较差异无显著性, 表明胡黄连苷Ⅱ并不诱导L-02细胞凋亡(图1).
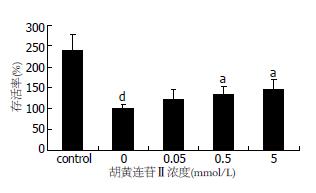
采用MMT法, 细胞存活率 = (A-A空白)/(A模型-A空白)×100%, 测不同浓度胡黄连苷Ⅱ对同一浓度H2O2抑制L-02细胞的生长的情况如图2. 结果显示, 胡黄连苷Ⅱ可提高L-02细胞H2O2损伤模型的细胞存活率. 0.5, 5 mmol/L浓度组胡黄连Ⅱ与H2O2模型组比较有明显差异(P<0.05).
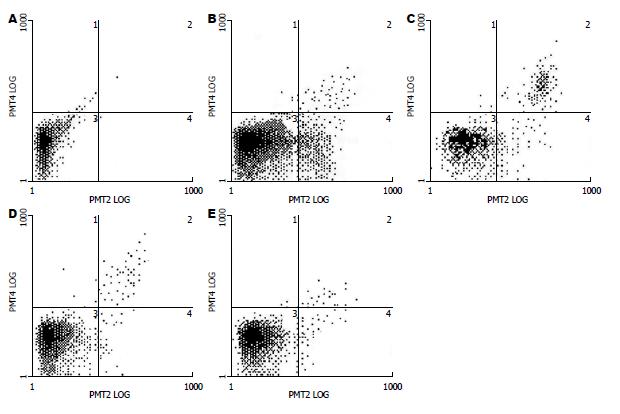
采用Annexin-V/PI法染色FCM检测细胞凋亡以了解胡黄连苷Ⅱ对H2O2诱导L-02细胞凋亡的情况. 如图3所示, 用H2O2模型对照(0.6 mmol/L) 作用L-02细胞24 h后, 细胞凋亡率为42.8%±8.28%; 空白对照组细胞凋亡率为1.7%±4.8%, 0.05 mmol/L胡黄连苷Ⅱ保护H2O2模型24 h; 细胞凋亡率为30.8%±9.09%, 0.5 mmol/L胡黄连苷Ⅱ保护H2O2模型24 h; 细胞凋亡率为10.2%±9.82%; 5 mmol/L胡黄连苷Ⅱ保护H2O2模型24 h; 细胞凋亡率为8.2%±7.10%. 各浓度组胡黄连苷Ⅱ和H2O2模型组相比较有明显的差异(P<0.01).
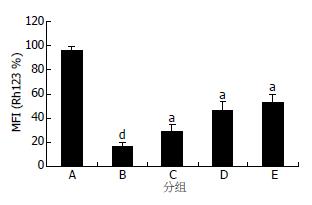
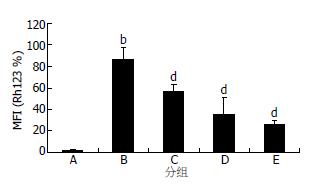
用胡黄连苷Ⅱ保护用H2O2诱导后的L-02细胞, 采用Rh123染色FCM检测细胞△Ψm的变化, 观察胡黄连苷Ⅱ对于细胞的保护作用. 结果如图4所示: L-02细胞在H2O2作用24 h后, 细胞的Rh123平均荧光强度16.4%±3.4%较正常细胞96.2%±3.2%的明显下降(P<0.01), 可见H2O2可使细胞的△Ψm下降, 在加入不同浓度(0.05, 0.5, 5 mmol/L)胡黄连苷Ⅱ后, 他的Rh123平均荧光强度较H2O2模型组明显升高(分别为: 28.9%±5.4%, 46.3%±7.18%, 53.0%±6.7%,P<0.05), 提示胡黄苷Ⅱ对H2O2引起的线粒体损伤有明显的保护作用.
用胡黄连苷Ⅱ保护H2O2诱导的L-02细胞, 采用DHR染色FCM检测细胞内的ROS的变化, 以观察胡黄连苷Ⅱ对这种变化的影响. 结果如图5所示, 0.6 mmol/L H2O2作用16 h后, L-02细胞的Rh123平均荧光强度86.7%±11.4%较对照组1.5%±1.58%明显增强, 表明给以H2O2后, 细胞内ROS的含量升高. 合用0.05, 0.5, 5 mmol/L胡黄连苷Ⅱ后, L-02细胞的Rh123平均荧光强度56.8%±6.48%, 35.8%±15.0%, 25.6%±4.47% 较H2O2组明显降低, 表明胡黄连苷Ⅱ可清除细胞内ROS. H2O2模型组与各药物浓度组和正常组相比有显著性差异(P<0.01).
氧化应激是指由内源性的活性氧(ROS)所致的细胞毒性损伤. 细胞内氧化系统与抗氧化系统失衡, 导致ROS在细胞中累积是氧化应激的主要特征之一. 同时细胞内ROS累积、△Ψm下降也是氧化应激诱导细胞凋亡的关键因素[5]. 线粒体内ROS累积, 可直接或间接损线粒体膜, 造成膜电位下降, 最终引起氧化应激损伤, 他是慢性病毒性肝炎、酒精性肝病(ALD)、自身免疫性肝脏疾病(AILD)和非酒精性脂肪肝(NASH)的共同病理学特征, 其至少在一定程度上可能与肝细胞和肝脏其他类型细胞的功能障碍或死亡有关, 并导致疾病的发生和发展[6-7].
本研究结果显示, 胡黄连苷Ⅱ可增加H2O2损伤后的L-02细胞生存率, 可抑制H2O2诱导L-02细胞凋亡, 表明胡黄连苷Ⅱ对氧化应激损伤肝细胞具有保护作用, 与有关文献报道相似[8]. 在用胡黄连苷Ⅱ作用L-02细胞后, 他的凋亡率和正常培养的L-02细胞相比较没有显著性差异, 表明胡黄连苷Ⅱ本身对L-02细胞没有细胞毒性.
线粒体是凋亡过程中一个非常重要的调控器, 多数凋亡发生过程都伴有线粒体△Ψm的异常, 表明△Ψm的降低是细胞发生凋亡早期的一个不可逆改变[9]. 而在凋亡发生时, 线粒体膜完整性破坏, 线粒体膜通透性转运孔开放, 引起△Ψm的崩溃, 本研究结果显示, H2O2可降低△Ψm, 而合用胡黄连苷Ⅱ后, 细胞的△Ψm升高, 表明胡黄连苷Ⅱ对氧化应激损伤肝细胞的保护作用可能与他抑制细胞△Ψm降低有关.
真核细胞在有氧呼吸过程中, 一小部分氧不能被完全还原, 生成了具有较强氧化作用的ROS, 包括超氧阴离子(O22-)、羟自由基(OH)、过氧化氢(H2O2)[10]等. 同时细胞内存在一套抗氧化酶类, 包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶, 能够清除代谢过程中不断产生的ROS, 使得细胞内ROS处于一个相对稳定的水平. ROS可引起脂类的过氧化, 蛋白质的变性, DNA的断裂等等, 可参与一系列炎症和变性疾病的形成. 近年来还发现ROS还可参与细胞信号转导, 启动某些基因的表达, 因此细胞内ROS水平对细胞的基本新陈代谢状态有着重要的影响[11]. 本研究结果显示胡黄连苷Ⅱ可明显降低H2O2作用16 h后细胞内ROS含量, 表明胡黄连苷Ⅱ对氧化应激损伤肝细胞的保护作用可能与对ROS的清除作用有关, 线粒体是细胞内的"能量工厂", 是产生ROS的主要部位, ATP、ROS、△Ψm三者之间的关系影响线粒体的功能, 进而影响到细胞的正常结构与功能以及细胞凋亡的产生与发展, ROS的增加可直接或间接损伤线粒体膜而使△Ψm降低. 因此, 认为胡黄连苷Ⅱ对氧化应激损伤肝细胞的保护作用可能是通过清除ROS进而抑制△Ψm的降低而实现的.
胡黄连苷Ⅱ有明显的抗H2O2对L-02细胞损伤作用, 其机制可能为: 可减少氧自由基, 从而发挥抗脂质过氧化损伤作用, 增强细胞本身抗氧化系统的功能, 从而阻断自由基损伤作用, 可能是通过保护细胞膜、线粒体膜的作用而达到. 因此, 胡黄连苷Ⅱ在治疗肝脏疾病方面值得进一步研究.
肝损伤是指各种有害因子如病毒、药物、毒物、缺氧、自由基、免疫因素等, 直接或间接损伤肝脏, 造成肝细胞的炎症、坏死或/和凋亡、纤维化等一系列病理改变. 本文研究了西藏胡黄连的主要有效成份胡黄连苷Ⅱ对肝细胞损伤的保护作用, 并初步探讨了其保护机制.
朱传武, 副主任医师, 江苏省苏州市第五人民医院传染科
胡黄连苷Ⅱ能有效的对受损肝细胞有保护作用, 本文对其保肝作用的机制, 主要是针对其抗氧化应激和细胞抗细胞凋亡方面做了初步研究.
通过体外实验, 探明了胡黄连苷Ⅱ保护肝细胞的部份药理作用, 为今后做抗病毒实验打下一定的基础.
保护肝细胞、减轻或阻止肝损伤, 不仅可阻止肝功能的进行性损害, 同时也可以逆转肝纤维化及早期肝硬化. 因此肝脏保护在肝病的治疗中是不可缺少的, 应采用抗炎保肝药物作为综合治疗的措施. 对肝损伤的治疗是评价肝病治疗效果的一个重要的方面, 因此, 研制开发有效治疗肝损伤的药物具有重要的现实意义.
本文为药物的实验研究, 设计合理, 方法得当, 采用的统计分析方法合理, 为一篇较好的文章.
编辑: 李军亮 电编:何基才
| 1. | Gao H, Zhou YW. Anti-lipid peroxidation and protection of liver mitochondria against injuries by picroside II. World J Gastroenterol. 2005;11:3671-3674. [PubMed] |
| 2. | Joy KL, Rajeshkumar NV, Kuttan G, Kuttan R. Effect of Picrorrhiza kurroa extract on transplanted tumours and chemical carcinogenesis in mice. J Ethnopharmacol. 2000;71:261-266. [PubMed] [DOI] |
| 3. | Rastogi R, Srivastava AK, Srivastava M, Rastogi AK. Hepatocurative effect of picroliv and silymarin against aflatoxin B1 induced hepatotoxicity in rats. Planta Med. 2000;66:709-713. [PubMed] [DOI] |
| 4. | 史 桂英, 高 飞, 石 学耕, 汤 雪明. 流式细胞术检测细胞内活性氧的方法. 上海第二医科大学学报. 2001;21:122-124. |
| 5. | Whittemore ER, Loo DT, Cotman CW. Exposure to hydrogen peroxide induces cell death via apoptosis in cultured rat cortical neurons. Neuroreport. 1994;5:1485-1488. [PubMed] [DOI] |
| 6. | Medina J, Moreno-Otero R. Pathophysiological basis for antioxidant therapy in chronic liver disease. Drugs. 2005;65:2445-2461. [PubMed] [DOI] |
| 7. | Tribble DL, Aw TY, Jones DP. The pathophysiological significance of lipid peroxidation in oxidative cell injury. Hepatology. 1987;7:377-386. [PubMed] [DOI] |
| 8. | Gao H, Zhou YW. Inhibitory effect of picroside II on hepatocyte apoptosis. Acta Pharmacol Sin. 2005;26:729-736. [PubMed] [DOI] |
| 9. | Nieminen AL, Saylor AK, Tesfai SA, Herman B, Lemasters JJ. Contribution of the mitochondrial permeability transition to lethal injury after exposure of hepatocytes to t-butylhydroperoxide. Biochem J. 1995;307:99-106. [PubMed] |
| 10. | Kanbagli O, Balkan J, Aykaç-Toker G, Uysal M. Hepatic mitochondrial prooxidant and antioxidant status in ethanol-induced liver injury in rats. Biol Pharm Bull. 2002;25:1482-1484. [PubMed] [DOI] |
| 11. | Cotgreave IA, Gerdes RG. Recent trends in glutathione biochemistry--glutathione-protein interactions: a molecular link between oxidative stress and cell proliferation? Biochem Biophys Res Commun. 1998;242:1-9. [PubMed] [DOI] |