修回日期: 2008-08-24
接受日期: 2008-08-26
在线出版日期: 2008-09-28
目的: 建立噁唑酮诱导的大鼠结肠炎模型, 观察阿泰宁对噁唑酮诱导的大鼠结肠炎的治疗作用及机制.
方法: 经直肠注入噁唑酮建立大鼠溃疡性结肠炎模型. 将大鼠随机分为: 空白对照组 (正常组, n = 8), 模型组(n = 10), 美沙拉秦组(正常组, n = 10), 阿泰宁组(n = 10), 治疗21 d后处死动物, 肉眼观察结肠病变, 分别测体质量、结肠湿质量、脾脏质量和结肠组织病理学变化, ELISA法测定大鼠血清IL-1β、IL-10、TNF-α以及结肠黏液内容物sIgA含量, 考马斯亮兰法测定血清总蛋白, 溴甲酚绿比色法测定白蛋白以及肠道菌群培养.
结果: 模型组、阿泰宁组和美沙拉秦组大鼠体质量均比正常组显著降低(均P<0.01). 美沙拉秦组和阿泰宁组血清球蛋白含量、结肠湿质量指数较模型组差异显著(29.9±5.7, 29.1±5.4 vs 23.7±9.5; 6.0±0.9, 6.2±0.4 vs 7.4±1.6, 均P<0.05). 模型组大鼠血清IL-1β和TNF-α含量较正常组、美沙拉秦组和阿泰宁组差异显著(44.6±17.2 vs 8.8±7.9, 14.5±4.7, 8.6±3.4, 均P<0.01; 33.5±7.2 vs 22.6±6.7, 22.3±9.2, 24.4±10.8, 均P<0.05). 模型组大鼠血清IL-10含量较正常组、阿泰宁组差异显著(101.5±35.8 vs 280.5±36.1, 271.3±33.8, P<0.01). 阿泰宁组脾脏指数、sIgA含量比正常组显著升高(3.4±0.8 vs 2.7±0.3; 46.0±20.3 vs 23.4±18.5, 均P<0.05), 而美沙拉秦组差异不显著. 较模型组双歧杆菌数量, 阿泰宁治疗后明显上升, 梭杆菌数量明显下降(9.7±0.1 vs 9.3±0.2; 3.7±0.3 vs 5.8±0.7, 均P<0.01).
结论: 阿泰宁能够有效治疗噁唑酮诱导的大鼠结肠炎.
引文著录: 张海强, 李爱玲, 乔刚, 杨鑫, 张海霞, 马庆英, 李雄彪, 崔云龙. 阿泰宁对噁唑酮诱导的大鼠结肠炎模型的治疗作用. 世界华人消化杂志 2008; 16(27): 3036-3042
Revised: August 24, 2008
Accepted: August 26, 2008
Published online: September 28, 2008
AIM: To establish a model of ulcerative colitis induced by oxazolone in rats, to observe therapeutic effects of A Tai Ning for treatment of oxazolone-induced ulcerative colitis and to investigate its mechanism.
METHODS: Intrarectal injection of oxazolone was performed to induce ulcerative colitis in rats. Rats were randomly assigned to control group (n = 8), model group (n = 10), mesalamine group and A Tai Ning group (n = 10). After 21 days's treatsment, all the animals were sacrificed and their body weight, weight of fresh ulcerative tissues, and the weight of spleen were measured. Histopathological changes in ulcerative tissues were determined using ELISA to specify the amount of IL-1β, IL-10 and TNF-α in rat serum, and sIgA in the contents of ulcerative tissues. The content of total protein and albumin in serum were determined using the Coomassie brilliant Blue and the Bromocresol Green colorimetric method, respectively. The intestinal bacterial flora was determined using bromocresol green method.
RESULTS: Compared with the control group, all test groups including model group, A Tai Ning and mesalamine groups showed significant weight loss (all P < 0.01). Compared with the control group, there were significant differences in colonic wet weight index and the quantity of serum globulin both in A Tai Ning and Mesalamine groups (29.9 ± 5.7, 29.1 ± 5.4 vs 23.7 ± 9.5; 6.0 ± 0.9, 6.2 ± 0.4 vs 7.4 ± 1.6, all P < 0.05). Serum IL-1β and TNF-α levels in the model group were significantly different from those inthe control group, the Mesalamine group or the A Tai Ning group (44.6 ± 17.2 vs 8.8 ± 7.9, 14.5 ± 4.7, 8.6 ± 3.4, both P < 0.01; 33.5 ± 7.2 vs 22.6 ± 6.7, 22.3 ± 9.2, 24.4 ± 10.8, both P < 0.05). The serum IL-10 level in the model group was significantly lower compared with the control group or A Tai Ning group (101.5 ± 35.8 vs 280.5 ± 36.1, P < 0.01), whereas the A Tai Ning group showed higher levels of IL-10 compared with the control group (271.3 ± 33.8 vs 101.5 ± 35.8, P < 0.01). The spleen mass index and the content of sIgA in rat ulcers in the A Tai Ning group were significantly increased compared with the control group (3.4 ± 0.8 vs 2.7 ± 0.3; 46.0 ± 20.3 vs 23.4 ± 18.5, both P < 0.05), but no significant difference was detected between the Mesalamine group and A Tai Ning group. Compared with the model group, the level of Bifidobacterium in the A Tai Ning group was remarkedly increased while the level of Fusobacterium was decreased greatly (9.7 ± 0.1 vs 9.3 ± 0.2; 3.7 ± 0.3 vs 5.8 ± 0.7, both P < 0.01).
CONCLUSION: A Tai Ning is effective for oxazolone induced-ulcerative colitis in rats.
- Citation: Zhang HQ, Li AL, Qiao G, Yang X, Zhang HX, Ma QY, Li XB, Cui YL. Therapeutic effects of A Tai Ning on oxazolone-induced ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(27): 3036-3042
- URL: https://www.wjgnet.com/1009-3079/full/v16/i27/3036.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i27.3036
炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). UC在我国近些年来发病率有逐年上升的趋势, 目前该病还没有根治的方法, 反复发作, 其发病机制并不十分明确. 炎症性细胞因子和抗炎性细胞因子及其相关的免疫机制在IBD的发生、发展中的作用是当前研究的热点, 并且动物实验表明, 肠道菌群改变或对肠道微生物免疫耐受缺陷可引起肠道炎症[1-2]. 噁唑酮是一种半抗原, 已证实其用于动物身体的各个部位都可诱发接触性过敏反应. 国内外均有研究显示噁唑酮诱导的结肠炎可能是一种IL-4介导的Th2型炎症, 其组织学特征和炎症分布均类似于人类UC[3-4]是一种较为满意的UC动物模型. IBD是一种与自身免疫功能紊乱有关的疾病, 在治疗方面多采用类固醇激素、免疫抑制剂及水杨酸类药物, 但此类药物不良反应较多且疗效不佳. 近年来, 用产丁酸的酪酸梭菌微生态制剂治疗UC的研究获得快速进展[5-8], 并引起医学界的高度重视. 我们在动物实验和临床应用中发现, 阿泰宁(酪酸梭菌CGMCC0313.1制剂)对动物及人的溃疡性结肠炎均有良好的治疗效果[9-11], 但是其治疗机制并不完全清楚. 因此, 本研究采用噁唑酮建立大鼠结肠炎模型, 用阿泰宁进行实验性治疗, 并用美沙拉秦作为阳性对照药, 来观察阿泰宁对肠黏膜的修复情况, 并检测大鼠血清球蛋白的浓度变化以及白介素-1β(interleukin-1β, IL-1β)、白介素-10(interleukin-10, IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、结肠分泌性免疫球蛋白A的表达水平以及大鼠肠道菌群分析, 以探讨其治疗机制.
清洁级♂Wistar大鼠, 体质量180-200 g, 购自北京军事医学科学院实验动物中心, 美沙拉秦片(市售), 阿泰宁(酪酸梭菌CGMCC0313.1制剂)和原料粉末由青岛东海药业有限公司提供, 噁唑酮购自Alfa Aesar公司, IL-1β ELISA试剂盒、IL-10 ELISA试剂盒、TNF-α ELISA试剂盒为武汉博士德生物工程有限公司产品, sIgA ELISA试剂盒购自美国ADL(Adlitteram Diagnostic laboratories)公司, 白蛋白测定试剂盒和考马斯亮兰总蛋白测定试剂盒购自南京建成生物工程研究所第一分所.
1.2.1 动物模型的建立: 根据Lamprecht et al[12]提供的方法并加以改进, 实验组(30只)大鼠, 先将大鼠背部毛剪除一小片, 约2 cm×2 cm. 用棉球蘸取噁唑酮溶液300 μL(50 g/L, 无水乙醇配制)擦拭除毛部位, 致敏. 此后分别在第5天、第7天用直径1 mm左右的橡胶管经肛门插入大鼠肠内, 深入约8 cm, 噁唑酮溶液(50 g/L, 500 mL/L乙醇配制)灌肠1次, 剂量为450 μL. 为确保注入的OXZ能够在大肠内弥散分布, 注入后将大鼠尾巴提起, 继续倒置45 s左右.
1.2.2 动物分组及治疗: 空白对照组8只(正常组), 大鼠造模成功后随机分组, 模型组10只, 阳性药(美沙拉秦, 100 g/L)对照组10只, 阿泰宁组(2.3×1011 cfu/L)10只(中途死亡2只), 各组动物按每次10 mL/kg体质量, ig, 1次/d, 连续给药21 d. 期间每周称体质量1次, 并持续观察动物一般情况及粪便性状.
1.2.3 动物处理及病理切片制作: 各组动物给药至第21天后, 断头处死动物, 将新鲜结肠肠管纵行剖开, 清除肠内容物, 生理盐水冲洗干净, 然后用滤纸吸干, 称量结肠湿质量, 结肠湿质量指数 = 结肠湿质量(g)/体质量(kg). 摘取脾脏, 称量脾脏质量, 脾脏指数 = 脾脏鲜质量(g)/宰前空腹体质量(kg). 将结肠用40 g/L甲醛液固定, 用不同浓度梯度乙醇脱水, 石蜡包埋, 切片厚度5 μm, HE染色, 光镜检查, 观察病理组织变化.
1.2.4 血清球蛋白浓度测定: 断头处死大鼠, 取血, 于4 ℃静置过夜, 3000 r/min, 20 min离心, 取上清, 分装, 放于-20 ℃保存待测. 血清球蛋白 = 血清总蛋白-血清白蛋白; 血清总蛋白的测定采用考马斯亮兰总蛋白测定试剂盒测定, 血清白蛋白的测定采用白蛋白测定试剂盒测定.
1.2.5 血清TNF-α、IL-1β和IL-10含量检测: 断头处死大鼠, 取血, 于4 ℃静置过夜, 3000 r/min, 20 min离心, 取上清, 分装, 置于-20 ℃保存待测. 使用ELISA试剂盒, 按照说明书, 测定大鼠血清TNF-α、IL-1β和IL-10含量.
1.2.6 结肠内黏液内容物sIgA含量测定: 断头处死大鼠, 立即刮取结肠黏膜黏液约0.5 mL, 加入等体积的PBS缓冲液(pH 7.4)混匀, 6000 r/min离心15 min, 取上清液, -20 ℃冰箱保存备用. 使用ELISA试剂盒, 按照说明书, 测定sIgA含量.
1.2.7 肠道菌群分析: 分别在造型前、造型后和治疗结束后, 在无菌操作下, 分别采取从大鼠肛门挤出的新鲜大便, 称重后10倍梯度稀释, 取一定梯度的稀释匀浆液0.1 mL, 接种到选择性培养基平板上, 涂匀, 需氧菌在37 ℃培养48 h, 厌氧菌在37 ℃培养72 h, 进行活菌计数(cfu/g). 肠杆菌, 双歧杆菌, 乳杆菌, 真杆菌, 梭杆菌的培养分别用EMB, BBL, MRS, ES, FS培养基.
统计学处理 数据均以mean±SD表示, 各组间的数据统计学差异采用t检验, P<0.05为差异显著.
模型组以及各治疗组体质量均较正常组显著降低(P<0.01). 在造模期间模型组大多数大鼠排稀便、黏液便、水样便, 少部分排脓血便, 治疗后均排便正常, 结肠病变肉眼观察均有明显改善. 美沙拉秦组和阿泰宁组大鼠的结肠湿质量指数均比模型组显著降低(P<0.05, 表1).
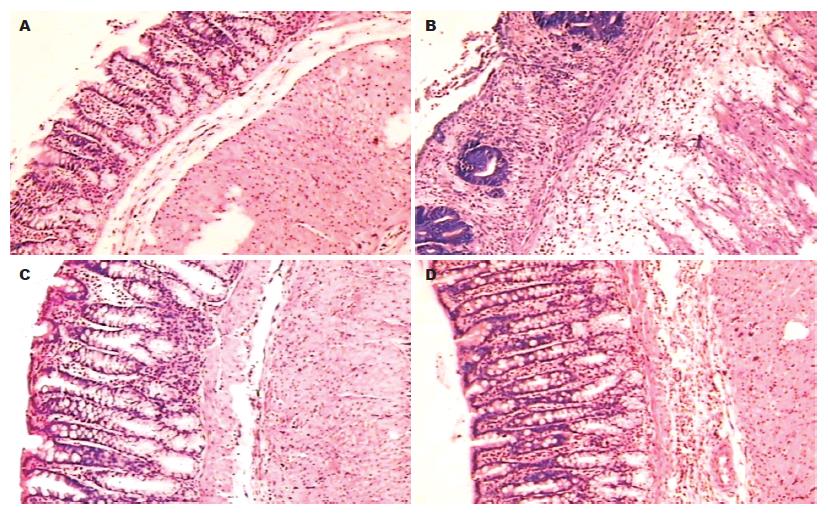
模型组大鼠造模成功后3 d处死, 病变主要发生在结肠中下段, 远端结肠黏膜充血、水肿, 病变呈连续性分布. 镜下表现为黏膜上皮细胞脱落、糜烂和溃疡形成, 杯状细胞减少, 肠腺萎缩或消失, 密度减低, 炎症存在于黏膜和黏膜下层, 少数可达肌层, 可见多种炎症细胞浸润, 主要为淋巴细胞、嗜酸性细胞、浆细胞, 嗜中性粒细胞较少. 治疗后黏膜充血、水肿、糜烂症状得到明显改善, 镜下观察, 结肠黏膜得到修复, 偶见较小的溃疡面存在, 但仍有炎症细胞浸润, 主要为淋巴细胞和嗜酸性细胞(图1).
阿泰宁组的脾脏指数显著高于正常组, 而模型组和美沙拉秦组的脾脏指数与正常组相比较差异不显著(表1).
正常组大鼠血清球蛋白含量为26.6±8.0 g/L, 阿泰宁组和美沙拉秦组大鼠血清球蛋白浓度较模型组有显著提高(29.1±5.4 g/L, 29.9±5.7 g/L vs 23.4±9.5 g/L, P<0.05).
模型组大鼠血清IL-1β和TNF-α含量比正常组均显著升高(P<0.05), 而美沙拉秦和阿泰宁组大鼠血清IL-1β和TNF-α含量较模型组显著降低(P<0.05). 模型组大鼠血清IL-10含量较正常组显著降低(P<0.01), 而阿泰宁组血清IL-10含量较模型组显著升高, 接近正常水平(P<0.01, 表2).
经噁唑酮建立大鼠结肠炎后, 大鼠结肠内sIgA含量比正常组有所升高(30.1±16.4 mg/L vs 23.4±18.5 mg/L), 但差异不显著. 经阿泰宁治疗后, 大鼠结肠内sIgA含量(46.0±20.3 mg/L)显著高于正常组(P<0.05), 而美沙拉秦组(25.7±20.5 mg/L)与正常组相比较, 没有显著性差异.
正常大鼠肠道内的大肠杆菌、双歧杆菌、乳杆菌、真杆菌、梭杆菌、梭菌的生长状态良好. 经噁唑酮造模后, 模型组大鼠肠道双歧杆菌数量较正常组明显降低(P<0.01), 梭杆菌却明显升高(P<0.01), 其他菌群无明显变化. 阿泰宁组的双歧杆菌数量显著高于模型组(P<0.01), 接近正常水平, 美沙拉秦组的双歧杆菌数量较模型组也有所提高, 但差异不显著. 大鼠肠道的梭杆菌数量经阿泰宁和美沙拉秦治疗后均显著低于模型组(P<0.01). 其他各组肠道菌群经治疗后基本恢复正常(表3).
本研究结果表明, 噁唑酮诱导的大鼠结肠炎模型表现为远端结肠黏膜充血、水肿, 病变呈连续性分布, 表现为黏膜上皮细胞脱落、糜烂和溃疡形成, 杯状细胞减少, 腺体密度降低或消失, 炎症多存在于黏膜和黏膜下层, 少数可达肌层, 可见多种炎症细胞浸润, 结肠湿质量指数明显升高, 致炎性细胞因子IL-1β、TNF-α的含量均显著上升, 抗炎因子IL-10较正常组表达显著降低. 阿泰宁治疗后, 黏膜充血、水肿症状得到明显的改善, 结肠黏膜基本上得到修复, 结肠湿质量指数明显降低, 致炎性细胞因子IL-1β、TNF-α的含量均显著降低, 抗炎细胞因子IL-10表达显著提高, 接近正常水平, 并且血清球蛋白浓度及脾脏指数较正常组有了很大的提高, 肠道菌群恢复平衡.
动物实验表明, 很多微生态制剂可以产生多种有益物质促进免疫器官的生长、发育和成熟, 并且本身也可以作为抗原物质促进免疫器官发育, 进而提高机体的抗病能力. 刘克琳等用芽孢杆菌制剂饲喂雏鸡后发现试验组鸡的中枢免疫器官发育比对照组快, 胸腺内淋巴细胞密度增大, T细胞数量增加, 法氏囊黏膜形成, 皱襞数量增加[13]. 易力 et al[14]将乳酸杆菌、光合细菌、芽孢杆菌添加到饲料中喂养康达尔鸡, 结果表明, 胸腺、脾脏、法氏囊指数都大于对照组, 有效促进胸腺、脾脏、法氏囊的发育. 本研究表明, 阿泰宁治疗后, 大鼠血清球蛋白浓度和脾脏指数较正常组和模型组均显著提高, 而美沙拉秦组的脾脏指数与正常组相比较差异不显著, 说明酪酸梭菌活菌制剂能够有效提高血清球蛋白浓度以及促进免疫器官的发育. 但是, 对于促进免疫器官发育与B细胞、T细胞的分化、成熟以及与结肠炎的关系尚需进一步的研究.
IL-1β在炎症和免疫反应中起重要作用, 具有多种生物学效应, 能通过自分泌或旁分泌刺激其他细胞因子和炎症介质IL-2、IL-6、IL-8、TNF-α等的产生. IL-1β可促进B细胞的增殖、分化、介导免疫球蛋白的分泌, 激活补体, 自然杀伤细胞及吞噬细胞的活性, 增强细胞免疫和体液免疫介导肠组织的损伤, 还可对中性粒细胞等炎症细胞产生趋化作用, 吸引其进入肠道病变部位, 引起一系列肠道炎症反应和组织损伤, 最终引起UC. 动物实验和临床研究均证实IL-1β与UC的发生发展密切相关, 并且在UC中高表达[15-17]. 本实验中, 模型组IL-1β的表达显著升高, 经阿泰宁和美沙拉秦治疗后, 均显著下降. 阿泰宁治疗后, IL-1β表达水平略低于正常水平, 基本上恢复到正常水平, 但美沙拉秦组仍然高于正常水平, 说明阿泰宁能够有效降低IL-1β的表达且效果优于美沙拉秦. TNF-α是重要的炎症因子, 他既能诱导IEC前列腺素的产生和上调内皮细胞黏附分子-1(intercellular adhesion molecule-1, ICAM-1)的表达, 促进炎症, 又能促进成纤维细胞(mesenchymal fibroblasts, MSF)产生大量的胞外蛋白降解酶, 即基质金属蛋白酶(matrix metalloproteinase, MMP), 能将黏膜基质溶解, 导致上皮细胞脱落[18]. TNF-α还通过降低跨膜闭合蛋白的表达, 促使肠上皮的通透性增加, 这是IBS、IBD的重要前期黏膜病理变化[19]. 张文远 et al[20]用葡聚糖硫酸钠(DSS)造型, 发现大鼠结肠炎结肠组织中TNF-α、IL-26、PGE2 较对照组显著增高. Araki et al[7]给DSS诱导的UC大鼠喂服酪酸梭菌制剂8 d, 发现该制剂能减轻UC大鼠的出血性腹泻和结肠黏膜损伤. 卢艺涛 et al[21]通过临床研究发现活动期溃疡性结肠炎患者血清TNF-α与IL-6水平与病情严重程度呈正相关, 认为活动期溃疡性结肠炎患者存在着严重的细胞免疫功能紊乱, 而TNF-α, IL-6, sIL-2R等在溃疡性结肠炎的发生和病情发展中起着重要作用. 王文杰 et al[9]通过牛结肠黏膜蛋白诱发大鼠免疫性溃疡性结肠炎中, TNF-α的表达显著上调, 经阿泰宁治疗后显著下调, 并且发现阿泰宁与美沙拉秦联合用药的治疗效果要优于美沙拉秦单独用药的治疗效果. 在本实验中, 模型组大鼠血清TNF-α浓度比正常组大鼠异常升高, 说明TNF-α是伴UC高度表达的致炎因子. 用酪酸梭菌制剂阿泰宁治疗后, TNF-α的过度表达被显著下调. 酪酸梭菌制剂阿泰宁通过下调IL-1β和TNF-α的表达可能是其治疗UC的机制之一.
IL-10主要由Th2细胞分泌, 是一种抗炎性细胞因子, 有免疫调节和抗炎性作用, 在肠道免疫调节中起着重要作用. IL-10能下调IL-1β、TNF-α、IL-4及IL-5的表达[22]. IL-10基因剔除的小鼠可发生慢性肠炎, 给予IL-10可预防其发生, 说明IL-10在维持正常肠道黏膜免疫调节中发挥重要作用. 临床试验表明, 注射人重组IL-10对克罗恩病有一定疗效. 本研究发现, 模型组的IL-10血清含量明显低于正常组, 经阿泰宁治疗后, IL-10的表达明显上调且接近正常水平, 而美沙拉秦却不能有效提高IL-10的表达, 这可能是阿泰宁较美沙拉秦治疗UC效果更好的原因之一.
IgA分为两型: 血清型IgA和分泌型IgA (sIgA). slgA的合成和主要作用部位在胃肠道和支气管分泌液、初乳、唾液和泪液中. slgA是参与黏膜局部免疫的主要抗体, 通过与相应病原微生物细菌、病毒等结合, 阻止病原体黏附到细胞表面, 从而在局部抗感染中发挥重要作用. 有研究表明, 益生菌Lactobacillus GG可以有效治疗儿童轮状病毒性腹泻, 提高抗轮状病毒特异性抗体分泌细胞的数量及血液IgA抗体水平, 促进机体对轮状病毒的局部和系统免疫应答[23-24]. 口服Lactobacillus GG可以提高肠道IgA免疫应答, 增强肠道免疫屏障, 有效缓解肠道炎症, 降低肠黏膜通透性[25-27]. Murayama et al[28]用酪酸梭菌饲喂无菌鼠, 发现模型鼠的小肠中IgA增加, 认为酪酸梭菌能够刺激黏膜免疫活性. 本研究表明, 经酪酸梭菌活菌制剂阿泰宁治疗后较正常组能够显著提高肠道sIgA水平, 而美沙拉秦组与正常组相比较差异不显著, 不能有效提高sIgA水平, 说明阿泰宁能够促进sIgA的分泌, 刺激黏膜免疫活性, 增强肠道免疫屏障.
微生态制剂大都有调节肠道菌群, 恢复肠道菌群平衡的作用. 张达荣 et al[29]研究表明, 肠易激综合症患者服用酪酸梭菌制剂后, 可抑制肠道内腐败菌、病原菌, 并能促进双歧杆菌、乳酸菌等肠道有益菌的生长和繁殖. 小鼠灌服丁酸梭菌活菌制剂泰平片后, 粪便中的有益菌双歧杆菌和乳杆菌的数量明显增加[30]. 体外研究表明, 酪酸梭菌对肠出血性大肠杆菌、痢疾志贺菌、霍乱沙门菌、霍乱弧菌均有显著的抑制作用[31]. 实验结果表明, 酪酸梭菌活菌制剂阿泰宁能够显著提高大鼠肠道内的双歧杆菌数量, 使其恢复到正常水平. 梭杆菌属革兰氏阴性专性厌氧菌, 他广泛存在于动物和人的口腔及胃肠道中, 属条件性致病菌. 本研究发现, 结肠炎模型组能够显著提高梭杆菌的数量, 经治疗后, 数量显著降低, 梭杆菌在结肠炎患者肠道内的数量以及是否有致病性尚需要进一步的研究.
由实验结果可以看出, 阿泰宁在促进脾脏生长发育, 降低炎症因子IL-1β表达水平, 提高抗炎因子IL-10的表达以及调节和恢复肠道菌群方面效果优于美沙拉秦, 而在降低结肠湿质量指数, 提高血清球蛋白浓度, 降低TNF-α的表达方面与美沙拉秦的效果基本一致. 美沙拉秦主要作用于肠道炎症黏膜, 抑制引起炎症的前列腺素合成及炎性介质白三烯的形成, 从而对肠道壁起到抗炎作用. 因此, 在治疗结肠炎方面阿泰宁与美沙拉秦存在一定的互补协同作用, 这也证实了最近的研究结果, 阿泰宁与美沙拉秦联合用药的治疗效果要优于美沙拉秦单独用药的治疗效果[9]. 阿泰宁为酪酸梭菌活菌制剂, 能够分泌丁酸, 有研究表明, 丁酸能逆转UC肠黏膜的通透性使其恢复正常, 并可抑制NF-κB的表达[32-34]. Lührs et al[35]证实, 用丁酸盐灌肠治疗UC患者, 临床症状可明显缓解, 肠黏膜中NF-κB的表达可明显下调. 由此可见, 酪酸梭菌对UC的治疗作用有可能部分通过增加肠道丁酸水平而实现的. 因此, 酪酸梭菌对UC的治疗不是单一作用的, 而是通过调控各种炎症因子的表达, 提高机体免疫功能, 调节和恢复肠道菌群平衡等多个方面而发挥治疗作用, 其具体的治疗机制还需要更加深入的研究.
炎症性肠病(包括溃疡性结肠炎和克罗恩病)在世界范围内日益增多, UC在我国近些年来发病率有逐年上升的趋势, 且无有效治疗药物和措施, 复发率高. 本课题组试图从酪酸梭菌微生态制剂方面打开新的突破口, 找到安全有效的治疗新药和途径.
黄晓东, 副主任医师, 武汉市中心医院消化内科
微生态制剂可以调节肠道菌群平衡, 促进肠道健康, 应用微生态制剂治疗炎症性肠病的报道日见增多, 酪酸梭菌制剂显示了良好的应用前景, 但其治疗的作用机制尚需阐明. 目前研究的重点是酪酸梭菌微生态制剂对UC模型和患者治疗的免疫调节机制.
醋酸、葡聚糖硫酸钠(DSS)以及噁唑酮等常用于大、小鼠溃疡性结肠炎模型造模, 并进行实验性治疗研究. 本文采用噁唑酮建立大鼠结肠炎模型并用酪酸梭菌活菌制剂阿泰宁进行治疗探讨有关机制尚属首次.
溃疡性结肠炎与免疫调控异常密切相关. 本研究采用噁唑酮建立大鼠结肠炎模型, 并进行了实验性治疗, 检测到血清促炎因子(如IL-1β等)伴随发病异常升高, 而抗炎因子IL-10却显著降低, 并且发现肠道菌群平衡遭到破坏, 经阿泰宁治疗后, 促炎因子和抗炎因子均趋于恢复正常, 肠道菌群平衡也得到恢复. 初步探明酪酸梭菌制剂阿泰宁有效治疗溃疡性结肠炎的作用机制是通过下调促炎因子, 有效提高抗炎因子的表达, 调节和恢复肠道菌群平衡而发挥治疗作用.
本研究表明, 酪酸梭菌活菌制剂阿泰宁能够有效修复受损的肠黏膜, 其作用机制是通过下调促炎因子和上调抗炎因子IL-10表达水平, 提高结肠内sIgA水平以及调节和恢复肠道菌群平衡而发挥治疗作用, 为临床上应用酪酸梭菌活菌制剂阿泰宁治疗UC提供了较充分的理论依据和实验资料.
本研究内容有一定新颖性, 设计合理, 统计学处理恰当, 结果明确, 结论可靠, 能较好地反映我国胃肠病学基础研究的先进水平.
编辑: 李军亮 电编: 何基才
| 6. | Araki Y, Andoh A, Takizawa J, Takizawa W, Fujiyama Y. Clostridium butyricum, a probiotic derivative, suppresses dextran sulfate sodium-induced experimental colitis in rats. Int J Mol Med. 2004;13:577-580. [PubMed] |
| 7. | Araki Y, Andoh A, Fujiyama Y, Takizawa J, Takizawa W, Bamba T. Oral administration of a product derived from Clostridium butyricum in rats. Int J Mol Med. 2002;9:53-57. [PubMed] |
| 8. | Araki Y, Andoh A, Fujiyama Y, Takizawa J, Takizawa W, Bamba T. Short-term oral administration of a product derived from a probiotic, Clostridium butyricum induced no pathological effects in rats. Int J Mol Med. 2002;9:173-177. [PubMed] |
| 9. | 王 文杰, 王 霖, 刘 洋, 彭 珊瑛, 张 弗盈, 李 萍, 万 阜昌, 崔 云龙. 阿泰宁对牛结肠黏膜蛋白诱发大鼠免疫性溃疡性结肠炎的治疗作用. 世界华人消化杂志. 2008;16:25-32. [DOI] |
| 10. | 熊 德鑫, 崔 云龙, 万 阜昌, 曹 云珍, 梁 明, 祝 小枫, 修 淑娟, 姜 仙琳, 魏 爱珍. 酪立宁胶囊对实验性腹泻小鼠的止泻作用. 中国新药杂志. 2002;11:319-321. |
| 12. | Lamprecht A, Yamamoto H, Takeuchi H, Kawashima Y. Nanoparticles enhance therapeutic efficiency by selectively increased local drug dose in experimental colitis in rats. J Pharmacol Exp Ther. 2005;315:196-202. [PubMed] [DOI] |
| 15. | Sasaki S, Hirata I, Maemura K, Hamamoto N, Murano M, Toshina K, Katsu K. Prostaglandin E2 inhibits lesion formation in dextran sodium sulphate-induced colitis in rats and reduces the levels of mucosal inflammatory cytokines. Scand J Immunol. 2000;51:23-28. [PubMed] [DOI] |
| 16. | Sawa Y, Oshitani N, Adachi K, Higuchi K, Matsumoto T, Arakawa T. Comprehensive analysis of intestinal cytokine messenger RNA profile by real-time quantitative polymerase chain reaction in patients with inflammatory bowel disease. Int J Mol Med. 2003;11:175-179. [PubMed] |
| 18. | Saarialho-Kere UK. Patterns of matrix metalloproteinase and TIMP expression in chronic ulcers. Arch Dermatol Res. 1998;290 Suppl:S47-S54. [PubMed] [DOI] |
| 19. | Sakaguchi T, Brand S, Reinecker HC. Mucosal barrier and immune mediators. Curr Opin Gastroenterol. 2001;17:573-577. [PubMed] [DOI] |
| 22. | Staples KJ, Bergmann M, Barnes PJ, Newton R. Stimulus-specific inhibition of IL-5 by cAMP-elevating agents and IL-10 reveals differential mechanisms of action. Biochem Biophys Res Commun. 2000;273:811-815. [PubMed] [DOI] |
| 23. | Kaila M, Isolauri E, Soppi E, Virtanen E, Laine S, Arvilommi H. Enhancement of the circulating antibody secreting cell response in human diarrhea by a human Lactobacillus strain. Pediatr Res. 1992;32:141-144. [PubMed] [DOI] |
| 24. | Raza S, Graham SM, Allen SJ, Sultana S, Cuevas L, Hart CA. Lactobacillus GG promotes recovery from acute nonbloody diarrhea in Pakistan. Pediatr Infect Dis J. 1995;14:107-111. [PubMed] [DOI] |
| 25. | Isolauri E, Kaila M, Arvola T, Majamaa H, Rantala I, Virtanen E, Arvilommi H. Diet during rotavirus enteritis affects jejunal permeability to macromolecules in suckling rats. Pediatr Res. 1993;33:548-553. [PubMed] [DOI] |
| 26. | Isolauri E, Kaila M, Mykkänen H, Ling WH, Salminen S. Oral bacteriotherapy for viral gastroenteritis. Dig Dis Sci. 1994;39:2595-2600. [PubMed] [DOI] |
| 27. | Isolauri E, Majamaa H, Arvola T, Rantala I, Virtanen E, Arvilommi H. Lactobacillus casei strain GG reverses increased intestinal permeability induced by cow milk in suckling rats. Gastroenterology. 1993;105:1643-1650. [PubMed] |
| 28. | Murayama T, Mita N, Tanaka M, Kitajo T, Asano T, Mizuochi K, Kaneko K. Effects of orally administered Clostridium butyricum MIYAIRI 588 on mucosal immunity in mice. Vet Immunol Immunopathol. 1995;48:333-342. [PubMed] [DOI] |
| 32. | Venkatraman A, Ramakrishna BS, Pulimood AB, Patra S, Murthy S. Increased permeability in dextran sulphate colitis in rats: time course of development and effect of butyrate. Scand J Gastroenterol. 2000;35:1053-1059. [PubMed] [DOI] |
| 33. | Kanauchi O, Andoh A, Iwanaga T, Fujiyama Y, Mitsuyama K, Toyonaga A, Bamba T. Germinated barley foodstuffs attenuate colonic mucosal damage and mucosal nuclear factor kappa B activity in a spontaneous colitis model. J Gastroenterol Hepatol. 1999;14:1173-1179. [PubMed] [DOI] |
| 34. | Hata K, Andoh A, Sato H, Araki Y, Tanaka M, Tsujikawa T, Fujiyama Y, Bamba T. Sequential changes in luminal microflora and mucosal cytokine expression during developing of colitis in HLA-B27/beta2-microglobulin transgenic rats. Scand J Gastroenterol. 2001;36:1185-1192. [PubMed] [DOI] |
| 35. | Lührs H, Gerke T, Müller JG, Melcher R, Schauber J, Boxberge F, Scheppach W, Menzel T. Butyrate inhibits NF-kappaB activation in lamina propria macrophages of patients with ulcerative colitis. Scand J Gastroenterol. 2002;37:458-466. [PubMed] [DOI] |