修回日期: 2008-08-15
接受日期: 2008-08-26
在线出版日期: 2008-09-18
目的: 观察ATRA对Walker-256肝癌细胞的分化诱导及促进凋亡作用, 探讨其作用机制.
方法: 在肝癌细胞Walker-256细胞株中加入不同浓度的ATRA(100、10、5、1 μmol/L), 培养2 d, 荧光倒置显微镜观察细胞形态学变化; MTT比色法检测Walker-256细胞的增殖抑制; 流式细胞术分析不同DNA含量的细胞分布, 计算细胞凋亡百分率; RT-PCR检测凋亡相关基因Fas、bcl-2 mRNA的表达; Western blot检测Caspase 3、8蛋白的表达.
结果: 随着ATRA浓度的递增, Walker-256细胞表现出细胞分化及凋亡的形态学上的改变. ATRA可明显抑制细胞增殖, 5和10 μmol/L ATRA对细胞增殖抑制最为明显, 24、48、72 h的增殖抑制率分别为21.86%、57.39%、68.17%和27.23%、80.09%、92.15%, 呈浓度及时间依赖性. 5和10 μmol/L ATRA对细胞的凋亡诱导率与对照组相比, 差异有统计学意义(t = 9.61, 11.38, P<0.05, 0.01). ATRA作用Walker-256细胞后上调Fas表达, 下调bcl-2的表达, 10 μmol/L ATRA对Fas及bcl-2的调节与对照组相比,差异有统计学意义(t = 12.33, 10.78, 均P<0.05). 与对照组相比, 10 μmol/L ATRA作用48 h后对Caspase 3及Caspase 8酶原剪切活化明显(t = 9.76, 10.21, 均P<0.05).
结论: ATRA对Walker-256肝癌细胞具有分化诱导及促进其凋亡的作用.
引文著录: 方建林, 郑传胜, 冯敢生, 陶红芳, 王勇, 任建庄. 全反式维甲酸对Walker-256肝癌细胞分化及凋亡的诱导作用. 世界华人消化杂志 2008; 16(26): 2929-2934
Revised: August 15, 2008
Accepted: August 26, 2008
Published online: September 18, 2008
AIM: To observe differentiation and apoptosis of Walker-256 hepatocarcinoma cells induced by all trans-retinoitc acid (ATRA), and to explore its possible mechanism.
METHODS: Walker-256 hepatocarcinoma cell lines were treated with ATRA at various concentrations (100, 10, 5 and 1 μmol/L, respectively). Forty-eight hours later, morphological changes were measured using inverted microscopy; The proliferation effect of Walker-256 cell lines treated with ATRA was determined using MTT assay; cellular distribution of DNA content and the apoptotic incidence of cells treated with ATRA was measured using flow cytometry (FCM); the changes of Fas and bcl-2 mRNA expression were determined using RT-PCR, and Caspase 3 and Caspase 8 protein expressions were determined using Western blot.
RESULTS: With the increasing concentration of ATRA, Walker-256 cells showed morphological changes in cell differentiation and apoptosis. ATRA inhibited cell proliferation of Walker-256, with the maximum inhibitory effects at concentrations of 5 and 10 μmol/L. Proliferation rates at 24, 48 and 72 h at concentrations of 5 and 10 μmol/L were 21.86%, 57.39%, 68.17%, and 27.23%, 80.09%, 92.15%, respectively, showing a concentration- and time-dependent relationship. There was significance in apoptosis incidence among 5, 10 μmol/L groups and the control group(t = 9.61, t = 11.38, all P <0.05); For Walker-256 cells treated with ATRA, the Fas expression mRNA was significantly up-regulated and the bcl-2 mRNA was significantly down-regulated at the concentration of 10 μmol/L ATRA, compared with the control group (t = 12.33, t = 10.78, P < 0.05). After treatment with 10 μmol/L ATRA for 48 h, the Caspase 3 and Caspase 8 zymogen were significantly activated, compared with the control group (t = 9.76, t = 10.21, P < 0.05).
CONCLUSION: ATRA induces Walker-256 hepatocarcinoma cell differentiation and apoptosis.
- Citation: Fang JL, Zheng CS, Feng GS, Tao HF, Wang Y, Ren JZ. Raised differentiation and apoptosis of Walker-256 hepatocarcinoma cells treated with all trans-retinoitc acid. Shijie Huaren Xiaohua Zazhi 2008; 16(26): 2929-2934
- URL: https://www.wjgnet.com/1009-3079/full/v16/i26/2929.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i26.2929
胃恶性肿瘤细胞丧失了正常分化的能力, 表现为分化障碍及失控性增殖. 利用分化诱导剂可使肿瘤细胞部分或全部恢复分化潜能, 转变为正常细胞或导致细胞凋亡, 从而达到治疗肿瘤的目的. 与传统的细胞毒疗法相比, 其目的不在于杀伤肿瘤细胞, 因而具有较小的细胞毒性. 本实验观察全反式维甲酸(ATRA)对Walker-256肝癌细胞诱导分化及凋亡作用, 为全反式维甲酸通过介入途径治疗肝癌打下理论基础.
Walker-256细胞由上海医药研究所提供. ATRA为Sigma公司产品, 50 mg/支. 兔抗鼠Caspase pAb均为Santa cruz公司产品, Beta-actin mAb为Proteintech公司产品, 辣根过氧化物酶标记的羊抗兔IgG为北京中杉生物技术有限公司产品. TRIzol试剂及RT-PCR试剂盒购于晶美, 各引物由上海生工合成.
1.2.1 细胞培养与实验分组: 取1只幼龄小鼠, 腹部消毒, 用注射器将Walker-256复苏瘤株注入小鼠腹腔, 7-10 d腹水形成后, 取1只大鼠麻醉后, 用注射器取传代腹水1 mL分成2部分. 一部分无菌条件下注射至健康大鼠皮下, 约10 d后长出直径约1.5 cm左右的肿瘤结节. 取出瘤结节, 选择新鲜鱼肉样活组织置于无菌器皿中, 植入Wistar大鼠肝左外叶, 用于ATRA对大鼠Walker-256肝癌的介入性分化诱导实验研究. 另一部分接种于含50 mL/L小牛血清RPMI 1640培养液培养瓶内, 培养条件为37 ℃ 50 mL/L CO2培养箱, 相对湿度950 mL/L, 每2天传代1次, 取对数生长期的细胞用于实验. 根据实验需要, ATRA作用于实验细胞, 作用终浓度设定4个: 大剂量100 μmol/L, 中剂量10 μmol/L和5 μmol/L, 小剂量1 μmol/L, 药物作用时间点均设3个: 24、48、72 h. 各浓度各时间点分别设加细胞悬液不加药物组作为对照, 同时设仅加等量培养液组作为调零孔. 为减少误差, 各药物作用孔设4个复孔, 取其各孔A平均值.
1.2.2 形态观察: ATRA作用于处于对数生长期的细胞, 荧光倒置显微镜观察细胞形态变化.
1.2.3 MTT比色法检测药物对Walk-256细胞的增殖抑制情况: 根据实验需要, ATRA作用于实验细胞, 作用终浓度设定4个: 大剂量100 μmol/L, 中剂量10 μmol/L和5 μmol/L, 小剂量1 μmol/L, 药物作用时间点均设3个: 24、48、72 h. 各浓度各时间点分别设加细胞悬液不加药物组作为对照, 同时设仅加等量培养液组作为调零孔. 为减少误差, 各药物作用孔设4个复孔, 取其各孔A平均值. 根据实验所得值, 计算各浓度各时间点药物对细胞的增殖抑制率, 公式: 细胞增殖抑制率IC = (A对照孔-A实验孔均值)/A对照孔×100%. 并以时间为横轴, 对应细胞增殖抑制率为纵轴, 绘制曲线.
1.2.4 FCM检测药物处理后细胞分化及凋亡: 作用终浓度设定3个: 10 μmol/L、5 μmol/L及1 μmol/L, 药物作用时间点设为48 h. 传代Walk-256细胞培养至对数生长期, 计数板计数, 细胞密度达到109/L符合实验要求. 每孔1 mL细胞悬液接种于24孔板中, 实验组分别加入不同剂量ATRA, 每孔达到实验所需终浓度. 离心去培养基, PBS洗涤后, 采用Annexin-V/PI双标记的流式细胞术避光室温标记30 min, 上流式细胞仪检测.
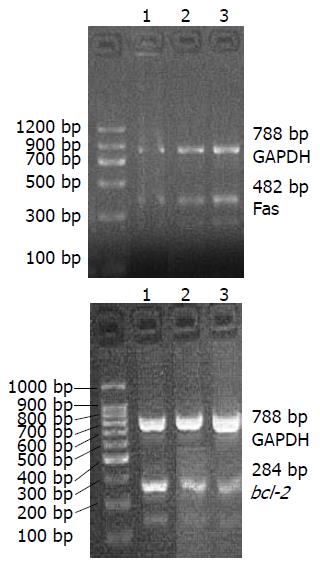
1.2.5 RT-PCR检测ATRA作用Walker-256细胞后Fas及bcl-2 mRNA表达变化: 提取各样本组总RNA, 测量RNA的浓度和纯度. 反应引物设计与合成如下: bcl-2(482 bp)上游: 5'-TTCAAACAAGACGCCAACAT-3', 下游序列5'-GAATAGAATTTCAACTGACTCCCT-3'; Fas(454 bp)上游序列 5'-GGATGCCATGCTCACCGATTC-3', 下游序列 5'-CACAGGCTACAAGTGGGAGACA-3', 内参物GAPDH(788 bp)上游序列: 5'-GGTCGGAGTCAACGGATTTGGTCG-3', 下游5'-CCTCCGACGCCTGCTTCACCAC-3'. 扩增条件为37 ℃逆转录1 h, 94 ℃预变性5 min, 然后冰上骤冷5 min, 再35个循环(94 ℃ 1 min, 57 ℃ 1 min, 72 ℃ 1 min), 72 ℃充分延伸10 min. 反应结束后取10 µL PCR产物加2 µL溴酚蓝后, 于20 g/L琼脂糖凝胶上电泳, 用紫外透射仪观察结果并拍照, 结果用Leica Q Win图像分析软件进行条带光密度积分值分析.
1.2.6 Western blot法分析Caspase 3、Caspase 8蛋白水平的表达: 三去污裂解液分别提取未加药细胞及各加药组细胞总蛋白, 变性后每孔50 µg进行SDS-PAGE电泳, 电转移至PVDF膜上, 含有50 g/L脱脂牛奶的1% TBS-T室温封闭2 h, 加一抗4 ℃孵育过夜, TBS-T洗膜, 加HRP连接的羊抗兔或羊抗鼠IgG室温振摇2 h, DAB显色液显色. 结果用Leica Q Win图像分析软件进行光密度积分值进行分析.
统计学处理 统计学分析使用SPSS10.0统计软件包,两组间比较采用t检验, 多组间比较采用单因素方差分析, 以P<0.05为差异有显著性.
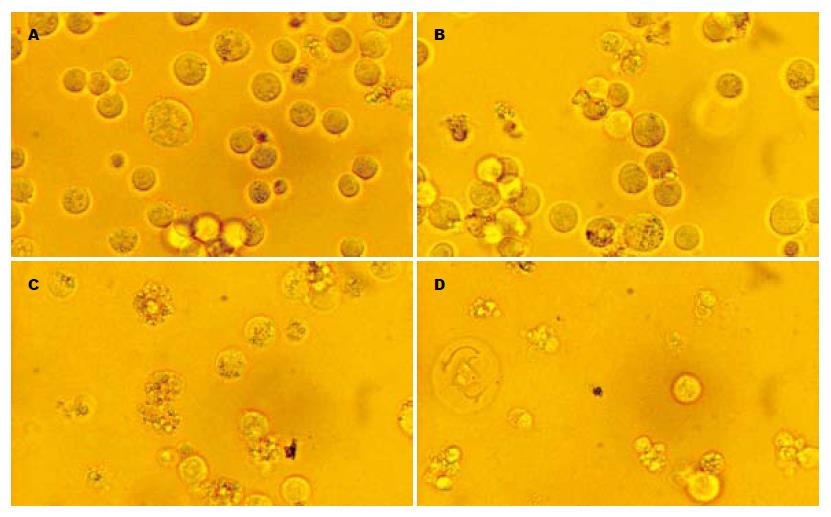
Walker-256细胞异型性明显, 其细胞大小形态很不一致, 细胞核大小形状不一, 胞核与胞质比例增大, 出现双核和多核. ATRA作用48 h后, 1 µmol/L ATRA诱导分化的作用比较明显, 表现为细胞及大小逐渐趋于一致, 胞核与胞质比例逐渐趋于正常, 双核和多核少见, 而凋亡的细胞相对较少. 随着ATRA浓度的递增, 凋亡细胞逐渐增多, 在10 µmol/L ATRA浓度作用下细胞基本凋亡, 可见大量的圆形和卵圆形的凋亡小体, 大小不等, 细胞质浓缩, 并可见深染的核碎片 (图1).
选择波长570 nm, 以调零孔调零, 酶联免疫检测仪依次测各孔A值, 记录结果, 根据实验所得值, 计算各浓度各时间点药物对细胞的增殖抑制率, 公式: 细胞增殖抑制率IC = (A对照孔-A实验孔均值)/A对照孔×100%. ATRA可明显抑制Walker-256细胞增殖, 1 µmol/L ATRA仅轻度抑制细胞增殖, 100 µmol/L ATRA对细胞毒性过强, 以5和10 µmol/L ATRA对细胞增殖抑制最为理想, 并显示一定的时间浓度依赖性(表1).
| IC1 μmol/L | IC5 μmol/L | IC10 μmol/L | IC100 μmol/L | |
| 24 h | 15.36 | 21.86 | 27.23 | 90.31 |
| 48 h | 20.27 | 57.39 | 80.09 | 100 |
| 72 h | 27.44 | 68.17 | 92.15 | 100 |
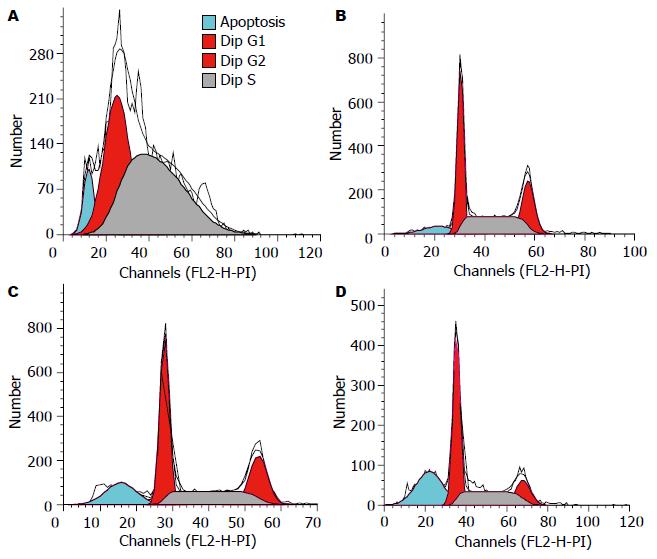
选择系列浓度的ATRA作用肿瘤细胞48 h, PI染色后FCM作各组DNA细胞周期分析, 发现Walker-256细胞增殖被明显抑制, S期细胞明显减少, 细胞被阻止于G0/G1期, 部分细胞发生凋亡, 可见在G1期峰前出现一个亚二倍体峰(图2), 并发现ATRA处理与细胞凋亡百分率存在明显的剂量效应关系(1 µmol/L 8.58%, 5 µmol/L 16.51%, 10 µmol/L 28.05%), 5和10 µmol/LATRA对细胞的凋亡诱导率与对照组相比, 差异有统计学意义(t = 9.61, P<0.05; t = 11.38, P<0.01); 此数据表明ATRA在10 µmol/L浓度时具有最佳的诱导肿瘤细胞凋亡的能力.
细胞内半胱氨酸蛋白酶Caspases系列的激活为细胞凋亡的关键, 本实验发现, 小剂量ATRA(5 µmol/L)作用细胞48 h后, Caspase 3及Caspase 8剪切活化不明显, 而大剂量的ATRA作用48 h后Caspase 3及Caspase 8酶原水解, 剪切活化明显. 提示ATRA作用于Walker-256肿瘤细胞后, 通过剪切活化Caspases级联包括Caspase 3及Caspase 8, 进而诱导肿瘤细胞凋亡(图3, 表2).
目前分化诱导剂被广泛应用于肿瘤的研究, 在肿瘤的预防和治疗方面取得一定的进展, 其中以维甲酸类药物效果肯定[1-2]. ATRA是迄今为止最重要的一类诱导分化剂, 是维生素A衍生物. 其生物学活性主要是由细胞核内的维甲酸受体和视黄素X受体介导, 使肝癌细胞凋亡相关基因Fas和P53的蛋白表达增高, 并抑制bcl-2的表达, 从而诱导肝癌细胞凋亡[3-4].
本实验结果表明ATRA对体外培养的Walker-256细胞具有明显的诱导分化作用和诱导其凋亡作用, 在一定的浓度范围内, 其作用也不尽相同. 从形态学上观察, ATRA作用前的Walker-256细胞异型性明显, 其细胞大小形态很不一致, 细胞核大小形状不一, 胞核与胞质比例增大, 出现双核和多核. 1 µmol/L ATRA诱导分化的作用比较明显, 表现为细胞及大小逐渐趋于一致, 胞核与胞质比例逐渐趋于正常, 双核和多核少见; 而凋亡的细胞相对较少. 随着ATRA浓度的递增, 凋亡细胞逐渐增多, 在10 µmol/L ATRA浓度作用下细胞基本凋亡, 可见大量的圆形和卵圆形的凋亡小体, 大小不等, 细胞质浓缩, 并可见深染的核碎片. 本实验结果显示, ATRA以浓度及时间依赖的方式抑制细胞增殖, 说明Walker-256细胞对ATRA敏感.
研究表明, 肿瘤细胞不仅增殖和分化异常, 同时凋亡也异常, 而这些异常的根本在于肿瘤细胞存在基因及蛋白的异常表达[5-6]. 抗肿瘤药物杀灭肿瘤细胞作用机制有多种, 其中诱发肿瘤细胞凋亡是最多见的形式[7]. 本组实验中ATRA作用肝癌细胞后, PI染色流式技术作各组细胞DNA周期及凋亡分析, 发现Walker-256细胞增殖被明显抑制, S期细胞明显减少, 细胞被阻止于G0/G1期, 呈剂量依赖性. 部分细胞发生凋亡, 可见在G1期峰前出现一个亚二倍体峰(xub-G1峰, 即apoptotic-peak AP峰), 代表凋亡细胞. G0/G1期是细胞进入分裂期的重要阶段, G0/G1期增加则进入分裂期的细胞减少, S期是细胞DNA合成期, S期减少则影响DNA合成. 实验分析结果提示, ATRA作用肝癌细胞后显著抑制细胞增殖并促进癌细胞分化及凋亡.
引起凋亡的信号以及随后的反应途径多样, 但细胞内凋亡蛋白酶Caspases的激活为细胞凋亡关键[8]. TNF受体家族成员Fas与其配体FasL结合后, 激活上游启动凋亡的Caspase 8, 进而启动Caspases级联诱导细胞凋亡[9]. 因而高表达的Fas有利于凋亡, 与此相反, 另一重要的凋亡调控基因bcl-2是一种凋亡抑制基因, Vaux et al证实了bcl-2高表达与恶性肿瘤的发生有关, 且发现他可以明显延长细胞的生长期[10]. 各种致癌因子引发细胞内bcl-2基因活化, 导致基因产物的过度表达, 抑制细胞凋亡, 进而促进肿瘤的发生与发展[11]. 因此在基因水平抑制bcl-2的表达将有助于肿瘤细胞凋亡. 本实验在RNA水平检测了ATRA作用Walker-256细胞48 h后Fas及bcl-2的表达变化, 结果显示, ATRA作用后在基因水平增加了Fas的表达, 同时抑制了凋亡抑制基因bcl-2的表达, 且ATRA作用于Walker-256细胞后, 通过剪切活化Caspases级联包括Caspase 3及Caspase 8, 进而诱导肿瘤细胞凋亡. 这种表达变化为ATRA诱导肿瘤细胞凋亡提供了有力依据.
总之, ATRA对体外培养的Walker-256肝癌细胞的分化诱导作用及促进其凋亡作用在本实验中得到充分体现, 这对我们进一步通过体内实验, 从整体水平, 从形态学、生物化学和分子生物学方向研究ATRA通过介入途径局部靶向给药的治疗作用和机制以及与介入化疗栓塞的协同作用治疗肝癌奠定了坚实的基础.
原发性肝癌细胞异型性明显, 而肝动脉化疗栓塞术后残存肝癌细胞恶性程度明显提高, 成为复发的根源, 严重影响了化疗栓塞治疗肿瘤的远期疗效. 因此, 如何诱导肿瘤细胞向正常的细胞转化或诱导肿瘤细胞凋亡, 从而控制残存肿瘤细胞, 减少和延缓肿瘤的复发及转移成为介入化疗栓塞治疗肝癌所面临的难题.
沈柏用, 副教授, 上海市交通大学医学院瑞金医院肝胆胰外科中心
目前分化诱导剂已经成功应用于多种血液肿瘤诱导分化的临床治疗, 在实体瘤的治疗中也发挥了一定的作用. 但是, 临床全身用药存在一定的缺点, 如易复发、出现对药物的耐受且大剂量使用毒副反应明显增强, 从而限制了其对实体瘤分化诱导的临床治疗. 将常规化疗栓塞治疗与分化诱导相结合治疗肝癌成为分化诱导剂治疗实体瘤的突破口, 其在临床应用有待进一步研究.
分化诱导剂被广泛应用于肿瘤的研究, 在肿瘤的预防和治疗方面取得一定的进展, 其中以维甲酸类药物效果肯定. 全反式维甲酸(ATRA)是迄今为止最重要的一类诱导分化剂, 是维生素A衍生物. 其生物学活性主要是由细胞核内的维甲酸受体和视黄素X受体介导, 使肝癌细胞凋亡相关基因Fas和P53的蛋白表达增高, 并抑制bcl-2的表达, 从而诱导肝癌细胞分化及凋亡.
本研究用显微镜进行细胞形态学观察, MTT比色法检测药物对Walker-256细胞的增殖抑制情况; 流式细胞术分析不同DNA含量的细胞分布, 计算细胞凋亡百分率; RT-PCR检测ATRA作用后对凋亡相关基因 Fas、bcl-2在RNA表达水平的调节; Western blot在蛋白水平检测ATRA作用后对凋亡蛋白酶Caspase 3、8的剪切活化作用, 说明ATRA对Walker-256肝癌细胞具有分化诱导及促进其凋亡作用.
本研究通过观察全反式维甲酸(ATRA)对Walker-256肝癌细胞诱导分化及凋亡作用, 为全反式维甲酸通过介入途径治疗肝癌打下理论基础.
1 分化诱导: 应用某些化学物质可使不成熟的恶性细胞逆转, 向正常分化. 这些物质称为分化诱导剂. 在分化诱导剂的作用下, 去分化的肿瘤细胞也可被诱导而重新向正常细胞分化, 表现为生物学特性均向正常细胞接近, 甚至转变成正常细胞, 这种现象称为重分化或再分化. 采用这一策略进行恶性肿瘤的治疗称为诱导分化治疗.
2 Walker-256肝癌细胞: 来源于大鼠自发性乳腺癌, AFP(-), 具有部分肉瘤性质, 将他植入肝内, 能较好地模拟人肝癌的膨胀性和浸润性生长方式. 该模型的肿瘤血供特点: 直径<3 mm时, 主要由门静脉供血; 直径 3-5 mm时, 少数由门静脉供血, 大部分由肝动脉供血; 直径>5 mm时, 除肿瘤边缘可见门静脉外, 其余均由肝动脉供血. 模型动物一般选用雄性Wistar大鼠. 该模型性质稳定、制作方法简单, 成功率高(>95%)、周期短(7-10 d), 自然生存时间为3-4 wk. 目前广泛地应用于肝癌影像学诊断实验及肝癌介入治疗.
本研究选题符合该领域的研究热点, 设计科学、合理, 作者掌握了相关的实验基础理论和专门实验技术, 统计处理符合统计学方法, 结论可靠.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Bertagnolo V, Grassilli S, Bavelloni A, Brugnoli F, Piazzi M, Candiano G, Petretto A, Benedusi M, Capitani S. Vav1 Modulates Protein Expression During ATRA-Induced Maturation of APL-Derived Promyelocytes: A Proteomic-Based Analysis. J Proteome Res. 2008; Jul 22. [Epub ahead of print]. [PubMed] |
| 2. | Cordoba R, Ramirez E, Lei SH, Lopez de la Guia A, Sanjurjo MJ, Carcas AJ, Hernandez-Navarro F. Hypercalcemia due to an interaction of all-trans retinoic acid (ATRA) and itraconazole therapy for acute promyelocytic leukemia successfully treated with zoledronic acid. Eur J Clin Pharmacol. 2008; Jun 27. [Epub ahead of print]. [PubMed] |
| 3. | Arce F, Gätjens-Boniche O, Vargas E, Valverde B, Díaz C. Apoptotic events induced by naturally occurring retinoids ATRA and 13-cis retinoic acid on human hepatoma cell lines Hep3B and HepG2. Cancer Lett. 2005;229:271-281. [PubMed] [DOI] |
| 4. | Zheng GH, Li HQ. [Effects of garlic oil combined with resveratrol on inducting of apoptosis and expression of Fas, bcl-2 and bax in human gastric cancer cell line]. Zhonghua Yufang Yixue Zazhi. 2008;42:39-42. [PubMed] |
| 5. | Gerl R, Vaux DL. Apoptosis in the development and treatment of cancer. Carcinogenesis. 2005;26:263-270. [PubMed] [DOI] |
| 6. | Vaux DL. Apoptosis timeline. Cell Death Differ. 2002;9:349-354. [PubMed] [DOI] |
| 7. | Protzel C, Klebingat HJ, Hakenberg OW. [Treatment of advanced penile cancer : Do we need new methods for chemotherapy?]. Urologe A. 2008; Aug 9. [Epub ahead of print]. [PubMed] |
| 8. | Marsden VS, O'Connor L, O'Reilly LA, Silke J, Metcalf D, Ekert PG, Huang DC, Cecconi F, Kuida K, Tomaselli KJ. Apoptosis initiated by Bcl-2-regulated caspase activation independently of the cytochrome c/Apaf-1/caspase-9 apoptosome. Nature. 2002;419:634-637. [PubMed] [DOI] |
| 9. | Spalding KL, Dharmarajan AM, Harvey AR. Caspase-independent retinal ganglion cell death after target ablation in the neonatal rat. Eur J Neurosci. 2005;21:33-45. [PubMed] [DOI] |
| 10. | Vaux DL. Early work on the function of Bcl-2, an interview with David Vaux. Cell Death Differ. 2004;11 Suppl 1:S28-S32. [PubMed] [DOI] |
| 11. | Tophkhane C, Yang S, Bales W, Archer L, Osunkoya A, Thor AD, Yang X. Bcl-2 overexpression sensitizes MCF-7 cells to genistein by multiple mechanisms. Int J Oncol. 2007;31:867-874. [PubMed] |